周围型肺鳞癌及肺腺癌超声造影初步研究
亓培君 鹿 皎 陈 烨 张世坤 李琳琳 崔莹莹
周围型肺鳞癌及肺腺癌超声造影初步研究
亓培君 鹿 皎 陈 烨 张世坤 李琳琳 崔莹莹
目的 分析周围型肺鳞癌及肺腺癌的超声造影增强模式及声学造影定量参数,探讨周围型肺鳞癌及肺腺癌的造影表现特征。方法回顾分析经超声造影后穿刺活检病理证实的52例周围型肺鳞癌(鳞癌组)和58例周围型肺腺癌(腺癌组)的超声造影增强表现,并应用QLAB软件制作时间-强度曲线(TIC),获取并比较两组声学造影定量参数。结果①不均匀增强、低增强是两组病例造影后的共同主要表现,其在鳞癌组与腺癌组出现率分别为76.9%、86.5%和67.2%、75.9%;②鳞癌组以局部-整体型增强模式为主(37/52),可见整体增强型及周边始增型;腺癌组以周边始增型模式为主(33/58),可见整体增强型及血管样始增型;③鳞癌组无增强区多于腺癌组,差异有统计学意义(P<0.05);④两组患者TIC曲线均呈“尖峰型”,鳞癌组以“速升缓降”表现为主,腺癌组以“速升速降”表现为主。鳞癌组始增时间、峰值减半时间均短于腺癌组,曲线下降支斜率大于腺癌组,两组比较差异均有统计学意义(均P<0.05);而两组达峰时间、上升时间、基础强度、增强强度、峰值强度及曲线上升支斜率比较差异均无统计学意义。结论分析超声造影增强表现的特点及声学造影定量参数的不同,对周围型肺鳞癌及肺腺癌的诊断有一定的提示意义。
超声检查;造影剂;肺鳞癌;肺腺癌;周围型
鳞癌与腺癌是周围型肺癌中最常见的组织类型,二者的鉴别诊断有着重要的临床意义。但两者常规超声均表现为低回声占位,且受病灶周围肺气体反射的影响,病灶边缘、边界及病灶内血流常探查不清,为临床诊断带来困难。超声造影可显示病灶内微血管的分布情况、灌注特点及其差异,分析不同病变超声造影的增强表现及相关声学造影定量参数,可为临床诊断提供更多有用的信息。本研究回顾性分析周围型肺鳞癌及周围型肺腺癌造影表现特征,提高超声对其的诊断能力。
资料与方法
一、研究对象
选取2013年4月至2016年1月在我院经CT或MRI检查发现周围型肺占位,经超声造影检查后行穿刺活检或手术病理结果证实的周围型肺癌患者110例,其中鳞癌组52例,男43例,女9例,年龄47~85岁,平均(70.4±9.2)岁;腺癌组58例,男37例,女21例,年龄49~83岁,平均(68.6±9.3)岁。所有患者接受超声造影及穿刺检查前均未进行任何治疗,且均获患者及其家属知情同意。
二、仪器与方法
1.仪器及试剂:使用Philips iU 22彩色多普勒超声诊断仪,C5-1凸阵探头,频率为1~5 MHz;配备脉冲反向谐波(PIH)超声造影成像技术。造影剂为SonoVue(意大利Bracco公司),使用前以5.0 ml生理盐水溶解,振荡混匀。
2.超声造影检查:参照胸部CT或MRI显示,嘱患者取相应体位,先行常规超声检查,详细记录病灶部位、形态、大小、边界、边缘、内部回声及血流分布情况并存储图像。选取病灶最佳切面,切换至造影模式,机械指数0.08,抽取1.5 ml SonoVue微泡混悬液,经肘部浅静脉以团注方式快速注射,随后推注5.0 ml生理盐水。同时启动造影模式及仪器内置计时器,记录造影剂进入病灶及消退全过程,并存储动态图像待分析。造影结束后,所有患者以18 G自动活检枪行超声引导下穿刺活检,部分患者同时接受外科手术。
3.图像分析:通过回放造影动态图像,用目测法观察病灶增强模式、达峰强度、增强均匀度、是否有大片状无增强区及造影后血管集束征等增强表现。应用QLAB造影分析软件,选取病灶内增强最明显的区域为感兴趣区,避开较大的血管分支,绘制时间-强度曲线(TIC),获得以下参数:始增时间(AT)、基础强度(BI)、达峰时间(TTP)、峰值强度(PI)及峰值减半时间(T1/2);通过计算获取造影参数:上升时间(RT)、增强强度(EI)、曲线上升支斜率(β)、曲线下降支斜率(α),计算公式为:RT=TTP-AT,EI=PI-BI,β=(PI-BI)/(TTP-AT),α=PI/[2(T1/2-TTP)];其中时间单位为s,强度单位为dB,斜率单位为dB/s。
4.评定标准:峰值强度以同时增强后肝脏的回声强度作为参照,低增强是指造影剂达峰时病灶回声强度低于肝脏回声强度。造影增强达峰后,观察病灶内的回声分布是否均匀一致。不均匀增强表现为达峰后病灶内部回声强度不均,可见边界不清、单发或多发的不规则低增强区和/或无增强区;均匀增强表现为病灶内部回声均匀一致。将肺内一支或多支直达肿块边缘或到达肿块内或穿过肿块的血管定义为肿块血管集束征[1]。
三、统计学处理
结果
一、两组患者一般情况
两组患者均为单侧单发病灶,其中5例合并胸腔积液(鳞癌组2例,腺癌组3例)。鳞癌组病灶最大切面直径3.4~14.0 cm,平均(7.23±2.57)cm,其中位于左肺23例,右肺29例;腺癌组病灶最大切面直径2.0~9.7 cm,平均(5.23±2.13)cm,其中位于左肺28例,右肺30例。两组病灶最大径均数比较差异有统计学意义(P<0.05)。
二、两组超声造影表现特点
两组超声造影增强表现见表1。两组患者始增模式特点:①局部-整体型:病灶局部一处或多处先呈斑片状增强,随后渐扩展、融合至全部,见图1;②整体增强型:病灶整体同时出现增强;③周边型:病灶周边先出现增强,逐渐向中心灌注,见图2;④血管样:始增时以血管为中心,呈树枝状增强扩展;⑤其他:鳞癌组中2例病灶内见大范围无增强区,仅残留少许活性组织,不能判断增强模式;腺癌组中1例病灶呈稀疏灌注,1例病灶较小,造影时与周围肺组织分界不清,亦不能判断其增强模式。不均匀增强、低增强是两组患者造影后的共同主要表现,其在鳞癌组与腺癌组的出现率分别为76.9%、86.5%和67.2%、75.9%,两组比较差异均无统计学意义。局部无增强区是鳞癌组造影后的特征性表现,与腺癌组比较差异有统计学意义(P<0.05)。而血管集束征在两组比较差异无统计学意义。
三、两组时间-强度曲线形态及造影定量参数分析
两组患者TIC曲线均呈“尖峰型”,其中鳞癌组以“速升缓降”表现为主,腺癌组以“速升速降”表现为主(图2 C)。
鳞癌组AT、T1/2均短于腺癌组,α大于腺癌组,两组比较差异均有统计学意义(均P<0.05),而两组TTP、RT、BI、EI、PI及β比较差异均无统计学意义。见表2。
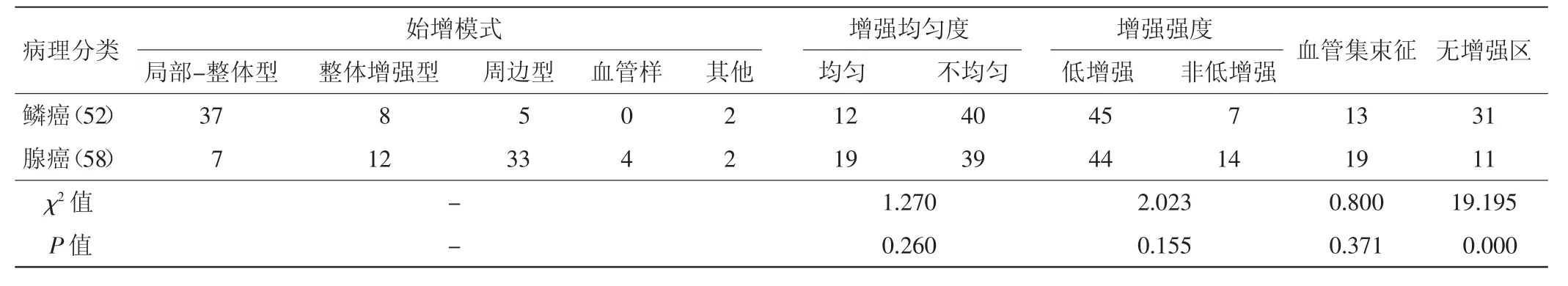
表1 周围型肺鳞癌及肺腺癌超声造影表现 例
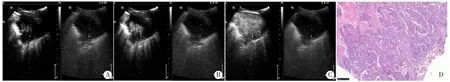
图1 周围型肺鳞癌患者局部-整体型始增模式超声造影图和病理图
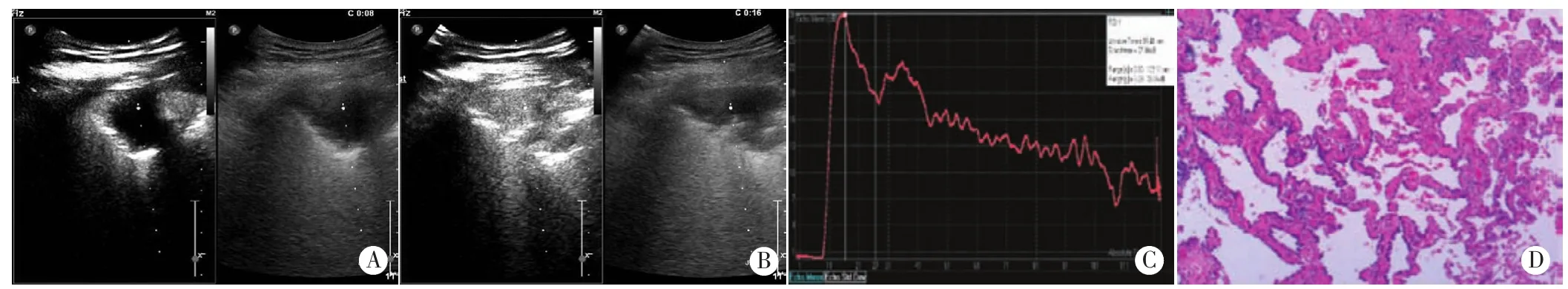
图2 周围型肺腺癌患者周边型始增模式超声造影图和病理图
表2 两组TIC曲线造影定量参数比较(±s)

表2 两组TIC曲线造影定量参数比较(±s)
AT:始增时间;TTP:达峰时间;T1/2:峰值减半时间;RT:上升时间;BI:基础强度;PI:峰值强度;EI:增强强度;β:曲线上升支斜率;α:曲线下降支斜率。
组别 AT(s) TTP(s) T1/2(s) RT(s) BI(dB) PI(dB) EI(dB) β(dB/s) α(dB/s)鳞癌组(52) 6.12±1.05 18.30±6.21 42.02±22.08 12.17±6.19 1.35±0.75 29.05±7.30 27.71±7.07 2.79±1.44 0.93±0.63腺癌组(58) 9.44±4.22 17.40±6.30 23.22±6.84 7.96±3.16 2.78±3.01 29.42±8.53 26.65±7.71 4.05±2.46 2.59±0.80 t值 2.155 -0.302 -2.322 -1.879 1.446 0.097 -0.300 1.278 4.759 P值 0.047 0.766 0.048 0.079 0.178 0.924 0.768 0.220 0.000
讨论
不同组织学类型的周围型肺癌常规超声均表现为低回声占位,且内部血流显示不佳,鉴别诊断困难。超声造影剂SonoVue是一种血池示踪剂,造影剂到达组织的数量及其进出的速度可反映该组织微循环灌注状态,实时动态地观察造影剂灌注的时间顺序、空间分布及其相应的差异,较常规超声更清晰地显示病灶位置、形态、边界及周边组织结构,弥补CDFI对微血管显示的不足,为诊断及鉴别诊断提供更多的信息[2],因此联合超声造影可帮助进一步诊断不同类型的周围型肺癌。
本研究中,周围型肺鳞癌造影始增模式以局部-整体型为主(37/52),而周围型肺腺癌以周边型始增模式为主(33/58),分析原因为,肺鳞癌是实性肿瘤,癌细胞堆积、聚集成群,呈巢片状的生长方式,营养需求较多,癌巢周围滋养血管丰富,且肿瘤血管迂曲扩张成团,使得造影剂能够迅速进入首先增强,形成斑片状强化区,继而扩展、融合至整体增强[3]。而周围型肺腺癌的组织学生长方式为癌细胞沿肺泡壁贴壁生长[4],癌组织分布松散,呈腺管样,间质成分多[5],因此肿块内部血供较肿块周边稀疏,造影剂注入后,肿块周边最先始增。这种始增模式的差异对周围型肺鳞癌及肺腺癌的诊断有一定的提示意义。据此推测,周围型肺腺癌周边及肺鳞癌的局部斑片状始增部位提示肿瘤血管的密集区,可能为肿瘤主要滋养供血血管所在。
超声造影同时还观察到两组患者多数病灶呈不均匀增强,其中周围型肺鳞癌的不均匀增强主要来自于无增强区(31/40)。由于肿瘤是血管生成依赖性疾病[6],当供应肿瘤的血液断流后,肿瘤组织就会出现缺血坏死,在造影时表现为不规则的片状的局部无增强区。较多的文献[3,5-7]报道坏死是鳞癌的病理特征,本研究结果证实,局部无增强是鳞癌组超声造影后的特征性表现,该表现与腺癌组比较差异有统计学意义(P<0.05),分析其原因,可能与周围型肺鳞癌生长迅速,而瘤内微血管密度较周围型肺腺癌少[7],缺乏较广泛的滋养血管,导致肿瘤组织营养障碍;加之肿块体积较大,成分密实,局部组织压力增大并压迫主要瘤供血管,血供相对不充足,从而出现坏死有关。
刘国荣等[1]通过对周围型小肺癌进行多层螺旋CT薄层扫描和多平面重建研究发现,血管集束征的出现率为88.5%。超声造影后,以周围型肺肿块为声窗,部分患者在肺门侧的肿块边缘可观察到快速高增强的搏动性血管样回声。本研究中,血管集束征出现率(25%vs. 33%)明显低于多数文献[1,8]报道,是由于病灶周围多是正常含气的肺组织,与超声观察切面受限有关。但该征象在鳞癌与腺癌两组间比较差异无统计学意义,提示血管集束征在本研究中不能作为诊断周围型肺鳞癌与周围型肺腺癌的一个有意义表现。
在实际目测观察过程中,周围型肺鳞癌与周围型肺腺癌的造影表现有部分重叠,仅通过目测法诊断很困难,需结合客观的定量指标来综合判断。本研究结果显示,鳞癌组AT早于腺癌组,差异有统计学意义(P<0.05),提示时间参数AT是两组鉴别的较好指标。分析本研究TIC曲线形态,两组上升支均陡直,但腺癌组下降支亦陡直,斜率大,呈“速降型”,与鳞癌组TIC曲线下降支“缓降型”比较差异有统计学意义(P<0.05),说明周围型肺腺癌的消退早于周围型肺鳞癌,可作为较好的参数指标。
本研究还发现,在超声造影过程中,病灶随着患者的呼吸上下移动,尤其是较小病灶,甚至脱离观察区域,影响了诊断的准确性,而在造影前引导并训练患者均匀平静呼吸及采用腹式呼吸,可减小病灶移动幅度,更容易获得相对稳定的图像。
综上所述,分析周围型肺鳞癌及肺腺癌超声造影增强表现的特点及声学造影定量参数的不同,对二者的鉴别诊断有一定的提示意义,尤其适用于无法获得病理诊断或增强CT等检查禁忌的周围型肺癌患者。
[1] 刘国荣,程传虎,蓝博,等.多层螺旋CT探讨血管集束征对周围型小肺癌的诊断价值[J].中国介入影像与治疗学,2006,3(4):294-296.
[2]Strazdina A,Krumina G,Sperga M.The Value and limitations of contrast-enhanced ultrasound in detection of prostate cancer[J]. Anticancer Res,2011,31(4):1421-1426.
[3]刘绚,李红钢,刘铭球,等.大鼠肺鳞癌发生发展过程中肿瘤血管生成及血液供应研究[J].中国肺癌杂志,2003,6(3):176-180.
[4]Travis WD.Pathology of lung cancer[J].Clin Chest Med,2011,32(4):669-692.
[5]王玮,李岩军,成建新,等.彩色多普勒超声对周围型肺癌组织学类型诊断价值的探讨[J].医学影像学杂志,2005,15(7):562-564.
[6]Folkman J,Beckner K.Angiogenesis imaging[J].Acad Radiol,2000,7(10):783-785.
[7]秦玉华,曹兵生,邓娟,等.周围型肺癌超声造影表现与微血管密度的相关性研究[J].天津医药,2013,41(10):1008-1009.
[8]徐宏刚,王海林.血管集束征在CT诊断周围型小肺癌中的价值[J].广州医学院学报,2006,34(3):47-49.
Preliminary study on contrast-enhanced ultrasonography for peripheral pulmonary squamous cell carcinoma and pulmonary adenocarcinoma
QI Peijun,LU Jiao,CHEN Ye,ZHANG Shikun,LI Linlin,CUI Yingying
Department of Ultrasound,the Affiliated Hospital of Xuzhou Medical University,Jiangsu 221006,China
ObjectiveTo investigate the characteristics of contrast-enhanced ultrasonography of peripheral pulmonary squamous cell carcinoma and pulmonary adenocarcinoma by analyzing the patterns of contrast-enhanced ultrasound and the quantitative parameters of acoustic contrast.MethodsThe sonographic features of contrast-enhanced ultrasound of 52 patients with peripheral pulmonary squamous cell carcinoma and 58 patients with peripheral pulmonary adenocarcinoma were analyzed retrospectively,which confirmed by puncture biopsy after contrast-enhanced ultrasound.QLAB software was used to draw timeintensity curve(TIC)and the acoustic contrast quantitative parameters were recorded at the same time.Results①Inhomogeneous enhancement and hypo-enhancement were the main manifestations of contrast-enhanced ultrasound of the patients in two groups,the rate of occurrence in peripheral pulmonary squamous cell carcinoma were 76.9%,86.5%,and 67.2%,75.9%in peripheral pulmonary adenocarcinoma,respectively.②The main performance of contrast-enhanced ultrasound of peripheral pulmonary squamous cell carcinoma were partial-whole enhancement mode(37/52),showing overall enhancement and peripheral enhancement beginning type.The main performance of contrast-enhanced ultrasound of peripheral pulmonary adenocarcinoma were peripheral enhancement beginning mode(33/58),showing overall enhancement and vascular morphology enhancement beginning pattern.③Local none-enhanced pattern was the characteristic manifestation of peripheral pulmonary squamous cell carcinoma,and the difference was statistically significant compared with pulmonary adenocarcinoma(P<0.05).④TIC curves of two groups presented“spike type”,the main performance of peripheral pulmonary squamous cell carcinoma was“speed up and slow down”,while peripheral pulmonary adenocarcinoma was mainly manifested as“steep in rise and drop down”.AT and T1/2ofperipheral pulmonary squamous cell carcinoma were both shorter than those of peripheral pulmonary adenocarcinoma,while α was greater than that of peripheral pulmonary adenocarcinoma,the differences were statistically significant between two groups(all P<0.05). The differences of TTP,RT,BI,EI,PI and β were not statistically significant between two groups.ConclusionThe analysis of the characteristics of contrast-enhanced ultrasonography and the differences of the quantitative parameters of acoustic contrast canprovide certain significance in the diagnosis of peripheral pulmonary squamous cell carcinoma and pulmonary adenocarcinoma.
Ultrasonography;Contrast agent;Pulmonary squamous cell carcinoma;Pulmonary adenocarcinoma;Peripheral
R734.2;R445.1
A
2016-09-06)
221006 江苏省徐州市,徐州医科大学附属医院超声医学科(亓培君、鹿皎、张世坤),病理科(李琳琳、崔莹莹);徐州市中心医院超声科(陈烨)

