利用二氧化碳选择性分离回收含锰废水中的锰
梅颖,薛余化,叶恒朋,杜冬云
(中南民族大学环境科学与工程研究所,中南民族大学资源与环境学院/催化材料科学国家民委-教育部共建重点实验室,湖北 武汉430074)
利用二氧化碳选择性分离回收含锰废水中的锰
梅颖,薛余化,叶恒朋,杜冬云
(中南民族大学环境科学与工程研究所,中南民族大学资源与环境学院/催化材料科学国家民委-教育部共建重点实验室,湖北 武汉430074)
讨论了反应时间、pH、温度、搅拌速率以及pH调节剂种类和投加量对Mn回收率的影响,确定了利用二氧化碳从含锰废水中选择性分离回收锰的最佳工艺条件。结果表明:在反应时间90 min,pH 6.6,反应温度45℃,搅拌速率600 r·min-1,NaOH投加量2 g·L-1的条件下,锰的回收率为99.79%,出水锰的浓度低于5 mg·L-1,达到《污水综合排放标准》(GB 8978—1996)中总锰的三级排放要求,沉淀物符合《工业碳酸锰标准》(HG/T 4203—2011)合格品技术要求。
含锰废水;二氧化碳;选择性分离回收;沉淀;碳酸锰
引 言
作为一种重要的金属原材料,金属锰被广泛应用于钢铁生产、有色冶金、电子工业、电池、催化剂、涂料、饲料添加剂等许多领域[1-4]。中国是世界上最大的金属锰生产和出口国,锰产量约占全球的90%,居世界首位[5]。然而,中国锰矿资源以贫矿为主,约占全国总储量的 93.6%,锰矿仍为我国短缺矿产,对外依存度高。菱锰矿的开采和电解锰的生产过程中产生大量含有高浓度Ca2+、Mg2+、Mn2+、的工业废水,每吨电解锰约产生 350 t含锰废水,包含锰矿采选废水和电解锰生产废水。如果不经处理直接排入周围水环境中,不仅造成水资源的大量浪费,而且严重污染环境,影响矿区人民的生活和发展[6-7]。同时,菱锰矿酸浸的过程中产生大量二氧化碳,前期的研究表明,每生产1 t电解锰产品约产生1 t CO2,全国电解锰行业每年产生约110×104t CO2。
目前对含锰废水的处理主要有氢氧化物沉淀法[8]、混凝沉淀法[9]、铁氧体沉淀法[10]、离子交换膜-电解法[11]、生物法等[12-14],对二氧化碳的捕捉和封存方式有矿石碳化[15-16]、地质封存[17]、生态封存[18]及工业利用[19-20]等。其中氢氧化物沉淀法是当前应用最为广泛的处理方法,一般与混凝沉淀法联用,如何强等[9]采用“石灰中和+板框压滤+NaOH反应沉淀+混凝沉淀”序批式运行处理含锰废水,通过调节pH至12左右生成氢氧化物沉淀,达到去除锰的效果。氢氧化物沉淀法的选择性分离效果较差,得到的沉淀物中既有氢氧化镁又有氢氧化锰。其中氢氧化镁颗粒小,成胶状,不易沉淀,需加入大量混凝剂辅助沉淀生成;氢氧化锰极易与氧气反应,生成棕色的偏氢氧化锰沉淀,故沉淀物成分非常复杂,很难回收再利用。同时由于出水pH较高,还需要通过加入硫酸进行pH回调,混凝剂和硫酸的大量使用不仅增加了处理成本,而且容易造成二次污染。铁氧体沉淀法由于需要消耗大量硫酸亚铁,导致处理成本高且出水硫酸盐含量高,容易造成二次污染。离子交换膜-电解法受到离子膜价格和性能因素的影响,处理成本高、周期长且仅适用于处理低浓度废水。生物法虽然环境效益好、运行成本低,但由于其处理效率低、运行不稳定,目前仍然处于研究阶段。针对含锰废水,以上方法均无法有效选择性分离回收其中的锰资源。
在上述背景下,提出利用菱锰矿酸浸工序中产生的二氧化碳来选择性分离回收含锰废水中的锰,利用CaCO3、MgCO3、MnCO3的溶度积差异,在通入二氧化碳后调节pH至6~7,达到选择性分离回收锰的效果[21-25]。由于理论上分离回收得到的锰以碳酸锰形态存在,具有资源化再利用的可行性。这一方法既可实现含锰废水和二氧化碳的综合减排,又能有效选择性分离回收锰,同时为镁、铵的回收创造条件。
1 实验材料和方法
1.1 实验材料
实验水样取自广西壮族自治区某厂污水处理站,水样中钙、镁、锰的浓度分别为 468、1059、1400 mg·L-1。NaOH、CaO均为分析纯,来自国药集团化学试剂有限公司。CO2为钢瓶气,纯度为99.6%~99.8%。N2为钢瓶气,纯度为≥99.999%,均由四川天一科技股份有限公司武汉供气分公司提供。
1.2 实验装置
实验装置如图1所示,由ZD-2型自动电位滴定仪、GS-2L型磁力高压反应釜、200 Flux混合气体流量控制器组成。通过前期在广西壮族自治区某厂测得菱锰矿酸浸废气中的二氧化碳平均浓度为15%,故本实验中选用85% N2和15% CO2混合气体作为模拟酸浸废气。

图1 实验装置Fig.1 Components for experimental setup
1.3 分析测试仪器
二氧化碳检测仪,HD2000-CO2型,深圳市华利奥电子有限公司;电感耦合等离子体质谱仪(ICP-MS),NexION 300型,美国Perkin Elmer;原子吸收光谱仪(AAS)AA-6300C型,日本岛津;X射线衍射仪(XRD),D8 Advance型,德国Bruker;扫描电子显微镜(SEM),SU8010型,日本日立。
1.4 实验步骤
将1 L水样放入反应釜中,控制反应温度和搅拌速率,向其中通入流量为2.7 L·min-1的CO2混合气体,保持出气口开启状态,维持釜内工作压力为常压,即CO2分压为0.15 MPa。pH快速降至5左右时用自动电位滴定仪以0.02 ml·s-1滴定速度缓慢加入20 ml浓度为2.5 mol·L-1的NaOH溶液维持溶液pH在6.2~7.0,并开始计时。当NaOH溶液加完后立即停止通入CO2,继续搅拌反应一段时间。过滤反应后的溶液,用火焰原子吸收法测定溶液中剩余的钙、镁、锰浓度,计算回收率。将滤渣于75℃下真空干燥12 h,用X射线衍射仪(XRD)和扫描电子显微镜(SEM)分析沉淀物的形态结构和形貌特征。
2 实验结果与讨论
2.1 最佳反应时间的确定
在搅拌速率为600 r·min-1,反应温度为45℃,维持pH为6.6的条件下,考察反应时间对分离回收锰效果的影响。
结果如图2所示,在60 min时钙、镁、锰的回收率分别为41.01%、6.06%和98.75%,溶液中锰的剩余浓度为17.50 mg·L-1。在90 min时钙、镁、锰的回收率分别为47.00%、6.32%和99.79%,溶液中锰的剩余浓度为2.94 mg·L-1,达到《污水综合排放标准》(GB 8978—1996)中总锰的三级排放标准。随着反应时间的进一步提高,镁和锰的回收率趋于稳定,而钙的回收率继续升高,在120 min时达到50.87%。考虑到过长的反应时间不仅使得沉淀物中钙含量的增加,也会导致运行成本的增加,为了在选择性分离回收锰的同时减少可溶性锰对环境的危害,故选择90 min为最佳反应时间。
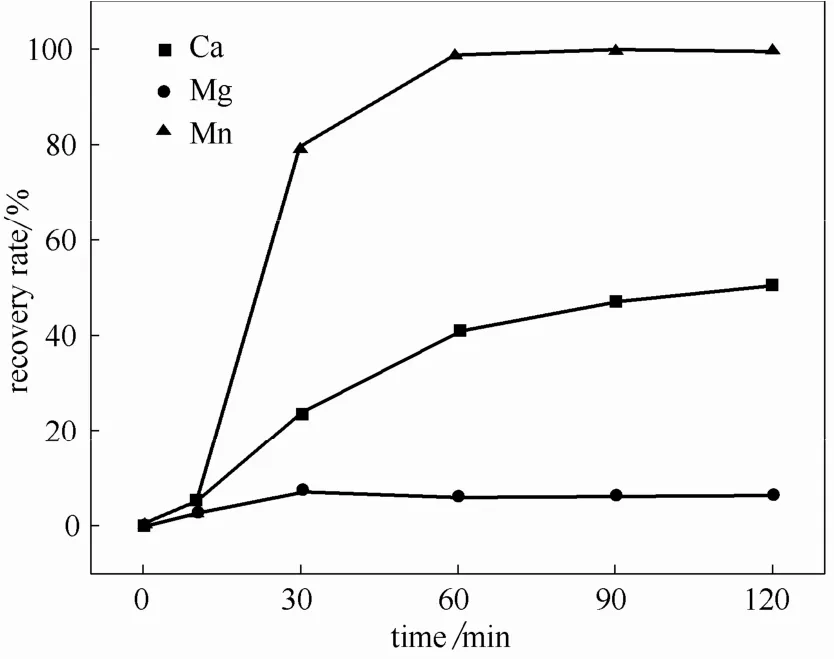
图2 反应时间对锰分离回收效果的影响Fig.2 Effect of reaction time on Mn separation and recovery efficiency
2.2 最佳pH的确定
由于 MnCO3的溶度积(Ksp=1.8×10-11)低于CaCO3(Ksp=2.8×10-9)和 MgCO3(Ksp=3.5×10-8),MnCO3更易于沉淀,因此可以达到选择性分离回收锰的目的[26-27]。其主要反应式为
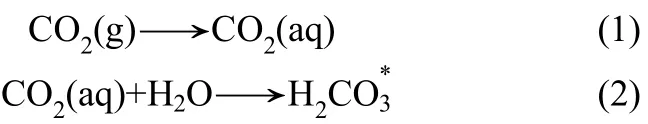
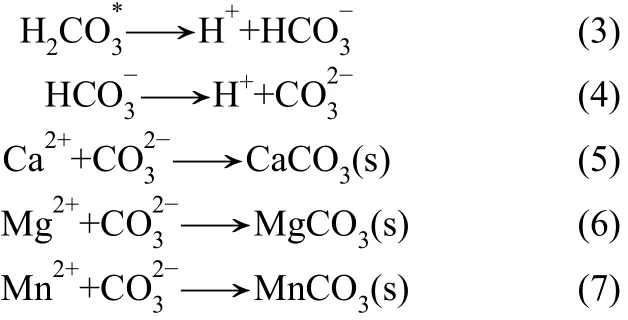
从反应式(1)~式(7)可知,在碳酸盐开放系统中,碳酸根离子浓度随着pH升高而升高[28]。根据式(8)、式(9)计算可得反应体系中碳酸盐和氢氧化物的理论沉淀pH,结果见表1。
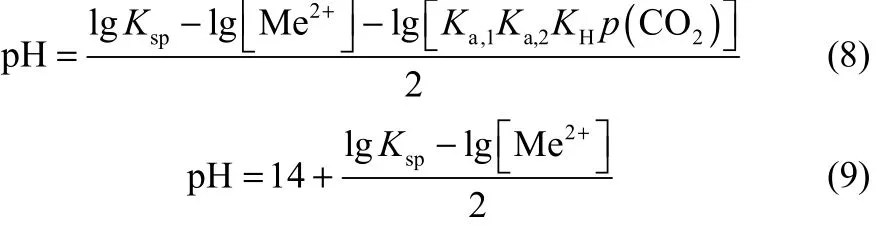
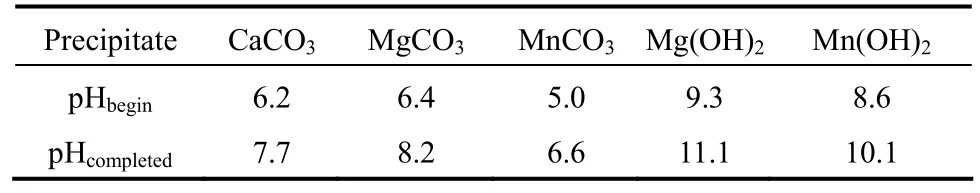
表1 理论沉淀pHTable 1 pH values for precipitation
由表1可知,碳酸锰完全沉淀时所需的理论pH为6.6,pH过高时会生成难溶解的碳酸钙、碳酸镁和氢氧化物,由于其直接影响沉淀物碳酸锰的纯度,要避免此类沉淀生成[29-30]。因此,pH是选择性分离回收含锰废水中锰的重要影响条件。
在反应时间为90 min,搅拌速率为600 r·min-1,反应温度为45℃,考察pH对分离回收锰效果的影响。
结果如图3所示,pH=6.6时,钙、镁、锰的回收率分别为47.00%、6.32%和99.79%,随着pH进一步升高,锰的回收率趋近于稳定,钙和镁的回收率仍在缓慢升高。实验结果与理论计算值基本一致,因此,维持pH在6.6为最佳选择。
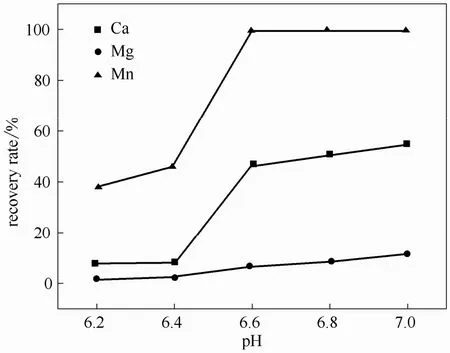
图3 反应pH对锰分离回收效果的影响Fig.3 Effect of pH on Mn separation and recovery efficiency
2.3 最佳反应温度的确定
在反应时间为90 min,搅拌速率为600 r·min-1,维持pH为6.6的条件下,考察反应温度分别为25、30、35、40和45℃时对分离回收锰效果的影响。
结果如图4所示,当温度从25℃提高至45℃时,钙、镁、锰的回收率分别从17.05%、2.10%、54.98%提高至47.00%、6.32%、99.79%。这是由于在反应前期温度升高可增加分子间的碰撞概率,促使反应速率加快,在大量碳酸锰沉淀后停止通入CO2继续搅拌的反应后期,过多的H2反而导致碳酸锰沉淀被溶解,在高温条件下继续搅拌可促使过多CO2逸出,有利于碳酸锰的进一步沉淀。因此在较高的温度条件下可促进碳酸盐沉淀的形成,提高锰的回收率。在 45℃时锰的剩余浓度为 2.94 mg·L-1,达到《污水综合排放标准》要求,而在35℃时锰的剩余浓度为45 mg·L-1,高于排放标准,故选择最佳反应温度为45℃。

图4 反应温度对锰分离回收效果的影响Fig.4 Effect of temperature on Mn separation and recovery efficiency
2.4 最佳搅拌速率的确定
在反应时间为90 min,反应温度为45℃,维持pH为6.6的条件下,考察搅拌速率分别为200、400、600和800 r·min-1时对分离回收锰效果的影响。
结果如图5所示,搅拌速率从200 r·min-1增加到600 r·min-1,钙、镁、锰的回收率分别从23.15%、6.19%、81.63%提高至 55.57%、7.37%、99.79%。在 400 r·min-1时锰的回收率为 96.23%,锰浓度为53 mg·L-1,高于排放标准。在 800 r·min-1时,钙的回收率升高至 91.92%,镁和锰的回收率则趋于稳定。由于过高的搅拌速率不但需要消耗额外的动能,而且会生成不必要的钙镁碳酸盐沉淀,降低碳酸锰质量,故选择最佳搅拌速率为600 r·min-1。
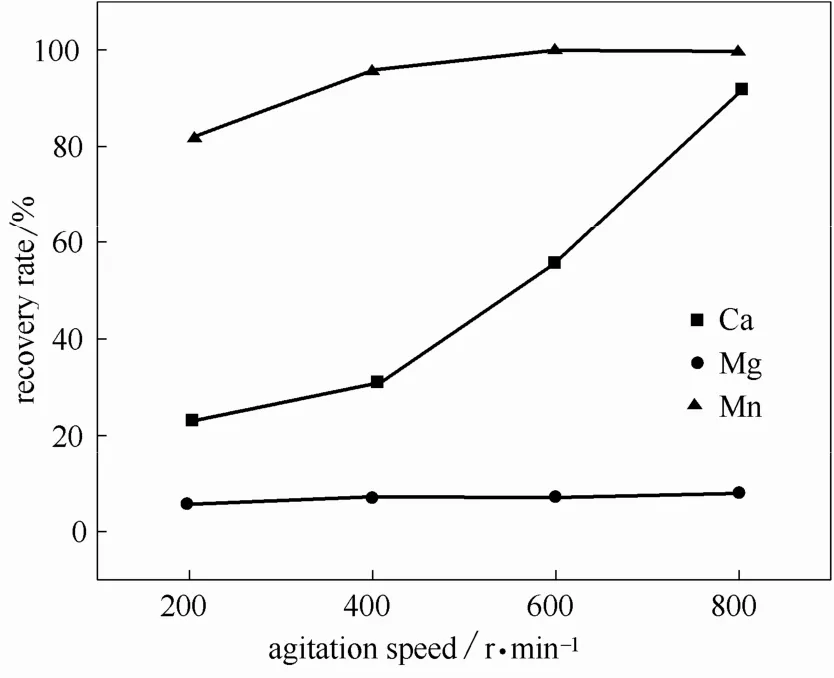
图5 搅拌速率对锰分离回收效果的影响Fig.5 Effect of agitation speed on Mn separation and recovery efficiency

图6 pH调节剂种类和投加量对锰分离回收效果的影响Fig.6 Effect of pH regulator type and dosage on Mn separation and recovery efficiency
2.5 pH调节剂种类和投加量的确定
在分离回收锰的反应中,主要成本来自于 pH调节剂的使用。由于与NaOH相比,CaO价格较低,故选用CaO作为pH调节剂进行对比实验。在反应时间为90 min,反应温度为45℃,搅拌速率为600 r·min-1,维持pH为6.6的条件下,加入不同剂量的pH调节剂,考察NaOH和CaO分别作为pH调节剂对分离回收锰效果的影响。
结果如图6所示,使用两种不同的pH调节剂时,锰的回收率均随着投加量增加而升高。投加量从1 g·L-1增加到2 g·L-1时,锰的回收率增幅较大。投加量为2 g·L-1时,使用NaOH和CaO作为pH调节剂得到的锰回收率分别为 99.79%和 90.82%,处理后的溶液中锰的浓度分别为 2.94和 128.52 mg·L-1。
图7为pH调节剂投加量在2 g·L-1的情况下得到的沉淀物滤饼实物。由图可知,当使用NaOH作为pH调节剂时沉淀物较少,质量为3.7449 g,呈浅棕色粉末狀;当使用CaO作为pH调节剂时沉淀物较多,质量为11.2122 g,呈白色块状。

图7 真空干燥处理后的沉淀物滤饼Fig.7 Images of solid products obtained with NaOH and CaO
沉淀物经过真空抽滤、去离子水洗涤、真空干燥处理后进行XRD和SEM表征。XRD检测结果如图8所示,使用NaOH作为pH调节剂得到的沉淀物中物相组成主要有 MnCO3、CaMn(CO3)2和Ca(Mn,Mg)(CO3)2,以碳酸盐为主,含锰废水中的锰以碳酸盐形态被沉淀下来,且沉淀物中 MnCO3含量较高;使用CaO作为pH调节剂得到的沉淀物中物相组成主要有 Ca(SO4)(H2O)2、MnCO3、CaMn(CO3)2和Ca(Mn,Mg)(CO3)2,除了有含锰碳酸盐外,还有大量硫酸钙存在,这是由于含锰废水中存在一定量的硫酸根离子。
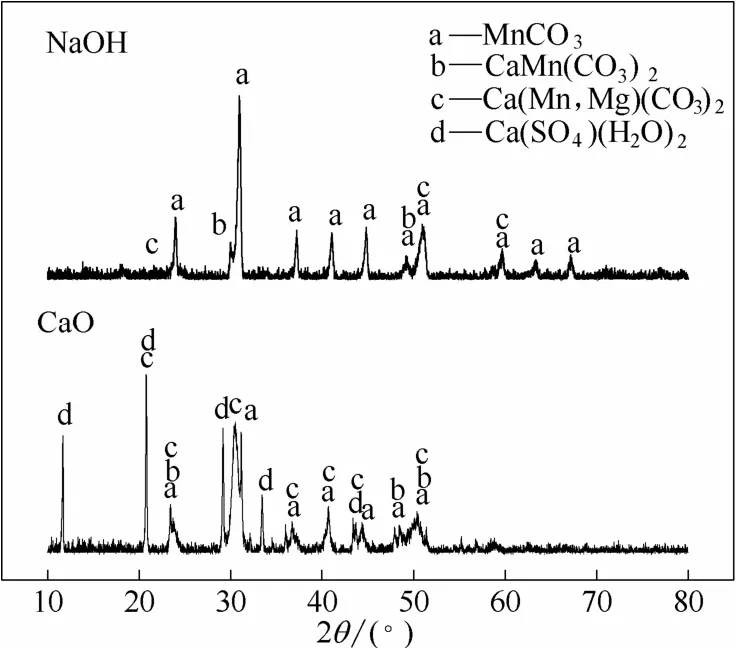
图8 最佳条件下不同pH调节剂所得沉淀物的XRD谱图Fig.8 XRD patterns of solid products obtained with NaOH and CaO
SEM检测结果如图9所示,图9(a)为使用NaOH作为pH调节剂得到的沉淀物,呈典型的六基面菱形晶体,与菱锰矿的三角晶系菱形晶体结构特征相一致。图9(b)为使用CaO作为pH调节剂得到的沉淀物,呈不规则的葡萄球状聚合体。
虽然使用CaO可以降低运行成本,但由于沉淀物较多且成分复杂,碳酸锰含量较低,不利于资源化回收利用。长期使用 CaO容易导致管道结垢堵塞,增加运行维护成本,影响处理效果。因此,选择NaOH作为最佳pH调节剂,投加量为2 g·L-1。

图9 不同pH调节剂对沉淀物SEM形貌的影响Fig.9 SEM images of solid products formed at different pH regulator NaOH and CaO
2.6 碳酸锰质量分析及成本效益估算
2.6.1 碳酸锰质量分析 实验使用硝酸铵氧化还原法、硝酸银滴定法和火焰原子吸收分光光度法分别测定沉淀物中碳酸锰、氯化物和硫酸盐的含量,从工业产品的角度对碳酸锰的质量进行分析,探索这一工艺技术所产生的经济效益。
由表2可知,使用NaOH作为pH调节剂所得沉淀物的各项技术指标均满足《工业碳酸锰标准》(HG/T 4203—2011)合格品技术要求。
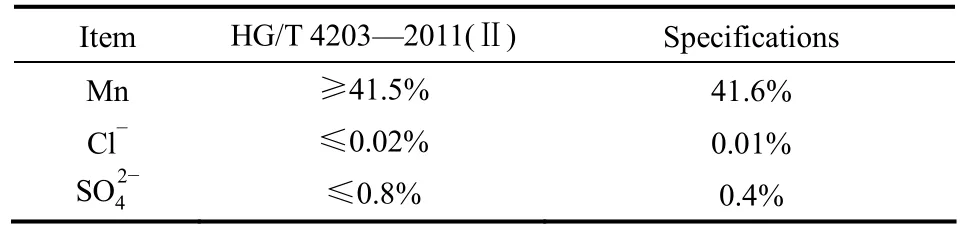
表2 工业碳酸锰技术指标Table 2 Manganese carbonate for industrial use
2.6.2 成本效益估算 在实验中反应釜的加热方式为电炉丝电加热,需要消耗电能。然而在工业应用中,完全可利用工厂锅炉蒸汽余热和酸浸废气余热为反应系统提供稳定热源,来维持反应所需的低热条件(45℃),故不对加热成本进行估算。
运行成本主要包括碱耗费、动力费和人工费,运行效益主要包括生产工业碳酸锰的经济效益和减少可溶性锰和二氧化碳排放的环境效益。根据实验结果可知,在初始锰浓度为 1400 mg·L-1的条件下每处理1 t含锰废水可获得2.9 kg工业碳酸锰产品(市场价 5元·kg-1),同时可实现减少排放可溶性锰1.4 kg和二氧化碳1.5 kg。根据现行国家排污费征收标准及计算方法,回收1.4 kg可溶性锰可减少排污费支出9.8元。计算结果见表3,以处理1 t含锰废水为计算单位。

表3 成本效益估算Table 3 Cost benefit analysis
由表3可知,运行总成本为7.2元·t-1,总效益为 24.3元·t-1。在考虑回收可溶性锰减少排污费支出 9.8元·t-1的情况下,可实现 17.1元·t-1的收益。
3 结 论
(1)以NaOH为pH调节剂,利用二氧化碳选择性分离回收含锰废水中锰的最佳反应条件为反应时间90 min,维持pH=6.6,反应温度45℃,搅拌速率 600 r·min-1,NaOH 投加量 2 g·L-1。在最佳反应条件下,钙、镁、锰的回收率分别为 47.00%、6.32%、99.79%,具有较好的分离效果,出水锰的浓度为2.94 mg·L-1,达到《污水综合排放标准》(GB 8978—1996)中总锰的三级排放标准。
(2)与NaOH相比,使用CaO作为pH调节剂时沉淀物成分复杂,碳酸锰含量较低且增加运行维护成本,不利于系统的长期运行。
(3)XRD、SEM 表征和碳酸锰质量分析结果显示该方法制取的碳酸锰符合《工业碳酸锰标准》(HG/T 4203—2011)合格品技术要求,具有很高的经济价值。
[1] LU J, DREISINGER D, GLÜCK T. Manganese electrodeposition —a literature review[J]. Hydrometallurgy, 2014, 141(2): 105-116.
[2] ZHANG W, CHENG C Y. Manganese metallurgy review (Ⅱ):Manganese separation and recovery from solution[J].Hydrometallurgy, 2007, 89(3/4): 160-177.
[3] WIECHEN M, NAJAFPOUR M M, ALLAKHVERDIEV S I, et al.Water oxidation catalysis by manganese oxides: learning from evolution[J]. Energy & Environmental Science, 2014, 7(7):2203-2212.
[4] BLACK J R, AMMERMAN C B, HENRY P R. Effects of high dietary manganese as manganese oxide or manganese carbonate in sheep[J]. Journal of Animal Science, 1985, 60(3): 861-866.
[5] YE L J, FAN D L, YANG P J. Characteristics of manganese ore deposits in China[J]. Ore Geology Reviews, 1988, 4(s1/2): 99-113.
[6] 段宁, 周长波, 于秀玲. 我国电解金属锰行业可持续发展探讨[J].长江流域资源与环境, 2007, 16(6): 764-768.DUAN N, ZHOU C B, YU X L. Analysis of sustainable development of the electrolytic manganese industry[J]. Resources and Environment in the Yangtze Basin, 2007, 16(6): 764-768.
[7] XU F Y, JIANG L H, DAN Z G, et al. Water balance analysis and wastewater recycling investigation in electrolytic manganese industry of China — a case study[J]. Hydrometallurgy, 2014, 149(7): 12-22.
[8] CHARERNTANYARAK L. Heavy metals removal by chemical coagulation and precipitation[J]. Water Science & Technology, 1999,39(10/11): 135-138.
[9] 何强, 王韧超, 柴宏祥, 等. 化学沉淀/混凝沉淀工艺序批式处理电解锰废水[J]. 中国给水排水, 2007, 23(10): 62-64.HE Q, WANG R C, CHAI H X, et al. Study on chemical precipitation/coagulation sedimentation process for sequencing batch treatment of electrolytic manganese wastewater[J]. China Water &Wastewater, 2007, 23(10): 62-64.
[10] TU Y J, CHANG C K, YOU C F, et al. Treatment of complex heavy metal wastewater using a multi-staged ferrite process[J]. Journal of Hazardous Materials, 2012, s209/210(4): 379-384.
[11] 钟琼, 高栗, 杨婵, 等. 用离子交换膜-电解法处理电解金属锰生产废水的研究[J]. 中国锰业, 2007, 25(1): 27-29.ZHONG Q, GAO L, YANG C, et al. On a study of waste in EMM production in electrolysis way-ion exchange film[J]. China Manganese Industry, 2007, 25(1): 27-29.
[12] 唐玉兰, 和娟娟, 武卫斌, 等. 曝气生物滤池同步除铁锰和氨氮[J].化工学报, 2011, 62(3): 792-796.TANG Y L, HE J J, WU W B, et al. Simultaneous removal of iron,manganese and ammonia in biological aerated filter[J]. CIESC Journal, 2011, 62(3): 792-796.
[13] XU J C, CHEN G, HUANG X F, et al. Iron and manganese removal by using manganese ore constructed wetlands in the reclamation of steel wastewater.[J]. Journal of Hazardous Materials, 2009, 169(1/2/3):309-317.
[14] PACINI V A, INGALLINELLA A M, SANGUINETTI G. Removal of iron and manganese using biological roughing up flow filtration technology[J]. Water Research, 2005, 39(18): 4463-4475.
[15] LEUNG D Y C, CARAMANNA G, MAROTO-VALER M M. An overview of current status of carbon dioxide capture and storage technologies[J]. Renewable & Sustainable Energy Reviews, 2014,39(6): 426-443.
[16] 包炜军, 李会泉, 张懿. 温室气体 CO2矿物碳酸化固定研究进展[J]. 化工学报, 2007, 58(1): 1-9.BAO W J, LI H Q, ZHANG Y, et al. Progress in carbon dioxide sequestration by mineral carbonation[J]. Journal of Chemical Industry and Engineering (China), 2007, 58(1): 1-9.
[17] JUANES R, SPITERI E J, ORR F M. Impact of relative permeability hysteresis on geological CO2storage[J]. Water Resources Research,2006, 42(12): 395-397.
[18] PAN Y, BIRDSEY R A, FANG J, et al. A large and persistent carbon sink in the world's forests.[J]. Science, 2011, 333(6045): 988-93.
[19] KANG S P, LEE H. Recovery of CO2from flue gas using gas hydrate:thermodynamic verification through phase equilibrium measurements[J]. Environmental Science & Technology, 2000, 34(20),4397-4400.
[20] LANGANKE J, WOLF A, HOFMANN J, et al. Carbon dioxide (CO2)as sustainable feedstock for polyurethane production[J]. Green Chemistry, 2014, 16(4): 1865-1870.
[21] SILVA A M, CRUZ F, LIMA R. Manganese and limestone interactions during mine water treatment[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 514-520.
[22] SILVA A M, CUNHA E C, SILVA F D R, et al. Treatment of high-manganese mine water with limestone and sodium carbonate[J].Journal of Cleaner Production, 2012, 29/30(5): 11-19.
[23] WANG N F, FANG Z J, PENG S, et al. Recovery of soluble manganese from electrolyte manganese residue using a combination of ammonia and CO2[J]. Hydrometallurgy, 2016, 164(4): 288-294.
[24] POKROVSKY O S. Precipitation of calcium and magnesium carbonates from homogeneous supersaturated solutions[J]. Journal of Crystal Growth, 1998, 186(1/2): 233-239.
[25] 何显达, 王勤, 陈艳红. 一种利用 CO2气体选择性沉淀分离镍锰的方法: 201110278293.6[P]. 2013-3-27.HE X D, WANG Q, CHEN Y H, et al. A method of separating nickel and manganese by selective precipitation using CO2:201110278293.6[P]. 2013-3-27.
[26] SUN R Y, LI Y J, LIU H L, et al. CO2capture performance of calcium-based sorbent doped with manganese salts during calcium looping cycle[J]. Applied Energy, 2012, 89(1): 368-373.
[27] HUBER P. Kinetics of CO2stripping and its effect on the saturation state of CaCO3upon aeration of a CaCO3-CO2-H2O system:application to scaling in the papermaking process[J]. Industrial &Engineering Chemistry Research, 2011, 50(24): 13655-13661.
[28] MA J, YOON R H. Use of reactive species in water for CO2mineralization[J]. Energy & Fuels, 2013, 27(8): 4190-4198.
[29] 李波. 金属碳酸盐沉淀过程的热力学分析[J]. 稀有金属与硬质合金, 2005, 33(2): 4-8.LI B. The thermodynamics analysis on the deposition process of metal carbonates[J]. Rare Metals and Cemented Carbides, 2005, 33(2):4-8.
[30] 蒋文杰, 张昭. 硫酸锰溶液中镁离子的沉淀行为研究[J]. 无机盐工业, 2014, 46(10): 34-38.JIANG W J, ZHANG Z. Precipitation behavior of magnesium ion in manganese sulfate solution[J]. Inorganic Chemicals Industry, 2014,46(10): 34-38.
Selective separation and recovery of manganese from manganese-bearing wastewater using carbon dioxide
MEI Ying, XUE Yuhua, YE Hengpeng, DU Dongyun
(Institute of Environmental Science and Engineering, School of Resources and Environmental Science, Key Laboratory of Catalysis and Materials Science of the State Ethnic Affairs Commission & Ministry of Education, South-Central University for Nationalities,Wuhan 430074, Hubei, China)
This article studied the effects of different parameters including reaction time, pH, temperature,agitation speed, pH regulator type, dosage on the selective separation, and recovery of manganese from manganese-bearing wastewater using carbon dioxide. Optimum condition was determined by the highest recovery rate of manganese. The results showed that the recovery ratio of manganese was 99.79% with reaction time of 90 min, pH of 6.6, temperature of 45℃, agitation speed of 600 r·min-1, and NaOH concentration of 2 g·L-1. Mn concentration in the effluent was lower than 5 mg·L-1, which met the third level integrated wastewater discharge standard (GB 8978—1996). The precipitate was able to meet the conforming product of manganese carbonate for industrial use standard (HG/T 4203—2011).
manganese-bearing wastewater; carbon dioxide; selective separation and recovery; precipitate;manganese carbonate
date:2016-12-12.
Prof. DU Dongyun, dydu666@mail.scuec.edu.cn
supported by National Key Technology Research and Development Program of China (2015BAB01B03).
X 75
A
0438—1157(2017)07—2798—07
10.11949/j.issn.0438-1157.20161737
2016-12-12收到初稿,2017-03-29收到修改稿。
联系人:杜冬云。
梅颖(1991—),男,硕士研究生。
国家科技支撑计划课题(2015BAB01B03)。
——以准噶尔盆地高探1井为例

