烟草总植物碱国际共同实验测定方法的比对
李跑,马雁军,马莉,张威,周骏,杜国荣,*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.上海烟草集团有限责任公司技术中心北京工作站,北京 101121;3.国家烟草质量监督检验中心,河南 郑州 450001)
烟草总植物碱国际共同实验测定方法的比对
李跑1,马雁军2,马莉2,张威3,周骏2,杜国荣1,2*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.上海烟草集团有限责任公司技术中心北京工作站,北京 101121;3.国家烟草质量监督检验中心,河南 郑州 450001)
联合国际烟草科学研究合作中心(CORESTA)10家国际共同实验室,对8个烟草样品分别用水和乙酸萃取、用连续流动(硫氰酸钾)法(NM法)替代高毒性氰化钾法(CRM35法)提取总植物碱,8个烟草样品的总植物碱含量为1.00%~5.00%。使用重现性和再现性、配对T检验、Bland–Altman、Passing–Bablok回归方法,对10个实验室的检测数据进行比对。结果表明:NM法和CRM35法的测定值相近;水萃取结果都略高于乙酸萃取结果,相对平均偏差小于4.00%;水萃取法和乙酸萃取法之间存在线性关系,且可以通过Passing–Bablok回归法实现不同萃取体系结果的相互转化。NM法避免了使用高毒的氰化钾试剂,且得到结果与CRM35一致,适用于烟草中总植物碱的测定。
烟草;总植物碱;配对T检验;Bland–Altman法;Passing–Bablok法
烟草总植物碱包括近 50种生物碱类物质,其中烟碱占植物碱总量的 95%以上[1–2]。目前测定烟草及其制品中总植物碱含量采用的方法,一类是光度法[3],另一类是连续流动法[4–5]。光度法操作过程包括蒸馏和光度测定两步,受蒸馏装置和单次测定量的限制,检测周期较长,难以适应大批量样品的检测需求,常被用作定标。连续流动法由SADELER等[6]首次采用。1981年,HARVEY等[7]提出使用氰化钾和氯胺T在线反应生成氯化氰,代替溴化氰测定总植物碱的连续流动法,避免使用易挥发、易爆炸、易分解、剧毒的溴化氰。国际烟草科学研究合作中心(CORESTA)借鉴HARVEY等的研究成果,于1994年发布了35号推荐方法(简称CRM35法)。该方法中仍使用氰化钾,依然存在使用危险和管理风险。自2011年起,CORESTA化学常规分学组先后着手用无毒的硫氰化钾与次氯酸钠、硫氰化钾与二水合二氯异氰尿酸钠(简称DCIC)的在线反应代替氰化钾和氯胺T在线反应的研究工作,但是次氯酸钠为液体,易分解,不稳定,用前要采用滴定方法确定其有效氯浓度,因此采用硫氰化钾与 DCIC在线反应比较理想。从安全性和技术进步角度出发,且保持与CRM35法测定准确度一致的前提下,中国国家烟草质量监督检测中心与上海烟草集团有限责任公司技术中心北京工作站率先找到了硫氰化钾与 DCIC最佳在线反应条件和缓冲体系[8],在CORESTA化学常规分学组会议上,提出了连续流动(硫氰酸钾)法(简称 NM 法)测定烟草及其制品总植物碱含量国际共同实验方案,涉及乙酸或水萃取2种方式。该方法经过2年多的CORESTA国际共同实验的验证,现已被CORESTA国际组织认可。
为了验证NM法和CRM35法测定烟草及其制品总植物碱结果的一致性,笔者提供了8个具代表性的样品,分发给 10家国际共同实验室,进行水萃取和5%乙酸萃取条件下的NM法和CRM35法测定总植物碱含量的国际共同实验。对CORESTA国际共同实验结果,按ISO 5725—2[9]标准规定,采用重现性和再现性、配对 T检验、Bland–Altman、Passing– Bablok回归方法进行一致性对比。
1 材料与方法
1.1 材料
国际共同实验样品,烤烟(A)、白肋烟(B)、香料烟(C)、晒红烟(D)、中式烤烟(E)、中式混合型卷烟2(F),由国家烟草质量监督检验中心提供;国际共同实验标烟 CM7(G)和 3R4F(H)由 CORESTA常规化学分学组提供。
1.2 测定项目及方法
样品水分含量按YC/T 31—1996方法测定。分别按 CRM35法(YC/T 160—2002)和 NM 法(YC/T 468—2013)测定烟草样品的总植物碱含量。
1.3 一致性评价方法
运用重现性和再现性[10]、配对 T检验[11–15]、Bland–Altman 检验[16–20]、线性回归法[21]4 种方法对10个实验室的测定结果进行一致性比对。
2 结果与分析
2.1 烟草样品总植物碱的含量
图1显示了10家实验室水萃取和乙酸萃取下CRM35法和NM法测定8个烟草样品总植物碱含量的平均值及标准偏差。从图1中可以看出,在相同的萃取方式下,CRM35法和NM法的结果差别较小;水萃取的结果略高于乙酸萃取的;部分实验室的测定结果可能是离群值,如5号实验室的样品E的测定结果偏高,4号实验室的CRM35水萃取体系结果较其他实验室的偏高,10号实验室的乙酸萃取结果较其他实验室的都偏低。

图1 10家实验室烟草样品总植物碱的测定结果Fig.1 The measured data for total alkaloids of tobacco in the ten labs
为了剔除异常值,首先使用Grubb Test剔除实验室内的异常值,再按照ISO 5725—2方法,剔除包含异常值的实验室,结果见表 1。在计算时设定最多剔除2家实验室结果,以便保留足够数据进行后续分析。经过分析,6号、9号、10号实验室出现异常的情况较多,分别为10次、7次、6次。

表1 异常值检验结果Table 1 Outlier test results
2.2 再现性限、重现性比对结果
剔除异常值后,8个样品CRM35法、NM法的水萃取、乙酸萃取95%概率再现性限、重现性限值,以及实验室平均值分布见图2。相同萃取条件下,2种方法的结果一致,相对偏差低于3.00%;水萃取结果略高于乙酸萃取结果,相对偏差低于4.00%。水萃取下,CRM35的重复性较大;乙酸萃取下,NM 的重复性较大。2种方法的再现性都较小。4种总植物碱测定方式的再现性限占比最大为26.93%,与CRM35方法再现性一致。
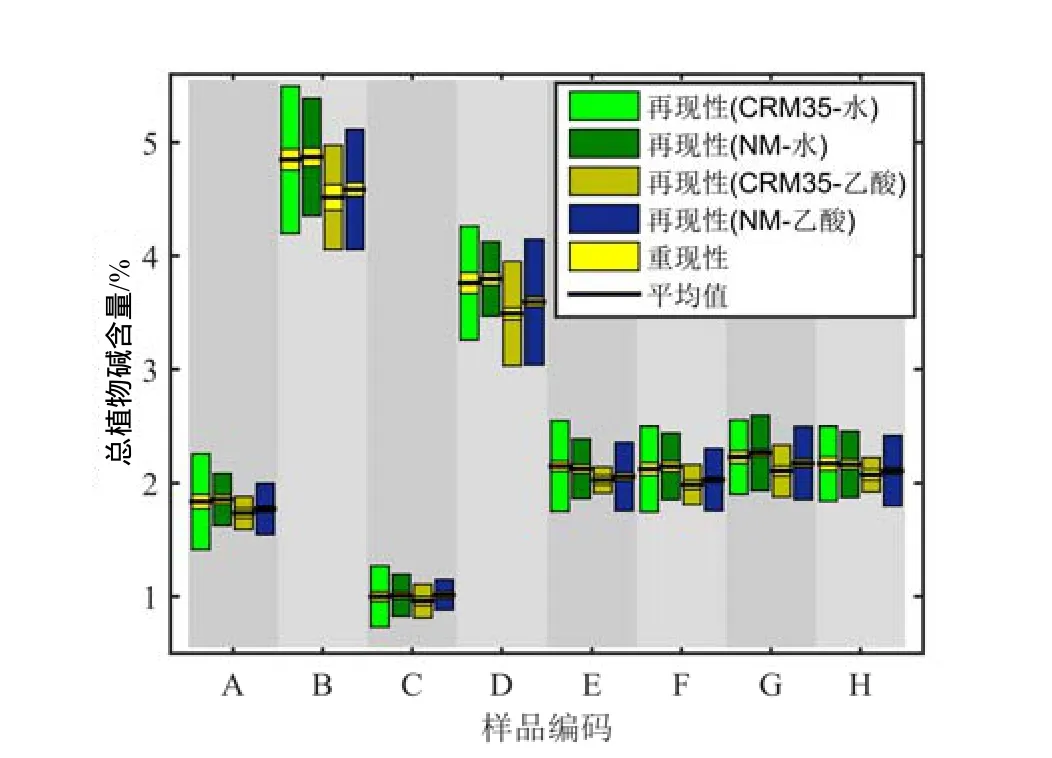
图2 CRM35和NM法的重现性和再现性结果Fig.2 The repeatability and reproducibility by CRM35 and NM methods
2.3 配对T检验法判断一致性结果
使用双尾配对T检验,分别对10家实验室的结果进行分析。剔除异常值后,结果见表2。使用实验室总体均值计算时,只有水萃取体系时,2种方法的结果系统误差小,P值大于0.05。乙酸萃取条件下2种方法的偏差很小,仍然无法通过配对T检验。原因可能是配对T检验容易受随机误差影响,需要和其他方法辅助进行分析。单个实验室结果的配对 T检验结果差别较大,无法得出统一的结论,因此需要采用其他方法进一步分析。

表2 配对T检验结果Table 2 Results of paired-t test
2.4 Bland-Altman法判断一致性结果
遵循Bland–Altman方法的指导原则,使用原始数据进行分析。8个样品实验室均值的 Bland–Altman比对结果见图3。图中蓝色虚线为方法间差值的平均值,红色实线为95%一致性限,阴影部分为一致性限的置信限。不同萃取条件下,CRM35法结果的差值和平均值的相关系数为0.988,NM 法的乙酸萃取为0.971,因而参照文献[14]进行了线性校正,结果如图3–C、图3–D所示。蓝色虚线是校正后方法间差值的均值分布。从图3–A、图3–B看出,相同萃取条件下,2种方法的差异非常小,都在0附近波动。同样方法在不同萃取条件下,方法间偏差都随样品浓度增加而增加,且具有较好的线性关系(图 3–C、图 3–D)。4种比较方式的 Bland–Altman分析结果都在95%一致性限内,表明方法间结果一致。此外,还计算了10家实验室的Bland–Altman结果,所有实验室的4种比较方式的结果都位于95%一致性限内。
为了比较各家实验室的Bland–Altman结果,表3列出了各家实验室及所有实验室Bland–Altman法95%一致性限。若结果经过回归校正,表3中列出方法差异平均值对应的上限和下限。排除受异常值影响严重的5号实验室,其余实验室的95%一致性区间都很窄,4种测定方式的单个实验室一致性限范围的中位值分别为0.227 5、0.185 4、0.163 4、0.165 2,表明方法间的一致性较好。

图3 Bland-Altman法结果Fig.3 Bland-Altman results

表3 Bland-Altman检验95%一致性限结果Table3 Results with 95% agreement limits determined by Bland-Altman method
2.5 Passing-Bablok回归分析
由Bland–Altman法比对知,水萃取和乙酸萃取结果之间的偏差与样品总植物碱含量呈线性关系。图4为4种比较方式结果的Passing–Bablok法线性回归图。表4列出了测定结果间的相关系数、拟合前均方根误差(RMSE)、线性回归的预测均方根误差(RMSEP)。从图4–A和图4–B看出,相同萃取条件下,2种方法的测定值的拟合线与正比例函数(y=x)线非常接近。相关系数均大于0.989 6,表明4种比较方式结果之间都具有线性关系,可以通过线性回归进行校正。图4–C和图4–D分别显示了CRM35、NM在不同萃取条件下结果的线性关系。经过线性回归后,相同方法在不同萃取条件下结果的均方根误差明显减小(表4),表明可以通过转换降低不同萃取条件下测定结果间的差异。

图4 使用最小二乘法判断一致性结果Fig.4 Least squares regression results

表4 Passing-Bablok法回归结果Table 4 Results of Passing-Bablok method
CRM35法和NM法都基于萃取液中的总植物碱(以烟碱计)与对氨基苯磺酸和氯化氰反应机理,差别在于氯化氰的生成方式不同,2种方法在水溶液中都会产成 ClO–,如果体系环境偏酸性,ClO–可能会与植物碱发生氧化还原反应,致使最终检测到的植物碱含量偏低[11],乙酸萃取体系显酸性,所以其结果低于中性的水萃取体系结果。
3 结论
对CRESTA的10家共同实验室8个烟草样品的水萃取和乙酸萃取的2种方法检测总植物碱结果进行分析,结果表明,相同萃取条件下,CRM35、NM检测结果的相对偏差小于3.00%;不同萃取条件下,CRM35和 NM 检测结果的相对偏差小于4.00%,水萃取体系结果略高。使用配对T检验方法比对不同实验室的检测值呈现不一致性结果,需要其他方法辅助进行分析。Bland–Altman法结果表明,4种比较方式下,方法之间的结果都是一致的;不同萃取条件下的结果需要经过线性回归校正。使用Passing–Bablok法得出了不同萃取条件下,结果之间的线性关系,可以通过该法实现不同萃取体系结果的相互转化。
参考文献:
[1] 金闻博,戴亚,雍国平,等.烟碱的合成、代谢和作用[J].烟草科技,1995(1):14–16.
[2] ISO 15152 — 2003 Tobacco–determination of the content of total alkaloids as nicotine–continuous–flow analysis method [S].
[3] GB/T 23225—2008 烟草及烟草制品 总植物碱的测定光度法[S].
[4] YC/T 160—2002 烟草及烟草制品 总植物碱的测定连续流动法[S].
[5] YC/T 468—2013 烟草及烟草制品 总植物碱的测定连续流动(硫氰酸钾)法 [S].
[6] SADELER W W,CHESSON R R,SCHOENBAUM A W.Automated procedure for determining the nicotine content of steam distillates[J].Tobacco,1960,4:208.
[7] HARVEY W R,HANDY B M.On–line generation of cyanogen chloride as a replacement for cyanogen bromide in the total alkaloids determination[J].Tobacco,1981,20:131.
[8] 张杰,马雁军,石睿,等.硫氰化钾与 DCIC反应法测定烟草总植物碱[J].烟草科技,2014(5):60–63.
[9] ISO 5725–2—1994 Accuracy (trueness and precision)of measurement methods and results – Part 2: basic method for the determination of repeatability and reproducibility of a standard measurement method [S].
[10] BARTLETT J W,FROST C.Reliability, repeatability and reproducibility: analysis of measurement errors in continuous variables[J].Ultrasound Obstet Gynecol,2008,31(4):466–475.
[11] PERONICO V C D,JORGE Luiz R.Ultrasound–assisted extraction for the determination of Cu, Mn, Ca, and Mg in alternative oilseed crops using flame atomic absorption spectrometry[J].Food Chem,2016,196:1287–1292.
[12] LIMA R A,ALMEIDA L F,LYRA W S,et al.Digital movie–based on automatic titrations[J].Talanta,2016,147:226–232.
[13] ALTUNAY N,GÜRKAN R.A new simple UV–Vis spectrophotometric method for determination of sulfite species in vegetables and dried fruits using a preconcentration process[J].Anal Methods,2015,8(2):342–352.
[14] BLAND J M,ALTMAN D G.Comparing two methods of clinical measurement: a personal history[J].Int J Epidemiol,1995,24 (S1):7–14.
[15] ATKINSON G,NEVILL A M.Statistical methods for assessing measurement error (reliability) in variables relevant to sports medicine[J].Sports Med,1998,26(4):217–238.
[16] BLAND J M,ALTMAN D G.Statistical methods for assessing agreement between two methods of clinical measurement[J].Lancet,1986,327:307–310.
[17] BLAND J M,ALTMAN D G.Measuring agreement in method comparison studies[J].Stat Med,1999,8(2):135–160.
[18] CARKEET A.Exact parametric confidence intervals for bland–altman limits of agreement[J].Optom Vis Sci,2015,92(3):71–80.
[19] MORADI A,PRAMANIK S,ATAOLLAHI F,et al.Archimedes revisited: computer assisted micro–volumetric modification of the liquid displacement method for porosity measurement of highly porous light materials[J].Anal Methods,2014,6:4396–4401.
[20] ISLAM K M,SCHWEIGERT F J.Comparison of three spectrophotometric methods for analysis of egg yolk carotenoids[J].Food Chem,2015,172:233–237.
[21] PASSING H,BABLOK W.A new biometrical procedure for testing the equality of measurements from two different analytical methods[J].J Clin Chem Clin Biochem,1983,21(11):709–720.
责任编辑:罗慧敏
英文编辑:罗 维
A comparative study of international collaborative methods for determination of total alkaloids in tobacco
LI Pao1, MA Yanjun2, MA Li2, ZHANG Wei3, ZHOU Jun2, DU Guorong1,2*
(1.College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2.Beijing Work Station, Technology Center, Shanghai Tobacco Group Co. Ltd., Beijing 101121, China; 3.China National Tobacco Quality Supervise and Test Center, Zhengzhou 450001, China)
Eight tobacco samples were tested in cooperation centre for scientific research relative to tobacco(CORESTA)collaborative study by ten laboratories. The total alkaloids were extracted by water and acetic acid and determined by NM method and CRM35 method, respectively. The total alkaloids are ranging from 1% to 5%. The repeatability and reproducibility were calculated and comparative study was achieved by paired–t test, Bland–Altman analysis and Passing–Bablok regression. Results show that agreement results were obtained by NM and CRM35 whether water or acetic acid is used. The results with water extraction were higher than that with acetic acid extraction for both NM and CRM35, and the relative deviation was lower than 4%. Besides, there is a linear relationship between the results of water extraction and acetic acid extraction and the differences caused by extractions can be modeled by Passing–Bablok regression analysis. NM method avoid the use of KCN, and the results obtained were agreeable to those obtained by CRM35 method which used KCN, indicating NM is suitable for the determination of total alkaloid in tobacco.
tobaccos; total alkaloids; paired–t test; Bland–Altman; Passing–Bablok
S572.01
A
1007-1032(2017)04-0388-06
2017–04–12
2017–05–22
国家自然科学基金项目( 31601551);湖南农业大学青年基金项目(15YJ08);湖南农业大学食品科学技术学院青年科学基金项目
李跑(1989—),男,湖南长沙人,博士研究生,主要从事烟草化学与数理统计分析研究,lipao@live.cn;*通信作者,杜国荣,博士研究生,主要从事烟草化学与数理统计分析研究,nkchem09@126.com

