肝细胞肝癌组织异黏蛋白的表达变化及临床意义
朱 凯, 战 昊, 周 俭, 樊 嘉, 代 智*
1. 复旦大学附属中山医院肝脏外科,复旦大学肝癌研究所,上海 200032 2. 教育部癌变与侵袭原理重点实验室,上海 200032
·论 著·
肝细胞肝癌组织异黏蛋白的表达变化及临床意义
朱 凯1,2, 战 昊1,2, 周 俭1,2, 樊 嘉1,2, 代 智1,2*
1. 复旦大学附属中山医院肝脏外科,复旦大学肝癌研究所,上海 200032 2. 教育部癌变与侵袭原理重点实验室,上海 200032
目的: 观察异黏蛋白(metadherin, MTDH)在肝细胞肝癌(HCC)组织中的表达变化,并探讨其可能的临床价值。方法: 对含323例肝细胞肝癌患者肿瘤及癌旁正常肝脏组织的组织芯片进行免疫组化染色,分析MTDH的表达情况及其与肝癌患者临床特征之间的关系。进一步采用免疫共沉淀(Co-Immunoprecipitation, Co-IP)结合质谱(mass spectrometry)技术寻找异黏蛋白的功能复合体。结果: 免疫组化结果显示MTDH在肝癌组织中表达明显高于癌旁正常肝脏组织,在有微血管侵犯、卫星结节、低分化和TNM分期Ⅱ~Ⅲ期的患者中升高尤其明显(P<0.01)。低MTDH表达组患者的1、3、5年生存率和无复发生存时间明显优于高MTDH表达组(P<0.05)。免疫共沉淀技术发现MTDH能与PRMT5形成蛋白复合体。结论: MTDH有助于判断肝癌患者术后预后,可作为潜在的预后指标。
异黏蛋白;肝细胞肝癌;肿瘤转移;预后
肝细胞肝癌(hepatocellular carcinoma, HCC,以下简称肝癌)是最常见的肝脏恶性肿瘤,也是世界范围内主要的健康问题之一。尽管外科切除和肝移植为治愈肝癌提供了一定的机会,但由于复发和转移率较高,肝癌的预后仍不理想。因此,寻找能指导预后和作为治疗靶点的分子标记对肝癌的治疗非常重要。
异黏蛋白(metadherin, MTDH)是近期发现的一种重要的促癌蛋白,在多条信号通路中发挥作用。癌基因H-ras通过激活phosphatidylinositol 3-kinase (PI3K)/Akt通路能明显促进MTDH的表达[1],MTDH同时也能影响PI3K/Akt的磷酸化水平[2-3]。MTDH还能促进核因子κB(NF-κB)介导的肿瘤进展和转移[4-5]。MTDH的表达增加能促进血管生成相关因子,包括血管生成素-1(angiopoietin-1)、基质金属蛋白酶-2(matrix metalloprotease-2, MMP-2)、缺氧诱导因子-1(hypoxia-inducible factor 1-α, HIF1-α)[6]和基质金属蛋白酶-9(matrix metalloprotease-9, MMP-9)[7]等的表达。但目前对于MTDH在肝癌患者预后中的价值尚未见报道。本研究旨在检测MTDH在肝癌组织中的表达及其预后价值,并探讨其在调节肝癌转移中的可能作用。
1 资料与方法
1.1 一般资料 入选患者为2003年1月至2004年3月复旦大学附属中山医院肝外科连续收治的323例原发性肝细胞肝癌患者,均接受了肝脏肿瘤切除手术。以323例肝细胞肝癌患者肿瘤及正常肝脏组织的组织芯片作为研究对象。患者术前均无远处转移,肝功能均为Child-Pugh A,其中278例(86.1%)感染了乙肝病毒。诊断均经病理证实。患者具体的临床病理特征见表1。本研究经复旦大学附属中山医院医学研究伦理委员会审核通过。最后随访时间为2009年3月15日,中位随访时间为66(2.3~74.0)个月。复发后治疗参照文献[8]。
1.2 免疫组化染色测定MTDH表达 组织芯片构建及免疫组化方法参照文献[8],所用抗体由Abcam公司提供(ab45338)。染色强度分为高低两组[以平均光密度(median integrated optical density, mIOD)为分界点,MTDHHigh为IOD大于mIOD,MTDHLow为IOD≤mIOD]。
1.3 免疫共沉淀与2D-LC-MS/MS技术 免疫共沉淀与2D-LC-MS/MS方法参照文献[9]。将细胞用预冷的PBS洗涤2次,然后用含有蛋白酶抑制剂(Roche)的RIPA裂解。通过12 000×g离心除去不溶物后,将溶解的提取物与50 μL兔抗人单克隆MTDH抗体偶联的蛋白A/G珠孵育4℃过夜。然后用裂解缓冲液洗涤珠子5次,然后在5×缓冲液中煮沸。免疫沉淀物在SDS-PAGE变性凝胶上电泳分离,通过考马斯蓝染色显现,取感兴趣的蛋白质条带用于MS分析。在反射模式下以19 kV加速电压进行MS,m/z范围为400~2 000。使用SEQUEST(v.28,Bioworks 3.3软件包,Thermo Electron)针对人国际蛋白质指数(IPI)数据库(IPI人v3.45 FASTA,具有71 983个条目)鉴定所有MS/MS数据。
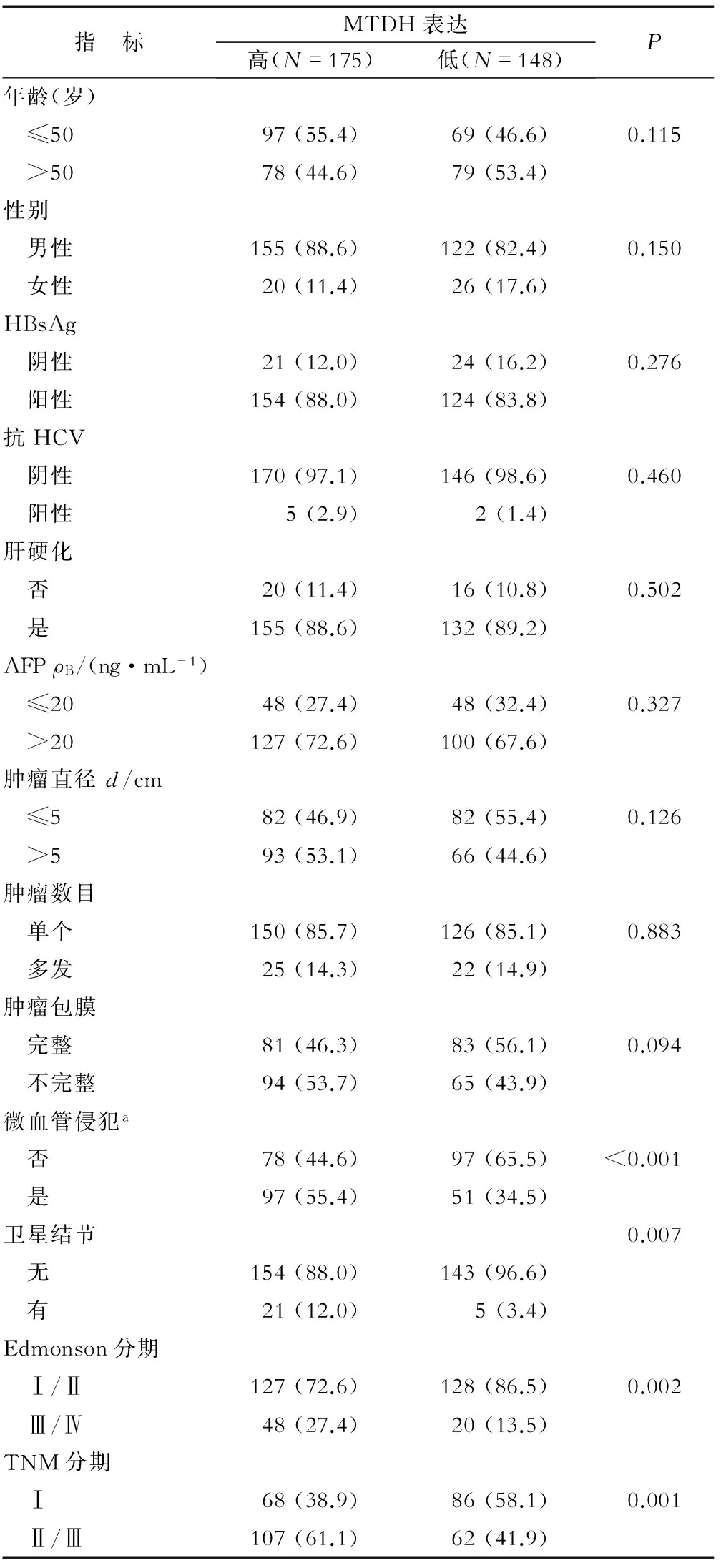
表1 患者肿瘤组织中MTDH表达与临床病理特征的关系 n(%)
a微血管侵犯:内皮细胞衬覆的血管腔内有癌细胞巢团,当脉管腔内出现悬浮癌细胞数目≥50个时,即可计为微血管侵犯
1.4 统计学处理 采用SPSS 17.0(SPSS, Chicago, IL)进行统计分析。MTDH表达情况与其他临床病理特征之间关系用Pearson卡方检验验证。随访方法参见文献[10],总生存期(overall survival, OS)定义为肝癌切除与死亡之间间隔时间,至复发时间定义为肝癌切除与影像学证实的复发/转移之间间隔时间。绘制总生存和复发的Kaplan-Meier生存曲线,并对其进行log-rank检验。采用单因素和多因素分析方法分析各因素对预后的影响。检验水准(α)为0.05。
2 结 果
2.1 MTDH表达与肝癌患者临床病理特征之间的关系 免疫组化染色结果显示:MTDH主要分布在细胞膜和细胞质中,大部分肿瘤组织表达均高于对应的正常肝脏组织(图1A~1D)。其中划分为MTDHHigh的占54.2%。MTDH过表达与微血管侵犯(P<0.001),卫星结节(P=0.007),肿瘤低分化(P=0.002)及TNM分期(P=0.001)密切相关(表1)。结果提示在有微血管侵犯、卫星结节、低分化和TNM分期Ⅱ~Ⅲ期的患者中,肿瘤组织更容易高表达MTDH。MTDH表达与其他因素如年龄、性别、肝硬化、血清AFP、肿瘤大小或有无包膜之间无明显相关。
2.2 MTDH表达与肝癌患者临床预后的相关性 直到2009年3月的最后随访,54.2%(175/323)的患者发生了复发或转移,51.1%(165/323)死于该病。术后1、3、5年总生存率和复发率在323例患者中分别为85.4%和25.4%,62.2%和50.2%,50.7%和59.7%。结果(图1E、1F)表明:术后1、3、5年总生存率在MTDHHigh组中明显低于MTDHLow组(83.0%vs89.7%,52.0%vs75.3%,37.4%vs66.9%,P<0.001);复发率则明显高于MTDHLow组(32.4%vs16.8%,61.2%vs38.2%,70.7%vs47.8%,P<0.001)。
单因素和多因素分析结果(表2、表3)显示:对于总生存时间和复发,MTDH表达与肿瘤大小、有无包膜、微血管侵犯及TNM分期都是肝癌预后的重要影响因素。
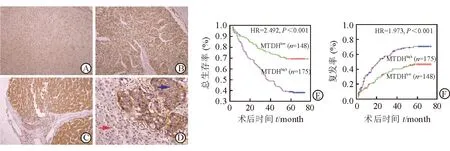
图1 肝癌组织中MTDH的表达
A:正常肝脏组织中MTDH低表达;B,C:肝癌组织中MTDH高表达;D:癌(蓝色箭头)与癌旁组织(红色箭头)的MTDH表达情况;E,F:Kaplan-Meier生存曲线显示,MTDH表达升高的患者,总生存率(E)更短,复发率(F)更高
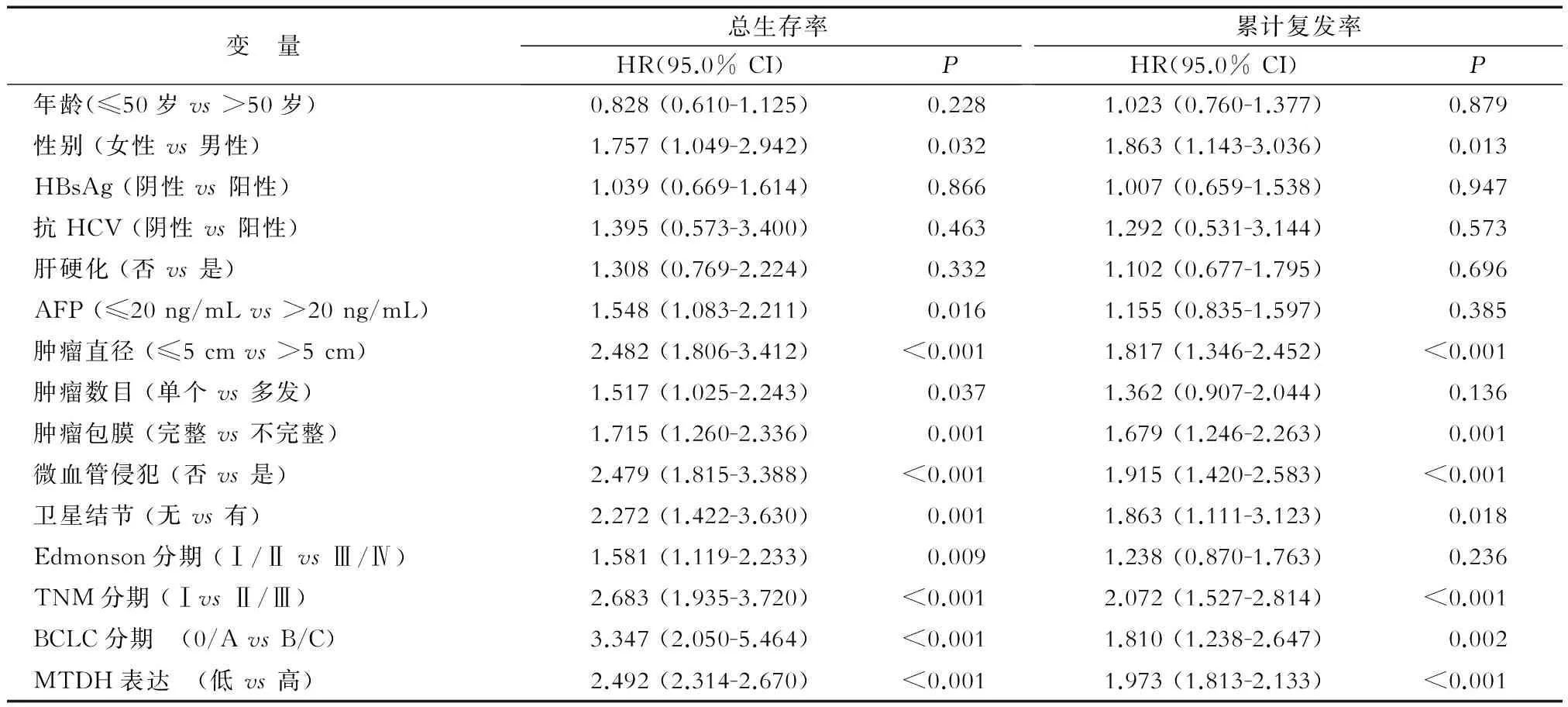
表2 肝癌患者术后总生存期和疾病复发影响因素的单因素回归分析
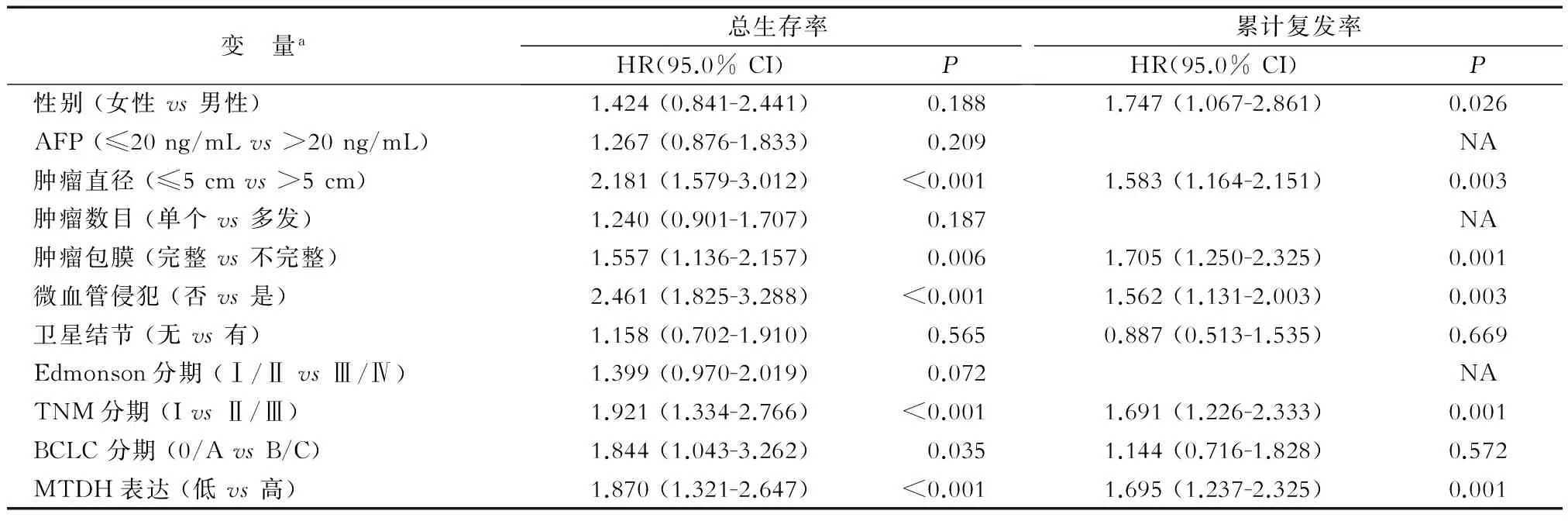
表3 肝癌患者术后总生存期和疾病复发影响因素的多因素回归分析
a在单因素分析中有统计学意义的因素被纳入多因素分析,分析方法为Cox回归分析的Forward LR法
2.3 Co-IP结合质谱技术寻找MTDH的功能复合体 对过表达MTDH(MTDH组)和对照组(CTRL组)HepG2细胞提取蛋白进行Co-IP,收集能与MTDH结合的蛋白。对这些蛋白进行SDS-PAGE电泳分离后发现,当MTDH含量增加后,多种蛋白含量明显增加(图2A)。选取蛋白含量增加最明显的条带(相对分子质量72 000处)进一步研究,质谱分析显示,相对分子质量72 000处变化最明显的蛋白质为PRMT5,提示MTDH能与PRMT5特异性结合。为了进一步证实MTDH与PRMT5之间的关系,以IgG为对照,分别利用抗MTDH和抗PRMT5抗体进行了Co-IP验证(图2B),进一步证实了MTDH能与PRMT5特异性结合。
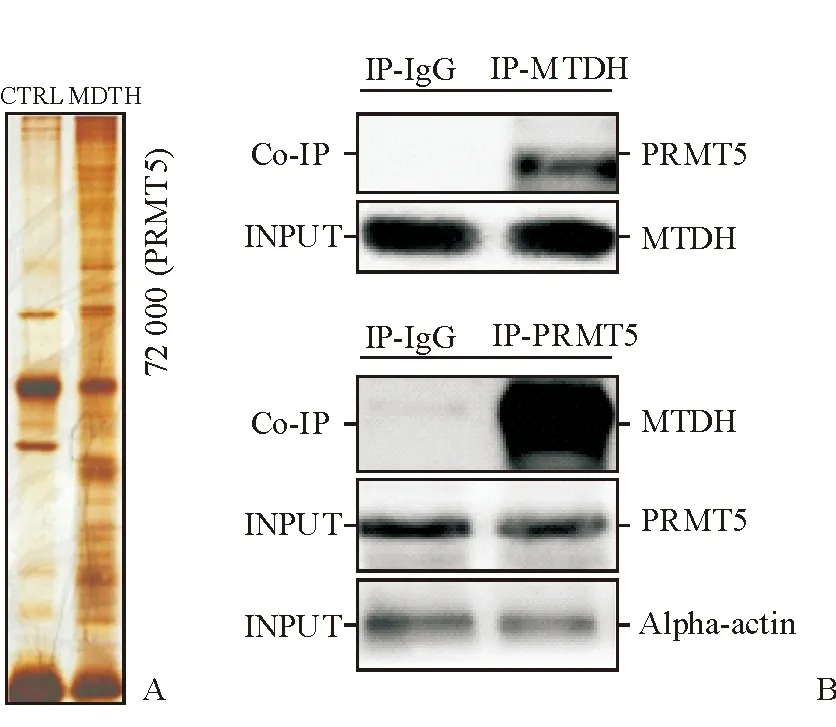
图2 MTDH特异性结合蛋白的筛选及验证
A:利用抗MTDH抗体进行Co-IP,对提取出的结合蛋白的SDS-PAGE电泳分离结果,当MTDH表达增加后,相对分子质量72 000处条带增加最明显;B:对HepG2细胞提取蛋白进行Co-IP,以IgG为对照,分别用抗MTDH抗体和抗PRMT5抗体提取蛋白,然后利用Western印迹检测结合蛋白. INPUT:总蛋白中的蛋白含量;Co-IP:免疫共沉淀法检测到的结合蛋白含量
3 讨 论
我们的前期研究[11]显示,miR-302c在内皮细胞中通过抑制MTDH从而抑制细胞的内皮-间质转化。本研究进一步探讨了MTDH在肝癌中的作用。MTDH是一种单链跨膜蛋白,其基因定位于8q22[12],这一区域的异常与许多肿瘤相关[13-14]。MTDH被证明在多种肿瘤中过表达,且与肿瘤的发生和转移有密切的关系,正日益受到肿瘤学家的关注。
研究证实,MTDH在调节细胞增殖、血管生成、肿瘤耐药以及干细胞分化中均发挥了重要的作用[15]。本研究利用包含323例肝癌患者肿瘤及正常肝组织的组织芯片评估了MTDH的表达,发现MTDH在很大比例的肝癌组织中表达升高,且与肿瘤分化和分期明显相关。这一情况在其他肿瘤如乳腺癌[13]、恶性胶质瘤[7]中也能发现。此外,生存分析显示MTDH过表达预示肝癌患者的总生存期缩短,复发率升高。这些结果均显示MTDH可以作为提示肝癌侵袭性的指标以及预后的预测因子。
MTDH在恶性肿瘤中发挥作用的机制还未明确。本研究通过免疫共沉淀结合质谱技术首次发现:MTDH能特异性与PRMT5形成功能复合体。PRMT5是一种重要的精氨酸甲基转移酶(protein arginine methyltransferase, PRMT)[16]。它通过与不同蛋白质结合形成功能复合体,参与包括DNA修复、胞核/胞质转运、mRNA转录、信号转导等多种细胞活动[17-19]。
PRMT5的异常表达与肿瘤发生发展也具有密切的关系[20-23]。如Pal等[20]发现,PRMT5能通过抑制抑癌基因tumorigenicity 7和nonmetastatic 23的表达,从而促进肿瘤细胞的生长。近来有研究显示,PRMT5在EMT中也具有一定的作用。Hou等[24]发现,PRMT5能与EMT关键转录因子snail结合形成功能复合体,从而抑制EMT关键蛋白E-cadherin的表达,促进EMT的发生。结果提示MTDH能与PRMT5结合成为功能复合体,从而在肝癌复发及转移中发挥重要作用,但其详细机制有待进一步体内及体外实验证实。
综上所述,本研究表明MTDH在肝细胞肝癌中过表达提示肝癌侵袭及预后不良,可作为肝癌预后的潜在预测指标及靶向治疗的有效靶点。
[1] LEE S G, SU Z Z, EMDAD L, et al. Astrocyte elevated gene-1 (AEG-1) is a target gene of oncogenic Ha-ras requiring phosphatidylinositol 3-kinase and c-Myc[J].Proc Natl Acad Sci USA, 2006,103(46):17390-17395.
[2] LEE S G, SU Z Z, EMDAD L, et al. Astrocyte elevated gene-1 activates cell survival pathways through PI3K-Akt signaling[J].Oncogene, 2008,27(8):1114-1121.
[3] LI J, YANG L, SONG L, et al. Astrocyte elevated gene-1 is a proliferation promoter in breast cancer via suppressing transcriptional factor FOXO1[J].Oncogene, 2009,28(36): 3188- 3196.
[4] EMDAD L, SARKAR D, SU Z Z, et al. Activation of the nuclear factor kappaB pathway by astrocyte elevated gene-1: implications for tumor progression and metastasis[J]. Cancer Res, 2006,66(3):1509-1516.
[5] SARKAR D, PARK E S, EMDAD L, et al. Molecular basis of nuclear factor-kappaB activation by astrocyte elevated gene-1[J]. Cancer Res, 2008,68(5):1478-1484.
[6] EMDAD L, LEE S G, SU Z Z, et al. Astrocyte elevated gene-1 (AEG-1) functions as an oncogene and regulates angiogenesis[J].Proc Natl Acad Sci USA, 2009,106(50): 21300-21305.
[7] LIU L, WU J, YING Z, et al. Astrocyte elevated gene-1 upregulates matrix metalloproteinase-9 and induces human glioma invasion[J]. Cancer Res, 2010,70(9):3750-3759.
[8] GAO Q, QIU S J, FAN J, et al. Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J]. J Clin Oncol, 2007,25(18):2586-2593.
[9] BAI D S, DAI Z, ZHOU J, et al. Capn4 overexpression underlies tumor invasion and metastasis after liver transplantation for hepatocellular carcinoma[J]. Hepatology, 2009,49(2):460-470.
[10] Ke A W, Shi G M, Zhou J, et al. Role of overexpression of CD151 and/or c-Met in predicting prognosis of hepatocellular carcinoma[J]. Hepatology, 2009,49(2):491-503.
[11] ZHU K, PAN Q, JIA L Q, et al. MiR-302c inhibits tumor growth of hepatocellular carcinoma by suppressing the endothelial-mesenchymal transition of endothelial cells[J]. Sci Rep, 2014,4:5524.
[12] KANG D C, SU Z Z, SARKAR D, et al. Cloning and characterization of HIV-1-inducible astrocyte elevated gene-1, AEG-1[J]. Gene, 2005,353(1):8-15.
[13] HU G, CHONG R A, YANG Q, et al. MTDH activation by 8q22 genomic gain promotes chemoresistance and metastasis of poor-prognosis breast cancer[J]. Cancer Cell, 2009,15(1):9-20.
[14] GARNIS C, COE B P, ZHANG L, et al. Overexpression of LRP12, a gene contained within an 8q22 amplicon identified by high-resolution array CGH analysis of oral squamous cell carcinomas[J]. Oncogene, 2004,23(14):2582-2586.
[15] SARKAR D, EMDAD L, LEE S G, et al. Astrocyte elevated gene-1: far more than just a gene regulated in astrocytes[J]. Cancer Res, 2009,69(22):8529-8535.
[16] BEDFORD M T, RICHARD S. Arginine methylation an emerging regulator of protein function[J]. Mol Cell, 2005,18(3):263-272.
[17] POWERS M A, FAY M M, FACTOR R E, et al. Protein arginine methyltransferase 5 accelerates tumor growth by arginine methylation of the tumor suppressor programmed cell death 4[J]. Cancer Res, 2011,71(16):5579-5587.
[18] GU Z, GAO S, ZHANG F, et al. Protein arginine methyltransferase 5 is essential for growth of lung cancer cells[J]. Biochem J, 2012,446(2):235-241.
[19] LI Y, CHITNIS N, NAKAGAWA H, et al. PRMT5 is required for lymphomagenesis triggered by multiple oncogenic drivers[J]. Cancer Discov, 2015,5(3):288-303.
[20] PAL S, VISHWANATH S N, ERDJUMENT-BROMAGE H, et al. Human SWI/SNF-associated PRMT5 methylates histone H3 arginine 8 and negatively regulates expression of ST7 and NM23 tumor suppressor genes[J]. Mol Cell Biol, 2004,24(21):9630-9645.
[21] PAL S, BAIOCCHI R A, BYRD J C, et al. Low levels of miR-92b/96 induce PRMT5 translation and H3R8/H4R3 methylation in mantle cell lymphoma[J]. EMBO J, 2007,26(15):3558-3569.
[22] KIM J M, SOHN H Y, YOON S Y, et al. Identification of gastric cancer-related genes using a cDNA microarray containing novel expressed sequence tags expressed in gastric cancer cells[J]. Clin Cancer Res, 2005,11(2 Pt 1):473-482.
[23] KRYUKOV G V, WILSON F H, RUTH J R, et al. MTAP deletion confers enhanced dependency on the PRMT5 arginine methyltransferase in cancer cells[J]. Science, 2016,351(6278):1214-1218.
[24] HOU Z, PENG H, AYYANATHAN K, et al. The LIM protein AJUBA recruits protein arginine methyltransferase 5 to mediate SNAIL-dependent transcriptional repression[J]. Mol Cell Biol, 2008,28(10):3198-3207.
[本文编辑] 廖晓瑜, 贾泽军
Expression and clinical significance of metadherin in hepatocellular carcinoma
ZHU Kai1,2, ZHAN Hao1,2, ZHOU Jian1,2, FAN Jia1,2, DAI Zhi1,2*
1. Department of Liver Surgery, Zhongshan Hospital, Fudan University; Liver Cancer Institute, Fudan University, Shanghai 200032, China2. Key Laboratory of Cancer Carcinogenesis and Invasion of Chinese Ministry of Education, Shanghai 200032, China
Objective: To investigate the expression of metadherin (MTDH) in hepatocellular carcinoma (HCC) and its role in promoting HCC metastasis.Methods: The expression of MTDH in HCC and adjucent normal tissues was detected. Co-Immunoprecipitation (Co-IP) and mass spectrometry was used to investigate the protein complex involving MTDH. Results: The expression of MTDH was significantly higher in HCC tumors than that in corresponding normal liver tissues, and tumors with microvascular invasion, pathological satellites, poor differentiation, or TNM stage Ⅱ-Ⅲ were prone to exhibit higher MTDH expression (P<0.01). The clinical outcome was poorer in the MTDH high group than that in the MTDH low group in both the 1-, 3-, 5-year overall survival rates (OS) and the 1-, 3-, 5-year cumulative recurrence rates (P<0.05). CO-IP results showed that MTDH can form a complex with PRMT5.Conclusions: MTDH can accurately predict the poor outcome of HCC patients after surgery, and is a great independent prognostic indicator.
metadherin; hepatocellular carcinoma; neoplasm metastasis; prognosis
2017-05-09 [接受日期] 2017-06-19
国家自然科学基金(81402376,81472218),复旦大学附属中山医院人才培养计划-优秀骨干计划(2015ZSYXGG). Supported by National Natural Science Foundation of China(81402376,81472218)and the Talent Development Program of Zhongshan Hospital, Fudan University (2015ZSYXGG).
朱 凯,博士,住院医师. E-mail: zhukai1860@outlook.com
*通信作者(Corresponding author). Tel: 021-64041990, E-mail: dai.zhi@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20170364
R 735.7
A

