食管鳞癌组织中锌α2糖蛋白的表达及其临床意义
朱雅萍,宋一民,张红新,赵卫星
(1.新乡医学院基础医学院病理学教研室,河南 新乡 453100;2.郑州大学第一附属医院病理科,河南 郑州 450052)
食管鳞癌组织中锌α2糖蛋白的表达及其临床意义
朱雅萍1,宋一民2,张红新2,赵卫星1
(1.新乡医学院基础医学院病理学教研室,河南 新乡 453100;2.郑州大学第一附属医院病理科,河南 郑州 450052)
目的 探讨食管鳞癌组织中ZAG蛋白的表达及其临床意义。方法 采用免疫组化法检测85例食管鳞癌组织和对应的正常食管黏膜组织中ZAG蛋白的表达,并分析ZAG蛋白表达与食管鳞癌患者预后之间的关系。结果 ZAG蛋白表达主要定位于细胞质中,其在食管鳞癌组织中表达的阳性率为38.8%(33/85),显著低于正常食管黏膜组织的90.6%(77/85),差异有统计学意义(χ2=49.867,P<0.001)。ZAG蛋白表达与食管鳞癌患者的组织学分级、TNM分期和淋巴结转移关系密切(P<0.05),但与患者的性别、年龄无关(P>0.05)。ZAG蛋白高表达的食管鳞癌患者生存时间显著长于ZAG低表达的食管鳞癌患者(P<0.05)。结论 ZAG在食管鳞癌发生、发展中发挥极其重要的作用,并可能与食管鳞癌患者的预后密切相关,因而可能成为食管鳞癌预后的分子标记。
锌α2糖蛋白;食管鳞癌;预后
锌α2糖蛋白(zinc α2-glycoprotein,ZAG)基因定位于人类染色体的7q22.1,由4个外显子和3个内含子构成,ZAG的基因序列包含18个氨基酸的疏水信号肽和278个氨基酸的成熟蛋白序列[1]。ZAG通过结合至β3肾上腺素受体,以GTP依赖的方式激活腺苷酸环化酶从而刺激小鼠附睾脂肪细胞脂质的分解,由于ZAG优先调控脂肪组织中脂肪酸的降解,因而被称为脂质动员因子[2]。ZAG与多种不同的肿瘤的发生、发展密切相关,如在乳腺癌组织中发现ZAG mRNA和蛋白的表达与乳腺癌患者的组织学分级密切相关[3]。此外,部分研究表明ZAG是一种前列腺癌潜在的血清学标志,在肿瘤增殖的早期阶段表达上升[4]。这些研究提示ZAG在肿瘤的发生、发展中发挥重要的作用。
目前,ZAG在食管鳞癌发生、发展中的作用及其分子机制尚不清楚,为了阐明ZAG在食管鳞癌发生、发展中的作用,本研究采用免疫组化技术检测食管鳞癌组织和正常食管黏膜组织中ZAG蛋白的表达,分析其表达与食管鳞癌患者临床病理学参数和预后之间的关系,初步阐明ZAG在食管鳞癌发生、发展中的作用。为以ZAG为靶点的食管鳞癌的分子靶向治疗奠定基础。
1 材料与方法
1.1 材料 85例食管鳞癌标本和其对应的距癌组织边缘4 cm以外的正常食管黏膜组织均来自郑州大学第一附属医院病理科。所有患者术前均未接受过化疗、放疗及其他相关治疗,临床资料完整,选取标本也获得了患者本人同意,并由2名以上经验丰富的病理科医生诊断证实其组织学类型为食管鳞癌。所有标本均经体积分数10%中性多聚甲醛固定,常规脱水透明,采用石蜡包埋,连续切片备用。85例食管鳞癌标本中,男49例,女36例;年龄34岁~79岁,中位年龄62岁,年龄≥60岁者53例,年龄<60岁者32例;临床分期根据2009年第7版国际抗癌联盟食管癌的TNM分期标准进行评定,Ⅰ~Ⅱ期38例,Ⅲ~Ⅳ期47例;有淋巴结转移者26例,无淋巴结转移者59例。
1.2 主要试剂 鼠抗人单克隆ZAG抗体购自美国Santa Cruz公司;S-P免疫组化通用试剂盒、SA-AP显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组化步骤 染色步骤按照免疫组化S-P法试剂盒说明进行,高压抗原修复,DAB显色,苏木素复染。采用已知阳性表达的组织切片作阳性对照,用0.01 mol·L-1PBS代替一抗作阴性对照。ZAG的一抗采用1100的稀释。
1.4 免疫组化结果判断 ZAG的染色的阳性信号呈棕黄色,主要定位于细胞质中,通过高倍镜观察随机选取的5个视野,对每个视野中染色的细胞数进行计数,并且不少于200个,同时根据染色深浅联合判定,最终染色结果的判定方式采用如下标准进行:染色深浅的判定标准如下:无显色(0分),呈浅黄色(1分),呈现棕黄色(2分),呈现棕褐色(3分)。阳性细胞数的判定标准如下:阳性细胞数的比率<5%(0分),5%~<25%(1分),25%~<50%(2分),50%~<75%(3分),≥75%(4分)。最后将染色深浅和阳性细胞数的百分比相乘,这一结果即是每张切片染色的最终分值,具体的判定标准为:0~1分为阴性(-),2~3分为弱阳性(+),≥4分为阳性(++),后两者均记为阳性。
1.5 统计学处理 采用SPSS 17.0处理实验数据,计数资料采用百分数表示,比较采用χ2检验;生存情况采用Kaplan-Meier法及log rank检验分析,检验水准α=0.05。
2 结果
2.1 ZAG蛋白在食管鳞癌组织和正常食管黏膜组织中的表达 ZAG蛋白表达主要定位于细胞质中,ZAG蛋白表达主要定位于细胞质中,其在食管鳞癌组织中表达的阳性率为38.8%(33/85),显著低于正常食管黏膜组织的90.6%(77/85),差异有统计学意义(χ2=49.867,P<0.001)。提示ZAG可能在食管鳞癌的发生、发展中发挥抑癌基因的作用。见图1、表1。
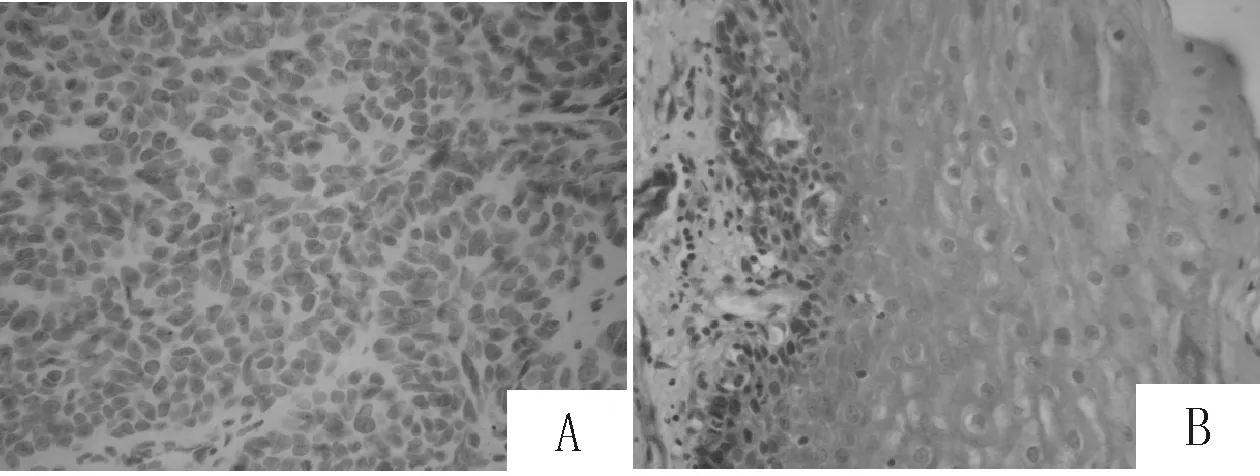
图1 ZAG蛋白在食管鳞癌(A)和正常食管黏膜(B)组织中的表达(S-P,×200)

组织类型n阳性阴性χ2P食管鳞癌85335249.867<0.001正常食管黏膜85778
2.2 ZAG蛋白表达与食管鳞癌患者临床病理学参数的关系 ZAG蛋白表达与食管鳞癌患者的组织学分级、TNM分期和淋巴结转移关系密切(P<0.05),但与患者的性别、年龄无关(P>0.05)。提示ZAG蛋白表达可能在食管鳞癌的发生、发展和进展中发挥极其重要的作用。见表2。
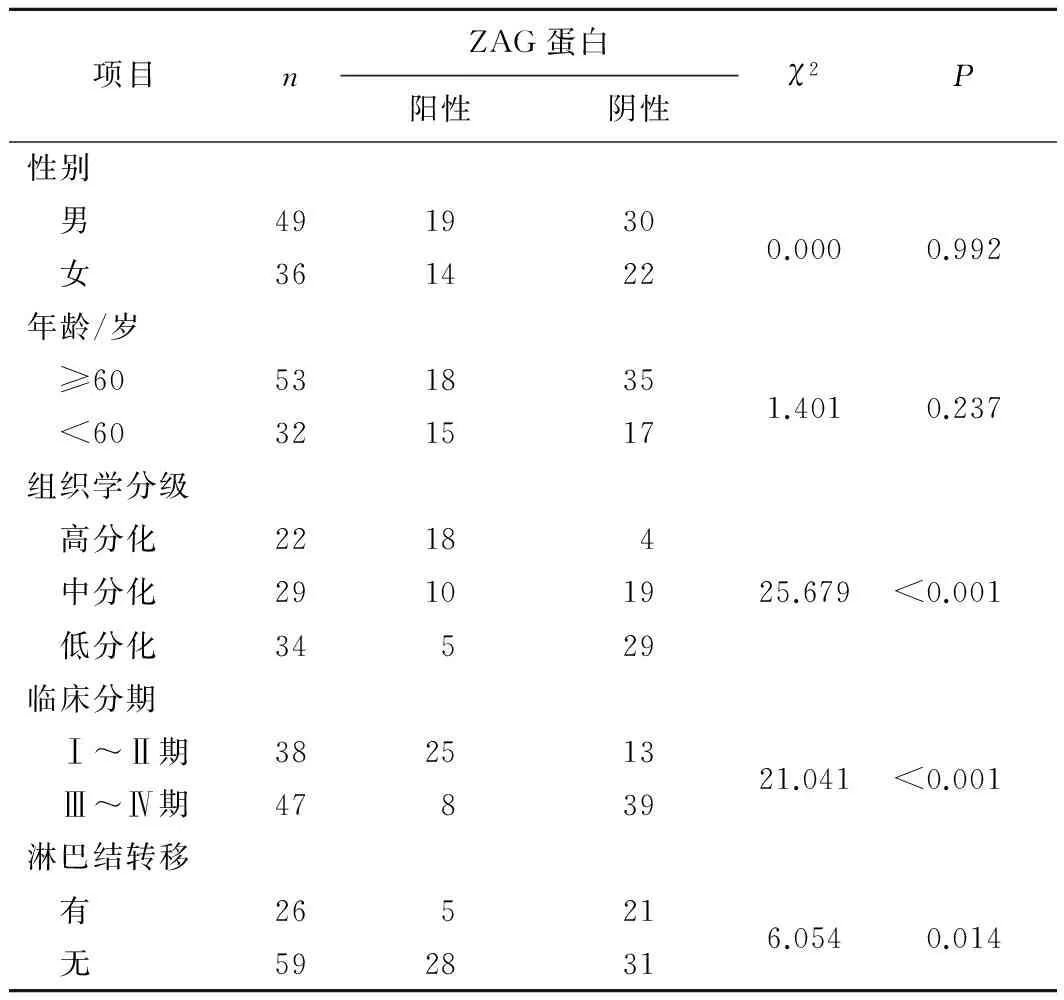
表2 ZAG蛋白表达与食管鳞癌患者临床病理学参数的关系
2.3 ZAG蛋白表达与食管鳞癌患者预后之间的关系 ZAG蛋白高表达的食管鳞癌患者生存时间显著长于ZAG低表达的食管鳞癌患者(P<0.05)。见图2。
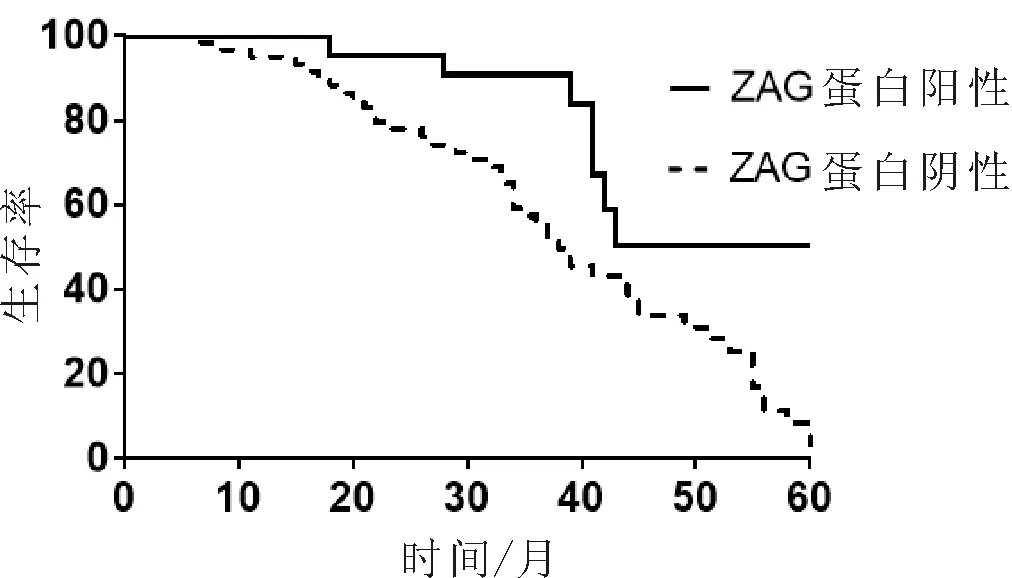
图2 ZAG蛋白表达与食管鳞癌患者预后之间的关系
3 讨论
癌基因和抑癌基因可能在不同肿瘤的发生、发展中发挥不同的作用,因而一种肿瘤的癌基因可能是另外一种肿瘤的抑癌基因[5],但其真正的作用机制尚不太明确。ZAG在多种不同的肿瘤中表达模式存在差异,因而在不同的肿瘤中发挥的作用不尽相同,一些发挥癌基因的作用,一些扮演着抑癌基因的作用。研究[6]发现,ZAG在宫颈鳞癌和腺癌组织中的表达水平显著高于正常组织。在分析口腔鳞癌样本中发现,ZAG在正常组织中表达水平显著高于肿瘤组织,且在高分化肿瘤中显著高于低分化肿瘤[7]。免疫组化结果发现恶性转化后,前列腺组织中ZAG的表达显著下降[8]。Huang等[9]通过实时荧光定量PCR检测20例成对的新鲜肝癌组织中ZAG mRNA的表达水平,并分析246例肝癌患者的临床资料,并采用免疫组化法检测这些组织中ZAG蛋白的表达水平,结果表明,ZAG在80%(16/20)的肝癌组织中的表达水平显著低于相应的正常组织(P<0.001),并发现ZAG的表达水平与血清中甲胎蛋白的水平、肝坏死和肿瘤分化密切相关,高表达ZAG的肝癌患者存活时间更长,提示其与肝癌患者的预后密切相关。Delort 等采用2株人类乳腺癌细胞系(MCF-7和MDA-MB-231)和1株纤维囊性的乳腺细胞系(MCF-10a)分析ZAG在乳腺癌组织中的功能,结果表明,重组的ZAG促进乳腺癌细胞的增殖,但显著抑制MCF-10a细胞的增殖,并发现ZAG能调控与凋亡相关的基因和蛋白的表达[10]。因此ZAG可能在不同的肿瘤中发挥不同的作用,具体的功能还有待进一步探讨。本研究发现,85例食管鳞癌组织中有33例ZAG蛋白呈现阳性表达,其阳性表达率为38.8%,而85例正常食管黏膜组织中有77例呈现阳性表达,其阳性表达率高达90.6%,这些结果提示ZAG可能与食管鳞癌的发生、发展关系极其密切,可能在食管鳞癌中发挥抑癌基因的功能。
研究表明,大量的临床病理学参数,如临床分期、组织学分级以及淋巴结转移可能成为临床上食管鳞癌患者的极为重要的预后因子。本研究也发现,ZAG蛋白的表达与食管鳞癌患者的性别和年龄无关,但与组织学分级、临床分期和淋巴结转移密切相关,提示这些临床病理学参数可能对于ZAG功能的判定发挥重要的作用。ZAG高表达的食管鳞癌患者比低表达或无表达的食管鳞癌患者预后更好,存活时间更长,这与在肝癌中的研究结果一致[9]。这些研究表明,ZAG可能成为食管鳞癌患者极其有用的预后分子标记,但确切的功能有待进一步研究。
总之,我们的研究结果表明,食管鳞癌组织中ZAG蛋白呈现低表达,其表达水平与食管鳞癌患者的组织学分级、临床分期和淋巴结转移密切相关,并且可能成为食管鳞癌患者有用的预后因子,结果提示ZAG可能在食管鳞癌的发生、发展中发挥极其重要的作用,为深入研究其在食管鳞癌中的功能奠定基础,为食管癌的基因治疗的临床研究提供基础。
[1] FREIJE JP,FUEYO A,URIA J,et al.Human Zn-alpha 2-glycoprotein cDNA cloning and expression analysis in benign and malignant breast tissues[J].FEBS Lett,1991,290 (1/2):247-249.
[2] BAO Y,BING C,HUNTER L,et al.Zinc-alpha2-glycoprotein,a lipid mobilizing factor,is expressed and secreted by human (SGBS) adipocytes[J].FEBS Lett,2005,579 (1):41-47.
[3] DíEZ-ITZA I,SANCHEZ LM,ALLENDE MT,et al.Zn-alpha 2-glycoprotein levels in breast cancer cytosols and correlation with clinical,histological and biochemical parameters[J].Eur J Cancer,1993,29A(9):1256-1260.
[4] FRENETTE G,DUBÉ JY,LAZURE C,et al.The major 40-kDa glycoprotein in human prostatic fluid is identical to Zn-alpha 2-glycoprotein[J].Prostate,1987,11(3):257-270.
[5] XIE Y,NAIZABEKOV S,CHEN Z,et al.Power of PTEN/AKT: Molecular switch between tumor suppressors and oncogenes[J].Oncol Lett,2016,12(1):375-378.
[6] ABDUL-RAHMAN PS,LIM BK,HASHIM OH.Expression of high-abundance proteins in sera of patients with endometrial and cervical cancers: analysis using 2-DE with silver staining and lectin detection methods[J].Electrophoresis,2007,28(12):1989-1996.
[7] BRYSK MM,LEI G,ADLER-STORTHZ K,et al.Zinc-alpha2-glycoprotein expression as a marker of differentiation in human oral tumors[J].Cancer Lett,1999,137(1):117-120.
[8] LAPOINTE J,LI C,HIGGINS JP,et al.Gene expression profiling identifies clinically relevant subtypes of prostate cancer[J].Proc Natl Acad Sci U S A,2004,101(3):811-816.
[9] HUANG Y,LI LZ,ZHANG CZ,et al.Decreased expression of zinc-alpha2 -glycoprotein in hepatocellular carcinoma associates with poor prognosis[J].J Transl Med,2012,10:106.
[10]DELORT L,PERRIER S,DUBOIS V,et al.Zinc-alpha2-glycoprotein: a proliferative factor for breast cancer? In vitro study and molecular mechanisms[J].Oncol Rep 2013,29(5):2025-2029.
[11]孙淼淼,姜国忠,赵志华,等.晚期糖化终产物受体在食管鳞癌组织中的表达及其意义[J].肿瘤基础与临床,2016,29(6): 467-470.
Expression of Zinc α2-glycoprotein in the Esophageal Squamous Cell Carcinoma
ZHU Yaping1,SONG Yimin2,ZHANG Hongxin2,ZHAO Weixing1
(1.DepartmentofPathology,XinxiangMedicalCollege,Xinxiang453003,China; 2.DepartmentofPathology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China)
Objective To study the expression and clinical significant of zinc α2-glycoprotein (ZAG) in human esophageal squamous cell carcinoma tissue.Methods Immunohistochemistry method was to detect the protein of ZAG in the 85 cases of esophageal squamous cell carcinoma and adjacent normal esophageal epithelial tissues.The relation of ZAG expression with survival time was analyzed.Results ZAG protein expression was localized in cytoplasm,and its expression in the esophageal squamous cell carcinoma tissues [38.8% (33/85)] was significantly lower than that in the normal esophageal epithelial tissues [90.6%(77/85)],and there was statistical difference (χ2=49.867,P<0.001).The expression of ZAG protein was correlated with histological differentiation,TNM staging and lymph node metastasis (P<0.05),but was not associated with gender and age of the patients with esophageal squamous cell carcinoma.The patients with high ZAG level had longer survival time than those with low ZAG level (P<0.05).Conclusion ZAG plays a pivotal role in the occurrence and development of esophageal squamous cell carcinoma,and may be related to the prognosis of patients with esophageal squamous cell carcinoma closely.ZAG may be molecular marker for the prognosis of the patients with esophageal squamous cell carcinoma.
zinc α2-glycoprotein; esophageal squamous cell carcinoma; prognosis
河南省基础研究计划项目(编号:142300413203)
朱雅萍(1980-),女,硕士,主治医师,主要从事消化道肿瘤的病理研究。E-mail:1226330153@qq.com
赵卫星(1958-),男,教授,硕士生导师,主要从事消化道肿瘤的病理研究与临床诊断工作。E-mail:zwx9@xxmu.edu.cn
10.3969/j.issn.1673-5412.2017.03.005
R735.1;R730.23
A
1673-5412(2017)03-0198-04
2016-01-23)

