人端粒酶逆转录酶抗原HLA-A0201限制性CTL表位预测及鉴定
袁竞妍 王宇 刘博轩 孟夏 孙瑞瑛 吕欣 李维 石婕 明宗娟 史红阳 杨拴盈
人端粒酶逆转录酶抗原HLA-A0201限制性CTL表位预测及鉴定
袁竞妍1王宇2刘博轩1孟夏1孙瑞瑛1吕欣1李维1石婕1明宗娟1史红阳1杨拴盈1
目的应用生物信息学方法对人端粒酶逆转录酶(hTERT)HLA-A2+限制性细胞毒性T细胞(CTL)表位进行预测和鉴定,寻找诱导机体特异性杀伤肺癌肿瘤细胞的抗原表位。方法应用生物信息学软件BIMAS、SYFPEITHI对hTERT蛋白进行HLA-A0201限制性CTL抗原表位预测,筛选优势表位;应用肽亲和力实验、乳酸脱氢酶(LDH)释放实验及人干扰素γ(IFN-γ)ELISPOT实验验证表位,筛选出激发机体产生特异性免疫反应的表位。结果生物信息学软件筛选出优势表位为:ILAKFLHWL、ELLRSFFYV及ILSTLLCSL;肽亲和力实验得到优势表位荧光系数(FI)为:ILAKFLHWL0.67、ELLRSFFYV0.66及ILSTLLCSL0.90;LDH释放实验显示ILAKFLHWL所诱导CTLs的杀伤率明显高于其它各表位,也明显高于阴性表位,差异均具有统计学意义(P<0.05);人IFN-γ ELISPOT实验证明ILAKFLHWL所诱导的CTLs产生的IFN-γ斑点数多于其他表位,差异具有统计学意义(P<0.05)。结论ILAKFLHWL的免疫原性强,可用于后续制备肺癌多肽疫苗。
支气管肺癌; hTERT; 表位预测; 表位鉴定; 免疫
肺癌是目前发病率和死亡率最高的恶性肿瘤[1-2]。免疫治疗已成为治疗肺癌的第4种主要方法。目前已经有相关肺癌多肽疫苗进入临床实验如 L-BLP25[3]、CIMAVAX[4]和GV1001[5]等。这些临床实验均证明多肽疫苗能够诱导针对肺癌的特异性CTL反应,且在患者体内检测到免疫记忆细胞,患者自身对多肽疫苗的耐受性也良好[6]。目前,寻找免疫原性强并激发机体产生特异性T细胞应答的抗原已成为治疗性多肽疫苗研发的焦点问题。人端粒酶(Telomerase)是能够延长端粒末端的核糖蛋白酶,其由人端粒逆转录酶(human telomerase reverse transcriptase, TERT, 127KD)、端粒酶RNA分子(human telomerase RNA, hTR, 153KD)和端粒酶相关蛋白(telomerase associated protein, TP1)3个亚单位组成[7]。端粒酶中的限速成分是hTERT。目前已知在90%的以上的人类恶性肿瘤中hTERT呈高表达,而在良性组织中,hTERT表达非常低[8]。研究证实hTERT是癌细胞永生化的必要途径,在维持肿瘤继续分裂、增殖和生存中发挥重要作用[9]。近年来发现hTERT和肿瘤干细胞也存在密切关系。有研究结果表明,将外源性hTERT导入正常组织细胞中,可产生致瘤效果。除此之外,研究人员发现端粒酶活化和附加基因突变是正常干细胞恶性转化为肿瘤干细胞的两个重要条件[10]。故hTERT是肿瘤免疫治疗的一个重要靶点。HLA-A2基因型在人群中分布较广,大约50%的亚洲人及33%的非洲人和美洲人存在这种表型。因此,HLA-A2限制性的T细胞表位在免疫治疗中具有很大的价值。本研究旨在对hTERT蛋白进行HLA-A0201限制性CTL抗原表位筛选及改造,获得优势表位,检测优势表位的免疫原性,筛选出1~2条免疫原性较强的表位,为制备治疗性多肽肺癌疫苗奠定基础。
材料和方法
一、细胞株及试剂
T2细胞小鼠B细胞杂交瘤细胞(TAP缺陷,HLA-A0201限制性)。购于上海富祥生物技术公司,用含10%的进口胎牛血清和1%青链霉素的1 640混合培养基悬浮培养。
人外周血单个核细胞(human peripheral blood mononuclear cells, PBMC)取自于HLA-A2+健康志愿者外周血,分离后用无血清培养基悬浮培养。
APC标记的鼠抗人HLA-A2抗体购于美国eBioscience公司;人β2微球蛋白(β2m)购于美国Sigma公司;重组人白介素-2冻干粉购于美国PeproTech公司。
二、实验方法
1. 多肽合成:本实验各候选肽均由郑州派和泰德医药科技有限公司合成,并使用HPLC方法纯化,合成肽的纯度均在98%以上,使用质谱技术鉴定分子质量。合成的冻干粉剂用DMSO溶解为20 mmol/L的溶液,-80 ℃长期保存。实验时,将20 mmol/L的肽溶液逐滴加入RPMI-1640培养基中配制成0.4 mmol/L的溶液,-20 ℃保存。
2. 生物信息学软件预测hTERT: HLA-A0201限制性CTL表位:①在NCBI数据库中对hTERT编码蛋白质序列查询;②应用BIMAS和SYFPEITHI软件,在其中输入hTERT抗原的氨基酸序列,限定条件为:长度为9个氨基酸残基的肽段和HLA-A0201 限制性表位。预测到不同的9肽片段并对其评分。结合两个软件的评分结果,选择出评分靠前的肽段用于后续研究。
3. 肽亲和力实验:即T2细胞结合实验:①使用无血清培养基重悬为密度4×106/ml的单细胞悬液,吸取50 μl种于96孔板中,保证每孔中含有2×105个细胞;②吸取定量的β2 m,并调整其每孔的浓度为3 μg/ml;③加入实验表位,保证每个孔实验肽的浓度为100 μmol/L,同时设置阴性表位(AHTKDGFNF)作为阴性对照,并设置仅加溶剂和3 μg/ml的β2 m组作为空白对照,同时设置T2细胞组作为背景对照;④将96孔板置于37 ℃、5% CO2培养箱中孵育18 h;⑤将孵育好的细胞用0.01M的冰PBS冲洗3次,并加入5 μl APC标记的鼠抗人HLA-A2抗体,4 ℃冰箱避光孵育30 min;⑥PBS洗涤3次后用200 μl 1%的多聚甲醛溶液固定细胞至少30 min;⑦使用300目过滤布对上述溶液进行过滤。检测流式细胞仪(美国BD公司)检测APC的荧光强度;⑧分析数据:记录每管流式细胞仪MFI值,以此值的高低来反映各个表位肽和T2细胞亲和力的强弱。并计算FI来定量比较各个表位肽和T2细胞亲和力的大小。计算公式为:荧光指数(FI)=(样本MFI-空白对照MFI)/空白对照MFI。
4. 效应细胞的诱导:①抽取HLA-A0201阳性健康志愿者外周血,使用人淋巴细胞分离液提取PBMC,使用不含肽的混合培养基及含10 μmol/L的合成肽的混合培养基分别重悬细胞,并种于24孔板中,每孔1×106个细胞密度进行细胞接种,每孔体积1 ml;②置于37 ℃ 5% CO2培养箱中培养。并且每隔2 d用1 ml不含肽的混合培养基和含20 μmol/L合成肽的混合培养基分别给相应孔的细胞进行换液,换液期间每3 d补充一次10 U/ml的重组人IL-2,一共培养2周。
5. 靶细胞的诱导:对T2细胞计数,培养基重悬为1×106个/ml的细胞悬液,取6 ml细胞悬液,分为6管,每管中加入5 μl 0.4 mmol/L的不同实验肽溶液,培养4 h后使用培养基洗涤3遍并重悬,以此细胞作为靶细胞;
6. 乳酸脱氢酶(lactate dehydrogenase, LDH)释放实验:①以步骤5中的细胞作为靶细胞;②以步骤4中的PBMC作为效应细胞; ③U型96孔板中加入各种肽诱导的靶细胞100 μl。再在各孔中按效靶比5︰1~40︰1分别加入100 μl PBMC效应细胞。同时设置自然释放组和最大释放组。自然释放组为100 μl靶细胞并加入100 μl培养液。最大释放组为加入100 μl靶细胞并加入100 μl 2%Triton X-100。每个孔均设置两个复孔; ④在酶标仪波长450 nm处检测各孔吸光度(OD)值。LDH释放率(%)=[ (实验组的OD值-靶细胞自然释放组的OD值) /(靶细胞最大释放组的OD值-靶细胞自然释放组的OD值)] ×100%
7. 人 IFN-γ ELISPOT实验: ①收集步骤4的效应细胞,以离心半径8 cm,800 r/min离心5 min,用12-725F UltraCULTURE Serum-free Medium培养基洗涤2遍,去除未结合的合成肽,用原体积的5 ml的12-725F UltraCULTURE Serum-free Medium培养基重悬,制备成原细胞密度的细胞悬液; ②取出预包被的人IFN-γ ELISPOT 试剂盒中的PVDF96孔板,每孔加入200 μl的12-725F UltraCULTURE Serum-free Medium培养基,室温静置孵育10 min,将其在高压灭菌的吸水纸上扣出; ③将效应细胞按每孔5×104个(50μl细胞悬液)接种于各个孔中。同时设只含12-725F UltraCULTURE Serum-free Medium培养基的空白对照组;④将上一步骤中各个孔分为三个部分:第一部分,效应细胞中分别加入10 μl 25 μg/ml的PHA溶液,用12-725F UltraCULTURE Serum-free Medium培养基补足至100 μl; 第二部分,效应细胞中分别加入50 μl靶细胞悬液,作为实验组; 第三部分,效应细胞中分别加入50 μl结合对应肽抗体封闭的靶细胞悬液,作为抗体封闭组; ⑤盖好板盖,置于37 ℃ 5% CO2孵箱中培养18 h。并按照深圳达科为公司的人IFN-γ ELISPOT试剂盒说明加入相应试剂; ⑥将板及其底座分开在室温阴凉通风处自然晾干。将板寄予深圳达科为生物技术有限公司,进行读板。
三、统计学方法
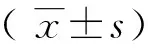
结 果
一、HLA-A0201限制性CTL表位的生物信息学预测
1. NCBI数据库上查询hTERT蛋白质序列:查询得到1 132个氨基酸序列,如下:
1mpraprcravrsllrshyrevlplatfvrrlgpqgwrlvqrgdpaafralvaqclvcvpw
61darpppaapsfrqvsclkelvarvlqrlcergaknvlafgfalldgarggppeafttsvr
121sylpntvtdalrgsgawglllrrvgddvlvhllarcalfvlvapscayqvcgpplyqlga
181atqarppphasgprrrlgcerawnhsvreagvplglpapgarrrggsasrslplpkrprr
241gaapepertpvgqgswahpgrtrgpsdrgfcvvsparpaeeatslegalsgtrhshpsvg
301rqhhagppstsrpprpwdtpcppvyaetkhflyssgdkeqlrpsfllsslrpsltgarrl
361vetiflgsrpwmpgtprrlprlpqrywqmrplflellgnhaqcpygvllkthcplraavt
421paagvcarekpqgsvaapeeedtdprrlvqllrqhsspwqvygfvraclrrlvppglwgs
481rhnerrflrntkkfislgkhaklslqeltwkmsvrgcawlrrspgvgcvpaaehrlreei
541lakflhwlmsvyvvellrsffyvtettfqknrlffyrksvwsklqsigirqhlkrvqlre
601lseaevrqhrearpalltsrlrfipkpdglrpivnmdyvvgartfrrekraerltsrvka
661lfsvlnyerarrpgllgasvlglddihrawrtfvlrvraqdpppelyfvkvdvtgaydti
721pqdrlteviasiikpqntycvrryavvqkaahghvrkafkshvstltdlqpymrqfvahl
781qetsplrdavvieqssslneassglfdvflrfmchhavrirgksyvqcqgipqgsilstl
841lcslcygdmenklfagirrdglllrlvddfllvtphlthaktflrtlvrgvpeygcvvnl
901rktvvnfpvedealggtafvqmpahglfpwcgllldtrtlevqsdyssyartsirasltf
961nrgfkagrnmrrklfgvlrlkchslfldlqvnslqtvctniykilllqayrfhacvlqlp
1 021fhqqvwknptfflrvisdtaslcysilkaknagmslgakgaagplpseavqwlchqafll
1 081rhrvtyvpllgslrtaqtqlsrklpgttltaleaaanpalpsdfktild
BIMAS软件预测表位及得分结果:通过软件预测可知,得分前10位的表位,见表1。
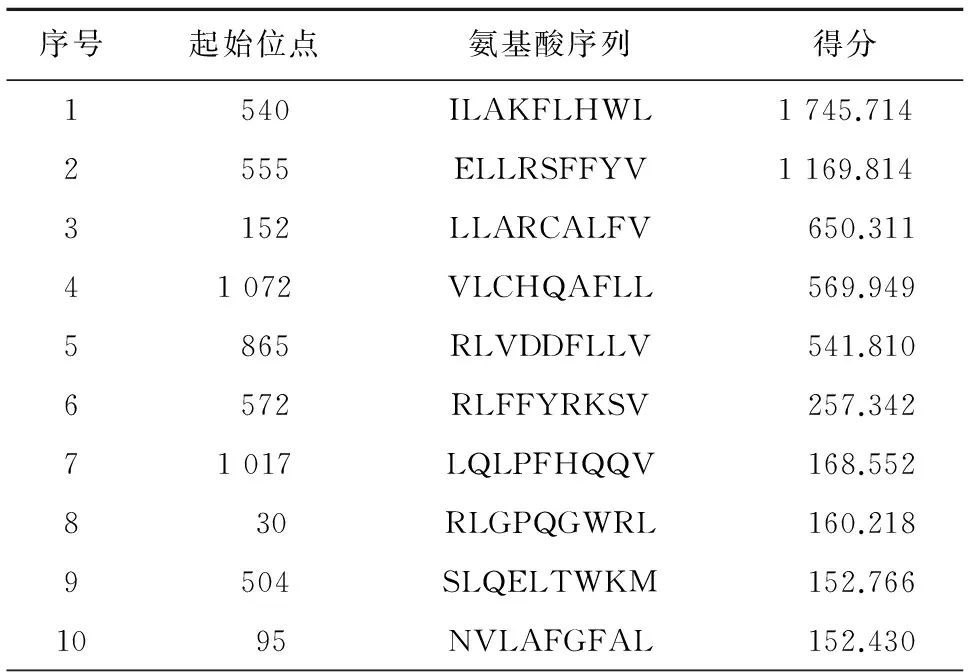
表1 BIMAS软件预测hTERT CTL天然表位得分表
SYFPEITHI软件预测预测表位及得分结果:通过软件预测可知,得分前10位的表位,见表2。

表2 SYFPEITHI软件预测hTERT CTL天然表位得分表
综合两种软件预测结果,最终选取了表位ILAKFLHWL、ELLRSFFYV及ILSTLLCSL用于后续研究。
二、肽亲和力实验
通过各表位的平均荧光强度来计算荧光系数(FI),通过对FI的比较来决定各合成肽和HLA-A2亲和力的高低,FI越高,则表位和HLA-A2分子的亲和力越强,其计算公式为:FI=(样本MFI-空白对照MFI)/空白对照MFI。各表位FI见表3,由表3可知,表位P1、P2及P3的FI之均高于阴性表位,说明这3个表位和T2细胞的亲和力均较高。因此P1、P2及P3均纳入之后的实验。

表3 各实验肽荧光系数
三、LDH释放实验
由图1知P2的LDH释放率较高,且在效靶比10︰1~40︰1范围内随着效靶比升高,其LDH释放率也随之提高。肽P1的LDH释放率也随着效靶比的升高而升高,和阴性肽相比差异不具有统计学意义(P>0.05);肽P3所诱导的PBMC在效靶比5︰1至20︰1时处于下降状态,在效靶比40︰1时升高,和阴性肽相比差异不具有统计学意义(P>0.05);在效靶比为5︰1和10︰1时,各肽之间两两比较,LDH释放率差异无统计学意义(P>0.05),各肽和阴性肽相比差异也不具有统计学意义;在效靶比为20︰1和40︰1时,肽P2的LDH释放率明显高于其它各肽,也明显高于阴性肽,差异具有统计学意义(P<0.05),而肽P1和肽P3的LDH释放率和阴性肽比较差异无统计学意义(P>0.05)。因此可知肽P2和肽P1、P3相比,能够诱导CTL产生更强的杀伤效应。

图1 LDH释放实验结果

表4 CTL分泌的 IFN-γ斑点数(单位:个)
注:a实验组和抗体封闭组比较,P<0.05;b肽P1及肽P2的实验组和肽P3组、阴性组比较,P<0.05
四、ELISPOT实验
PHA组的结果,示肉眼观察各表位诱导的斑点密集,读板计数在440~500个之间,多于阴性肽诱导的斑点数364.67±18.72个,而无肽诱导的CTL斑点数为388.33±34.02个,说明实验肽和阴性肽存在差异,并且该试剂盒系统反应正常。
实验组和抗体封闭组的斑点数稀疏, 寄予公司读板。读板结果见表4。合成肽P1实验组斑点数为14.67±0.58个,抗体封闭组斑点数为8.00±1.00个;合成肽P2实验组斑点数为28.00±5.00个,抗体封闭组斑点数为9.00±2.65个。肽P1和肽P2实验组和抗体封闭组斑点数的差异具有统计学意义(P<0.05);合成肽P3及阴性肽实验组斑点数多于抗体封闭组,但差异无统计学意义(P>0.05)。肽P1和肽P2的实验组与肽P3及阴性肽实验组比较,斑点数差异也具有统计学意义(P<0.05),见图2。
此实验说明合成肽P2比合成肽P1和合成肽P3相比,能够诱导出CTL细胞分泌出更多的IFN-γ,也说明合成肽P2诱导的CTL具有更强的特异性杀伤能力。

图2 CTL分泌的 IFN-γ斑点数;注:*实验组和抗体封闭组比较,P<0.05;#肽P1及肽P2的实验组和肽P3组、阴性组比较,P<0.05;
讨 论
恶性肿瘤疫苗的主要成分是肽、蛋白、重组载体及肿瘤细胞等具有免疫原性的肿瘤相关抗原,通过抗原提呈细胞的提呈和免疫佐剂辅助,达到增强疫苗免疫原性的目的。在此基础再应用预处理方案,如使用疫苗治疗时使用小剂量化疗药物进行预处理或是联合细胞因子进行免疫刺激[11],可进一步提高疫苗抗恶性肿瘤能力。
由以上理论可知,在制备肿瘤疫苗时,首先需找到具有免疫原性的肿瘤相关抗原。hTERT作为端粒酶的催化亚基,且是合成端粒酶的限速因素,对维持端粒的长度具有重要作用。众所周知,端粒酶以自身RNA为模板并延长后随链模板3′端,防止因为不完全复制而引起的染色体DNA短缩[12]。而在恶性细胞及永生化的细胞中,由于端粒酶的激活引起端粒长度的维持是引起癌细胞无限复制的重要因素。因此本实验通过生物信息学对hTERT全长度氨基酸序列进行预测及筛选,筛选出理论上可能具有较强免疫原性的表位作为肿瘤相关抗原,并通过实验比较所筛选多肽诱导CTL的杀伤能力,为今后制备治疗性肺癌疫苗寻找强免疫原性表位。
hTERT表位疫苗能够诱导良好的免疫应答。p540是研究较多的HLA-A0201限制性的天然表位。已有研究证明p540能够激发特异性针对HLA-A2+肿瘤细胞的特异性免疫应答;在HHD转基因小鼠体内,使用(p540+IFA)注射小鼠后,也观察到相似的CTL反应[13]。更为重要的是,并未观察到p540对正常细胞具有攻击性。不仅p540,p572(序列为RLFFYRKSV),p865(序列为RLVDDFLLV)也被鉴定出能够诱导出HLA-A2特异性CTL反应。
本实验中,我们应用BIMAS、SYFPEITHI软件联合评分预测的方法来筛选出理论上具有强免疫原性的HLA-A0201 CTL天然表位。通过综合评分可知,540-548位点的ILAKFLHWL(即本文编号P2)表位在天然表位的评分中处于第一,在BIMAS评分为1 745.714分,在SYFPEITHI软件中评分为30分;排名第二的表位为ELLRSFFYV,位于555-563位点。其在BIMAS评分为1 169.81分,在SYFPEITHI软件中评分为17分;而位于836-844位点的表位ILSTLLCSL虽在BIMAS评分仅有83.53,但其在SYFPEITHI中评分为29分,因而也纳入其进行下一步实验。
肽亲和力实验通常用来测定表位和MHC分子的亲和力。在体内正常特异性免疫过程中,CTL表位需要APC的提呈才能与MHCⅠ类分子结合,进而结合TCR引起T细胞应答,而此免疫应答强弱依赖于表位肽和MHC Ⅰ类分子之间亲合力的大小,较高免疫原性的抗原均具有较强的亲合力[14]。T2细胞是一个TAP缺陷的细胞,它不能提呈抗原,因此其表面的MHCⅠ类分子的表达极其不稳定,但是在低温条件或是外源性表位结合条件下,MHCⅠ分子可以暂时稳定表达。通过以上理论可知,若表位和MHCⅠ亲和力越强,其表面表达MHCⅠ类分子量越多。本实验在肽浓度均为100 μmol/L的条件下通过对HLA-A0201分子荧光强度的检测,P1、P2及P3的FI分别是:0.66、0.67和0.90,均高于阴性表位FI。
表位诱导出CTL的杀伤能力主要通过LDH释放实验和ELISPOT实验评价。CTL是最主要的抗肿瘤效应细胞,它能直接溶解肿瘤细胞,分泌一系列细胞因子,如IFN-γ、TNF和GM-CSF等,增强机体对肿瘤的免疫反应。ELISPOT实验则是直接检测CTL产生的IFN-γ斑点数来证实CTL杀伤能力。本实验通过对各表位孵育的PBMC诱导的CTL释放IFN-γ斑点数比较,发现肽P1和肽P2产生的斑点数实验组明显多于实验抑制组,差异具有统计学意义(P<0.05)。肽P3实验组和实验抑制组所诱导的CTL释放IFN-γ斑点数差异不明显,不具有统计学意义(P>0.05)。LDH释放实验中,可以看出肽P2和肽P1诱导的T2细胞LDH的释放具有明显的效靶比依赖性,且肽P2在效靶比20︰1和40︰1时的LDH释放率明显多于阴性肽组及其它组,差异具有统计学意义(P<0.05),而肽P1、肽P3分别和阴性肽相比,LDH释放率结果差异不具有统计学意义(P>0.05)。
综合分析肽P2即ILAKFLHWL具有更优的免疫原性。本研究针对hTERT相关肺癌多肽疫苗的制备提供了有力基础。同时为肺癌分子靶向治疗提供临床参考依据[15]。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及其原因[J/CD]. 中华肺部疾病杂志(电子版) , 2011, 4(1): 1-6.
2 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
3 Wu YL, Park K, Soo RA, et al. INSPIRE: A phase Ⅲ study of the BLP25 liposome vaccine (L-BLP25) in Asian patients with unresectable stage Ⅲ non-small cell lung cancer[J]. BMC Cancer, 2011, 11(1): 430.
4 Neninger Vinageras E, de la Torre A, Osorio Rodríguez M, et al. Phase Ⅱ randomized controlled trial of an epidermal growth factor vaccine in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(9): 1452-1458.
5 Inderbergsuso EM, Trachsel S, Lislerud K, et al. Widespread CD4+ T-cell reactivity to novel hTERT epitopes following vaccination of cancer patients with a single hTERT peptide GV1001[J]. 2012, 1(5): 670-686.
6 Mizukoshi E, Nakagawa H, Kitahara M, et al. Immunological features of T cells induced by human telomerase reverse transcriptase-derived peptides in patients with hepatocellular carcinoma[J]. Cancer Lett, 2015, 364(2): 98-105.
7 Podlevsky JD, Chen JJ. It all comes together at the ends: Telomerase structure, function, and biogenesis[J]. Mutat Res, 2012, 730(1-2): 3-11.
8 Gladych M, Wojtyla A, Rubis B. Human telomerase expression regulation [J]. Biochem Cell Biol, 2011, 89(4): 359-376.
9 Yu ST, Chen L, Wang HJ, et al. hTERT promotes the invasion of telomerase-negative tumor cells in vitro[J]. Lnt J Oncol, 2009, 35(2): 329-336.
10 Xu Y, He K, Goldkorn A. Telomerase targeted therapy in cancer and cancer stem cells[J]. Clin Adv Hematol Oncol, 2011, 9(6): 442-455.
11 Dalgleish AG, Whelan MA. Cancer vaccines as a therapeutic modality: the long trek[J]. Cancer Immunol Immunother, 2006, 55(8): 1025-1032.
12 陈陵, 杨仕明, 蔡永国. 针对端粒酶蛋白催化亚单位的肿瘤免疫治疗研究[J]. 世界华人消化杂志, 2005, 13(4): 28-533.
13 Sette A, Vitiello A, Reherman B, et al. The relationship between class I binding affinity and immunogenicity of potential cytotoxic T cell epitopes[J]. J Immunol, 1994, 153(12): 5586-5592.
14 赵建强, 何爱丽, 张王刚, 等. 白血病相关抗原MLAA-34HLA-A2+限制性CTL表位的预测及鉴定[J]. 西安交通大学学报:医学版, 2011, 32(4): 424-428.
15 杨拴盈, 孟夏, 王薇. 多靶点酪氨酸激酶抑制剂在晚期非小细胞肺癌治疗中的是与非[J/CD]. 中华肺部疾病杂志(电子版), 2015, 8(6): 665-673.
(本文编辑:王亚南)
袁竞妍,王宇,刘博轩,等. 人端粒酶逆转录酶抗原HLA-A0201限制性CTL表位预测及鉴定[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(3): 257-262.
Prediction and identification of HLA-A0201 restricted CTL epitopes derived from human telomerase reverse transcriptase antigen
YuanJingyan1,WangYu2,LiuBoxuan1,MengXia1,SunRuiying1,LyuXin1,LiWei1,ShiJie1,MingZongjuan1,ShiHongyang1,YangShuanying1.
1DepartmentofRespiratoryMedicine;2Departmentofcardiacsurgical,thesecondaffiliatedhospital,Xi′anJiaotongUniversity,Xi′an710004,China
YangShuanying,Email:Yangshuanying66@163.com
Objective HLA-A0201 restricted epitopes were screened for the hTERT protein, and the dominant epitopes were obtained. Then the immunogenicity of the dominant epitopes were detected, finally 1-2 stronger epitopes were acquired which could induced stronger immune response. Method applied bioinformatics software BIMAS and SYFPEITHI to predict hTERT protein HLA-A0201 restricted CTL epitopes. Then screened dominant epitopes according to the score of two kinds of software. Next, applied peptide affinity experiment, lactate dehydrogenase(LDH) release assay as well as human interfron gamma(IFN-γ) ELISPOT epitope screening experiments to veriify dominant epitopes. Finally, acquired the epitopes which had ability to elicit stronger immune respons. Results Comprehensive analysis of SYFPEITHI software and BIMAS software for HLA-A0201 restricted CTL antigen epitope prediction of hTERT protein showed that 3 peptides were better than others. They were ILAKFLHWL, ELLRSFFYV and ILSTLLCSL. The result of peptide affinty experiment showed that the fluorescence index(FI) of each peptide was ILAKFLHWL 0.67, ELLRSFFYV 0.66 and ILSTLLCSL 0.90; The result of LDH releasing assay showed that the killing rate of ILAKFLHWL was significantly higher than other peptides and negative peptide(P<0.05); The result of human IFN-γ ELISPOT test showed that the number of spots elicited by ILAKFLHWL epitope was significantly higher than other epitopes(P<0.05). Conclusions The PBMCs cells induced by epitope ILAKFLHWL had a most significant killing effect. The epitope ILAKFLHWL could be used to make lung cancer poly-peptide vaccine.
Bronchogenic lung carcinoma; hTERT; Epitope prediction; Immune
10.3877/cma.j.issn.1674-6902.2017.03.003
国家自然科学基金资助项目(81172234) 陕西省科技统筹创新工程计划项目(2014KTCL03-02) 中央高校基本科研业务费交叉重点项目(XKJC2015001)
710004,西安,西安交通大学第二附属医院呼吸内科1、心脏外科2
杨拴盈, Email: yangshuanying66@163.com
R734.2
A
2017-05-08)

