细胞-凝胶复合物促进聚己内酯内核与细胞膜片组织整合的可行性研究
徐亚文 何爱娟 刘豫周 广东 曹谊林
细胞-凝胶复合物促进聚己内酯内核与细胞膜片组织整合的可行性研究
徐亚文 何爱娟 刘豫周 广东 曹谊林
目的探讨运用软骨膜片包裹聚己内酯(Polycaprolactone,PCL)内核,在裸鼠体内构建组织工程软骨的可行性;探讨Pluronic F-127凝胶和软骨细胞混合物促进PCL内核与软骨膜片组织整合的可行性。方法常规分离培养乳猪耳软骨细胞,取第1代软骨细胞高密度接种,体外培养4周后形成软骨膜片。软骨膜片包裹PCL内核形成“三明治”模型作为未处理对照组(NC组);模型内注射Pluronic F-127凝胶作为对照组(PC组);模型内注射Pluronic F-127凝胶和软骨细胞混合物作为实验组(Exp组)。3组植入同一裸鼠皮下(n=8),12周后取材比较各组软骨再生情况。结果软骨细胞高密度培养可形成软骨样组织,组织学证实有典型软骨陷窝结构,且高表达蛋白聚糖和Ⅱ型胶原。“三明治”模型植入体内后,可见软骨膜片形成了更为成熟的软骨样组织,表面光滑,质地柔韧。各组湿重、体积及厚度测量结果均有显著性差异,但各组力学检测结果无显著性差异。组织学证实,NC组和PC组仅外周软骨膜片形成了成熟的软骨样组织,PCL内核与膜片间未见软骨形成;Exp组PCL内核与软骨膜片间可见大量软骨再生,新生软骨与外周软骨膜片再生软骨实现了良好整合。结论软骨膜片包裹PCL内核可构建具有一定力学强度的组织工程软骨,注射Pluronic F-127凝胶和软骨细胞混合物后可有效促进PCL内核与软骨膜片的组织整合。
组织工程聚己内酯内核软骨膜片温敏凝胶
软骨为无血管组织,自我修复能力差,软骨缺损一直是外科治疗的难题。传统治疗方式,如自体软骨移植、人工假体等,存在供区损伤、假体外露等诸多缺陷。组织工程技术可利用少量自体细胞构建软骨组织,为软骨缺损修复提供了新的思路。
传统组织工程方法常采用细胞复合支架材料的体内软骨构建策略,支架材料及其降解产物在大动物及人体内可引起严重的炎症反应,干扰软骨再生,进而影响软骨缺损治疗的效果[1-4]。
软骨膜片技术,无需人工合成或天然生物可降解材料作为支架,避免了上述材料本身及降解产物引起的不良炎症反应[5-7],并能够最大程度模拟体内细胞微环境,保存细胞间以及细胞与细胞外基质间的天然生物信号,更有利于构建成熟的组织工程软骨[8]。然而,最初形成的组织工程软骨膜片作为一种低成熟度软骨,基质分泌不够旺盛,力学强度相对差,植入体内后无法抵抗皮肤张力、承受重力,无法维持形状稳定。因此,形状控制和力学强度成为阻碍软骨膜片技术进一步发展应用的关键因素。
聚己内酯(Polycaprolactone,PCL)生物相容性好,且具有充足的力学强度,已被广泛应用于组织工程软骨的构建[9-11]。本研究使用3D打印PCL作为内核,外包软骨细胞膜片构建成熟的组织工程软骨,在软骨形成初期,PCL作为内核支架可帮助抵抗皮肤张力并承受重力,最大程度避免组织工程软骨破裂变形,促进组织工程软骨体内的形态维持;在组织工程软骨形成后期,随着PCL逐步降解吸收[12-13],软骨细胞分泌基质,PCL内核支架被成熟组织工程软骨替代,从而解决软骨细胞膜片形状控制和力学强度维持难题。
本研究探讨利用PCL内核复合软骨膜片技术,构建具有一定力学强度的组织工程软骨的可行性,以避免可降解材料残留引起体内炎症反应,解决软骨膜片力学强度难题,推动组织工程软骨临床转化进程。为验证PCL内核复合软骨膜片技术构建组织工程软骨的可行性,本研究将体外培养4周的软骨膜片包绕3D打印PCL内核并缝合作为NC组;内填充Pluronic F-127水凝胶(4℃时自由流动,37℃时凝胶化为稳定形状[14-16])作为PC组;内填充Pluronic F-127凝胶混软骨细胞作为Exp组。将3组复合物植入裸鼠体内,12周后评估再生组织的形成质量、力学性能等,以明确PCL内核复合软骨膜片技术构建具备一定力学强度的组织工程软骨的可行性。
1 材料和方法
1.1 实验动物
原代耳软骨细胞取自出生1~3 d乳猪(上海甲干生物科技有限公司提供)。样本植入6~8周雄性BALB/ C裸鼠皮下(上海甲干生物科技有限公司提供)。
1.2 实验器材与试剂
H-DMEM培养基、胎牛血清、青霉素-链霉素-两性霉素B(Hyclone公司,美国),胶原酶、Pluronic F-127粉剂(Sigma公司,美国),0.25%胰蛋白酶(Gibco公司,美国),bFGF(R&D公司,美国),恒温磁力搅拌器(上海司乐仪器有限公司)。
1.3 软骨细胞的获取和培养
无菌获取乳猪外耳,去除皮肤和软骨膜,将耳廓软骨剪成1 mm×1 mm的小块,加入1.5 mg/mLⅡ型胶原酶,37℃恒温摇床消化6~8 h,100 μm滤网过滤,收集滤液离心,弃上清,以含10%胎牛血清、1%三抗(青霉素-链霉素-两性霉素B)的高糖培养基重悬细胞,以2.5×104cells/cm2的密度接种于培养皿,置于37℃、5%CO2、饱和湿度的培养箱中,每两天换液一次,至80%融合时传代。
1.4 软骨膜片体外构建
收集第一代软骨细胞,以3×106 cells/cm2接种于六孔板。常规高糖培养基每天换液。1周后改用无血清软骨重分化培养液(高糖培养基,内含1%三抗、TGF-β1等),每日换液。体外培养4周后,用镊子将软骨膜片从六孔板上揭下。
1.5 PCL内核的制备
采用热熔融沉积快速成型技术,在105℃左右将PCL颗粒制成网格状多孔材料,网格厚度约为0.9 mm。将网格剪成7 mm×7 mm大小,75%乙醇浸泡,紫外照射过夜。PBS冲洗3遍,常规高糖培养基预培养3 d。
1.630 %Pluronic F-127水凝胶的制备
取30 g Pluronic F-127粉剂加入100 mL HDMEM培养基,置于4℃冰箱,加入磁力搅拌转子,借助磁场底座缓慢溶解粉剂,直至粉末完全消失,高温高压灭菌备用。
1.7 “三明治”模型制备及裸鼠体内植入
修剪软骨膜片为9 mm×18 mm长方形,沿长轴对折包裹PCL内核,5-0不可吸收缝线缝合PCL内核与软骨膜片,制成膜片-内核-膜片的“三明治”模型,将其植入裸鼠背部皮下,作为NC组。无细胞30%Pluronic F-127凝胶注射入“三明治”模型,直至PCL内核与软骨膜片之间无空隙,植入裸鼠背部皮下,作为PC组。4℃下,用30%Pluronic F-127重悬软骨细胞,细胞终浓度调至75×106cells/mL,凝胶-细胞复合物注射入“三明治”模型,直至PCL内核与软骨膜片之间无空隙,植入裸鼠背部皮下作为Exp组。各组在体内培养12周,平行样品数为8个。
1.8 体内软骨再生情况
体内培养12周后取出组织块,剥去表面结缔组织,观察大体形态、质地,测量湿重、厚度和体积等。
1.9 生物力学检测
将体内构建的软骨修剪为7 mm高,位移速度为2 mm/min,500 N最大负荷加压,当样本发生严重变形时停止加压。记录最大抗压强度,计算弹性模量。
1.10 组织学检测
将体外培养4周的软骨膜片,以4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(厚度为5 μm),常规HE染色、番红-O染色和Ⅱ型胶原染色。体内培养12周后取材,组织块以4%多聚甲醛固定、脱水、透明以及石蜡包埋,常规HE染色和番红-O染色。观察体内外构建软骨的基本结构和细胞外基质的分泌情况。
1.11 统计学分析
体内构建软骨的厚度、湿重、体积和力学强度等定量指标以(x±s)表示,SPSS 11.0软件进行单因素方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 体外构建软骨膜片形成质量
光镜下可见原代乳猪耳软骨细胞呈多角形或梭形,折光性强,活力较强。接种于培养皿后约12 h贴壁,4~5 d达80%~90%融合(图1A)。传代扩增到第一代时,细胞形态及增殖活性均无明显变化,2~3 d达80%~90%融合(图1B)。软骨细胞高密度接种且经体外培养4周后,形成了质地光滑、具有一定厚度及力学强度的软骨膜片(较为柔韧、手术器械操作过程中无组织断裂、破碎等现象)(图1C);HE染色可见软骨膜片具有大量、典型的软骨陷窝结构(图1D);番红-O染色和Ⅱ型胶原免疫组化提示,软骨膜片能强表达黏多糖和Ⅱ型胶原(图1E-F)。说明体外培养的软骨膜片能形成成熟且具有功能的软骨样组织。
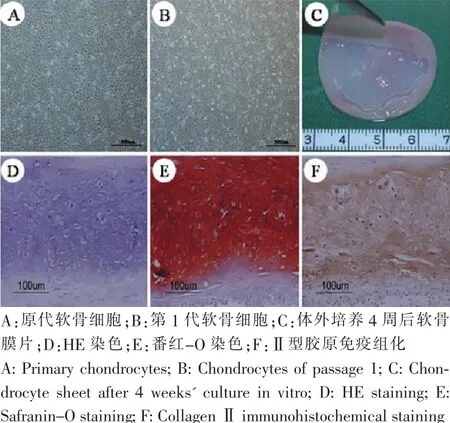
图1 体外构建软骨膜片形成情况Fig.1Examination of engineered cartilage sheet in vitro
2.2 Pluronic F-127和软骨细胞复合物制备
混合软骨细胞的Pluronic F-127泛黄色,光镜下可见软骨细胞均匀分散于Pluronic F-127中(图2)。

图2 Pluronic F-127和软骨细胞复合物的制备Fig.2The preparation of the mixture of Pluronic F-127 thermo-sensitive hydrogel and chondrocytes
2.3 “三明治”模型制备与裸鼠体内植入
应用3D打印技术可制备具有一定力学强度的多孔PCL支架(图3A)。软骨膜片质地柔韧,易剪裁为特定形状并包裹PCL内核,形成具有充足力学强度的PCL-软骨膜片复合物(图3B-D)。于PCL-软骨膜片复合物内注射凝胶软骨细胞混合物,20℃下,水凝胶固化稳定软骨细胞,复合物略泛黄(图3E-F)。单纯水凝胶注射PCL-软骨膜片复合物,室温下水凝胶固化,形态稳定,复合物略泛红(图3GH)。植入裸鼠皮下后,复合物形态维持稳定(图3I)。
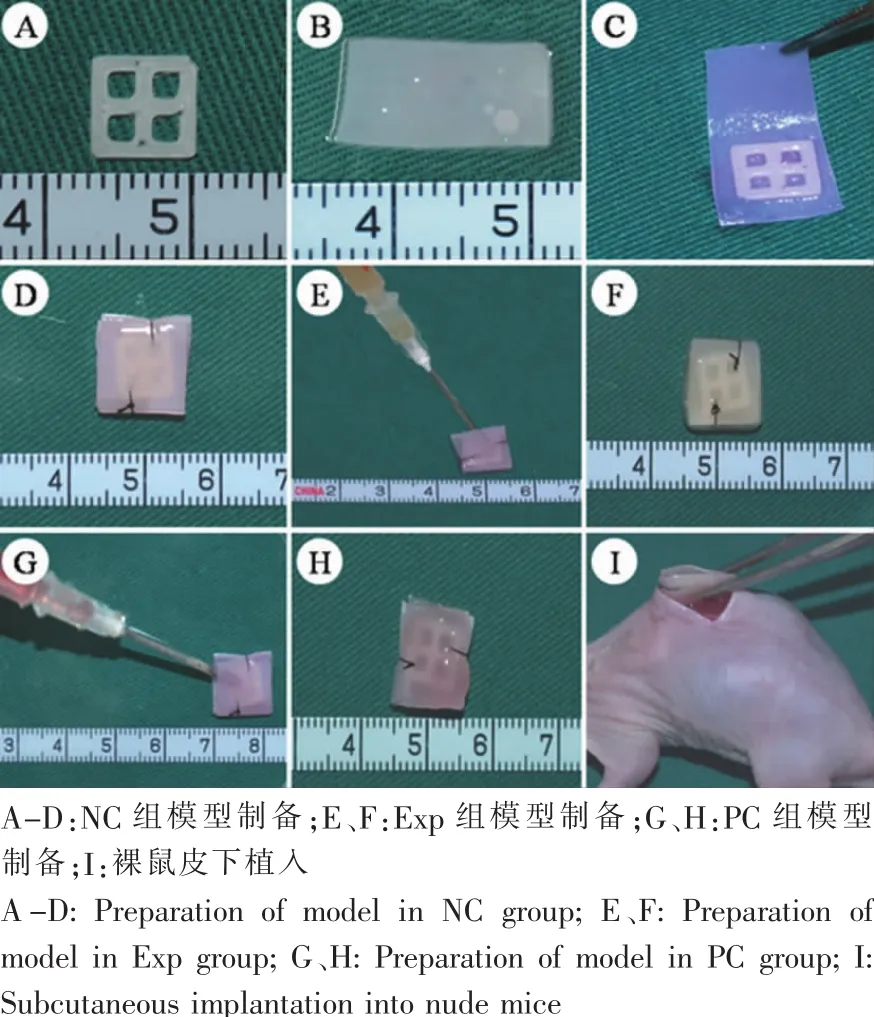
图3 “三明治”模型的制备与裸鼠皮下植入Fig.3 The preparation of sandwich model and implantation into rude rice
2.4 体内再生软骨组织检测
2.4.1 大体观察
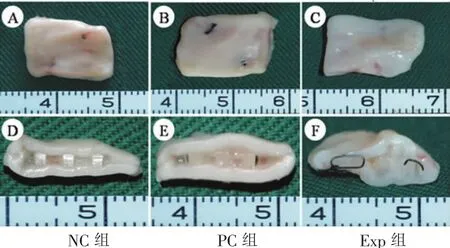
图4 体内再生软骨大体观Fig.4Gross view of in vivo engineered cartilage
体内培养12周后,“三明治”模型复合物中软骨膜片均形成了质地紧实、表面光滑的成熟软骨组织。三组复合物大体观差异明显。NC组和PC组,PCL内核与软骨膜片之间界限清楚,内无白色软骨样组织,多为无组织间隙或是纤维结缔组织(图4A、B、D、E);Exp组,PCL内核与软骨膜片之间有较多条带状白色软骨样组织,界限不清晰,偶见岛状红色样组织(图4C,F)。
2.4.2 组织厚度、湿重、体积及生物力学检测
NC组、PC组和Exp组厚度分别为(2.36±0.16)mm、(3.34±0.18)mm和(3.05±0.12)mm;湿重分别为(557.0±71.9)mg、(608.6±22.5)mg和(815.5±37.4)mg;体积分别为(0.66±0.09)mL、(0.76±0.05)mL和(0.98±0.04)mL。统计结果表明,3组的厚度、湿重和体积均有显著差异(P<0.05)。Exp组厚度明显小于其他两组,但湿重与体积均大于NC组和PC组,表明内填充Pluronic F-127凝胶和软骨细胞混合物有利于促进PCL内核与软骨膜片组织整合。各组的弹性模量无统计学差异(P>0.05),我们认为这主要是由于Exp组外包软骨膜片内尚未形成足够均质且成熟的软骨样组织,导致其力学强度与NC组、PC组之间差异不明显(图5)。
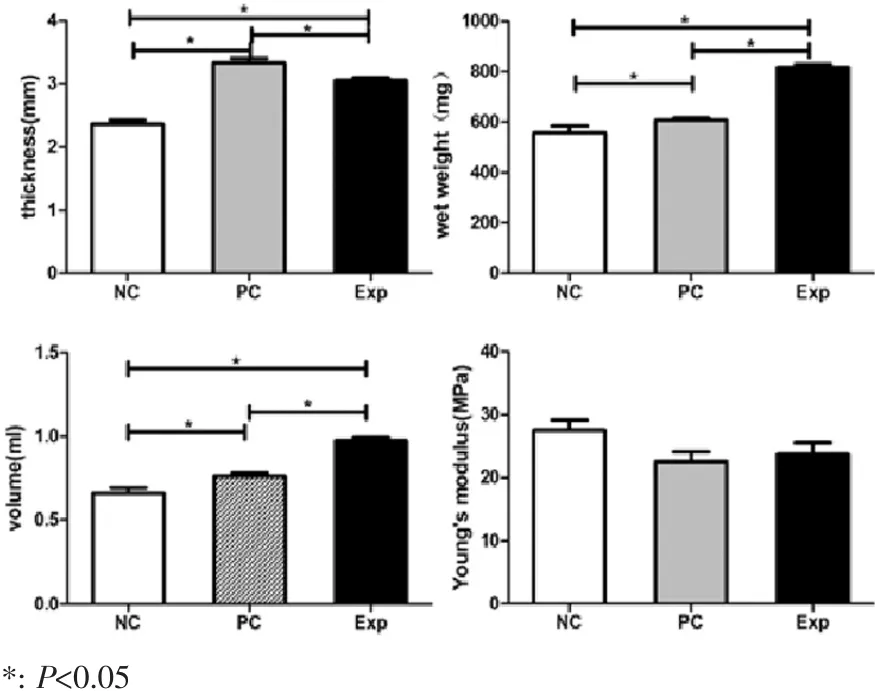
图5 植入裸鼠皮下12周后各组厚度、湿重、体积以及弹性模量评估Fig.5Evaluation of thickness,wet weight,volume and Young's modulus after 12 weeks implantation to rude rice
2.4.3 组织学检测
体内培养12周后,复合物中软骨膜片进一步成熟,番红-O染色显著加强。3组复合物组织学结果差异明显。NC组和PC组,PCL内核与软骨膜片之间未找到软骨样组织,多为纤维结缔组织(图6A、B、D、E);Exp组,PCL内核与软骨膜片之间多为具有典型软骨陷窝结构的软骨样组织,连续分布,番红-O染色呈强阳性,表明Pluronic F-127内均匀分布的软骨细胞具有活力,强表达黏多糖(图6C、F)。这些结果证明,细胞凝胶复合物有助于促进PCL内核与软骨膜片的组织整合。
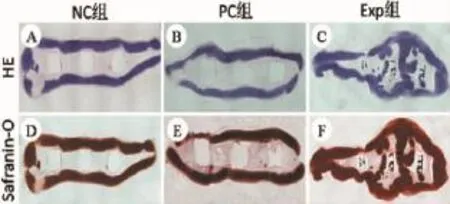
图6 体内再生软骨组织学观察(40×)Fig.6Histological observation of in vivo engineered cartilage(40×)
3 讨论
软骨膜片,由自体软骨细胞及其分泌的细胞外基质构成,在形态学、组织学等方面接近天然软骨组织,已在软骨再生领域得到广泛应用[17-18]。然而,软骨膜片力学强度较差,无法实现特定形态的软骨再生[19]。我们在前期研究中,创建了PCL内核外层包被PGA纤维支架的“三明治”模型,并成功地在体外构建精确耳郭形态软骨。PCL内核充足的力学强度有效对抗了组织构建过程中的外力,使再生软骨形态维持不变。但是,PGA支架材料在体外培养12周后仍有较多残留,植入大动物皮下后残留的PGA纤维及其降解产物引起明显炎症反应,体内再生软骨效果较差[20-21]。本研究中,我们采用软骨膜片包裹3D打印PCL内核的“三明治”模型构建组织工程软骨。该模型中,无支架软骨膜片可避免PGA纤维及降解产物引起的免疫炎症反应,PCL内核又可解决软骨膜片的形态维持难题。实验结果表明,软骨膜片体外培养4周已形成具有典型软骨陷窝结构的软骨样组织,并表达硫酸黏多糖等大量软骨特异性细胞外基质;将体外构建PCL内核-软骨膜片复合物植入裸鼠皮下12周,体内再生出成熟软骨组织,其三维形态基本维持不变。上述结果证实了软骨膜片-PCL内核-软骨膜片的“三明治”模型可构建成熟软骨组织,且其力学强度足以使再生软骨在体外、裸鼠体内保持形态基本不变。
尽管如此,由于“三明治”模型多孔的PCL内核腔隙间无种子细胞,体内12周后软骨膜片内部见大量间隙与纤维结缔组织,未形成连续的软骨样组织,PCL内核与软骨膜片之间整合不足。我们在PCL内核与软骨膜片间注射Pluronic F-127凝胶和软骨细胞混合物,试图解决这一问题。Pluronic F-127水凝胶在4℃时呈液态,37℃时固化为凝胶状态,这保证了Pluronic F-127可在液体状态下与软骨种子细胞均匀混合,并在体内环境中固化为凝胶状态,避免了复合物因流动而导致种子细胞流失[22-23]。其次,高含水量的凝胶为软骨细胞提供了类似于天然软骨组织的微环境,有效促进体内外软骨再生。实验结果表明,体内培养12周时,NC组和PC组中,内核孔隙内均未见到软骨样组织,内核与软骨膜片间为明显间隙与结缔组织;Exp组中,内核孔隙内形成较均质软骨组织,孔隙区域再生软骨与两侧软骨膜片相互连续,形成整合良好的软骨组织。该结果证实了PCL多孔内核中填充Pluronic F-127凝胶和软骨细胞的复合物,内核孔隙内可再生出良好的软骨样组织,并与两侧软骨膜片再生软骨相互连续,促进了内核与膜片之间有效整合,再生出一定厚度的软骨组织。
4 结论
软骨膜片包裹PCL内核可在体内构建特定形态的组织工程软骨,同时在内核孔隙内注射Pluronic F-127凝胶和软骨细胞的混合物,有效促进了内核与两侧软骨膜片之间的组织整合,再生出一定厚度、整合良好的软骨组织。基于软骨膜片的“三明治”模型有望解决大片软骨再生中存在的“中空”问题,和大动物体内支架材料及其降解产物易引起炎症反应的问题,具有良好的应用前景。
[1]Liu Y,Zhang L,Zhou G,et al.In vitro engineering of human ear-shaped cartilage assisted with CAD/CAM technology[J]. Biomaterials,2010,31(8):2176-2183.
[2]陶然,刘浥,殷宗琦,等.利用软骨细胞膜片技术在山羊皮下构建软骨样组织的研究[J].组织工程与重建外科,2013,9(2):61-65.
[3]Haisch A.Ear reconstruction through tissue engineering[J].Adv Otorhinolaryngol,2010,68:108-119.
[4]Sittinger M,Hutmacher DW,Risbud MV.Current strategies for cell delivery in cartilage and bone regeneration[J].Curr Opin Biotechnol,2004,15(5):411-418.
[5]Caron MM,Emans PJ,Coolsen MM,et al.Redifferentiation of dedifferentiated human articular chondrocytes:comparison of 2D and 3D cultures[J].Osteoarthritis Cartilage,2012,20(10):1170-1178.
[6]Ge Y,Gong YY,Xu Z,et al.The Application of sheet technology in cartilage tissue engineering[J].Tissue Eng Part B Rev,2016, 22(2):114-124.
[7]Liu Y,Li D,Yin Z,et al.Prolonged in vitro precultivation alleviates post-implantation inflammation and promotes stable subcutaneous cartilage formation in a goat model[J].Biomed Mater,2016,12(1):015006.
[8]王健,刘霞,肖苒,等.应用细胞膜片复合硅胶管内支撑构建组织工程管状软骨[J].组织工程与重建外科,2011,7(5):241-243.
[9]Kang HW,Lee SJ,Ko IK,et al.A 3D bioprinting system to produce human-scale tissue constructs with structural integrity [J].Nat Biotechnol,2016,34(3):312-319.
[10]Lee CH,Cook JL,Mendelson A,et al.Regeneration of the articular surface of the rabbit synovial joint by cell homing:a proof of concept study[J].Lancet,2010,376(9739):440-448.
[11]Serrano MC,Pagani R,Vallet-Regí M,et al.In vitro biocompatibility assessment of poly(epsilon-caprolactone)films using L929 mouse fibroblasts[J].Biomaterials,2004,25(25):5603-5611.
[12]Sun H,Mei L,Song C,et al.The in vivo degradation,absorption and excretion of PCL-based implant[J].Biomaterials,2006,27(9): 1735-1740.
[13]Chang KY,Hung LH,Chu IM,et al.The application of type II collagen and chondroitin sulfate grafted PCL porous scaffold in cartilage tissue engineering[J].J Biomed Mater Res Part A,2010, 92(2):712-723.
[14]Saim AB,Cao Y,Weng Y,et al.Engineering autogenous cartilage in the shape of a helix using an injectable hydrogel scaffold[J]. Laryngoscope,2000,110(10 Pt 1):1694-1697.
[15]Oh KS,Song JY,Yoon SJ,et al.Temperature-induced gel formation of core/shell nanoparticles for the regeneration of ischemic heart [J].J Control Release,2010,146(2):207-211.
[16]Liu S,Li L.Multiple phase transition and scaling law for poly (ethylene oxide)-poly(propylene oxide)-poly(ethylene oxide) triblock copolymer in aqueous solution[J].ACS Appl Mater Interfaces,2015,7(4):2688-2697.
[17]Neo PY,Teh TK,Tay AS,et al.Stem cell-derived cell-sheets for connective tissue engineering[J].Connect Tissue Res,2016,57(6): 428-442.
[18]Kikuchi T,Shimizu T,Wada M,et al.Automatic fabrication of 3-dimensional tissues using cell sheet manipulator technique[J]. Biomaterials,2014,35(8):2428-2435.
[19]Yan D,Zhou G,Zhou X,et al.The impact of low levels of collagen IX and pyridinoline on the mechanical properties of in vitro engineered cartilage[J].Biomaterials,2009,30(5):814-821.
[20]Ceonzo K,Gaynor A,Shaffer L,et al.Polyglycolic acid induced inflammation:Roleofhydrolysisandresultingcomplement activationl[J].Tissue Eng,2006,12(2):301-308.
[21]Asawa Y,Sakamoto T,Komura M,et al.Early stage foreign body reaction against biodegradable polymer scaffolds affects tissue regeneration during the autologous transplantation of tissueengineered cartilage in the canine model[J].Cell Transplant, 2012,21(7):1431-1442.
[22]Cao Y,Rodriguez A,Vacanti M,et al.Comparative study of the use of poly(glycolic acid),calcium alginate and pluronics in the engineering of autologous porcine cartilage[J].J Biomater Sci Polym Ed,1998,9(5):475-487.
[23]Bhat S,Kumar A.Biomaterials and bioengineering tomorrow's healthcare[J].Biomatter,2013,3(3):e24717.
The Feasibility of Using Cell-Hydrogel to Integrate PCL Inner Support with Cell-Sheet
XU Yawen1,2,HE Aijuan1,2, LIU Yu2,3,ZHOU Guangdong1,2,3,CAO Yilin1,2.
1 Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's HospitaL,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Shanghai Key laboratory of Tissue Engineering,Shanghai 200011,China;3 Plastic Surgery Research Institute,Weifang Medical College,Weifang 261042,China.Corresponding author:CAO Yilin(E-mail:yilincao@yahoo.com).
ObjectiveTo explore the feasibility of using sandwich model,PCL as an inner support encapsulated by chondrocyte sheet,to create tissue-engineered(TE)cartilage;To explore the feasibility of integrating PCL with chondrocyte sheet by injecting the mixture of Pluronic F-127 hydrogel and chondrocytes.MethodsThe isolated auricular chondrocytes of passage 1 were seeded in six-well plate at a high density.Chondrocyte sheet formed after 4 weeks in vitro.PCL inner support encapsulated by chondrocyte sheet was set up as non-treated control group(NC group).Sandwich model injected with Pluronic F-127 hydrogel was set up as control group(PC group).Sandwich model injected with the mixture of Pluronic F-127 hydrogel and chondrocytes was set up as the experiment group(Exp group).The above constructs were implanted subcutaneously into the same nude mice(n=8).The samples were harvested 12 weeks after implantation for the evaluation of cartilage formation.ResultsAfter in vitro high cell-density culture,chondrocyte sheet formed into cartilaginous tissue. Histologically,sheet showed specific cartilage characters including cartilage lacunae and expressed GAG and collagenⅡ. After in vivo culture,sheet from the"sandwich"structure formed more mature cartilaginous tissue with smooth surface and flexible texture.The results of wet weight,thickness and volume from every group were significantly different.However,therewas no significant difference for Young's modulus.Histologically,an abundance of cartilage-like tissue was found between PCL inner support and chondrocyte sheet in Exp group,strongly expressing GAG.Although sheet developed into mature cartilage tissue in the NC and PC group,none of cartilaginous tissue was found between the PCL inner support and chondrocyte sheet.ConclusionPCL inner support encapsulated by chondrocyte sheet could construct TE cartilage with high mechanical strength.The approach of injection with the mixture of Pluronic F-127 hydrogel and chondrocytes could realize the cartilaginous integration of PCL inner support and chondrocyte sheet.
Tissue engineering;PCL inner support;Cartilage sheet;Thermo-sensitive gel
Q813.1+2
A
1673-0364(2017)03-0131-06
2017年2月12日;
2017年4月28日)
10.3969/j.issn.1673-0364.2017.03.004
200011上海市上海交通大学医学院附属第九人民医院整复外科(徐亚文,何爱娟,周广东,曹谊林);200011上海市上海市组织工程研究重点实验室(徐亚文,何爱娟,刘豫,周广东,曹谊林);261042山东省潍坊市潍坊医学院整形外科研究所(刘豫,周广东)。
曹谊林(E-mail:yilincao@yahoo.com)。

