运用抗原芯片原理与竞争免疫层析技术制备鱼类病原性溶藻弧菌快速检测试纸❋
李嘉文, 绳秀珍, 唐小千, 邢 婧, 战文斌
(中国海洋大学水产学院免疫与病害学实验室,山东 青岛 266003)
运用抗原芯片原理与竞争免疫层析技术制备鱼类病原性溶藻弧菌快速检测试纸❋
李嘉文, 绳秀珍❋❋, 唐小千, 邢 婧, 战文斌
(中国海洋大学水产学院免疫与病害学实验室,山东 青岛 266003)
本文将抗原芯片法原理与竞争免疫层析技术相结合,利用兔抗溶藻弧菌(Vibrioalginolyticus)多克隆抗体标记20 nm胶体金颗粒后制得金标垫,将溶藻弧菌的外膜蛋白、鞭毛蛋白、胞外产物和全菌破碎蛋白4种抗原组分以及羊抗兔IgG喷涂在硝酸纤维素膜上,分别作为4条检测线和1条质控线,制备溶藻弧菌胶体金免疫层析快速检测试纸,并确定检测结果的判定方法。使用该试纸同时对溶藻弧菌、副溶血弧菌(V.parahaemolyticus)、哈维氏弧菌(V.harveyi)、鳗弧菌(V.anguillarum)和鱼肠弧菌(V.ichthyoenteri)进行检测,检查结果显示其能够准确区分溶藻弧菌感染与其他弧菌的交叉反应,排除了交叉反应对结果判定的干扰。溶藻弧菌快速检测试纸的最低检测限为5×105cfu·mL-1,检测时间为10~15 min。该试纸具有操作简便、快速、准确、特异性强的优点,适用于普通人员在养殖现场对鱼类溶藻弧菌的快速检测。
溶藻弧菌; 胶体金; 竞争免疫层析法; 特异性抗原; 免疫交叉反应; 抗原芯片原理; 快速检测试纸
溶藻弧菌(Vibrioalginolyticus)属革兰氏阴性嗜盐嗜温菌,广泛分布在世界各地的海水和河口处,其数量居海水类弧菌之首。溶藻弧菌是中国海洋中优势菌群之一[1],存在于多种海洋动物体内,是鱼、贝、虾蟹等海水养殖动物的条件致病菌,可通过其受损表皮、黏膜、口引发感染[2],多在夏季发病,给水产养殖业带来巨大经济损失[3]。另外,溶藻弧菌也可导致人类患多种疾病,包括感染伤口溃疡、中耳炎、外耳炎、败血症等[4],近年来的研究证实该菌与副溶血弧菌(Vibrioparahaemolyticus)一样,是沿海地区导致腹泻病和食物中毒的常见病原菌[5]。有效快速的检测诊断是预防和控制该病原菌引起的疾病以及食源性中毒的关键。
目前溶藻弧菌常用的检测方法有免疫酶联反应、环介导等温扩增技术(LAMP)、聚合酶链式反应(PCR)、实时定量PCR等[6],但这些技术在实用性上皆有一定的局限,耗时长,操作复杂,需要专业设备和技术人员,不适用于普通养殖人员对溶藻弧菌的现场检测。胶体金免疫层析试纸具有易于携带、操作简便快捷、结果肉眼可见、不需要专业人员和设备、经济实用等优点,是一种十分有发展前景的即时、现场快速检测技术,近年来在生物医学领域特别是医学检验中得到广泛应用[7]。但是,利用免疫学技术进行病原菌检测时,病原菌之间存在的交叉免疫反应往往会对检测结果的准确判定造成干扰,因此,排除交叉反应对结果判定的干扰是免疫学检测技术需要解决的关键问题。
本文运用竞争免疫层析技术与抗原芯片法原理相结合[8],利用溶藻弧菌制备兔多克隆抗体并标记胶体金,将提取的溶藻弧菌四种特异性抗原蛋白作为检测线,研制出溶藻弧菌的胶体金快速检测试纸,能够准确区分溶藻弧菌感染与其他菌的交叉反应,避免了交叉反应对结果判定的干扰。
1 材料与方法
1.1 菌株与实验动物
溶藻弧菌(V.alginolyticus)、哈维氏弧菌(V.harveyi)、副溶血弧菌(V.parahaemolyticus)、鱼肠弧菌(V.ichthyoenteri)和鳗弧菌(V.anguillarum)由本实验室分离保存。
纯种新西兰大白兔,6周龄,雌性,购自青岛市药品检验所。
1.2 兔抗溶藻弧菌多克隆抗体的制备及效价测定
将溶藻弧菌扩大培养,福尔马林灭活后,去除福尔马林菌体调整浓度至1×108cfu·mL-1,分4次免疫纯种新西兰大白兔。第一次按1∶1比例将溶藻弧菌混入弗氏完全佐剂,背部6点皮下注射免疫,每点0.2 mL;间隔一周后加强免疫,将溶藻弧菌按1∶1比例与弗氏不完全佐剂混匀,背部皮下注射免疫,每点0.2 mL,间隔2周后重复一次;最后一次于耳缘静脉注射0.2 mL,1周后取血,分离得到血清,辛酸-硫酸铵法纯化得到兔抗溶藻弧菌多克隆抗体。
运用间接免疫酶联吸附实验(ELISA)测定兔抗溶藻弧菌多克隆抗体效价[9]。用0.01 mol·mL-1磷酸盐缓冲液(PBS)将溶藻弧菌浓度调整为5×107cfu·mL-1,在96孔酶标板(Costar,Corning,USA)中每孔加入100 μL溶藻弧菌菌液包被过夜,次日弃去板内液体,用含0.05% Tween-20的0.01 mol·mL-1PBS(PBST,pH=7.4)洗涤酶标板,每孔加入200 μL的3% BSA,37 ℃封闭1 h;洗涤酶标板,依次加入100 μL梯度稀释的兔抗溶藻弧菌抗体(见表1),设置3个平行,阴性对照加100 μL 0.01 mol·mL-1PBS,37 ℃孵育1 h;用PBST洗涤酶标板,每孔加入100 μL AP标记羊抗兔IgG抗体37 ℃孵育1 h;洗涤酶标板,每孔加入200 μL底物显色液(含1 mg·mL-1pNPP-Na,0.5 mol·mL-1氯化镁以及体积比为10%的二乙醇胺)避光发色5 min,用酶标仪测定OD405值。
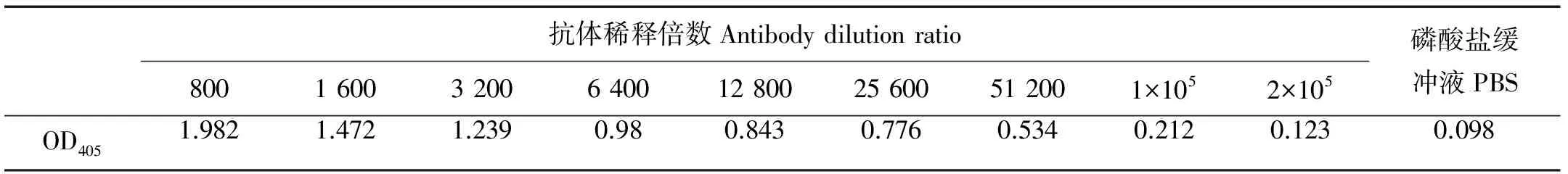
表1 兔抗溶藻弧菌抗体效价的测定
1.3 溶藻弧菌特异性抗原的制备
1.3.1 溶藻弧菌外膜蛋白的提取 参照熊焰等[10]的方法,将溶藻弧菌扩大培养,离心后PBS洗涤、重悬至原体积1/25,加入少量10%蔗糖,混匀后于-20 ℃下作用15 min。室温下加入等体积0.4% Triton-X100,作用一段时间后离心取上清,加入2.5倍体积冰乙醇,-20 ℃过夜。离心取沉淀,洗涤重悬后,加入等体积碘化钾溶液,37 ℃作用1 h。离心取上清,加入2.5倍体积冰乙醇-20 ℃过夜。离心取沉淀,重悬后透析、冻干,PBS调至合适浓度,于-80 ℃冻存。
1.3.2 溶藻弧菌鞭毛蛋白的提取 参照张晓佩等[11]的方法,将溶藻弧菌扩大培养,离心后用PBS洗涤,重悬至原体积1/20,用1.0 mol·mL-1HCl将所收集菌液的pH调整至2.0,室温下不断搅拌30 min。4 ℃条件下1 500×g离心30 min,取上清。然后,4 ℃下533 000g离心上清液1 h,取上清。上清液用1 mol·mL-1NaOH调整pH至7.2,并缓慢加入硫酸铵至终浓度为2.67 mol·mL-1,冰浴搅拌30 min,将混合液4 ℃放置过夜。次日,4 ℃下533 000g离心15 min,弃上清,取沉淀,并溶于一定量0.01 mol·mL-1PBS中,透析24 h。冻干后,溶于PBS中调至合适浓度,-80 ℃保存。
1.3.3 溶藻弧菌胞外产物的提取 参照Inamura等[12]的方法,将溶藻弧菌接种于营养琼脂液体培养基,37 ℃摇床培养24 h。取1 mL的液体培养物涂布在预先放置了一层玻璃纸的营养琼脂平板上,37 ℃培养24~48 h。用6 mL 0.01 mol·mL-1PBS洗下菌体,收集菌悬液,在4 ℃下7 000g离心30 min,上清经0.22 pm微孔滤膜过滤后,加入终浓度为2.0 mol·mL-1硫酸铵,室温下搅拌1 h,4 ℃沉降过夜。次日,4 ℃下10 000g离心1 h,取沉淀并将其溶于0.01 mol·mL-1PBS中,于超纯水中透析24 h,然后用PBS调至合适浓度,于-80 ℃冻存。
1.3.4 溶藻弧菌全菌破碎蛋白的制备 将溶藻弧菌接种于营养琼脂液体培养基,37 ℃扩大培养24 h。将菌液调整至1×108cfu·mL-1,超声波破碎机破碎(Sonics & Materials;振幅39%;pulse on,3;pulse off,3 s)至液体澄清,即为溶藻弧菌破碎蛋白,用0.01 mol·mL-1PBS调整至适合浓度,冻存于-80 ℃。
1.4 胶体金、金标抗体及金标垫的制备
1.4.1 胶体金的制备及电镜观察 取0.01%氯金酸溶液100 mL,高档火沸腾2 min,迅速一次性加入少量1%柠檬酸三钠溶液,放入微波炉中用中档火继续加热3 min后,取出冷却至室温并补充损失水分,制得颗粒大小为20 nm左右的胶体金。用0.1 mol·mL-1碳酸钾溶液和0.1 mol·mL-1盐酸调节pH至8.4后,密封保存于4 ℃。
将制得的胶体金滴在铜网上,空气中自然干燥15 min,透射电镜观察胶体金的形态。
1.4.2 最适合标记pH与蛋白标记浓度的确定 为确定胶体金的最适合标记pH,用0.1 mol·mL-1碳酸钾溶液和0.1 mol·mL-1盐酸分别将制得的20 nm胶体金溶液调至不同pH梯度,然后各取1.5 mL胶体金,分别加入10 mg·mL-1兔抗溶藻弧菌多抗100 μL,迅速混匀,在室温下静置30 min后,加入10 μL 5% NaCl,混匀后室温静置2 h。分光光度计测每个pH梯度在520 nm处的OD值,并根据数值以OD值为纵轴、pH值为横轴制作曲线图,取曲线中OD值达到峰值后最大处对应的pH即为最合适标记pH。
为了测定最适合的蛋白标记浓度,用0.1 mol·mL-1碳酸钾溶液和0.1 mol·mL-1盐酸将制得的20 nm胶体金调至最适合标记pH。然后将胶体金设置10个浓度梯度,每个浓度取出1 mL胶体金,分别加入10 μL不同浓度的兔抗溶藻弧菌多抗,迅速混匀,在室温下静置30 min后加入5% NaCl 10 μL,混匀后室温静置2 h。分光光度计测定每个浓度梯度在520 nm处的OD值,并以OD值为纵轴、蛋白浓度为横轴制作曲线图,取曲线中OD值最大处对应的兔多抗用量为稳定胶体金的最低蛋白量,在此基础上加20%的蛋白标记量即是最适合的蛋白标记浓度。
1.4.3 金标抗体与金标垫的制备 将胶体金调至最合适标记的pH,按照最合适标记浓度加入兔抗溶藻弧菌多抗,连续搅拌20 min,室温静置10 min。加入BSA使终浓度为1%,连续搅拌15 min,室温下静置10 min,经1 200g于4℃离心15 min,弃沉淀取上清液。上清经13 500g4 ℃离心30 min,弃上清取沉淀,用金标多抗洗涤液(含1%BSA的0.01 mol/L PBS,pH=8.4)洗涤,离心,吸去上清液,将沉淀用金标多抗保存液(0.01 mol·L-1PBS中含3%蔗糖,1%BSA,0.2%Tween-20和0.02%NaN3,pH=8.4)重悬至原体积1/10,即为金标兔抗溶藻弧菌多抗。将金标溶藻弧菌多抗喷涂于玻璃纤维上成为金标垫,冷冻干燥,避光密封保存于4 ℃。
1.5 间接ELISA法确定溶藻弧菌4种抗原蛋白特异性与划线浓度
将溶藻弧菌4种抗原蛋白包被96孔酶标板(100 μL/孔),每个蛋白设3个平行,以无菌PBS作为阴性对照,4 ℃过夜。次日用PBST洗涤3次,每孔加入200 μL 3%的牛血清白蛋白(PBS配制),37 ℃封闭1 h,PBST洗涤3次,再加入100 μL兔抗溶藻弧菌多抗(1∶2 000稀释),37 ℃孵育1 h,PBST洗涤3次。每孔加入100 μL碱性磷酸酶标记的羊抗兔IgG(1∶8 000稀释),37 ℃孵育1 h,PBST洗涤3次;加入200 μL底物显色液,暗处反应10~20 min,然后加入50 μL 2 mol·mL-1NaOH溶液终止显色反应,检测405 nm处的OD值。
以包被PBS为阴性对照,测定波长为405 nm时各孔的光吸收值,计算各实验孔与阴性对照光吸收值之比(P/N),当P/N≥2.1时为阳性,计算4种抗原蛋白间的P/N的比。根据蛋白包被浓度和P/N比值确定划线浓度。
1.6 溶藻弧菌胶体金快速检测试纸的结构设计与制备
将抗原芯片法原理和竞争免疫层析技术相结合进行溶藻弧菌胶体金免疫层析试纸的结构设计。利用抗原芯片法原理,将病原菌的多种抗原组分排列在一起同时与该病原菌的抗体进行反应,则所有抗原皆与抗体发生反应,而其他菌只有个别共同抗原与抗体发生交叉反应,由此,将溶藻弧菌的多种特异性抗原排列在一起成为多条检测线,用金标溶藻弧菌抗体制备金标垫,利用竞争免疫层析技术进行检测,则待检样品中的溶藻弧菌与检测线上的抗原竞争结合金标溶藻弧菌抗体,使检测线上的抗原无法与金标溶藻弧菌抗体反应而全部不显色,反之,待检样品中不含有溶藻弧菌时,金标溶藻弧菌抗体则与检测线上的抗原结合,检测线全部显色;当待检样品中有其他病原菌时,只有其共同抗原与检测线上的溶藻弧菌抗原竞争结合金标抗体,则部分检测线不显色。
根据上述设计原理,用0.01·mol·mL-1PBS将溶藻弧菌外膜蛋白、鞭毛蛋白、胞外产物和全菌破碎蛋白的浓度分别调至1.5中所确定的划线浓度,用喷膜仪将四种蛋白喷涂于硝酸纤维素膜上分别作为检测线T1、T2、T3和T4,4条检测线之间各相距1.5 mm。用0.01 mol·mL-1PBS调整羊抗兔IgG浓度为0.5 mg·mL-1,将其喷涂于硝酸纤维膜上作为质控线(C线),质控线与检测线T4相距5 mm,质控线靠近吸水垫,检测线T1靠近样品垫(见图1)。
在PVC底板上依次粘贴上硝酸纤维素膜、金标垫、样品垫和吸水垫,组装成试纸条整板。其中硝酸纤维膜上端边缘重叠于吸水垫边缘之下,而硝酸纤维素膜下端边缘则在金标垫上端边缘之下,样品垫的上端边缘重叠在金标垫的下端边缘之上(见图1)。将组装好的试纸条整版用切条机裁成3.75 mm宽的试纸条,装入塑料卡盒中,密封保存于有干燥剂的铝箔小袋中。
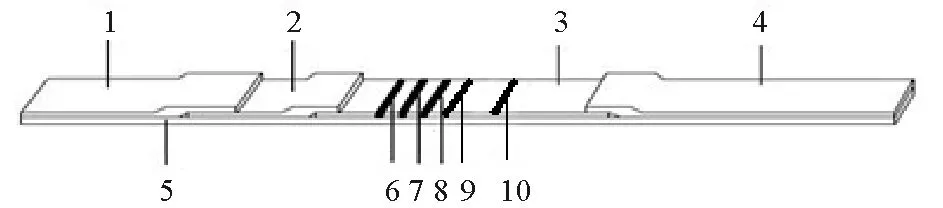
(1.样品垫;2.金标垫;3.硝酸纤维素膜(NC膜);4.吸水垫;5.PVC底板;6~9.检测线T1~T4(T线);10.质控线(C线)。1. Sample pad;2. Glass fiber containing anti-V.alginolyticuspolyclonal antibody;3.Nitrocellulose membrane;4. Absorption pad;5. PVC board;6~9. Test Lines 1~4 (T lines);10. Control Line (C line).)
图1 溶藻弧菌快速检测试纸结构模式图
Fig.1 Structure of colloidal gold strip for rapid detection ofV.alginolyticus
1.7 特异性检测
使用制备的溶藻弧菌快速检测试纸检测浓度为1×107cfu·mL-1的纯化鳗弧菌、鱼肠弧菌、副溶血弧菌、哈维氏弧菌和溶藻弧菌,PBS作为阴性对照,以确定所制备试纸的检测特异性。
1.8 检测限测定
将纯化的溶藻弧菌设置5×107、5×106、5×105、5×104cfu·mL-1共4个梯度,使用制备的检测试纸进行检测。当某个浓度时检测试纸的检测线T1-T4全部或部分显色,则该浓度的高一级浓度确定为检测试纸的最低检测限。
1.9 牙鲆组织中溶藻弧菌的检测
使用5×107cfu·mL-1的溶藻弧菌注射感染牙鲆,牙鲆逐渐表现出体色变黑、腹部肿胀、有腹水、体表溃疡以及肝、脾、肾充血等症状。取牙鲆腹水及体表皮肤溃疡组织,每1g加5 mL无菌PBS或生理盐水(0.9% NaCl溶液)研磨3~5 min,3 000g离心获得上清样品液。平放试纸检测卡,向样品孔中滴加检测样品液100 μL,等待10~15 min,肉眼观察检测结果。使用健康牙鲆组织作为阴性对照。
以ELISA法作为对照检测方法。将相同的样品液和健康牙鲆组织液各100 μL添加至96孔酶标板4 ℃包被过夜,以1.5中所述ELISA操作步骤测定样品液与PBS在405 nm处的OD值,P/N值≥2.1时为阳性。
2 结果
2.1 兔抗溶藻弧菌多抗的效价
双抗夹心ELISA方法测得兔抗溶藻弧菌多抗的效价为1×105(见表1)。
2.2 胶体金的质量鉴定
经过煮沸、柠檬酸钠还原制得的胶体金溶液呈现鲜艳的酒红色,澄清、无沉淀。透射电镜观察发现,胶体金颗粒分散均匀,胶体金颗粒平均直径大小为20 nm左右(见图2)。
2.3 胶体金最适合标记条件
OD值曲线法测定胶体金标记兔多抗最佳pH的结果显示,当pH< 8时,胶体金OD值呈上升趋势,当pH>8时,胶体金OD值呈下降趋势,即pH=8是曲线中OD值最高点,是胶体金标记兔多抗的最佳pH(见图3)。

图2 胶体金电子显微镜图
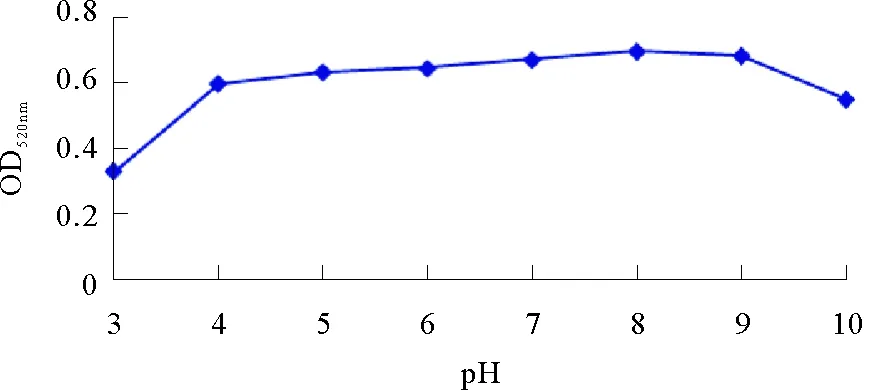
图3 OD值曲线法确定胶体金标记兔多抗的最佳pH
OD值法测定胶体金标记兔多抗的最佳蛋白量结果表明,当蛋白浓度<2 μg·mL-1时,胶体金OD值呈上升趋势,当蛋白浓度>2 μg·mL-1时,胶体金OD值呈下降趋势并渐趋于平缓,即稳定胶体金的最低蛋白量为2 μg·mL-1,此为胶体金标记兔多抗的最低标记浓度,在此基础上加20%即为最佳标记浓度,即2.4 μg·mL-1(见图4)。
2.4 溶藻弧菌4种抗原蛋白的划线浓度
计算溶藻弧菌4种蛋白的OD405值与PBS OD405值的比值得到P/N值,P/N≥2.1时为阳性,结果显示,4种抗原蛋白皆与兔抗溶藻弧菌抗体特异性结合(见表2)。根据4种抗原蛋白的浓度与P/N值,确定检测线T1、T2、T3和T4线上4种抗原蛋白的划线浓度分别为外膜蛋白0.6mg·mL-1、鞭毛蛋白0.2 mg·mL-1、胞外产物1.5 mg·mL-1和全菌破碎蛋白0.3 mg·mL-1。
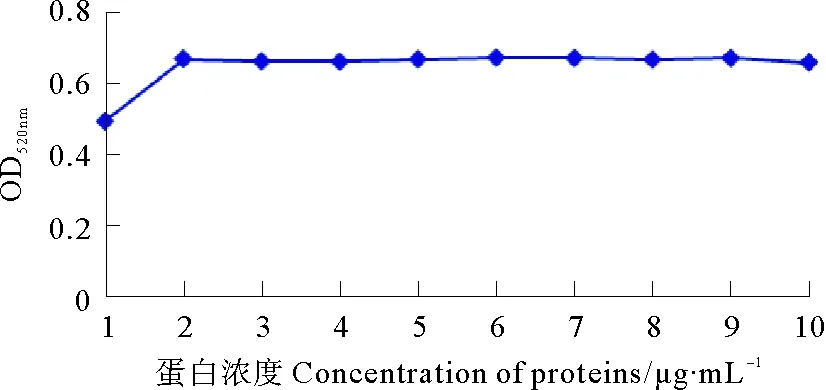
图4 OD值曲线法确定胶体金标记兔多抗的最佳标记浓度
2.5 试纸的特异性
分别以溶藻弧菌的外膜蛋白、鞭毛蛋白、鞭毛蛋白和全菌破碎蛋白作为4条检测线制备溶藻弧菌快速检测试纸。根据抗原芯片法和竞争免疫层析法原理,确定对试纸检测结果的判定方法如下:在质控线(C线)显色前提下,检测线T1、T2、T3、T4全部不显色,表明感染了溶藻弧菌;检测线T1、T2、T3、T4皆显色,表明未感染溶藻弧菌;T4线显现红色,T1、T2、T3中个别条带不显色,表明未感染溶藻弧菌,但感染了与溶藻弧菌具有共同抗原的其他病原菌;检测线T1、T2、T3、T4和质控线都不显色,表明该试纸失效或本次操作出现问题(见图5A)。
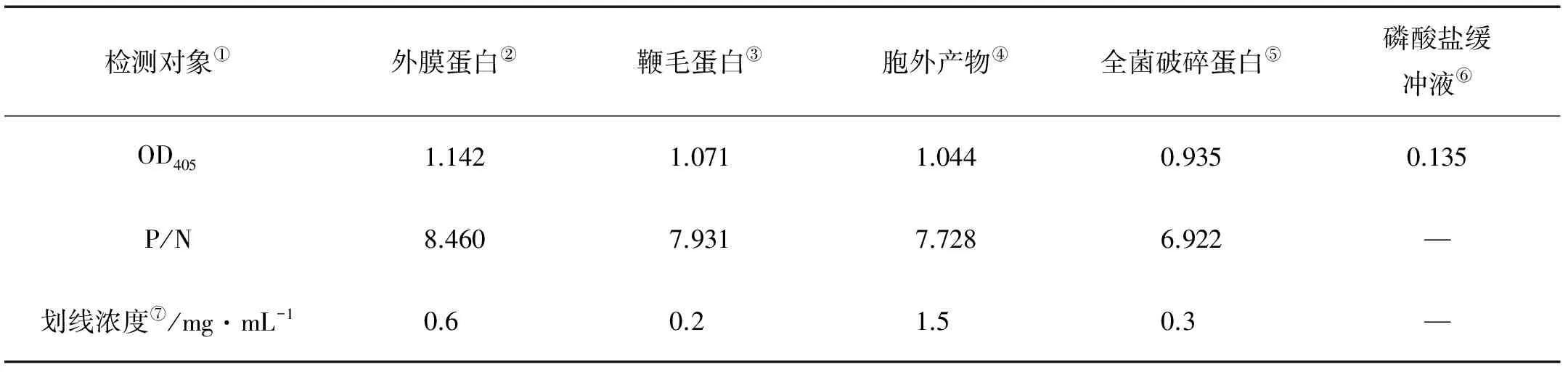
表2 ELISA法确定溶藻弧菌4种抗原蛋白的划线浓度
Note: ①Detection target;②Outer membrane protein;③Flagellum protein;④Extracellular products;⑤Whole-cell bacteria protein;⑥PBS;⑦Dispensed concentration
(A.Ⅰ:阳性结果;Ⅱ:阴性结果;Ⅲ:交叉反应;Ⅳ:试纸失效。B.Ⅰ:鳗弧菌检测结果;Ⅱ:鱼肠弧菌检测结果;Ⅲ:副溶血弧菌检测结果;Ⅳ:哈维氏弧菌检测结果;Ⅴ:PBS阴性对照;Ⅵ:溶藻弧菌检测阳性结果。A.Ⅰ:Positive results;Ⅱ:negative results;Ⅲ:cross reaction;Ⅳ:invalid results. B.Ⅰ:V.anguillarum;Ⅱ:V.ichthyoenteri;Ⅲ:V.parahaemolyticus;Ⅳ:V.harveyi;Ⅴ:PBS;Ⅵ:V.alginolyticus.)
图5 溶藻弧菌快速检测试纸检测结果示意图(A)及特异性检测(B)
Fig.5 Diagram and Specificity of colloidal gold test strip for rapid detection ofV.alginolyticus
使用制备的溶藻弧菌快速检测试纸检测鳗弧菌、鱼肠弧菌、副溶血弧菌、哈维氏弧菌和溶藻弧菌,结果显示,检测鳗弧菌、鱼肠弧菌、副溶血弧菌和哈维氏弧菌时,质控线和T4检测线显色,鳗弧菌、鱼肠弧菌的T3线颜色明显变浅(见图5B,Ⅰ、Ⅱ),副溶血弧菌和哈维氏弧菌的T3线不显色(见图5B,Ⅲ、Ⅳ),表明这些菌与溶藻弧菌位于T3线上的抗原成分存在交叉反应;PBS组的C线和4条T线皆显色(见图5B,Ⅴ),表明结果为阴性;溶藻弧菌组仅C线显色,4条检测线皆不显色,即检测结果为阳性(见图5B,Ⅵ)。以上结果表明该试纸具有良好的特异性,且能够准确区分溶藻弧菌感染与其他菌的交叉反应。
2.6 试纸的检测限
将溶藻弧菌设置5×107、5×106、5×105、5×104cfu·mL-14个梯度,使用制备的溶藻弧菌快速检测试纸进行检测,结果显示在浓度为5×107、5×106、5×105cfu·mL-1时,只有质控线显色,T1-T4线皆不显色,而浓度为5×104cfu·mL-1时,T1-T4线开始出现显色,表明该试纸的检测限为5×105cfu·mL-1(见图6),低于该浓度则无法检测到细菌。

图6 试纸的灵敏度
2.7 牙鲆中溶藻弧菌的检测
对人工感染溶藻弧菌的牙鲆样品进行检测,结果显示,C线显现红色,牙鲆腹水和皮肤溃疡组织皆不使T1、T2、T3、T4线显色,表明含有溶藻弧菌;健康牙鲆组织的检测结果显示,C线和T1、T2、T3、T4线皆显色(见图7)。
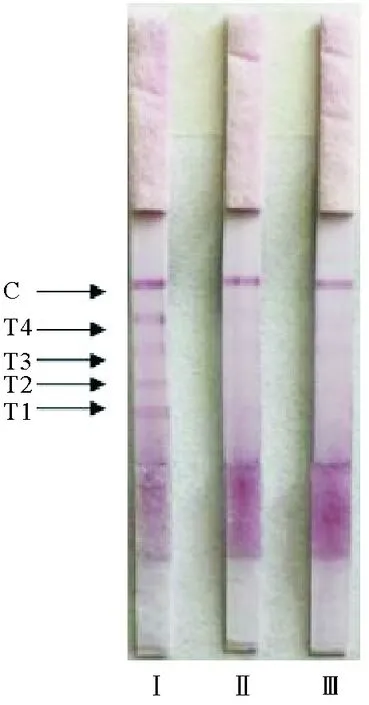
(Ⅰ:健康牙鲆组织样品检测结果;Ⅱ:患病牙鲆腹水检测结果;Ⅲ:患病牙鲆溃疡组织检测结果。Ⅰ.Negativecontrol using the tissues of healthy flounder;Ⅱ. Positive results forV.alginolyticusinthe ascites of flounder;Ⅲ. Positive results forV.alginolyticusinskinwith ulcer of flounder.)
图7 牙鲆中溶藻弧菌的检测结果
Fig.7 Detection results ofV.alginolyticusindiseased
flounderParalichthysolivaceus
ELISA检测结果显示,牙鲆腹水和溃疡组织样品的OD值与健康牙鲆组织阴性对照组OD值的比值即P/N值皆大于2.1,表明为溶藻弧菌阳性(见图8)。
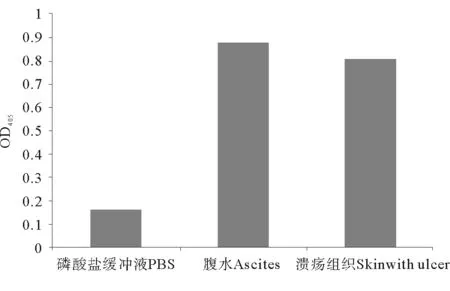
图8 ELISA法检测牙鲆样品中溶藻弧菌
3 讨论
近年来,由于水产养殖水域生态变化,弧菌已成为海水养殖动物的主要病原菌之一,已见报道的海水养殖动物病原弧菌有20多种,且常发生多种(血清型或亚种)弧菌的混合感染,其中溶藻弧菌与副溶血弧菌、哈维氏弧菌是海洋生物尤其是海水鱼类弧菌病的主要致病菌[13]。细菌是多种抗原成分组成的复合体,其抗原包括菌体抗原、鞭毛抗原、荚膜抗原和菌毛抗原等,可诱导机体产生抗体,因此,可利用抗原-抗体特异性反应的原理以达到确诊病原的目的。但是,由于分类地位相近,弧菌间具有的共同抗原性蛋白会导致不同弧菌之间存在交叉免疫反应性[14-15],从而对检测结果的准确判定造成干扰。所以,准确判定某种病原菌感染还是其他菌的交叉反应是免疫学技术检测病原时需要解决的关键问题。
本文将抗原芯片法原理与竞争免疫层析技术相结合研制了溶藻弧菌快速检测试纸。利用免疫芯片法原理,将病原菌的多种抗原组分排列在一起与待检样品同时进行反应,则该菌的所有抗原成分皆与抗体发生反应,而其他菌只有个别抗原成分与抗体发生交叉反应,所以当所有抗原成分全部为阳性反应时即判定为检测结果阳性,部分抗原为阳性反应时则为交叉反应。由此,将溶藻弧菌四种特异性抗原组分作为试纸的4条检测线,羊抗兔IgG作为质控线,利用竞争法免疫层析技术制备溶藻弧菌快速检测试纸,在检测水产动物待测样品时,若待测样品中含有溶藻弧菌,待测样品液扩散至金标垫时,金标溶藻弧菌兔多抗与溶藻弧菌结合,形成金标多抗-菌复合物,并封闭金标多抗上与溶藻弧菌特异性抗原结合的位点,阻止金标多抗与硝酸纤维素膜上检测线T1、T2、T3和T4线上的特异性抗原蛋白结合,则T1-T4线皆无红色条带出现,结果判别为阳性;当复合物扩散至质控线(C线)处,被该处的羊抗兔IgG所俘获,聚集而形成肉眼可见的条带。相反,若待测样品中不含有溶藻弧菌,待测样品液扩散至金标垫时未形成金标多抗-菌复合物,金标多抗与T1、T2、T3和T4线上的4种抗原反应而形成肉眼可见的条带,结果为阴性;如果待测样品中含有其他与溶藻弧菌具有相同抗原成分的病原菌,金标多抗与共同抗原结合形成少量的金标多抗-菌复合物,则含共同抗原的检测线颜色会变浅或者不显色,而T4线上的全菌蛋白因含有除共同抗原以外的其他抗原蛋白则一定出现红色条带。因此,只要出现T4线显色、T1-T3线中1条或几条线不显色的情况则检测结果为其他菌的交叉反应,由此,建立了该试纸检测结果的判定方法。本文利用制备的溶藻弧菌快速检测试纸,对鳗弧菌、鱼肠弧菌、副溶血弧菌、哈维氏弧菌和溶藻弧菌同时进行检测,发现溶藻弧菌使T1-T4线皆不显色,其他4种弧菌皆使T4、T2、T1线显色,而鳗弧菌和鱼肠弧菌使T3线颜色明显变浅,副溶血弧菌和哈维氏弧菌的T3线不显色,表明这4种菌与溶藻弧菌的胞外产物中含有共同抗原成分,与溶藻弧菌试纸发生了交叉反应,这些结果说明所制备的溶藻弧菌快速检测试纸能够准确检测溶藻弧菌,且能够排除其他弧菌的交叉反应对结果判定的影响,具有很好的特异性。对人工感染溶藻弧菌的牙鲆样品的检测结果也证明该试纸可以实际应用于鱼类组织中溶藻弧菌的准确检测。
目前胶体金免疫层析试纸的灵敏度在105~106cfu·mL-1之间[16-18],本检测试纸的灵敏度为5×105cfu·mL-1,达到同类检测试纸的水平。但是,该试纸与实验室常用的PCR技术相比灵敏度还存在差距,病原菌浓度小于检测限5×105cfu·mL-1时,检测结果显示为阴性,使其应用受到一定的限制,即病原菌感染量较低时不能及时检测到病原的存在,不能用于感染早期的病原检测。鉴于该试纸具有较好的准确性和特异性,而水产动物感染溶藻弧菌患病时,体内病原菌的浓度一般高于5×105cfu·mL-1[19-20],因此该试纸可用于患病水产动物中溶藻弧菌的快速诊断,但还有待于通过优化抗体及其他实验条件参数提高其灵敏度。
本文制备的溶藻弧菌快速检测试纸具有操作简便、反应速度快、特异性强、准确性高、无需专业人员和专用仪器、检测样品处理简单等优点,适用于普通人员在养殖现场对鱼类溶藻弧菌的快速、准确检测,具有较广阔的应用前景。
[1] 蒋学兵, 马聪, 郭建巍, 等. 中国海域海洋细菌的分离与鉴定方法研究[J]. 解放军医学杂志, 2009(7): 898-900. JIANG Xue-bing, MA Cong, GUO Jian-wei, et al. Studies on the isolation and identification of marine bacteria in near sea territory of China [J]. Medical Journal of Chinese People’s Liberation Army, 2009(7): 898-900.
[2] Jayaprakash N S, Pai S S, Philip R, et al. Isolation of a pathogenic strain ofVibrioalginolyticusfrom necrotic larvae ofMacrobrachiumrosenbergii(de Man)[J]. Journal of Fish Diseases, 2006, 29(3): 187-191.
[3] 陈强, 鄢庆枇, 邹文政, 等. 环境因子对溶藻弧菌(Vibrioalginolyticus)粘附大黄鱼(Pseudosciaenacrocea)表皮粘液影响的研究[J]. 海洋与湖沼, 2007, 38(4): 361-366. CHEN Qiang,YAN Qing-pi, ZHOU Wen-zheng,et al., Influence of antagonistic bacteria on adhesion ofpathogenicVibrioalginolyticusto skin mucus ofPseudosciaenacrocea[J]. Oceanologia EtLimnologia Sinica, 2007, 38(4): 361-366.
[4] Schmidt U, Chmel H, Cobbs C.Vibrioalginolyticusinfections in humans [J]. Journal of Clinical Microbiology, 1979, 10(5): 666-668.
[5] 严纪文, 马聪, 朱海明, 等. 2003-2005年广东省水产品中副溶血弧菌的主动检测及其基因指纹图谱库的建立[J]. 中国卫生检验杂志, 2006, 16(4): 387-391. YAN Ji-wen, MA Cong, ZHU Hai-ming, et al. Estabishment of fingerprinting database and surveillance on marine products forVibrioparahaemolyticusin Guangdong from 2003 to 2005 [J].Chinese Journal of Health Laboratory Technology, 2006, 16(4): 387-391.
[6] 刘骁, 杨劲, 张春辉. 水产品中溶藻弧菌检测技术发展研究[J]. 生物技术世界, 2013(4): 45-46. LIU Xiao, YANG Jing, ZHANG Chun-hui. Development of detection technology ofVibrioalginolyticusin aquatic products[J]. Biotech World, 2013(4): 45-46.
[7] 方莹. 免疫胶体金技术及其在微生物检测中的应用[J]. 中国卫生检验杂志, 2006, 16(11): 1399-1401. FANG Ying. Application of colloidal gold technology in microbiological tests[J]. Chinese Journal of Health Laboratory Technology, 2006, 16(11): 1399-1401.
[8] 李永芹.养殖鱼类病原菌检测芯片技术的建立[D]. 青岛: 中国海洋大学, 2010. LI Yong-qin. Development of Microarray for Detection of Fish Pathogenic Bacteria[D]. Qingdao: Ocean University of China, 2010.
[9] 金伯泉. 细胞和分子免疫学实验技术[M]. 西安: 第四军医大学出版社, 2002: 9-54. JIN Bo-quan. Cellular and Molecular Immunology Experiment Technology[M]. Xi’an: The Tourth Military MedicaLuniversity Press, 2002: 9-54.
[10] 熊焰, 孙霞, 荀琳.猪肺炎支原体MY-99株膜蛋白SDS-PAGE分析及免疫原性研究[J].畜牧兽医学报, 2004, 35(1): 74-78. XIONG Yan, SUN Xia, XUN Lin. Study on SDS-PAGE and immunogenicity ofMycoplasmahyopneumoniaestrain MY-99 membrane protein[J]. Acta Veterinariaet Zootechnica Sinica, 2004, 35(1): 74-78.
[11] 张晓佩, 龚晖, 陈如敬, 等. 迟钝爱德华氏菌鞭毛蛋白的提取与分析[J]. 福建农业学报, 2008, 23(1): 35-38. ZHANG Xiao-Pei, GONG Hui, CHEN Ru-Jing, et al. Purification and analysis ofEdwardsiellatardaflagellin[J]. Fujian Journal of Agricultural Sciences, 2008, 23(1): 35-38.
[12] Inamura H, Muroga K, Nakai T. Toxisity of extracellular products ofVibrioanguillarum[J]. Fish Pathol, 1984, 19(2): 89-96.
[13] 陶诗, 何芳芳, 刘雪珠, 等.海水养殖鱼类病原微生物研究进展[J]. 水产科学, 2013(3):175-182. TAO Shi, HE Fang-fang, LIU Xue-zhu, et al. Research progress of pathogenic microorganisms in fish in mariculture[J]. Fisheries Science, 2013(3): 175-182.
[14] van Gils Marit J, B Evelien, M Burger Judith A,et al.Rapid escape from preserved cross-reactive neutralizing humoral immunity without loss of viral fitness in HIV-1-infected progressors and long-term nonprogressors[J].Journal of Virology, 2010, 84(7): 3576-3585.
[15] Rashid T, Jayakumar K S,Binder A,et al.Rheumatoid arthritis patients have elevated antibodies to cross-reactive and non cross-reactive antigens from Proteus microbes [J]. Clinical and Experimental Rheumatology, 2007, 25(2): 259-267.
[16] Chunmei Song, Cheng Liu, Shunyan Wu, et al. Development of a lateral flow colloidal gold immunoassay strip for the simultaneous detection ofShigellaboydiiandEscherichiacoliO157:H7 in bread, milk and jelly samples[J].Food Control, 2016(59): 345-351.
[17] Shiqi Xia, Zhibiao Yu, Daofeng Liu, et al.Developing a novel immunochromatographic test strip with gold magnetic bifunctionalnanobeads (GMBN) for efficient detection ofSalmonellacholeraesuisin milk [J]. Food Control, 2016(59): 507-512.
[18] 侯湾湾. 鸭疫里默氏杆菌免疫胶体金试剂盒的研制[D]. 南京: 南京农业大学, 2014. HOU Wan-wan. Development of the Colloidal Gold Immunochromatographic Strip for the Detection ofRiemerellaanatipestiper[D]. Nanjing: Nanjing Agricultural University, 2014.
[19] 万文菊. 剑尾鱼HSP70家族两成员的分子克隆及溶藻弧菌感染与免疫对其基因的诱导表达[D].泰安: 山东农业大学, 2006. WAN Wen-ju. Molecular Cloning of Two Members of HSP70 and Their Transcriptional Regulation Responding toVibrioalginolyticusInfection and Immunization inXiphophorushelleri[D]. Taian: Shandong Agricultural University, 2006.
[20] 胡雪峰, 石存斌, 潘厚军, 等, 海水养殖斜带石斑鱼溃疡病病原菌(溶藻弧菌)的初步研究[J]. 中国海洋大学学报(自然科学版), 2005, 35(2):232-236. HU Xue-feng, SHI Cun-bin, PAN Hou-jun, et al., Preliminary studies on the pathogen (Vibrioalginolyticus) of the ulceration disease of maricultured Estuary Cod,Epinepheluscoioides[J]. Periodical of Ocean University of China, 2005, 35(2): 232-236.
Abstract: Anti-Vibrioalginolyticuspolyclonal antibody was labeled with freshly prepared colloidal gold particles with a 20 nm diameter. Four specific antigens ofV.alginolyticus, including outer membrane protein, flagellum protein, extracellular products and whole-cell bacterial protein, and goat anti-rabbit IgG were dispensed on the nitrocellulose membrane as four test lines and the control line, respectively, and the colloidal gold test strip for rapiddetection ofV.alginolyticuswas developed through competitive immunochromatography combined with the antigen microarray principle. The developed colloidal gold test strip could distinguish the infection ofV.alginolyticusfromV.parahaemolyticus,V.harveyi,V.anguillarumandV.ichthyoenteri, and accurately tell the difference betweenV.alginolyticusinfection and cross-reactivity of other bacteria. The test strip gave a detection limit of 5×105cfu·mL-1ofV.alginolyticus, and the testing took 10~15 min and presented a visualizing result. This easy-to-use test strip allowed on-site rapid detection ofV.alginolyticuswithout the requirement of specialized equipment and professional personnel, providing a potential application prospect in fish aquaculture.
Key words:Vibrioalginolyticus; colloidal gold; competitive immunochromatography; specific antigen; cross-reactivity; antigen chip technology; rapid test strip
责任编辑 朱宝象
Development of a Competitive Gold Immunochromatography Test Strip for Rapid Detection ofVibrioalginolyticusin Fish
LI Jia-Wen, SHENG Xiu-Zhen,TANG Xiao-Qian,XING Jing, ZHAN Wen-Bin
(Laboratory of Pathology and Immunology of Aquatic Animal, College of Fisheries, Ocean University of China, Qingdao 266003, China)
山东省科技发展计划项目(2014GNC111015);山东省自主创新成果转化项目(2014ZZCX06205);国家自然科学基金项目(31472295;31672685)资助 Supported by Science and Technology Development Project of Shandong Province(2014GNC111015); Independent Innovation and Achievement Transformation Project in Shandong Province (2014ZZCX06205); National Natural Science Foun-dation of China (31472295;31672685)
2016-12-29;
2017-02-10
李嘉文(1991-),男,硕士生,主要从事水产动物病害与免疫学研究。
❋❋ 通讯作者:E-mail: xzsheng@ouc.edu.cn
S94
A
1672-5174(2017)09-046-09
10.16441/j.cnki.hdxb.20160432
李嘉文, 绳秀珍, 唐小千, 等.运用抗原芯片原理与竞争免疫层析技术制备鱼类病原性溶藻弧菌快速检测试纸[J]. 中国海洋大学学报(自然科学版), 2017, 47(9): 46-54.
LI Jia-Wen, SHENG Xiu-Zhen, TANG Xiao-Qian,et al.Development of a competitive gold immunochromatography test strip for rapid detection ofVibrioalginolyticusin fish[J]. Periodical of Ocean University of China, 2017, 47(9): 46-54.

