中国鲎内脏N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及其酶学性质❋
林建城, 许恒棋, 罗新明
(莆田学院环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室,福建 莆田 351100)
中国鲎内脏N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及其酶学性质❋
林建城, 许恒棋, 罗新明
(莆田学院环境与生物工程学院,福建省新型污染物生态毒理效应与控制重点实验室,福建 莆田 351100)
以中国鲎(Tachypleustridentatus)内脏为材料,分别通过30%和80%饱和度(NH4)2SO4沉淀分级分离、葡聚糖凝胶柱Sephadex G-200层析、以及离子交换柱DEAE-32层析,从而获得N-乙酰-β-D-氨基葡萄糖苷酶(EC3.2.1.52,NAGase),经PAGE检定达到电泳纯,酶的比活力为505.21 U/mg。SDS-PAGE显示一谱带,测得该酶蛋白亚基分子量为121.5 kDa,等电聚焦电泳法测得酶的等电点pI为6.01。以pNP-β-D-GlcNAc为底物,研究NAGase催化反应的动力学参数。结果表明:中国鲎NAGase的最适pH、最适温度、Km和Vmax分别为5.4和55 ℃、0.421 mmol/L和13.158 μmol/L·min-1;酶在pH=4.5~7.0范围内较稳定,在20~50 ℃之间具有较好的热稳定性。酶在276 nm波长处有紫外吸收峰,在232.2 nm波长的内源荧光激发下,酶内源荧光发射光谱峰在330.9 nm波长处。Na+,K+和Li+对NAGase活力没有影响,Ca2+、Ba2+和Co2+对NAGase有不同程度的激活作用,Co2+对NAGase的激活作用较大,5 mmol/L Co2+能使NAGase活力提高41.67%;Mg2+、Cu2+、Zn2+、Mn2+、Fe3+、Al3+、Pb2+、Ag+、Cd2+和Hg2+等10种金属离子对NAGase活力有不同程度的抑制作用,5 mmol/L Cd2+可使酶活力丧失85.60%,而Hg2+对酶的抑制作用最强,0.1 mmol/L Hg2+可使酶活力丧失90.10%。EDTA对酶活力没有影响,推断中国鲎NAGase属于非金属酶类。
中国鲎;N-乙酰-β-D-氨基葡萄糖苷酶;分离纯化;酶学性质
N-乙酰-β-D-氨基葡萄糖苷酶(EC3.2.1.52,NAGase)是几丁质酶系的一个重要组分成分,NAGase具有外切酶活力,对几丁质进行外切为单体—β-N-乙酰葡萄糖胺,又能将外切几丁质酶降解几丁质产生的几丁二糖继续降解为单体[1]。近几年主要集中在对甲壳动物和节肢动物NAGase的研究。前已研究了凡纳滨对虾(Penaeusvannamei)内脏NAGase的酶学特性[2],而朴顺金等[3]对凡纳滨对虾外壳膜NAGase进一步研究表明:对虾外壳膜NAGase与对虾蜕壳生长发育密切相关,不同生长期对虾外壳膜NAGase含量存在较大的差异;颜雅雯等[4]分离到锯缘青蟹(Scyllaserrata)内表皮NAGase,发现锯缘青蟹内表皮NAGase活力变化的趋势表现出一定的季节性规律;而Meyer等[5]研究发现,南极磷虾(Euphausiasuperba)在蜕壳前虾体中蜕壳激素浓度升高,几丁质酶的表达量也明显增加。此外,Koga等[6]从家蚕(Bombyxmori)的表皮层和消化道中分别获得NAGase,研究表明:来自家蚕表皮的NAGase与其周期性蜕皮生理、以及生活周期中蛹的形成有关,而家蚕内脏NAGase的主要作用是降解消化道内几丁质,与家蚕周期性蜕皮无关。此后,从菜青虫(Pierisrapae)表皮中也分离到NAGase[7],对菜青虫NAGase的酶学性质有了深入研究。这些研究结果显示:节肢动物和甲壳动物的NAGase主要功能是降解消化道内含几丁质的食物,并与其周期性蜕皮密切相关。
中国鲎(Tachypleustridentatus)是暖水性近海名贵珍稀节肢动物,是地球上最古老的物种之一,被称为“活化石”,是具有很好药用价值和重要科研意义的古老海洋底栖动物。但目前鲎资源不断减少,成为了濒危物种。究其原因,除了过度捕杀造成鲎资源严重衰减外,还由于近年来对海洋的过度开发利用,工业化不断推进使得沿海地区工业和生活污水及废物大量排入大海,近海污染严重,直接威胁到鲎的生长发育和生存。在中国鲎的胚胎发育过程中,受精卵要经过4次的胚内蜕皮和2次的胚外蜕皮,才能孵化出幼鲎,每次蜕皮体长即增加约25%,从幼鲎到达性成熟,还要蜕皮13~14次。海洋环境因素变化会直接对鲎胚胎发育和幼体生长造成影响,已有海水中重金属、温度、盐度等环境因素对中国鲎胚胎和幼体发育影响的报道[8,9],但有关中国鲎几丁质酶的催化生理以及与周期性蜕皮之间相关性研究还是空白。因此,本课题从中国鲎中分离提取NAGase,研究其酶学特性,探讨环境因素对中国鲎几丁质酶催化生理的影响,这对揭示鲎几丁质酶与蜕皮生理之间的相关性具有重要的科学与实践意义,为鲎资源减少成因提供重要的科学依据。
1 材料与方法
1.1 材料
中国鲎购自莆田市城南市场。酶催化的底物对硝基苯-N-乙酰-β-D-氨基葡萄糖苷(pNP-β-D-GlcNAc),由上海医药工业研究院生化室合成;葡聚糖凝胶G-200(Sephadex G-200)出自Pharmacia,二乙氨基乙基纤维素32(DE-32)是Whatman产品。牛血清蛋白(BSA)为标准蛋白,SDS-PAGE使用的标准蛋白分子质量为14.4~116 kDa,等点电测定使用DH020-1载体两性电解质,来自天根生化科技(北京)有限公司;其余化学试剂均为分析纯。
1.2 方法
1.2.1 中国鲎内脏NAGase的分离纯化 中国鲎内脏NAGase分离纯化方案参照文献[2]。挑取中国鲎活体的内脏部分,加入1∶3(W/V)预冷0.01 mol/L Tris-HCl缓冲液(pH=7.4),匀浆后抽提(4 ℃)4 h,在离心力为40 000×g (4 ℃)下离心0.5 h。再依次采用30%、80%饱和度的(NH4)2SO4分级分离,沉淀物经透析后在50 000×g,4 ℃下离心0.5 h,离心上清液为粗酶制剂。酶制剂经过Sephadex G-200层析柱(2.6 cm×60 cm)层析,采用0.01 mol/L Tris-HCl缓冲液(pH=7.4)为洗脱液,洗脱液内含0.2 mol/L NaCl,流速0.4 mL/min,自动部分收集器收集流出液,按每管4 mL收集,共收集120管,集中有酶活力的收集管,收集液透析后用于DE-32离子交换柱层析;在纤维素DE-32层析柱(1.6 cm×40 cm)层析中,采用与分子筛层析柱相同的洗脱液,内含0~1.0 mol/L NaCl,采用直线梯度洗脱,洗脱液流速为0.25 mL/min,每管收集5 mL,共收集110管,收集酶活力峰,得到的酶制剂在4 ℃下经过双蒸馏水透析后,用于酶学性质的研究。
1.2.2 中国鲎内脏NAGase活力测定 中国鲎内脏NAGase活力的测定方法:分别加入75 mmol/L pH=5.4 HAC- NaAC缓冲液1 mL,5 mmol/L底物pNP-β-D-GlcNAc 0.2 mL,双蒸馏水0.78 mL,混匀,在37 ℃下恒温10 min后,加入20 μL酶液,共2 mL的反应体系,反应时间为10 min,最后加入0.5 mol/L NaOH 2 mL终止反应,测定其光吸收值(A405 nm),以未加入酶制剂的为对照组。以产物硝基酚(pNP)为标准物,制定标准曲线。
1个酶活力单位(U)定义为:在上述条件下,每分钟催化水解产生1 μmol/L pNP所需的酶量规定为1 U。比活力定义为每毫克酶蛋白所具有的酶活力单位数(U)。
1.2.3 中国鲎内脏NAGase蛋白浓度测定 NAGase蛋白浓度测定参考Bradford[10]采用的考马斯亮蓝法,以BSA为标准蛋白;用A280 nm表示各收集管中的蛋白质浓度。
1.2.4 中国鲎内脏NAGase纯度鉴定和蛋白亚基分子质量的测定 NAGase的纯度通过PAGE检定;而NAGase蛋白亚基的相对分子质量采用SDS-PAGE测定,SDS-PAGE所用的分离胶和浓缩胶质量分数分别为12.5%和3.0%;以电泳图谱中各标准蛋白的迁移率(变量x)对各蛋白分子质量的对数(变量y)作图,得一直线:y=-2.515x+5.123。
1.2.5 中国鲎内脏NAGase等电点的测定 参照高英杰等[11]方法,采用等电点聚焦电泳法进行测定。
1.2.6 中国鲎内脏NAGase最适pH值和酸碱稳定性的测定 改变缓冲液 HAC-NaAC的pH(3.6~10.0),检测在不同pH的反应体系中NAGase活力,确定NAGase的最适pH。然后,将NAGase酶液分别与不同pH的HAC-NaAC缓冲液等量混匀处理(4 ℃)1 h,取处理后的酶液20 μL,测定其酶活力,分析NAGase的酸碱稳定性。
1.2.7 中国鲎内脏NAGase最适温度和温度稳定性的测定 改变反应体系的温度(20~90 ℃),检测不同温度下反应体系中NAGase活力,确定NAGase的最适温度。将NAGase酶液经不同温度处理(4 ℃)1 h,取20 μL处理过的酶液,测定其酶活力,分析NAGase的温度稳定性。
1.2.8 中国鲎内脏NAGase米氏常数(Km)测定 在NAGase活力的测定体系中,改变pNP-β-D-GlcNAc底物的摩尔浓度,选择底物浓度为0.15、0.2、0.25、0.33、0.4和0.5 mmol/L,分别检测其酶活力,以底物浓度倒数(1/[S])对测定的相应酶反应速度(1/v)倒数作图,从直线在纵、横坐标轴的交点可分别求出NAGase的最大反应速度Vmax和Km。
1.2.9 NAGase紫外吸收光谱和内源荧光发射光谱特征 在pH=5.4 NaAc-HAc缓冲液体系中,NAGase浓度为7.2 μg/mL,用日本岛津UV-2550型紫外分光光度计扫描,测定酶的紫外吸收峰;再用美国Cary Eclipse荧光分光光度计扫描,在酶内源荧光激发光谱波长为232.2 nm下,测定酶的内源荧光发射光谱峰。
1.2.10 金属离子对中国鲎内脏NAGase活力的影响
在中国鲎内脏NAGase活力的测定体系中,分别加入一定浓度的不同金属化合物(NaCl,KCl,Li2SO4,CaCl2,BaCl2,CoCl2,MgSO4,CuSO4,ZnSO4,MnCl2,FeCl3,AlCl3,Pb(NO3)2,AgNO3,Cd(NO3)2,HgCl2和乙二胺四乙酸(EDTA)溶液,测定加入各金属离子和EDTA后的NAGase活力,分析金属离子对中国鲎内脏NAGase活力的影响。
2 结果与分析
2.1 中国鲎内脏NAGase的分离纯化
中国鲎内脏NAGase各步分离纯化结果见表1。从Sephadex G-200层析洗脱曲线(见图1a)可知,分子筛层析第一个蛋白峰周围就出现NAGase活性,Sephadex G-200是大孔径葡聚糖凝胶,NAGase分子先被排阻洗脱出,说明该NAGase分子质量较大。在离子交换柱DE-32层析色谱(见图1b)中,又出现两个蛋白峰,但只有第二个蛋白峰具有NAGase活性,收集酶活力峰;从NaCl洗脱曲线分析,在0.20 mol/L NaCl下NAGase开始洗脱出来,最终得到纯化倍数5.55,比活力为505.21 U/mg的NAGase酶制剂。
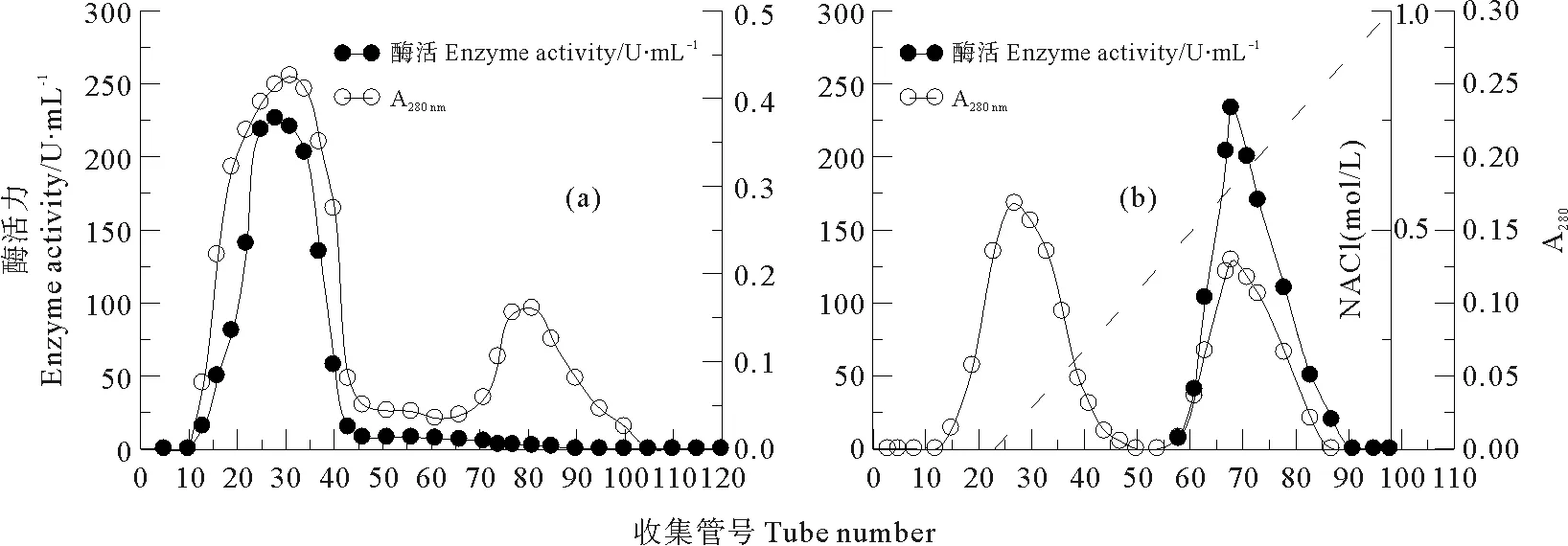
图1 中国鲎内脏NAGase的Sephadex G-200层析色谱(a)和DE-32层析色谱(b)
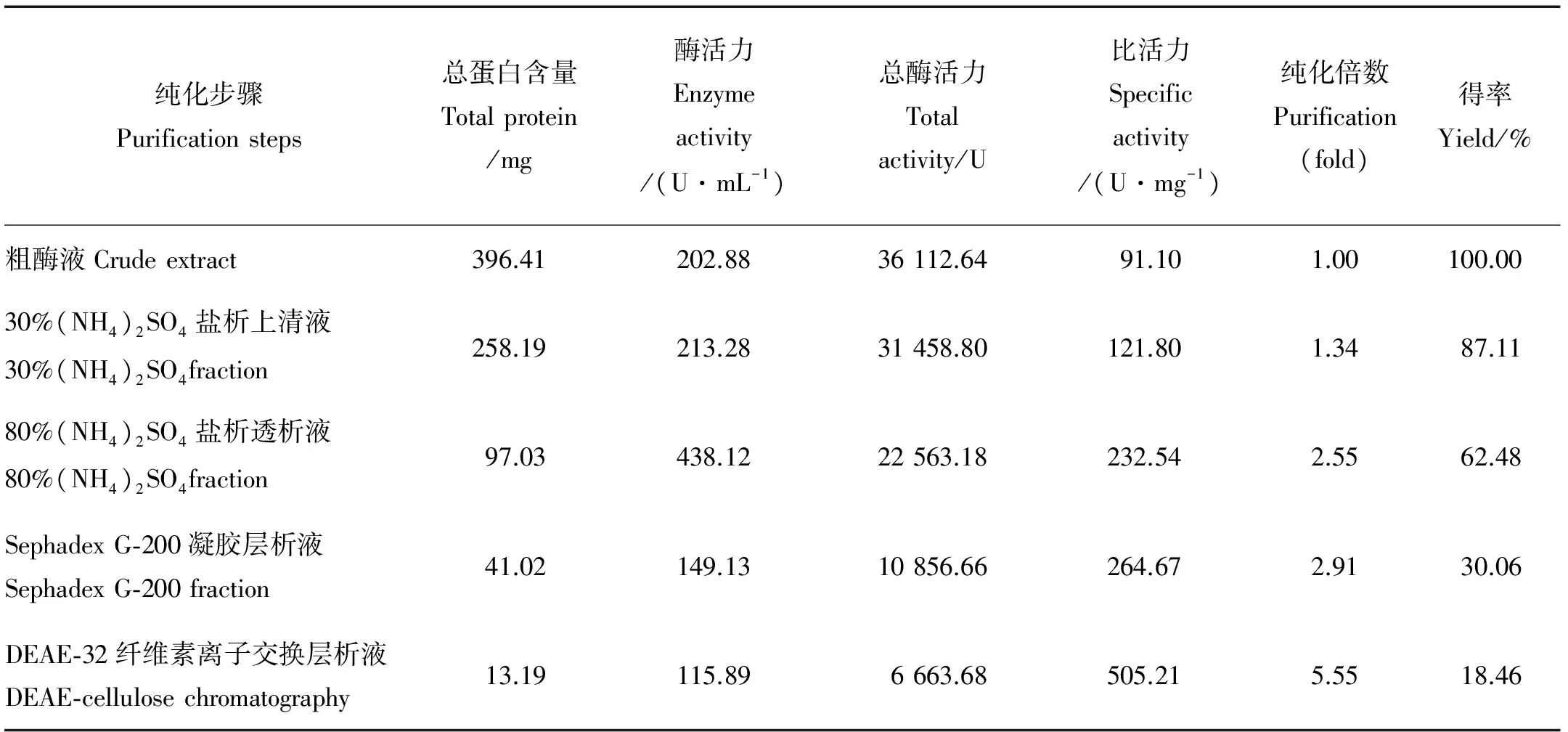
纯化步骤Purificationsteps总蛋白含量Totalprotein/mg酶活力Enzymeactivity/(U·mL-1)总酶活力Totalactivity/U比活力Specificactivity/(U·mg-1)纯化倍数Purification(fold)得率Yield/%粗酶液Crudeextract396.41202.8836112.6491.101.00100.0030%(NH4)2SO4盐析上清液30%(NH4)2SO4fraction258.19213.2831458.80121.801.3487.1180%(NH4)2SO4盐析透析液80%(NH4)2SO4fraction97.03438.1222563.18232.542.5562.48SephadexG⁃200凝胶层析液SephadexG⁃200fraction41.02149.1310856.66264.672.9130.06DEAE⁃32纤维素离子交换层析液DEAE⁃cellulosechromatography13.19115.896663.68505.215.5518.46
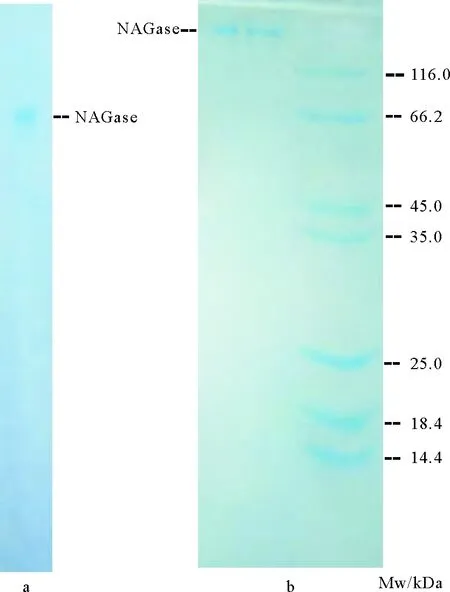
图2 中国鲎NAGase的PAGE(a)及SDS-PAGE(b)图谱
NAGase酶制剂经PAGE检定发现只有一条蛋白带(见图2a),说明经分离纯化后NAGase已达到电泳纯。SDS-PAGE检测结果(见图2b)显示,只获得单一条带的NAGase酶制剂。根据NAGase的相对迁移率,求得NAGase亚基分子质量为121.5 kDa。等电聚焦电泳法测定NAGase等电点为6.01。
2.2 中国鲎内脏NAGase的最适pH值和酸碱稳定性
图3显示,中国鲎内脏NAGase的最适pH为5.4,在pH=5.0~6.0下,NAGase有较高活力,当pH>7.0时酶失活速度加快。NAGase在pH=4.5~7.0区域内相对稳定,在pH=10.0缓冲液中处理1 h后,酶活力只有19.1%。
2.3 中国鲎内脏NAGase的最适温度和温度稳定性
从图4可见,温度对中国鲎内脏NAGase活力影响呈钟罩型曲线变化,NAGase对底物pNP-β-D-GlcNAc催化水解的最适温度为55 ℃。NAGase在20~50 ℃之间具有较好的热稳定性,在60 ℃下处理1 h相对酶活力仅为21.3%,90 ℃下酶接近失活。
2.4 NAGase水解底物pNP-β-D-GlcNAc的动力学分析
从图5可知,底物浓度[S]在0.15~0.5 mmol/L范围内,随着[S]的增大,中国鲎内脏NAGase反应速度[v]也增大。以1/[S]对1/v作图(双倒数作图),获得一直线,直线方程为:y=0.032x+ 0.076。求得Km为0.421 mmol/L,Vmax为13.158 μmol/L·min-1。
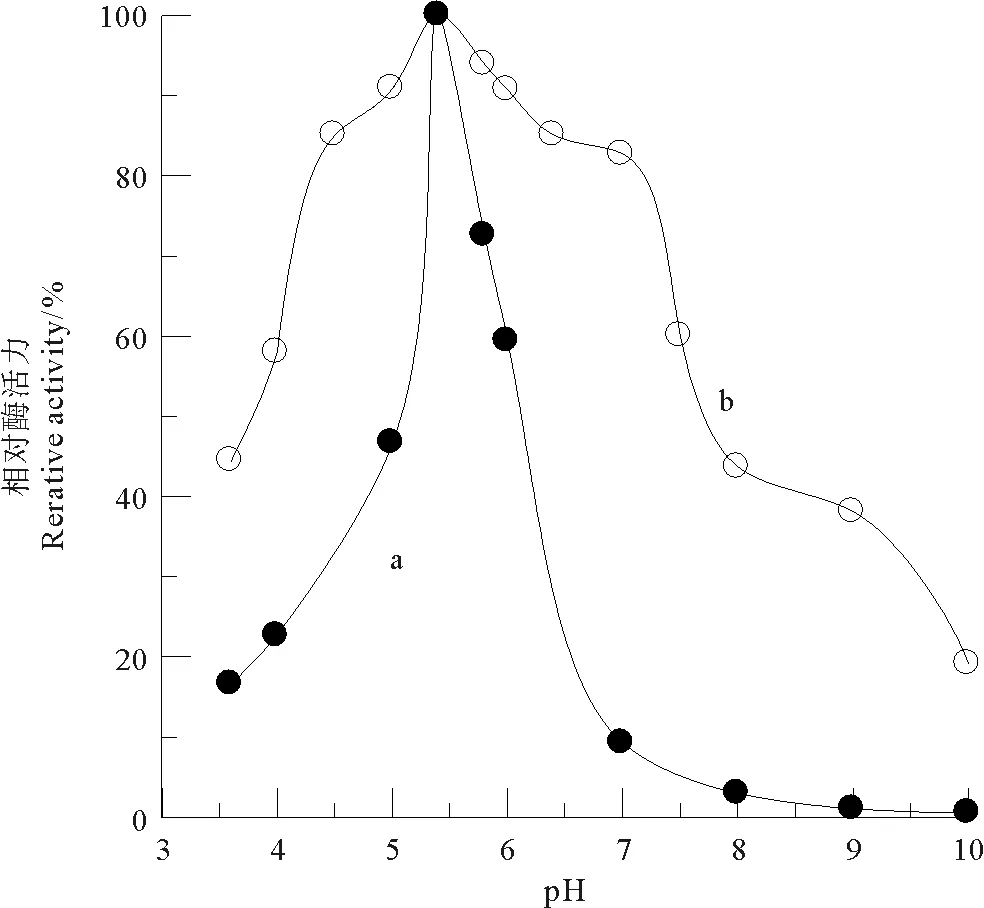
(a.最适pH; b.酸碱稳定性。a.Optimum pH; b. pH stability.)
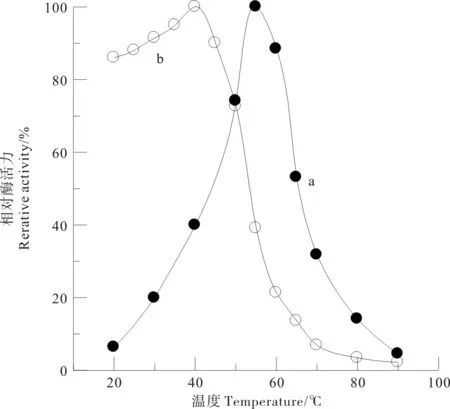
(a.最适温度; b.热稳定性。a.Optimum temperature; b.Temperature stability.)
图4 中国鲎NAGase的最适温度和温度稳定性
Fig.4 Optimum temperature and temperature stability of NAGase fromTachypleustridentatus
2.5 NAGase紫外吸收光谱和内源荧光发射光谱特征
选择腹部或心脏线圈,以胎头为中心,尽量贴紧扫描部位,协助孕妇取侧卧位,保证胎儿与线圈距离更近。为孕妇带耳塞,减少噪声干扰,减少其不自主运动。先对胎头进行三平面定位,因为胎儿会活动,检查时随时进行实时定位。
中国鲎内脏NAGase在NaAc-HAc缓冲液体系中,在276 nm波长处有紫外吸收峰;而在232.2 nm波长的光激发下,NAGase的内源荧光发射光谱峰在330.9 nm波长处。
2.6 金属离子对NAGase活力的影响
从表2可知,在本试验条件下,Na+, K+和Li+对中国鲎内脏NAGase活力没有影响;Ca2+、Ba2+对NAGase活力有微弱的激活作用,5 mmol/L Co2+能使NAGase活力提高41.67%;Mg2+、Cu2+、Zn2+、Mn2+、Fe3+、Al3+、Pb2+、Ag+、Cd2+、Hg2+等10种金属离子对NAGase活力有不同程度的抑制作用,5 mmol/L Cd2+可使NAGase活力丧失85.60%,而Hg2+对NAGase抑制作用最强,0.1 mmol/L Hg2+可使酶活力丧失90.10%。EDTA对NAGase活力没有影响,说明NAGase活性中心不含金属离子,不属于金属酶类。
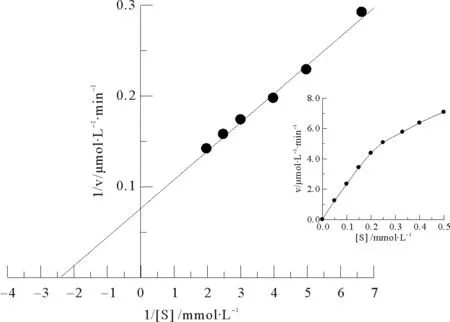
(图内插图为底物浓度对初速度的双曲线。The inset shows the relationship between the substrate concentration and the initial rate.)
图5 中国鲎NAGase米氏常数Km的测定
Fig.5 The determination of Michaelis constant(Km)of NAGase fromTachypleustridentatus.
3 讨论
3.1 NAGase的功能与基本性质
前人研究[12]表明:植物NAGase主要是在抵抗真菌等微生物的侵染中进行应激防卫反应而产生;细菌类NAGase主要是起到降解几丁质的作用,细菌进而从中获得营养;而在节肢动物以及甲壳动物中,NAGase的作用除了用于消化含几丁质的食物,还参与到周期性蜕皮的生理过程。此外,目前认为动物精巢中的NAGase与动物生殖机能还存在密切相关[13],动物卵子表面的糖蛋白链参与精卵结合过程,而动物精子中的NAGase可能在受精后又能水解该糖蛋白链。黄小红等[12,14]已从番鸭(Cairinamoschata)睾丸、猪精液中获取NAGase,并阐明其酶学性质。目前,NAGase的功能与性质的研究已越来越受重视。不同动物来源的NAGase,它们的酶学性质存在差异。猪[14]精液来源的碱性NAGase,该酶蛋白亚基的相对分子质量为58.03 kDa,米氏常数Km为1.94 mmol/L;而菜青虫[7]表皮的NAGase是由2个相对分子质量分别为59.5和57.2 kDa的酶蛋白亚基组成,Km为0.285 mmol/L;虾类体内的NAGase,如中国明对虾(Fenneropenaeuschinensis)[15]体壁NAGase的酶蛋白亚基分子质量为48.88 kDa,Km为0.23 mmol/L;而中华绒螯蟹(Eriocheirsinensis)[16]内脏NAGase则含有3个相对分子质量分别为121.21、98.63、73.48 kDa的酶蛋白亚基,Km为0.357 mmol/L。本试验结果表明:中国鲎内脏NAGase酶蛋白亚基分子质量为121.5 kDa,亚基分子质量较大,Km为0.421 mmol/L。前人研究结果表明:不同动物NAGase降解底物(pNP-β-D-GlcNAc)的Km大小不同,即不同来源的NAGase对同一底物亲和力不同,中国明对虾[15]体壁NAGase的Km较小,对底物亲和力相对较大。
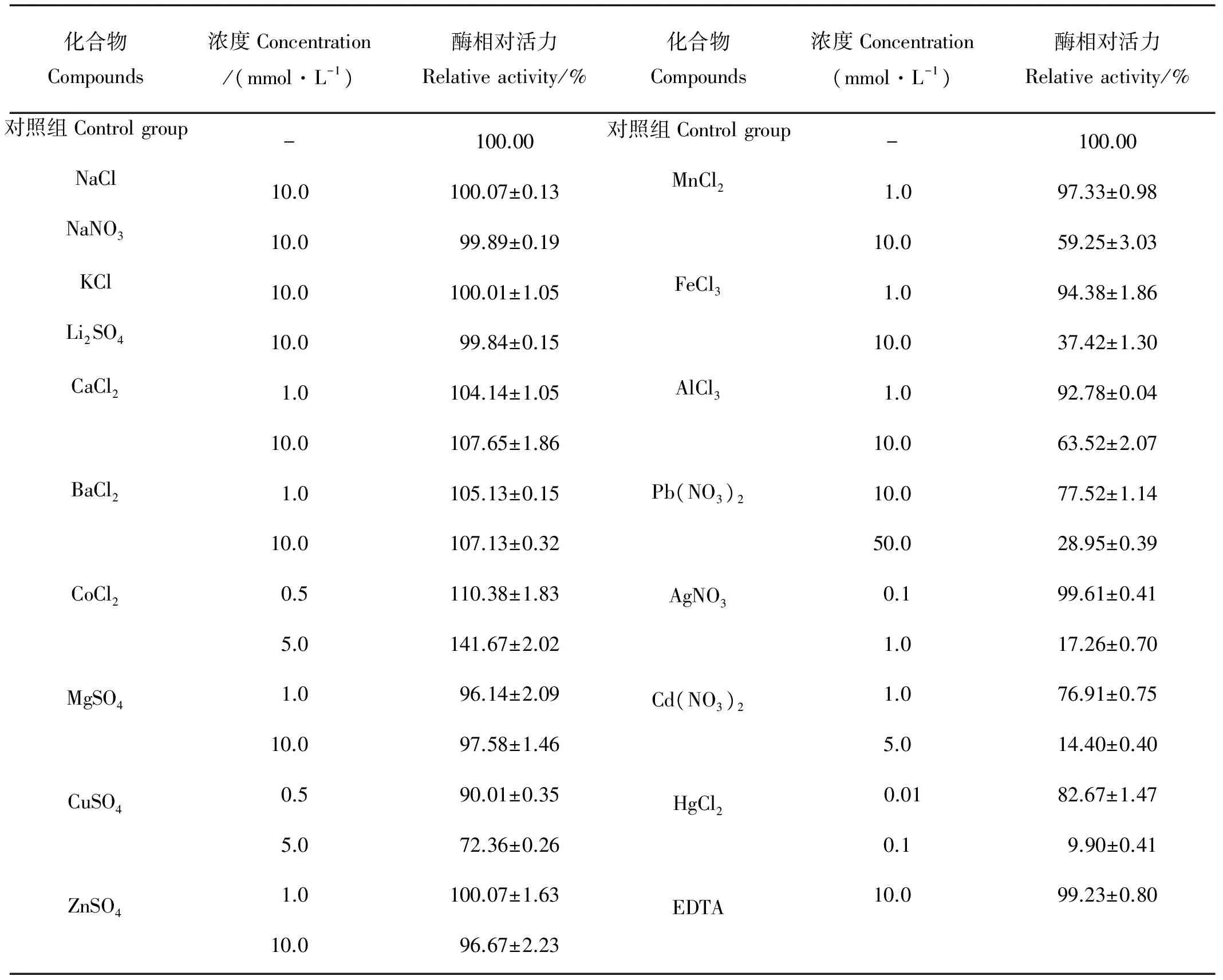
表2 16种金属离子对中国鲎NAGase的影响
pH对不同生物来源的NAGase有不同效应。菜青虫[7]表皮NAGase最适pH是6.2,而前研究的中国明对虾[15]体壁NAGase的最适pH为6.0,本试验结果表明:中国鲎内脏NAGase的最适pH为5.4。与中华绒螯蟹[16]内脏NAGase最适pH(5.5)、猪[14]精液碱性NAGase最适pH(5.5)和罗非鱼(Oreochromisniloticus)[17]精巢NAGase最适pH(5.7)相近,这些来自不同动物的NAGase,其最适pH均偏向酸性。
在温度对动物NAGase影响的研究中,菜青虫[7]表皮NAGase最适温度为42 ℃,中华绒鳌蟹[16]内脏NAGase最适温度为45 ℃,而番鸭[12]睾丸与罗非鱼[17]精巢NAGase的最适温度均为55 ℃。试验结果显示:中国鲎内脏NAGase的最适温度为55 ℃。因为中国鲎幼体发育适宜水温为30 ℃左右[8],在此水温下,中国鲎内脏NAGase活力较低。
3.2 NAGase的稳定性
不同动物来源的NAGase对酸碱稳定性不同。罗非鱼[17]精巢NAGase在pH=3.3~8.1内稳定,猪[14]精液碱性NAGase酸碱稳定区域是pH=3.0~8.9,而家蚕[6]和菜青虫[7]表皮NAGase分别在pH=5.5~8.5、pH=4.0~9.0内稳定,可见,这些不同来源的NAGase在酸碱区域内均具一定的稳定性。在本试验中,中国鲎内脏NAGase在pH=4.5~7.0区域内较为稳定,稳定区域偏酸性,在pH=10.0缓冲液中处理1 h后,酶活力只有19.1 %,说明中国鲎内脏NAGase较不耐碱性。
对NAGase的温度稳定性研究结果表明,来自菜青虫[7]表皮、番鸭[12]睾丸、中国明对虾[15]体壁、中华绒螯蟹[16]内脏和罗非鱼[17]精巢的NAGase在45 ℃以上失活速度均加快,但中国鲎内脏NAGase在20~50 ℃区域内稳定,在55 ℃以上酶才迅速失活,说明中国鲎内脏NAGase具有较好的热稳定性。
3.3 金属离子对NAGase的影响
本试验结果表明:Ca2+对中国鲎内脏NAGase呈现微弱的激活作用,而Mg2+对NAGase活力又具有微弱的抑制作用。Mg2+和Ca2+往往对酶会呈现激活作用,它们对中国明对虾[15]体壁NAGase和锯缘青蟹(Scyllaserrata)[18]内脏NAGase均有激活作用,但两者对中华绒螯蟹[16]内脏NAGase又都没有影响,Ca2+对番鸭[12]睾丸NAGase反而呈现抑制作用。在本试验中,Ba2+和Co2+对中国鲎内脏NAGase活力有不同程度的激活作用,但Ba2+和Co2+对凡纳滨对虾[2]内脏NAGase又均呈现抑制作用。试验还表明,Cu2+、Zn2+、Mn2+、Fe3+和Al3+等金属离子对中国鲎内脏NAGase活力有不同程度的抑制作用。在相关研究中,Cu2+、Zn2+对菜青虫[7]表皮、中国明对虾[15]体壁和中华绒螯蟹[16]内脏的NAGase均有抑制作用;Mn2+对罗非鱼[17]精巢NAGase有一定抑制作用,但对凡钠滨对虾[2]内脏NAGase又呈现激活作用;Fe3+对凡纳滨对虾[2]内脏NAGase呈现抑制作用,但对中国明对虾[15]体壁NAGase又有激活作用。此外,Al3+对番鸭[12]睾丸和中华绒螯蟹[16]内脏NAGase也均有抑制作用。因此,这5种金属离子对不同来源的NAGase影响效应存在差异。
Pb2+、Ag+、Cd2+和Hg2+这4种重金属离子对生物毒性大,往往是生物体内酶的强烈抑制剂。Pb2+对中华绒螯蟹[16]内脏和罗非鱼[17]精巢NAGase均有抑制作用;当Ag+浓度超过0.27 mmol/L时,Ag+开始对中华绒螯蟹[19]内脏NAGase产生抑制作用。本试验中,50 mmol/L Pb2+可使中国鲎内脏NAGase活力丧失71.05%,而1 mmol/L Ag+则可使中国鲎内脏NAGase活力丧失82.74%。Cd2+对凡纳滨对虾[2]内脏NAGase有较强的抑制作用,Hg2+对锯缘青蟹[18]内脏和菜青虫[7]表皮NAGase均有很强的抑制作用。本试验结果表明:5 mmol/L Cd2+可使中国鲎内脏NAGase活力丧失85.60%,Hg2+对中国鲎内脏NAGase抑制作用最强,0.1 mmol/L Hg2+可使酶活力丧失90.10%。这4种重金属离子对中国鲎内脏NAGase抑制作用从大到小顺序为:Hg2+>Ag+>Cd2+>Pb2+。
因此,不同金属离子对NAGase存在不同生理效应,相同金属离子对不同动物来源的NAGase影响也不同,海洋水体中金属离子含量会直接影响到中国鲎NAGase的催化生理。
[1] Broadway R M, Williams D L, Kaln W C, et al. Partial characterization of chitinolytic enzymes fromStreptomycesalbidoflavus[J]. Letters in Applied Microbiology, 1995, 20: 271-276.
[2] Xie X L, Chen Q X, Lin J C, et al. Purification and some properties ofβ-N-acetyl-D-glucosaminidase from prawn(Penaeusvannamei)[J]. Marine Biol, 2004, 146: 143-148.
[3] 朴顺金, 谢晓兰, 黄乾生, 等. 不同养殖期的凡纳滨对虾外壳膜NAGase基本性质比较[J]. 台湾海峡, 2006, 25(3): 348-352. Piao S J, Xie X L, Huang Q S, et al. Comparison of the basic properties of NAGase from the crustaceous membrane of shrimp(Litopenaeusvannamei) in different stages[J]. Journal of Oceanography in Tai Wan Strait, 2006, 25(3): 348-352.
[4] 颜雅雯, 王 勤, 石 艳, 等. 不同季节锯缘青蟹内表皮N-乙酰-β-D-氨基葡萄糖苷酶活力与性质的比较[J]. 厦门大学学报(自然科学版), 2009, 48(2): 265-268. Yan Y W, Wang Q, Shi Y, et al. Investigation on the activity and basic properties of NAGase from endepidermis of the green crab(Scyllaserrata) during different seasons[J]. Journal of Xiamen University(Natural Science), 2009, 48(2): 265-268.
[5] Meyer B, Saborowski R, Atkinson A. Seasonal differences in citrate synthase and digestive enzyme activity in larval and postlarval Antarctic krill,Euphausiasuperba[J]. Marine Biology, 2002, 141(5): 855-862.
[6] Koga D, Shimazaki C, Yamamoto K, et al. NAGase from integument of the silkworm,Bombyxmori: Comparative Biochemistry with the pupal alimentary canal enzyme[J]. Agric Biol Chem, 1987, 51(6): 1679-1681.
[7] Shi Y, Jiang Z, Han P, et al. Purification and some properties ofβ-N-acetyl-D-glucosaminidase from the cabbage butterfly(Pierisrapae)[J]. Biochimie, 2007, 89(3): 347-354.
[8] 王德祥, 苏永全, 王君, 等.几种因子对中国鲎胚胎和幼体发育的影响[J]. 中国水产科学, 2001, 8(3): 10-14. Wang D X, Su Y Q, Wang J, et al. Influence of environmental factors on development of embryo and larvae inTachypleustridentatues[J]. Journal of Fishery Sciences of China, 2001, 8(3): 10-14.
[9] 梁君荣, 王军, 苏永全, 等. 四种重金属离子对中国鲎胚胎发育的影响[J]. 生态学报, 2001, 21(6): 1009-1012. Liang J R, Wang J, Su Y Q, et al. Effects of metals on embryodevelopment ofTachypleustridentatus[J]. Acta Ecologic Sinica, 2001, 21(6): 1009-1012.
[10] Bradford M M. A rapid and sensitive for the quantitation of microgram qulities of protein utilozing the principle of protein dye binding[J]. Anal Biochem, 1976, 72(2): 248-254, 2145-2147.
[11] 高英杰, 郝林琳.高级生物化学实验技术[M]. 北京: 科学出版社,2011: 1-231. Gao Y J, Hao L L. Experimental Technology of Advanced Biochemistry[M]. Beijing: Science Press, 2011: 1-231.
[12] 王长康, 黄一帆, 黄小红, 等. 番鸭(Cairinamoschata)睾丸N-乙酰-β-D-氨基葡萄糖苷酶的提取及性质研究[J]. 畜牧兽医学报, 2007, 38(6): 552-557. Wang C K, Huang Y F, Huang X H, et al. Priliminary purification and properties of theβ-N-acetyl-D-glucosaminidase fromCairinamoschata[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(6): 552-557.
[13] Miller D J, Gong X H, Shur B D. Sperm requireβ-N-acetylglucosaminidase to penetrate through the egg zona pellucida[J]. Development, 1993, 118: 1279-1289.
[14] 黄小红, 罗忠宝, 李明伟, 等. 猪精液碱性N-乙酰-β-D-氨基葡萄糖苷酶的纯化与酶学性质研究[J]. 中国农业科学, 2008, 41(9): 2843-2849. Huang X H, Luo Z B, Li M W, et al. Study on purification and properties of the alkaline N-acetyl-β-D-glucosaminidase from porcine semen[J]. Scientia Agricultura Sinica, 2008, 41(9): 2843-2849.
[15] 林建城, 林大河, 林秀春. 中国明对虾体壁N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及酶学性质[J]. 海洋科学, 2014, 38(8): 52-58. Lin J C, Lin D H, Lin X C. Isolation, purification and characterization ofβ-N-acetyl-D-glucosa-minidase from the integument ofFenneropenaeuschinensis[J]. Marine Sciences, 2014, 38(8): 52-58.
[16] 黄小红, 陈宏惠, 黄一帆. 中华绒螯蟹(Eriocheirsinensis)N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及性质的初步研究[J]. 水生生物学报, 2007, 31(4): 563-569. Huang X H, Chen H H and Huang Y F. Preliminary studies on isolation, purification and some properties of theβ-N-acetyl-D-glucosaminidase fromEriocheirsinensis[J]. Acta Hydrobiologica Sinica, 2007,31(4): 563-569.
[17] Zhang W N, Bai D P, Huang Y F, et al. Enzymatic characterizations and activity regulations of N-acetyl-β-D-glucosaminidase from the spermary of Nile tilapia(Oreochromisniloticus)[J]. J Biosci Bioeng, 2014, 117(2): 153-157.
[18] Zhang J P, Chen Q X, Wang Q, et al. Purification and some properties ofβ-N-acetyl-D-glucosaminidase from viscera of green crab(Scyllaserrata)[J]. Biochem(Moscow), 2006, 71: 55-59.
[19] 黄小红, 陈宏惠, 刘建昌, 等. 几种重金属离子对中华绒螯蟹N-乙酰-β-D-氨基葡萄糖苷酶活力的影响[J]. 水生生物学报, 2008, 32(6): 850-855. Huang X H, Chen H H, Liu J C, et al. Effects of some heavy metal on the N-acetyl-β-D-glucosaminidase fromEriocheirsinensis[J]. Acta Hydrobiologica Sinica, 2008, 32(6): 850-855.
Study on Purification and Enzymatic Characteristics ofβ-N-acetyl-D-glucosaminidase
Abstract: Chitinase was composed of endochitinase, exochitinase, and β-N-acetyl-D-glucosaminidase(EC3.2.1.52, NAGase). Chitin was cleavaged into monomer and oligomers of β-N-acetylglucosamine by NAGase, thenNAGase hydrolyzed chitobiose into monomer. NAGase had many functions in arthropod. NAGase not only degraded chitin in food, but also played important roles in the molting and hatching processes. Horseshoe Crab (Tachypleustridentatus) was an important marine species. Tachypleustridentatus needed no more than six times molting during embryonic development and thirteen to fourteen times molting in its life cycle. Therefore, the appropriate level of NAGase activity was a benefit to the molting cycle, especially during embryonic development. Marine environmental factors, such as temperature, pH, metal ions and others pollutants might influence the NAGase activity, which would regulate the animal's molting. Now, the purpose of this study was to discuss the purification of NAGase from the viscera of Tachypleustridentatus and its enzymatic characteristics. The NAGase was purified from the viscera of Tachypleustridentatus by 30% and 80% ammonium sulfate fractionation and chromatography on Sephadex G-200 and DEAE-cellulose(DE-32). The purified enzyme preparation was homogeneous as judged by polyacrylamide gel electrophoresis(PAGE)and SDS-PAGE. The specific activity of purified enzyme was 505.21 U/mg. The molecular weight of enzyme protein subunit was determined to be 121.5 kDa. The pI value was calculated to be 6.01 by isoelectric focusing. The optimal pH value was 5.4 and the optimal temperature was 55 ℃. The NAGase was stable at a temperature range from 20 ℃ to 50 ℃ and in the pH range of 4.5 to 7.5. The activity of NAGase also had 21.3% at temperature 60 ℃ for one hour treatment. The result suggested that the thermal stability of NAGase in Tachypleustridentatus was better than other species. In addition, the activity of NAGase was 19.1% at pH 10.0 for one hour treatment. The result suggested that NAGase was not stable at alkaline environment. The enzyme followed typical Michaelis-Menten kinetics for the hydrolysis of ρ-nitrophenyl-N-acetyl-β-D-glucosaminide(pNP-β-D-GlcNAc). TheKmandVmaxvalues were determined to be 0.421 mmol/L and 13.158 μmol/L·min-1, respectively. The peak wavelength of UV absorption of the NAGase was 276 nm. When the excitation wavelength was 232.2 nm, the peak wavelength of fluorescence emission spectra of the NAGase was 330.9 nm. The effect of metal ions on the NAGase was studied. Metal ions Na+, K+and Li+had no effect on the enzyme activity. Ca2+and Ba2+activated the enzyme slightly. 5 mmol/L Co2+led enzyme activity to increase by 41.67%. Mg2+、Cu2+、Zn2+、Mn2+、Fe3+、Al3+、Pb2+、Ag+、Cd2+and Hg2+showed various degrees of inhibitory effects on the enzyme. 5 mmol/L of Cd2+inhibited the activity of enzyme by 85.60% when 0.1 mmol/L of Hg2+inhibited the activity of enzyme by 90.10%. EDTA had no effect on the enzyme activity indicating the NAGase was nonmetallic enzyme.
Key words:Tachypleustridentatus;β-N-acetyl-D-glucosaminidase; purification; enzymatic characteristics
责任编辑 高 蓓
from the Viscera of Horseshoe Crab(Tachypleustridentatus)
LIN Jian-Cheng, XU Heng-Qi, LUO Xin-Ming
(College of Environmental and Biological Engineering, Fujian Provincial Key Laboratory of Ecology-toxicological Effects & Control for Emerging Contaminants, Putian University, Putian 351100, China)
福建省科技引导性项目(2015N0013);福建省新型污染物生态毒理效应与控制重点实验室开放课题项目(PY16009)资助 Supported by the Science and Technology Pilot Project of Fujian Province(2015N0013);the Open Project from Fujian Provincial Key Laboratory of Ecology-toxicological Effects&Control for Emerging Contaminants(PY16009)
2016-08-29;
2016-09-23
林建城(1966-),男,教授,从事海洋生物酶学的研究工作。E-mail: ptljc660402@sina.com
Q556.2
A
1672-5174(2017)09-062-08
10.16441/j.cnki.hdxb. 20160301
林建城, 许恒棋, 罗新明. 中国鲎内脏N-乙酰-β-D-氨基葡萄糖苷酶的分离纯化及其酶学性质[J]. 中国海洋大学学报(自然科学版), 2017, 47(9): 62-69.
LIN Jian-Cheng, XU Heng-Qi, LUO Xin-Ming. Study on purification and enzymatic characteristics ofβ-N-acetyl-D-glucosaminidase from the viscera of horseshoe crab(Tachypleustridentatus) [J]. Periodical of Ocean University of China, 2017, 47(9): 62-69.

