术前C反应蛋白与胃癌长期预后的Meta分析
田琦 刘海燕
(郑州大学第一附属医院 急救中心急诊外科 河南 郑州 450052)
术前C反应蛋白与胃癌长期预后的Meta分析
田琦 刘海燕
(郑州大学第一附属医院 急救中心急诊外科 河南 郑州 450052)
目的 采用Meta分析系统评价术前C反应蛋白(CRP)与胃癌长期预后的关系。方法 计算机检索PubMed、Cochrane Library、中国期刊全文数据库、中国生物医学文献数据库、中文科技期刊全文数据库、万方数据库,收集国内外公开发表的关于术前CRP与胃癌长期预后的相关文献。采用Stata 12.0软件进行统计学分析,计算合并风险比(HR)及95%可信区间(CI)。结果 本Meta分析共纳入了11篇文献,共14组有效数据。合并的术前高水平CRP组与正常水平CRP组之间差异有统计学意义(HR=1.91,95%CI:1.69~2.15,P<0.01)。针对不同观察类型进行亚组分型后,两组在DFS(HR=1.97,95%CI:1.55~2.49,P<0.01)及OS(HR=1.89,95%CI:1.64~2.17,P<0.01)水平上差异均有统计学意义。进一步根据样本例数、随访时间及界值水平进行亚组分析,结果均提示高水平CRP组与正常水平CRP组之间差异有统计学意义。结论 手术前高水平的C反应蛋白与胃癌较差的长期预后密切相关。
胃癌;C反应蛋白;预后;Meta分析
胃癌已成为全球第5大常见恶性肿瘤,且排在恶性肿瘤死因的第3位[1]。在过去的几十年中,尽管手术技术的提高及放化疗方式的转变使其死亡率较前有所下降,但胃癌患者的预后仍不能令人满意[2]。目前,TNM分期是评估患者预后的最主要指标,但由于个体差异而降低了其预测的准确性,众所周知,相同的TNM分期,不同患者往往预后有所差异,这就急需一项有效的生物指标协助评估预后[3]。
C反应蛋白(CRP)是一种急性蛋白,受到促炎性细胞因子如白细胞介素-1(IL-1),白细胞介素-6(IL-6),肿瘤坏死因子-α(TNF-α)等的刺激后由肝细胞合成,是一种广泛用于诊断全身的急性和慢性炎症的非特异性生物学标志物[4]。目前手术仍为胃癌患者的首选治疗方式,术前CRP水平较术后更能体现患者胃癌的病理状态及生物特征,更好地对胃癌的预后进行评估。有研究表明,高水平的CRP与结肠癌[5]、肺癌[6]等恶性肿瘤有关,Yu[3],Tang[7]等亦得出了CRP为胃恶性肿瘤较差预后的血液学指标。但各项研究间存在一定的差异,且研究样本量较少,不能有效地对临床工作进行指导。本研究旨在收集有关CRP与预后的文献进行Meta分析,以明确其与胃癌长期生存的关系。
1 资料和方法
1.1 文献检索 计算机检索PubMed、Cochrane Library、中国期刊全文数据库 (CNKI)、中国生物医学文献数据库(CBM)、中文科技期刊全文数据库(VIP)、万方数据库,检索时限均为从建库至2016年10月,语种限制为中文或英文,中文检索词为“胃癌”“胃肿瘤”“C反应蛋白”“CRP”“预后”“生存率”“复发”和“死亡率”;英文检索词为“stomach carcinoma OR gastric carcinoma OR stomach cancer OR gastric cancer OR neoplasms”“C-reactive protein OR CRP”和“prognosis OR survival OR recurrence OR mortality”。同时,追溯纳入文献的参考文献,避免漏查尚未公开发表的文献。
1.2 文献纳入与排除标准
1.2.1 纳入标准 ①研究对象:国内外公开发表的有关CRP与胃癌长期生存的研究;②文献提供了风险比(hazard ratio,HR)及95%可信区间(confidence interval,CI),或有原始数据可计算HR及95%CI;③对于重复发表或资料相似的研究,仅纳入可获得有效数据的高质量研究。
1.2.2 排除标准 ①综述、述评和病例报道类文献,以及未报告CRP与胃癌长期生存的文献;②未手术或者提供的为术后CRP的文献;③数据不完整或无法获取有效数据的文献及会议摘要;④重复发表的文献;⑤原始文献的研究对象不是人类;⑥除中文和英文以外的其他语种文献。
1.3 文献筛选及资料提取
1.3.1 文献筛选 通过阅读文献题目和摘要进行初筛,通过阅读全文进行二次筛选,最终根据纳入标准和排除标准决定文献是否被纳入。以上筛选由2名研究者独立完成,若有分歧经讨论决定或寻求第3位研究者解决。
1.3.2 资料提取 从纳入的文献中提取的信息:作者、发表年限、研究地点、样本量、平均年龄、平均随访时间、结局指标、HR及95%CI、TNM分期和界值信息。
1.4 纳入文献的质量评价 根据纽卡斯尔-渥太华质量评价量表(Newcastle-Ottawa Quality Assessment Scale)对纳入文献的质量进行评价。NOS满分为9分,评分≥6分认为是高质量研究,可纳入该Meta分析。
1.5 统计学方法 该Meta分析应用Stata 12.0软件进行分析,首先应用χ2检验分析研究之间的异质性,检验标准为0.1,即P≤0.1时,各研究结果之间存在异质性,采用随机效应模型进行合并效应量;反之,采用固定效应模型进行分析。采用逐一排除各研究的方法进行敏感性分析,如合并HR值没有明显改变,说明结果稳定性好。采用Begg法对发表偏倚进行定量分析。以上结果以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 初步检出相关文献301篇,剔除重复文献73篇。按照纳入和排除标准逐层筛选,最后纳入11篇研究(英文文献10篇,中文文献1篇),共包括患者2 736例(图1)。
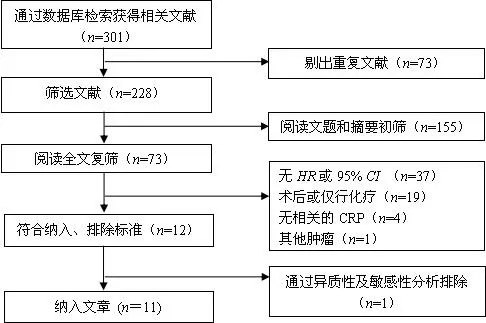
图1 文献筛选流程
2.2 纳入研究的基本特征及质量评价 纳入文献的基本特征及质量评价见表1。纳入的11篇文献的研究对象均为亚洲人群,均为高质量研究,总共获得14组数据,其中有11组数据观察类型为OS,有3组数据观察类型为DFS。
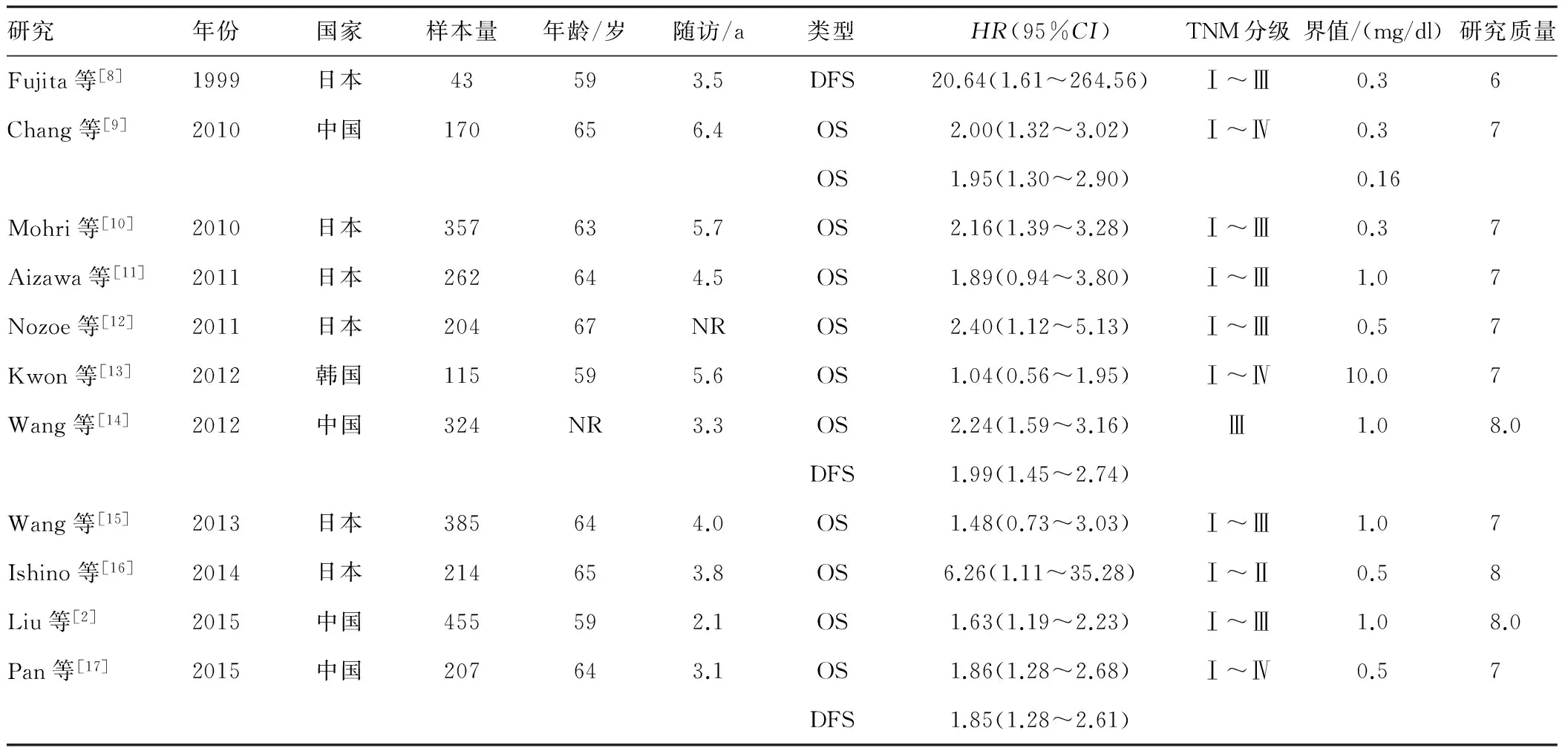
表1 纳入文献的基本特征
注:OS,总生存期;DFS,无病生存期;NR,无相关数据。
2.3 Meta分析结果
2.3.1 总效应的合并 纳入的14组数据中,各组数据之间差异无统计学意义(P=0.53,I2=0%),因此采用固定效应模型进行Meta分析。结果显示,高水平CRP组与低水平CRP组之间差异有统计学意义(HR=1.91,95%CI:1.69~2.15,P<0.01)。针对不同观察类型进行亚组分型后,两组在DFS(HR=1.97,95%CI:1.55~2.49,P<0.01)及OS(HR=1.89,95%CI:1.64~2.17,P<0.01)水平上差异均有统计学意义。见图2。
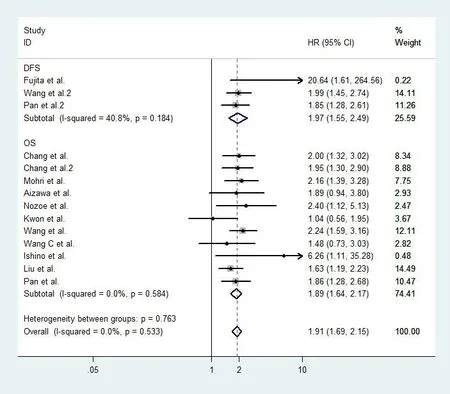
图2 高水平CRP与胃癌预后的Meta分析森林图
2.3.2 亚组分析 按照病例数、随访时间、CRP界值水平进行亚组分型,发现在不同亚组分型上,高水平CRP组与低水平CRP组之间差异有统计学意义(P<0.01)。见表2。

表2 对各因素进行亚组分析
2.4 发表偏倚 利用统计分析软件Stata 12.0对纳入文献进行发表偏倚的评估,采用Begg秩相关法绘制漏斗图,结果如图3所示,显示纳入研究分布较为对称,考虑存在发表偏倚的可能性较小。
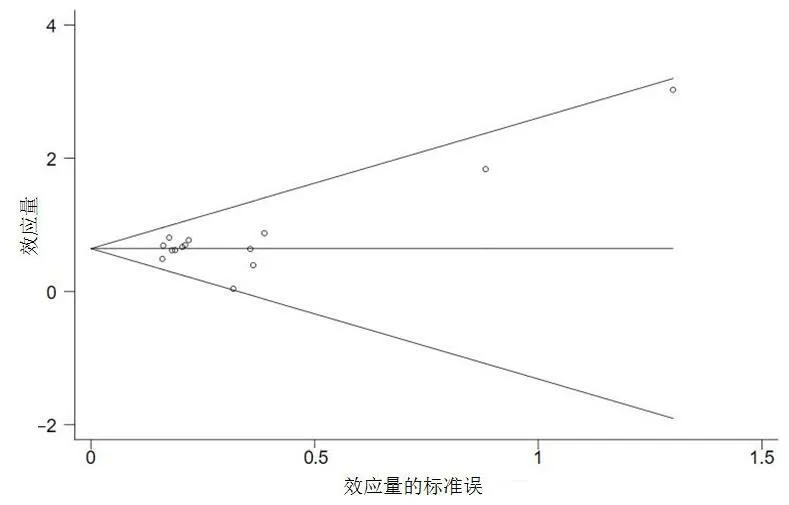
图3 Begg漏斗图
3 讨论
对于较早期胃癌患者,手术仍为首选治疗方式,在给予手术干预前进行CRP水平检测,能够反应CRP在预测长期预后中的真实价值,更重要的是,可以帮助临床医师选择最佳的手术方式及制定良好的术后康复方案。对胃癌患者,合适的选择能够获得长期受益,并提高生活质量[3]。
在胃癌患者中,CRP作为评估预后的生物标志物,其潜在的分子机制尚不明确[3]。有研究表明,系统性炎症反应与大多数进展期实体瘤(如胃癌等)有关[18],因此全面评估胃癌患者的炎症反应程度,可以明确患者肿瘤的浸润情况及临床预后。胃癌肿瘤细胞能够产生促炎性细胞因子如IL-1,IL-6,TNF-α等,在促炎性细胞因子的刺激下,血浆急性时相反应蛋白(APRP)如C-反应球蛋白(CRP)、α1-抗胰蛋白酶(α1-AT)、纤维蛋白原(FIB)浓度发生显著变化。然而促炎性细胞因子在外周血中检测较为困难,且有些仅释放于肿瘤细胞周围,间接引起机体的全身免疫反应[19],因此,APRP如CRP成为预测胃癌患者预后的良好指标。CRP是一种非特异性的,敏感的反应全身炎症的生物标志物,进展期胃癌往往与慢性炎症反应密切相关,因此高水平的CRP在进展期胃癌中非常常见[20]。Yamamoto等[1]认为在胃癌患者中,CRP水平可以了解肿瘤的浸润深度及淋巴结转移情况,升高的CRP预示着肿瘤具有较差的病理分期,提示患者的长期预后不佳。
针对CRP对胃癌患者预后评估的价值,各个研究结果并不完全一致,Baba等[21]认为CRP为急性时相反应蛋白,可以作为预测Ⅳ期胃癌生存的独立指标,尤其是短期预后,界值设定为1.7 mg/dl时,对胃癌的3个月生存期预测价值较大。Saito[22]及Tang[7]等的研究表明,CRP作为胃癌预后指标较为可靠,且CRP水平越高,其预后越差。Aizawa和其同事的研究则显示CRP与胃癌的T分期有一定的关系,但与淋巴结浸润及病理分型没有明显的关联,因此运用术前高水平CRP评估预后不能成为可靠的独立因素。
本Meta分析共纳入了11篇文献,共14组有效数据。以总体长期生存为研究对象,合并的术前高水平CRP组与正常水平CRP组之间差异有统计学意义(HR=1.91,95%CI:1.69~2.15,P<0.01)。针对不同观察类型进行亚组分型后,两组在DFS(HR=1.97,95%CI:1.55~2.49,P<0.01)及OS(HR=1.89,95%CI:1.64~2.17,P<0.01)水平上差异均有统计学意义,表明在胃癌患者中,较高水平的CRP提示长期预后较差。进一步根据样本例数、随访时间及界值水平进行亚组分析,结果显示,样本量大于200例(HR=1.93,95%CI:1.69~2.21,P<0.01)及样本量小于200例(HR=1.81,95%CI:1.40~2.35,P<0.01)差异均有统计学意义,但样本量小于200例组I2值为56.4%,其异质性较大,考虑为样本量不足导致结果不稳定。平均随访时间大于5 a(HR=1.86,95%CI:1.49~2.33,P<0.01)及平均随访时间小于5 a(HR=1.91,95%CI:1.65~2.20,P<0.01)差异均有统计学意义,提示随访时间长短不影响CRP对预后的评估。而CRP水平以0.3、0.5、1 mg/dl为界进行的亚组分析均提示差异有统计学意义,0.3、0.5、1 mg/dl均为超出正常范围的CRP,表明CRP水平升高,不论幅度大小均提示长期预后不佳。
Meta分析能客观地评价及定量分析多个研究结果,提高检验效能,但本Meta分析存在一定的局限性:①由于只纳入了中文和英文文献,可能存在一定的发表偏倚;②纳入研究病例大部分为Ⅰ~Ⅲ且能进行手术的较早期胃癌患者,对于不能手术患者未进行评估;③未排除除手术外其他治疗措施对结果的影响;④纳入样本量较小,不能有效代表总体情况;⑤CRP检测方法的准确性、标本来源的不同也会影响研究结果。
综上,术前高水平的CRP与胃癌较差的长期预后密切相关,且超出正常范围的CRP水平,不论幅度大小均提示长期预后不佳。肿瘤的预后是由多种因素共同参与的复杂过程,而仅仅通过CRP单个因素来分析,其结果是不确定的,未来可联合TNM分期等不同指标进行联合检测,从而更加准确地预测患者的长期生存。
[1] Yamamoto M, Kurokawa Y, Miyazaki Y, et al. Usefulness of Preoperative Plasma Fibrinogen Versus Other Prognostic Markers for Predicting Gastric Cancer Recurrence[J]. World J Surg, 2016, 40(8): 1904-1909.
[2] Liu X, Sun X, Liu J, et al. Preoperative C-Reactive protein/albumin ratio predicts prognosis of patients after curative resection for gcastric cancer[J]. Transl Oncol, 2015, 8(4): 339-345.
[3] Yu Q, Yu X F, Zhang S D, et al. Prognostic role of C-reactive protein in gastric cancer: a meta-analysis[J]. Asian Pac J Cancer Prev, 2013, 14(10): 5735-5740.
[4] Chen Z, Sun Y, Wang J, et al. Prognostic and predictive value of serum C-reactive protein levels in patients with metastatic or locally recurrent gastric cancer[J]. Int J Biol Markers, 2016, 31(3): e294-299.
[5] Crozier J E, Mckee R F, Mcardle C S, et al. Preoperative but not postoperative systemic inflammatory response correlates with survival in colorectal cancer[J]. Br J Surg, 2007, 94(8): 1028-1032.
[6] Shao N, Cai Q. High pretreatment serum C-reactive protein level predicts a poor prognosis for combined small-cell lung cancer[J]. Tumour Biol, 2015, 36(11): 8465-8470.
[7] Tang Z, Sheng H, Zheng X, et al. Upregulation of circulating cytokeratin 20, urokinase plasminogen activator and C-reactive protein is associated with poor prognosis in gastric cancer[J]. Mol Clin Oncol, 2015, 3(6): 1213-1220.
[8] Fujita T, Hara A, Yamazaki Y. The value of acute-phase protein measurements after curative gastric cancer surgery[J]. Arch Surg, 1999, 134(1): 73-75.
[9] Chang C C, Sun C F, Pai H J, et al. Preoperative serum C-reactive protein and gastric cancer; clinical-pathological correlation and prognostic significance[J]. Chang Gung Med J, 2010, 33(3): 301-312.
[10] Mohri Y, Tanaka K, Ohi M, et al. Prognostic significance of host- and tumor-related factors in patients with gastric cancer[J]. World J Surg, 2010, 34(2): 285-290.
[11] Aizawa M, Gotohda N, Takahashi S, et al. Predictive value of baseline neutrophil/lymphocyte ratio for T4 disease in wall-penetrating gastric cancer[J]. World J Surg, 2011, 35(12): 2717-2722.
[12] Nozoe T, Iguchi T, Adachi E, et al. Preoperative elevation of serum C-reactive protein as an independent prognostic indicator for gastric cancer[J]. Surg Today, 2011, 41(4): 510-513.
[13] Kwon H C, Kim S H, Oh S Y, et al. Clinicopathologic significance of expression of nuclear factor-kappa B RelA and its target gene products in gastric cancer patients[J]. World J Gastroenterol, 2012, 18(34): 4744-4750.
[14] Wang D S, Ren C, Qiu M Z, et al. Comparison of the prognostic value of various preoperative inflammation-based factors in patients with stage Ⅲ gastric cancer[J]. Tumour Biol, 2012, 33(3): 749-756.
[15] 王超. 格拉斯哥预后评分对接受根治性手术的进展期胃癌患者术后预后的预测意义[D]. 南京: 东南大学, 2013.
[16] Ishino Y, Saigusa S, Ohi M, et al. Preoperative C-reactive protein and operative blood loss predict poor prognosis in patients with gastric cancer after laparoscopy-assisted gastrectomy[J]. Asian J Endosc Surg, 2014, 7(4): 287-294.
[17] Pan Q X, Su Z J, Zhang J H, et al. A comparison of the prognostic value of preoperative inflammation-based scores and TNM stage in patients with gastric cancer[J]. Onco Targets Ther, 2015, 8: 1375-1385.
[18]Falconer J S, Fearon K C, Plester C E, et al. Cytokines, the acute-phase response, and resting energy expenditure in cachectic patients with pancreatic cancer[J]. Ann Surg, 1994, 219(4): 325-331.
[19]Deans D A, Wigmore S J, Gilmour H, et al. Elevated tumour interleukin-1 beta is associated with systemic inflammation: A marker of reduced survival in gastro-oesophageal cancer[J]. Br J Cancer, 2006, 95(11): 1568-1575.
[20]Yamashita H, Katai H. Systemic inflammatory response in gastric cancer[J]. World J Surg, 2010, 34(10): 2399-2400.[21]Baba H, Kuwabara K, Ishiguro T, et al. C-reactive protein as a significant prognostic factor for stage Ⅳ gastric cancer patients[J]. Anticancer Res, 2013, 33(12): 5591-5595.
[22]Saito T, Kurokawa Y, Miyazaki Y, et al. Which is a more reliable indicator of survival after gastric cancer surgery: Postoperative complication occurrence or C-reactive protein elevation [J]. J Surg Oncol, 2015, 112(8): 894-899.
The relationship between preoperative C-reactive protein level and gastric cancer survival:a meta-analysis
Tian Qi, Liu Haiyan
(DepartmentofEmergencySurgery,EmergencyCareCenter,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China)
Objective To evaluate the relationship between preoperative C-reactive protein level and gastric cancer survival using meta analysis.Methods The relevant published studies were retrieved from PubMed, Cochrane Library, China National Knowledge Infrastructure, Chinese Biomedical Literature Database, Chinese Science and Technology Periodicals Data, Wan Fang databases with computer.The statistical analysis was conducted by the Stata 12.0 software. hazard ratio(HR) and 95% confidence interval(CI) for preoperative C-reactive protein level and gastric cancer survival were calculated.Results This meta-analysis included 11 studies and 14 valid data. The pooledHRs of elevated preoperative CRP for patients were 1.91(95%CI: 1.69~2.15)for all types,1.97(95%CI: 1.55~2.49) for DFS, and 1.89 (95%CI: 1.64~2.17) for OS. Subgroup analysis showed consistent results when we divided the included studies by “number of patients”, “follow-up” and “cut off value”.Conclusion The increased preoperative serum CRP level is significantly associated with poor prognosis in gastric cancer patients.
stomach neoplasms;C-reactive protein;prognosis;Meta-analysis
R 735.2
10.3969/j.issn.1004-437X.2017.08.005
2016-12-26)

