湘西龙山百合对小鼠B-16黑色素瘤细胞黑色素含量、酪氨酸酶活性的影响
刘朝圣,龚 坚,申梦洁
(1.湖南中医药大学第一附属医院皮肤科,湖南 长沙 410007;2.重庆市中医院皮肤科,重庆 400011;3.湖南中医药大学,湖南 长沙 410208)
湘西龙山百合对小鼠B-16黑色素瘤细胞黑色素含量、酪氨酸酶活性的影响
刘朝圣1,2,龚 坚3,申梦洁3
(1.湖南中医药大学第一附属医院皮肤科,湖南 长沙 410007;2.重庆市中医院皮肤科,重庆 400011;3.湖南中医药大学,湖南 长沙 410208)
目的观察不同浓度湘西龙山百合提取液对小鼠B-16细胞细胞活力、黑色素含量、酪氨酸酶活性的影响。方法选用同一传代小鼠B-16黑色素瘤细胞并分组,分别加入不同浓度百合提取液、维生素C二种溶液作用3 d后,用MTT法测定B-16细胞活力;用Maeda等的方法测定B-16细胞酪氨酸酶活性;用Victoria等的方法测定B-16细胞黑色素含量。结果湘西龙山百合提取液对小鼠B-16细胞的酪氨酸酶活性、黑色素合成的抑制作用明显强于维生素C,组间差异有统计学意义(P<0.05),且其抑制作用随浓度的增加而增加;同时湘西龙山百合提取液其细胞毒性作用同样强于维生素C,组间差异有统计学意义(P<0.05)。结论百合提取液对B-16细胞的生长、酪氨酸酶活性和黑色素合成的抑制作用强于维生素C,其抑制作用与浓度呈正相关。
湘西龙山百合;维生素C;B-16细胞;黑色素;酪氨酸酶
随着人们生活水平和审美标准的提高,越来越多的人追求皮肤的白皙与润泽。近年来,美白化妆品顺应“回归自然”的潮流,纷纷选用自然界绿色、无毒、有效的物质为原料,以满足消费者的需求。
祖国传统医学认为百合味甘微苦,性微寒,入肺、胃、心经,具有养阴润肺、清心安神的功效[1];现代分析表明,百合主要含皂苷类、多糖类、磷脂类、生物碱类等活性成分,还含有淀粉、蛋白质、氨基酸、各种维生素和微量元素等营养物质[2],有较高的临床应用价值。从外观而言,新鲜百合本身色白晶莹,按照中医皮肤“以色治色”理论,其在美白领域应有较大应用前景。湖南湘西龙山百合是全国知名的道地药材,在前期临床观察基础上,本研究探讨湘西龙山百合对小鼠B-16黑色素瘤细胞株酪氨酸酶活性和黑色素含量的影响,为百合在美白领域应用提供实验依据。
1 材料与仪器
1.1 受试物
百合原材料为湖南新世纪集团提供的卷丹百合Lilium lancifolium(龙山百合)的干燥肉质鳞叶;维生素C(Vit C,规格 2 mL:0.1 g):石药集团维生药业有限公司,批号H13022052。
1.2 试剂
2,6-二氯酚靛酚(2,6-D),北京索莱宝生物科技有限公司产品,批号:D8410;小牛血清,美国Hy-Clone公司产品,批号:NWK0489;DMEM高糖培养基,美国HyClone公司产品,批号:NAC1362;左旋多巴(L-dopa),南京奥多福尼生物科技有限公司产品,批号:A0169;噻唑蓝(MTT),中国Solarbio公司产品,批号:M8180;二甲基亚砜(DMSO),中国 Solarbio 公司产品,批号:M0231;2.5 g/L胰酶,北京索莱宝生物科技有限公司产品,批号:T1300;pH 6.8磷酸缓冲液(PBS),北京中彬金桥公司产品,批号:ZLI-9062;Triton X-100,北京索莱宝生物科技有限公司产品,T8200;无水乙醇、2-丙二醇,均为国药集团产品。
1.3 仪器
DNP-9162 CO2孵箱,上海精宏实验设备有限公司生产;752-P酶联免疫检测仪,上海现科仪器有限公司生产;TG-16M低温冷冻离心机,上海卢湘仪离心机仪器有限公司生产。
2 方法
2.1 细胞培养
小鼠B-16黑色素瘤细胞购自湖南省湘雅医学院细胞库。待细胞生长至融合状态,经0.25%胰蛋白酶消化,用含有10%小牛血清的DMEM高糖培养液传代,置于CO2培养箱37℃,5%CO2饱和湿度环境中进行培养。每一次实验取自同一传代细胞,初始接种细胞浓度为5 000个/cm2左右。
2.2 药品制备
2.2.1 百合提取物的配制 参照张秀芳、贺文英等报道的方法[3]提取百合提取液:将龙山百合粉碎,用无水乙醇浸泡、振荡或搅拌,浸泡24 h以上,24 h后滤过,收集浸取液;剩余的药渣再加无水乙醇溶液浸取24 h以上。将两次浸取液的滤液,回收乙醇,最后得到百合提取物(浓度为45.5 g/mL)。
2.2.2 百合提取物中Vit C含量的测定 采用2,6-D滴定法进行测定[4]。将一定量的百合提取液溶于草酸中,用相应浓度的2,6-D溶液去缓慢滴定混合液,当混合液开始出现淡红色时,停止滴定,从2,6-D消耗量计算出被检样品中Vit C的量。
2.2.3 不同浓度百合提取液及Vit C溶液的配制(1)配制溶媒:先配制PEH溶液(按双蒸水∶无水乙醇∶2-丙二醇=2∶3∶5 的比例配制), 后用 0.01 mol/L的PBS液将PEH溶液释成100 mL/L溶液作为溶媒;(2)用溶媒将百合提取物和Vit C配成10 g/L的浓度,再把10 g/L维生素C溶液稀释成0.01、0.02、0.04、0.08 g/L 的浓度备用[5];根据所测定的百合提取液中Vit C含量按比例稀释成4组浓度的百合溶液,使其中所含Vit C的量分别与4组浓度的Vit C溶液接近。
2.3 MTT法测定B-16黑色素瘤细胞活力抑制率
取第3代小鼠B-16黑色素瘤细胞以6×104个/mL的密度接种于96孔板中,每孔100 μL。37℃CO2孵箱中培养1 d后,吸弃上清液,实验组(百合组、Vit C组)每孔加入DMEM高糖培养液180 μL及百合溶液或Vit C溶液20 μL,每一浓度4个孔;空白对照组每孔加入180 μL DMEM高糖培养液和20 μL溶媒溶液;空白孔不接种细胞。37℃ CO2孵箱中孵育3 d。药物作用3 d后,每孔加入0.5%MTT 20 μL,继续孵育 4 h,弃去上清液,每孔加入180 μL DMSO,振荡 10 min,选择 490 nm 波长以空白孔调零,在酶联免疫检测仪上测各孔吸光度值。每一实验重复4次,细胞活力抑制率=(1-实验组各浓度平均吸光度值÷空白对照组各浓度平均吸光度值)×100﹪。
2.4 酪氨酸酶活性抑制率的测定
以L-Dopa为底物,参考Maeda等[6]的方法测定细胞酪氨酸酶活性抑制率。各组及加药情况同上,药物作用3 d后,弃去上清液,0.01 mol/L的PBS洗2次,每孔加90 μL 10 mL/L的 Triton X-100,震荡5 min以溶解细胞,每孔加10 μL 10 g/L的L-Dopa,37℃孵育30 min,于490 nm波长处,以空白孔调零,测各孔吸光度值。每一实验重复4次,酪氨酸酶活性抑制率=(1-实验组各浓度平均吸光度值÷对照组各浓度平均吸光度值)×100﹪。
2.5 黑色素合成抑制率的测定[7]
将培养的第3代黑色素细胞以1×104个/cm2密度接种于5个6孔板,24 h后换液,实验组(百合组、维生素C组)每孔加入4.5 mL DMEM高糖培养液及0.5 mL百合溶液或Vit C溶液,空白对照组每孔加入4.5 mL DMEM高糖培养液和0.5 mL溶媒溶液;空白孔不接种细胞。每一浓度3个孔。37℃50 mL/L CO2孵箱孵育3 d后,弃去上清液,每孔加入2.5 g/L胰酶1 mL于室温下消化2 min,加入4 mL DMEM高糖培养液中止消化,吹打成单细胞悬液.取0.5 mL作细胞计数,其余细胞悬液1 500 r/min离心10 min,弃上清,加入1 mL 1 mol/L 的NaOH,振荡5 min.选择490 nm 波长在酶联免疫检测仪上测吸光度值。每一实验重复4次,黑色素合成抑制率=[1-(实验孔吸光度值÷实验孔细胞密度)÷(空白组对照孔吸光度值÷空白组对照孔细胞密度)]×l00﹪。
2.6 统计分析
数据采用SPSS 17.0统计软件进行统计分析。符合正态分布时,采用参数检验,方差齐时组内采用单因素方差分析,组间两两比较采用Newmankeuls法检验,方差不齐者用Tambane’s T2检验;不符合正态分布时,采用非参数检验,等级资料多样本比较采用Kruskal-wallis H秩和检验。所有结果以“±s”表示。
3 结果
3.1 不同浓度百合提取液与Vit C对小鼠B-16细胞活力抑制率的影响
表1显示,百合提取液及Vit C对小鼠B-16细胞活性均有抑制作用,其抑制作用均随着浓度的增高而增高;但同一浓度,Vit C组对小鼠B-16细胞活力影响较小,尤其是Vit C浓度为0.01 g/L时,对小鼠B-16细胞活力影响最弱;而浓度为0.08 g/L的百合提取液对小鼠B-16细胞活力抑制作用最强。说明百合提取液对小鼠B-16细胞有较强的细胞毒性作用;百合液组及Vit C组组内各浓度差异具有统计学意义(P<0.01),同浓度百合组与Vit C组两两对比差异有统计学意义(P<0.05)。
表1 不同浓度百合提取液、Vit C对小鼠B-16细胞活力抑制率的影响(±s,%)
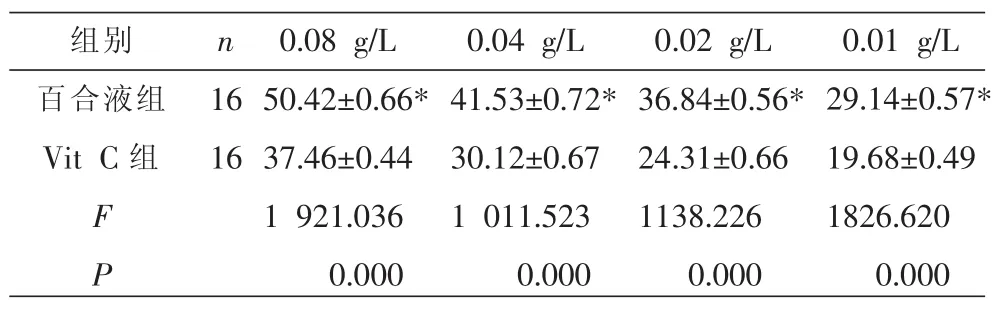
表1 不同浓度百合提取液、Vit C对小鼠B-16细胞活力抑制率的影响(±s,%)
注:与 Vit C组相比 *P<0.05。
组别百合液组Vit C组n 16 16 F P 0.08 g/L 50.42±0.66*37.46±0.44 1 921.036 0.000 0.04 g/L 41.53±0.72*30.12±0.67 1 011.523 0.000 0.02 g/L 36.84±0.56*24.31±0.66 1138.226 0.000 0.01 g/L 29.14±0.57*19.68±0.49 1826.620 0.000
3.2 不同浓度百合提取液与Vit C对小鼠B-16细胞酪氨酸酶抑制率的影响
表2显示,百合提取液及Vit C对小鼠B-16细胞酪氨酸酶活性均有抑制作用,其抑制作用均随着浓度的增高而增高;在同等浓度下,百合提取液对酪氨酸酶抑制作用明显强于Vit C组。百合组及Vit C组组内各浓度差异具有统计学意义 (P=0.000<0.01),两组同浓度组间两两对比P<0.05。
表2 不同浓度百合提取液、Vit C对小鼠B-16细胞酪氨酸酶活性抑制率的影响(±s,%)

表2 不同浓度百合提取液、Vit C对小鼠B-16细胞酪氨酸酶活性抑制率的影响(±s,%)
注:与Vit C组相比*P<0.05。
组别百合液组Vit C组n 16 16 FP 0.08 g/L 56.37±0.67*44.95±0.93 399.215 0.000 0.04 g/L 50.01±0.68*37.55±0.63 720.809 0.000 0.02 g/L 44.84±0.79*30.92±1.07 437.563 0.000 0.01 g/L 39.01±0.94*23.32±0.81 636.972 0.000
3.3 不同浓度百合提取液与Vit C对小鼠B-16细胞黑色素合成抑制率的影响
如表3可知,百合提取液和Vit C液随浓度的增加对细胞黑色素的合成的抑制率增加;百合提取液对细胞黑色素合成的抑制率在各浓度都显著高于Vit C液。百合液组及Vit C组组内各浓度差异具有统计学意义(P<0.01),同浓度百合组及Vit C组组间两两对比差异有统计学意义(P<0.05)。
表3 不同浓度百合提取液、Vit C对小鼠B-16细胞黑色素合成抑制率的影响(±s,%)

表3 不同浓度百合提取液、Vit C对小鼠B-16细胞黑色素合成抑制率的影响(±s,%)
注:与Vit C组相比*P<0.05。
组别百合液组Vit C组n 12 12 FP 0.08 g/L 48.09±1.67*36.07±1.43 58.954 0.000 0.04 g/L 37.84±0.72*26.98±0.33 369.053 0.000 0.02 g/L 33.41±0.33*21.43±0.62 719.843 0.000 0.01 g/L 28.65±1.75*15.61±1.87 51.596 0.000
4 讨论
现代研究表明,阻断或抑制新的黑色素形成,还原或加速已有黑色素分解是美白主要机制。而中医学认为气血阻滞、肝气郁结等原因使黑色素、色斑等形成,可通过服用养血补血、活血行气、舒肝解郁的中草药来减少黑色素的形成[8]。实验研究发现多种中草药提取物中富含美白活性成分,如酚类、黄酮类、多糖类、挥发油、有机酸、三萜皂苷类等,均具有美白作用,并且可以从多种途径抑制黑色素生成及促进黑色素排出,从而达到美白效果。如,甘草的有效成分通过有效清除超氧离子和抑制酪氨酸酶的活性美白[9],白藜芦醇和熊果苷等通过吸收紫外线减少黑色素的合成[10]等。并根据这些美白机制开发出多种中药美白产品。现代药理研究表明百合有抗肿瘤、抗氧化活性、镇静及抗应激损伤等作用[11-13]。
本研究旨在观察百合提取液对黑色素合成的影响。有文献表明Vit C已被证实为酪氨酸酶抑制剂,能从多种途径抑制黑色素的生成[14],故本实验选用Vit C为实验的对照药物。研究结果显示:湘西龙山百合提取液对小鼠B-16细胞酪氨酸酶活性有明显的抑制作用,也能明显减少B-16细胞的黑色素生成,表明龙山百合有较好的美白功用,其基本机制是通过抑制酪氨酸酶活性进而减少黑色素的合成。但是,随着百合提取液浓度的增高,其对小鼠B-16细胞活性的抑制作用也不断增加,即细胞毒性作用增强。因此湘西龙山百合提取液直接作为美白用品是不合适的,湘西龙山百合中的美白物质基础、细胞毒性物质以及其美白的具体机制有待进一步研究。
[1]高学敏.中药学[M].第2版.北京:中国中医药出版社,2007;470-471.
[2] 黄燕萍.百合的研究现状[J].中国药业,2010,19(8):88.
[3]张秀芳,贺文英,常彦景,等.几种中草药美白护肤化妆品的研制[J].内蒙古农牧学院学报,1997(4):60-63.
[4]王丽彬.柑橘中维生素C的测定[J].食品安全导刊,2015(18):106-107.
[5]马晶波,冯树芳,李 锋,等.甘草黄酮对B16黑色素瘤细胞代谢的影响[J].复旦学报(医学版),2003,30(4):353-355.
[6]Maeda K.Fuknda M.Arburin:mechanism of its depigmenting action in Melanocyte culture[J].J pharmaol Exp Ther, 1996,276(2):765-769.
[7]Victoria VM,Kohayasbi N.Matsunage J,et al.A standardized prouocolfor assessing regulators ofpigmentation [J].Anal Buochem, 1999,270(2):207-219.
[8]石 宇,李德如.中药在皮肤美容中的应用研究进展[J].中国美容医学,2008,17(5):766-768.
[9]黄晓凤,顾 华,何 黎,等.植物美白剂的研究进展[J].中华皮肤科杂志,2013,46(9):688-690.
[10]郑洪艳,庞建平,苏 宁,等.天然植物紫外线防护效果研究[J].香料香精化妆品,2013(5):33-35.
[11]朱 泉,韩永斌,顾振新,等.百合多糖研究进展[J].食品工业科技,2012,33(11):370-374.
[12]李利华.百合多糖的含量测定及抗氧化活性研究[J].湖北农业科学,2011,14:2954-2957.
[13]高 昱,易刚强,刘平安,等.湘产百合核心种质库的SRAP体系的建立[J].湖南中医药大学学报,2014,34(12):13-18.
[14]曾伟成,郑能武,陈曾燮.维生素C对酪氨酸酶催化反应的影响[J].中国生化药物杂志,2001(6):300-302.
(本文编辑 杨 瑛)
Effects of Xiangxi Longshan Lily on Melanin Content and Tyrosinase Activity in B-16 Melanoma Tumor Cells of Mouse
LIU Chaosheng1,2,GONG Jian3,SHEN Mengjie3
(1.Department of Dermatology,the First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;2.Department of Dermatology,Chongqing TCM Hospital,Chongqing,400010,China;3.Hunan University of Chinese Mediicne,Changsha,Hunan 410208,China)
ObjectiveTo observe the effects of different concentrations of Xiangxi Longshan lily extract on cell viability,melanin content and tyrosinase activity in mouse B-16 cells.MethodsThe same passage B-16 mouse melanoma cells were selected and divided into different groups,then different concentrations of lilium extract and vitamin C were added after 3 days.The B-16 cell viability was measured by MTT,B-16 tyrosinase activity in cells was measured by using Maeda's method,and the content of B-16 melanoma cells was conducted by Victoria's method.ResultsThe effect of Xiangxi Lon gshan Lilium extract in inhibiting tyrosinase activity and synthesis of melanin was better than Vitamin C,the difference was statistically significant between groups (P<0.05),and the inhibition increased with the concentration.Similarly,the cell toxicity from the Xiangxi Longshan Lilium extract was stronger than Vitamin C,a statistically significant difference between the two groups (P<0.05).ConclusionThe inhibition effect of lily extract on cell viability,tyrosinase activity and concentration of melanin in cells is stronger than vitamin C,and the inhibition effect is positively correlated with the concentration.
lily;Vitamin C;B-16 cells;melanin;tyrosinase
R285.5;R275
A
10.3969/j.issn.1674-070X.2017.02.008
2016-05-17
湖南省教育厅科学研究项目 (13C679);湖南省中医药科研计划重点项目 (201518);重庆市人社局博士后特别资助基金项目(Xm2015087);湖南省“十二五”重点学科开放基金项目(ZXLCXK201508)。
刘朝圣,男,博士,副教授,研究方向:皮肤病中西医结合防治,E-mail:chaoliu2807@sina.com。
本文引用:刘朝圣,龚 坚,申梦洁.湘西龙山百合对小鼠B-16黑色素瘤细胞黑色素含量、酪氨酸酶活性的影响[J].湖南中医药大学学报,2017,37(2):145-148.

