白藜芦醇影响CNE-2细胞生长的端粒酶机制研究
张洁,林培彬,马宇昕
(广东药科大学,广东广州510006)
·实验研究·
白藜芦醇影响CNE-2细胞生长的端粒酶机制研究
张洁,林培彬,马宇昕
(广东药科大学,广东广州510006)
目的观察不同浓度白藜芦醇对鼻咽癌CNE-2细胞生长及对细胞内端粒酶活性的影响。方法不同浓度白藜芦醇处理体外培养鼻咽癌CNE-2细胞48 h后,噻唑蓝(MTT)法检测药物对细胞增殖的抑制作用。流式细胞术检测白藜芦醇对细胞凋亡的影响。TRAP荧光定量PCR检测不同浓度药物处理后,CNE-2细胞内端粒酶活性的改变。结果0.025,0.050,0.100,0.200 mmol/L的白藜芦醇作用48 h后,白藜芦醇呈浓度依赖性抑制CNE-2细胞增殖,抑制率分别为(1.16±2.95)%,(7.51±2.77)%,(20.12±6.01)%,(54.82± 8.66)%;流式细胞仪分析结果表明,CNE-2细胞凋亡率上升,且呈浓度依赖性;药物处理后,细胞内端粒酶活性均降低,其中0.100mmol/L组和0.200mmol/L组活性降低,差异有统计学意义(P<0.05)。结论白藜芦醇呈浓度依赖性抑制鼻咽癌CNE-2细胞生长,促进其凋亡,并可降低细胞内端粒酶活性。
白藜芦醇;鼻咽癌;CNE-2;端粒酶;作用机制
鼻咽癌(NPC)是我国南方最常见的头颈部恶性肿瘤,目前临床治疗首选放射治疗(简称放疗)。端粒酶活性激活是NPC细胞的重要特征之一。Chen等[1]对NPC组织检测后发现,85%初发NPC有端粒酶活性表达,100%复发NPC有端粒酶活性表达。近年的临床研究发现,NPC放化疗中配合中药治疗,在直接杀伤肿瘤细胞、增加放疗敏感性、减轻放疗毒副作用、延长患者生存期方面均有良好效果[2]。白藜芦醇(resvertrol)为广泛存在于虎杖、葡萄等植物中的天然多酚化合物,具有抗菌、抗炎、抗氧化等功效[3-4]。有研究表明,白藜芦醇亦具有抗肿瘤活性[5]。本研究中通过观察白藜芦醇对鼻咽癌细胞株CNE-2细胞内端粒酶活性的影响,旨在探讨其抗肿瘤的机制。现报道如下。
1 材料与方法
1.1 仪器及试药
1640细胞培养基(美国Gibco公司);白藜芦醇(美国Sigma公司),用二甲基亚砜(DMSO)溶解,配成100 mmol/L贮存液,0.22μm一次性无菌滤器过滤灭菌,分装-20℃贮存,使用时稀释,使DMSO终浓度低于0.3%;噻唑蓝(MTT,美国Sigma公司);流式细胞仪(美国BD公司);AnnexinV-FITC/PI凋亡检测试剂盒(四正柏生物公司,批号为FXP018-50);端粒酶活性TRAP定时定量检测试剂盒(上海杰美基因医药科技有限公司,批号为GMS20106.2);荧光定量PCR仪(Bio-Rad公司)。
1.2 细胞
人鼻咽癌细胞株CNE-2由中山大学肿瘤防治中心赠送,用含10%胎牛血清的RPMI-1640培养基,置37℃及5%二氧化碳培养箱培养。细胞每2~3 d传代1次。实验用细胞均处于对数生长期。
1.3 方法
1.3.1 MTT比色法测定细胞增殖抑制率
将CNE-2细胞按每孔5×103个细胞接种于96孔板中,设不同浓度加药试验组、不加药对照组及空白对照组,每组不同浓度药物设5个复孔,37℃及5%二氧化碳培养过夜。改用含不同浓度(0.025,0.050,0.100,0.200mmol/L)的白藜芦醇培养基继续培养48 h。弃去培养液,每孔加入MTT(5mg/m L)20μL继续培养4 h,后弃去培养液,每孔加入100μLDMSO,振荡5min,待完全显色后,用酶标仪测定其吸光度(A)值,测定波长为570 nm。重复3次。按以下公式求出细胞增殖抑制率。
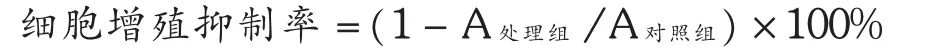
1.3.2 流式细胞检测术检测细胞凋亡率
用6孔板培养细胞,设不加药对照组和不同浓度(0.050,0.100,0.200mmol/L)加药组,贴壁后加药培养48h,收集培养液内及贴壁的细胞至离心管内,1 000 r/min离心5min后,去上清。按试剂盒说明书,用1倍浓度结合缓冲液重悬细胞,调节其浓度为2×106个/mL。取100μL细胞悬液于5m L流式管中,加入5μL Annexin V/FITC混匀后室温避光孵育5min,加入20μg/m L的PI 10μL,并加入400μL磷酸盐缓冲液(PBS),立刻进行流式检测凋亡率。重复试验3次。
1.3.3 TRAP法检测端粒酶活性
此法基于多聚酶联扩增的敏感高效的体外端粒酶活性的检测技术,运用SYBR绿色荧光染料作为标记信号,快速地进行DNA模板的扩增。
细胞样品制备:用6孔板培养细胞,设不加药对照组和不同浓度(0.050,0.100,0.200mmol/L)加药组,贴壁后加药培养48 h,细胞浓度不低于1×105个/m L。留少量培养液,用细胞刮收集细胞至1.5mL离心管,3000 r/min离心5min。弃上清液,根据细胞数加入适量预冷裂解液,冰上孵育30min后4℃15000 r/min离心5min,取上清液。
定量检测:按试剂盒说明书,移取15μL反应液置0.5mL PCR管,加入约含250 ng总蛋白待测的细胞裂解液,加入2.5μL染色液后用补充液定容至25μL,瞬时离心5 s后放入荧光定量PCR仪。30℃作用20min后进入PCR循环,95℃30 s,60℃90 s循环35次,收集数据,分析Ct值。重复操作3次。
1.4 统计学处理
2 结果
2.1 白藜芦醇对CNE-2细胞增殖的影响
MTT检测结果显示,不同浓度(0.025,0.050,0.100,0.200mmol/L)白藜芦醇处理细胞48 h后,细胞增殖被抑制,抑制率分别为(1.16±2.95)%,(7.51± 2.77)%,(20.12±6.01)%,(54.82±8.66)%。详见图1。
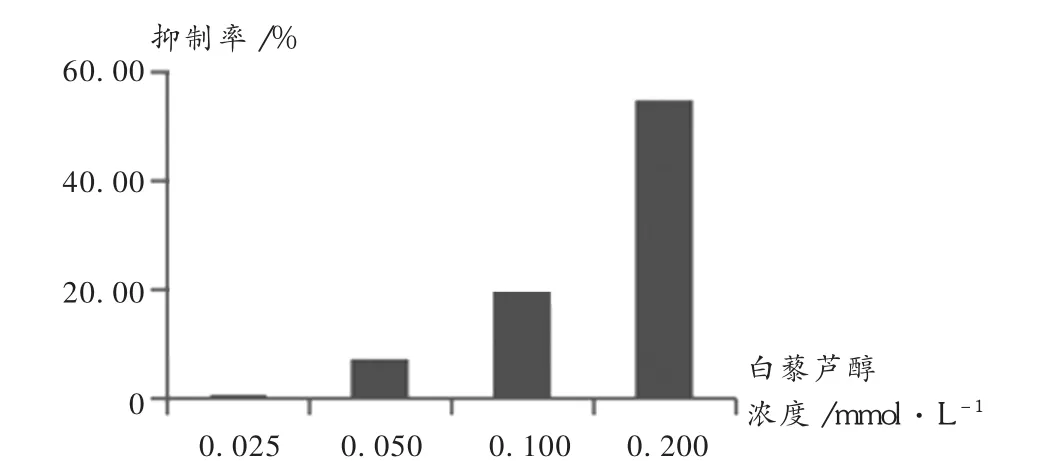
图1 不同浓度白藜芦醇对CNE-2细胞的抑制率曲线(n=3)
2.2 白藜芦醇诱导细胞凋亡作用
流式细胞检测术后发现,不同浓度(0.050,0.100,0.200mmol/L)白藜芦醇作用于细胞48 h后,细胞凋亡率分别为(4.95±1.60)%,(16.11±6.02)%,(39.99± 2.74)%,可见,0.100,0.200mmol/L药物作用组均明显高于不加药对照组的(2.89±0.89)%(P<0.01)。详见图2及图3。
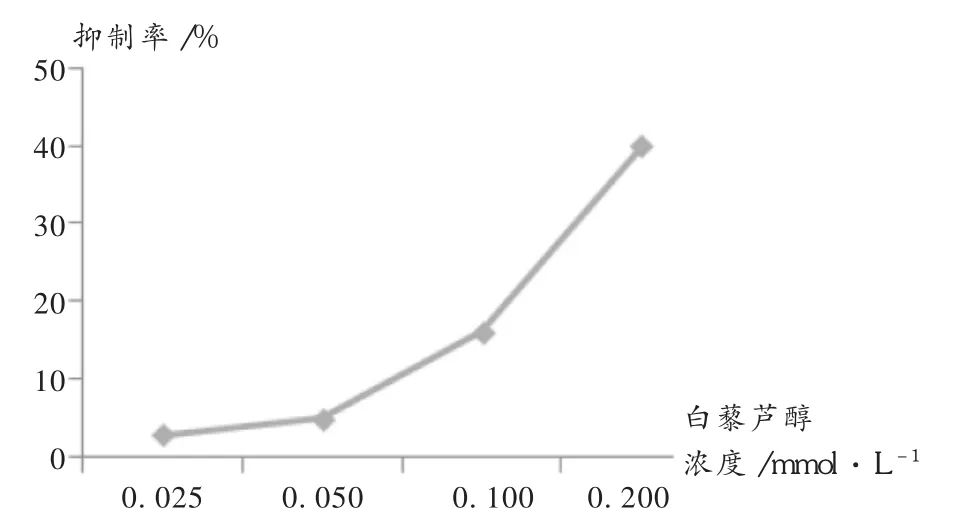
图2 不同浓度白藜芦醇对CNE-2细胞凋亡诱导率曲线(n=3)

注:纵、横坐标分别为采用PI和Annexin V/FITC为染料的荧光强度。图3不同浓度白藜芦醇诱导CNE-2细胞凋亡流式分析图
2.3 端粒酶活性测定结果
根据试剂盒和荧光定量PCR仪数据结果分析,以Ct值反映端粒酶活性高低。Ct值大表明酶活性低,Ct值小表明酶活性高。结果见表1。

表1 白藜芦醇对CNE-2细胞端粒酶活性的影响(n=3)
3 讨论
广东省是NPC高发区,临床治疗以放疗为主,而中草药在NPC治疗中的辅助作用也越来越受到重视。有研究报道,NPC患者在放疗基础上配合中药治疗,可明显提高临床疗效和患者的生存率[6]。白藜芦醇为天然多酚化合物,广泛存在于虎杖等70余种植物中。由于其有抗炎、抗肿瘤、抗氧化、免疫调节及神经保护作用等广泛的生物学效应,临床应用前景非常广阔[7]。白藜芦醇对人神经母细胞瘤SH-SY5Y和小鼠胚胎成纤维细胞有明显增殖抑制作用,并能启动细胞凋亡[8-9]。也有学者报道过白藜芦醇对NPC细胞生长和凋亡的影响,Lee等[10]发现,白藜芦醇能增加Caspase-3表达,通过p53依赖性途径引起凋亡。但对于其他可能引起细胞凋亡的分子机制,现在仍未明确,研究也不多。
端粒酶活性激活是NPC细胞重要特征之一。NPC患者血浆中端粒酶逆转录酶催化亚基(hTERT)表达水平明显升高[11];在NPC细胞中端粒酶活性特异性高表达,且随着肿瘤的发生、发展,端粒酶活性持续升高,使得肿瘤细胞能避开复制衰老而进入“永生化”[12]。文忠等[13]采用TRAP银染等方法对临床不同分期NPC细胞中端粒、端粒酶及其亚单位进行检测,发现临床晚期NPC细胞端粒酶阳性率明显高于临床早期,伴颈部淋巴结转移者端粒酶阳性率高于无颈部淋巴结转移者。姚小宝等[14]、沈永忠等[15]利用siRNA抑制hTERT表达来降低端粒酶活性,结果发现,NPC细胞增殖明显抑制,细胞凋亡数目增加,并能有效控制肿瘤细胞迁移和侵袭。
本研究中将不同浓度(0.025,0.050,0.100,0.200mmol/L)白藜芦醇作用于CNE-2细胞48 h后,通过MTT法检测细胞活力。结果发现,药物对细胞增殖的抑制率随着药物浓度的增高而增加,提示白藜芦醇对细胞增殖有抑制作用,且呈浓度依赖性。用流式细胞仪检测不同浓度(0.050,0.100,0.200mmol/L)药物作用后细胞凋亡情况发现,CNE-2细胞凋亡率随药物浓度升高而上升,特别在药物浓度达到200μmol/L时,细胞晚期凋亡较100μmol/L的给药浓度明显增加,提示药物呈浓度依赖地诱导细胞凋亡,且作用强度在其浓度达到200μmol/L时有明显质的飞跃。TRAP法检测不同浓度药物作用后,CNE-2细胞内端粒酶活性发现,随着药物浓度升高,肿瘤细胞内端粒酶活性依次下降,呈浓度相关性。将用药后细胞凋亡率与端粒酶活性Ct值作相关性分析发现,2个变量Pearson相关系数为0.966(P<0.01),故推测,白藜芦醇有可能通过下调端粒酶活性促进细胞凋亡,抑制细胞生长,可为后续研究提供新的思路。
[1]Chen RY,Yuan PW,Nicholls JM,et al.Telomerase activation in nasophryngealcarcinoma.[J].Br JCancer,1998,77(3):456-460.
[2]梅全喜,孙雪颖,高玉桥,等.中医药防治鼻咽癌的研究进展[J].中国药业,2007,16(4):28-29.
[3]孙颖,黄明亮,王华.白藜芦醇抗氧化性及安全性的研究进展[J].食品工业,2013,34(4):177-180.
[4]李萍,程晓馨.白藜芦醇抗菌抗病毒作用的研究进展[J].中国微生态学杂志,2014,26(10):1215-1219.
[5]杜成,任玉杰,王庆伟,等.白藜芦醇衍生物的合成及抑制宫颈癌HeLa细胞肿瘤活性[J].有机化学,2013,33(6):1279-1283.
[6]都基亮,宋莉,王曦,等.放疗配合中药治疗鼻咽癌的临床观察[J].中外医疗,2010,29(20):75-77.
[7]安梅,周瑾,陈晓宇.白藜芦醇药理学作用的研究进展[J].肿瘤药学,2014,4(4):242-246.
[8]张黎,张洁,李勇,等.白藜芦醇对小鼠胚胎成纤维细胞增殖和细胞周期的影响[J].细胞与分子免疫学杂志,2009,25(12):1109-1111.
[9]张黎,张洁,刘靖.白藜芦醇对神经母细胞瘤SH-SY5Y增殖的影响[J].神经解剖学杂志,2010,26(2):150-154.
[10]Lee YJ,Park IS,Shim JH,et al.Resveratrol contributes to chemosensitivity ofmalignantmesothelioma cells with activation of p53[J].Food Chem Toxicol,2014,63(1):153-160.
[11]付新洒,申聪香,李冠雪,等.鼻咽癌患者外周血端粒酶hTERTmRNA的定量检测及其临床意义[J].南方医科大学学报,2015,35(6):894-897.
[12]Liu JP,Cassar L,Pinto A,et al.Mechanisms of cell immortalization mediated by EB viral activation of telomerase in nasopharyngealcarcinoma[J].CellRes,2006,16(10):809-817.
[13]文忠,肖健云,唐发清,等.鼻咽癌病人端粒酶表达的研究[J].中国耳鼻咽喉颅底外科杂志,1998,4(4):25-28.
[14]姚小宝,王晓侠,张少强,等.干扰hTERT基因慢病毒载体对人鼻咽癌细胞的生长抑制作用[J].临床耳鼻咽喉头颈外科杂志,2011,25(20):939-943.
[15]沈永忠,王燕,陈始明,等.短发夹RNA抑制hTERT基因对鼻咽癌细胞端粒酶活性及PCNA和Caspase-3蛋白表达的影响[J].临床耳鼻咽喉头颈外科杂志,2008,22(9):411-415.
Influence M echanism of Resveratrol A ffecting Telomerase of CNE-2 Cells
Zhang Jie,Lin Peibin,Ma Yuxin
(Guangdong Pharmaceutical University,Guangzhou,Guangdong,China 510006)
Ob jective To observe the effects of Resveratrol(Res)with different concentration on the proliferation,apoptosis and the activity of telomerase of the CNE-2 cells.M ethods After CNE-2 cells were treated with different concentration of Res for 48 h,the inhibition of cell proliferation with MTT assay was detected,and the cell apoptosis by flow cytometry was analyzed.The telomerase activity of CNE-2 cells was observed by TRAP fluorogenic quantitative PCR.Resu lts After CNE-2 cells were treated with different concentration(0.025,0.050,0.100,0.200 mmol/L)of Res for 48 h,Res could inhibit the proliferating of cells as concentration-dependence,and their inhibition ratio were(1.16±2.95)%,(7.51±2.77)%,(20.12±6.01)%,(54.82±8.66)%,respectively.The apoptotic rates were up-regulated which were detected by flow cytometry,and the effects was concentration dependent.The telomerase activity of the cells was reduced after the cells was treated by Res,and the result was statistically significant of the groups of Res with concentration of 0.100 mmol/L and 0.200 mmol/L(P<0.05).Conclusion Res can inhibit the growth of CNE-2 cells,promote cells′apoptosis,and down-regulate the telomerase activity of the cells.
Resvetrol;throat cancer;CNE-2;telomerase;mechanism of action
R284;R285.5
A
1006-4931(2017)10-0011-03
2017-02-10)
10.3969/j.issn.1006-4931.2017.10.003
广东省中医药管理局科研立项项目[20141160]。
张洁(1981-),女,讲师,研究方向为中药抗肿瘤药理学,(电子信箱)yingchichong@163.com。

