三维荧光光谱结合交替三线性分解算法测定徐长卿药材中丹皮酚的含量Δ
白雪梅,刘德龙,魏永巨(河北师范大学化学与材料科学学院,石家庄 050024)
三维荧光光谱结合交替三线性分解算法测定徐长卿药材中丹皮酚的含量Δ
白雪梅*,刘德龙#,魏永巨(河北师范大学化学与材料科学学院,石家庄 050024)
目的:采用三维荧光光谱结合交替三线性分解(ATLD)算法测定徐长卿药材中丹皮酚的含量。方法:构建三线性模型,利用最小二乘原理进行ATLD,采用核一致诊断法对体系的组分数进行拟合,采用数学校正法校正内滤光效应。三维荧光光谱扫描条件:激发波长范围为250~400 nm,发射波长范围为410~600 nm,波长间隔为5 nm,狭缝宽度为5.0/5.0 nm,扫描速度为1 200 nm/m in;测定吸收光谱条件:扫描波长范围为250~600 nm,扫描速度为600 nm/m in;以A l(Ⅲ)作敏化剂增强丹皮酚的荧光强度。以高效液相色谱法(HPLC)测定药材样品中丹皮酚含量作为验证。结果:丹皮酚检测质量浓度线性范围为0.132~1.188μg/m L(r=0.999 9);精密度、稳定性、重复性试验的RSD<3.0%;加样回收率为100.1%~104.7%(RSD=2.39%,n=9);丹皮酚的解析光谱与其真实光谱几乎完全重合。HPLC测定结果与ATLD算法结果十分相近。结论:三维荧光光谱结合ATLD算法简便、快速、高效、准确,可用于复杂体系中特定组分的定性与定量分析。
三维荧光光谱;交替三线性分解算法;徐长卿;丹皮酚;高效液相色谱法
徐长卿Cynanchum paniculatum为中医常用药材[1]。其化学成分复杂,主要有效成分为丹皮酚。丹皮酚能镇静、抗菌、降血压,还可抗动脉粥样硬化、抗心律失常、抗心肌缺血、抗肿瘤、抗抑郁[2-4]。丹皮酚含量是徐长卿药材质量的重要衡量指标,因此测定徐长卿药材中丹皮酚含量具有重要的价值。目前,丹皮酚含量的测定方法主要有气相色谱法[5-6]、近红外光谱法[7]、高效液相色谱法(HPLC)[8-10]、紫外分光光度法[11]等,尚未见利用三维荧光光谱进行测定的报道。为此,本课题组采用三维荧光光谱结合交替三线性分解(ATLD)算法测定了药材样品中丹皮酚的含量,并采用HPLC法进行了验证。
1 材料
1.1 仪器
F-4600型荧光分光光度计(用1 cm石英比色皿扫描激发-发射三维荧光光谱)、U-3010型紫外-可见分光光度计(用1 cm石英比色皿扫描吸收光谱)均购自日本Hitachi公司;1260型HPLC仪(美国Agilent公司);AUY220型电子分析天平(日本Shimadzu公司);868型pH酸度计(美国Orion公司);KQ-100DE型超声波清洗器(昆山市超声仪器有限公司,功率:250W,频率:40 kHz);SYZ-550型石英亚沸高纯水蒸馏器(金坛市丹阳门石英玻璃厂)。
1.2 试剂
丹皮酚对照品(成都指标化纯生物科技有限公司,批号:14016,纯度:>98%);甲醇为色谱纯,其余试剂均为分析纯,水为重蒸水。
1.3 药材
徐长卿药材(购自石家庄乐仁堂大药房)经河北中医学院中药炮制实验室高艳芝主管技师鉴定为真品。
2 方法与结果
2.1 方法原理
2.1.1 三线性模型 在选定的I个激发波长、J个发射波长下对K个样本进行三维荧光光谱扫描,得到一系列的荧光光谱矩阵,并收集在一个大小为I×J×K的三维数据阵X中,xijk表示这个三维数据阵中的元素,用数学式[12-13]表达如下:

其中,ain、bjn、ckn分别是大小为I×N的相对激发光谱矩阵A、大小为J×N的相对发射光谱矩阵B和大小为K× N的相对浓度矩阵C中的元素;eijk是大小为I×J×K的残差阵E中的元素。N代表组分数,即对荧光作出贡献的总组分数,包括感兴趣组分和背景干扰。
2.1.2 ATLD算法 ATLD算法利用最小二乘原理,根据以下迭代公式,并引入Moor-Penrose广义逆计算[14],对矩阵A、B、C进行迭代求解:
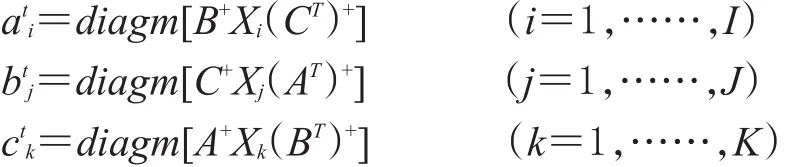
2.1.3 核一致诊断法 在二阶校正法的计算过程中,采用核一致诊断法对体系的组分数进行拟合,使其与实际组分数更接近,使计算更准确。通过计算核一致值来确定体系的组分数,通常情况下,当核一致值≥60%时,认为模型接近三线性;当核一致值<60%时,则认为模型偏离三线性[15]。
2.1.4 内滤光校正 内滤光效应会导致荧光光谱矩阵偏离三线性,当溶液吸光度>0.05时,需要进行校正。主要的校正方法有稀释法和数学校正法[16]。本课题组采用数学校正法,根据I0=I×100.5×b(Aex+Aem)对溶液吸光度进行校正,其中I0是校正后的荧光强度,I是校正前的荧光强度,Aex和Aem分别是激发和发射波长处的吸光度,b是比色皿厚度。
2.2 三维荧光光谱结合ATLD算法测定药材样品中丹皮酚含量
2.2.1 试验条件 进行三维荧光光谱扫描时,设置激发波长范围为250~400 nm,发射波长范围为410~600 nm,波长间隔为5 nm,狭缝宽度为5.0/5.0 nm,扫描速度为1 200 nm/m in;测定吸收光谱时,设置扫描波长范围为250~600 nm,扫描速度为600 nm/m in。
2.2.2 丹皮酚的光谱特点及影响因素 丹皮酚自身几乎没有荧光,用Al(Ⅲ)作敏化剂后其荧光强度明显增加(见图1)。结果表明,当Al(Ⅲ)溶液浓度达到0.02 mol/L以上,溶液pH约为4.40时,丹皮酚的光谱性质较稳定。因此,确定Al(Ⅲ)溶液浓度为0.05mol/L,选择pH 4.46的醋酸-醋酸钠缓冲液。
2.2.3 组分数估计 利用核一致诊断法估计待测体系的组分数N。当N=1和2时,核一致值为100%;当N=3时,核一致值下降到56%。因此,选择体系组分数为2,一个组分对应于丹皮酚,另一个组分对应于药材样品中一个干扰成分。
2.2.4 丹皮酚的解析光谱及定性分析 用ATLD算法解析三维荧光光谱数据阵得药材样品中丹皮酚的相对激发光谱(见图2A)和相对发射光谱(见图2B)。
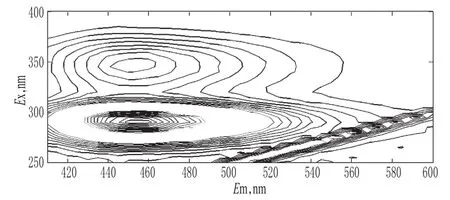
图1 三维荧光光谱(c=0.924μg/m L)Fig 1 Three-dimensional fluorescence spectrum(c=0.924μg/m L)

图2 药材样品中丹皮酚的光谱Fig 2 Spectrum ofpaeonol in samples
结果表明,ATLD算法解析得到的药材样品中丹皮酚的解析光谱与其真实光谱几乎完全重合,说明这种方法用于定性分析是可靠的。同时也可看出,在药材样品中有一种干扰成分的荧光光谱与丹皮酚发生严重重叠。
2.2.5 溶液的制备 (1)对照品溶液。准确称取对照品3.3mg,加水溶解制成丹皮酚质量浓度为33μg/m L的对照品溶液。(2)供试品溶液。将药材样品粉碎(过60目筛),准确称取50mg,以水浸泡过夜(12 h)后滤过,定容至50m L,得质量浓度为1.0mg/m L的供试品溶液。
2.2.6 线性关系考察 分别精密量取“2.2.2”项下对照品溶液适量,分别置于10m L量瓶中,加醋酸-醋酸钠缓冲液2m L、Al(Ⅲ)溶液1m L、氯化钠溶液1m L,加水定容,制成质量浓度分别为0.132、0.396、0.660、0.924、1.188μg/m L的系列对照品溶液(C1~C5)。按“2.2.1”项下试验条件对上述系列对照品溶液分别进行三维荧光光谱扫描,记录荧光强度。以丹皮酚质量浓度(x,μg/m L)为横坐标、荧光强度(y)为纵坐标进行线性回归,得丹皮酚回归方程y=290.87x+6.42(r=0.999 9)。结果表明,丹皮酚检测质量浓度线性范围为0.132~1.188μg/m L。
2.2.7 精密度试验 分别取“2.2.5”项下供试品溶液适量,分别置于10m L量瓶中,加缓冲液2m L、A l(Ⅲ)溶液1m L、氯化钠溶液1m L,加水定容,得溶液E1~E5(质量浓度均为30μg/m L),作为平行预测集。分别取“2.2.5”项下对照品溶液和供试品溶液各适量,分别两两置于10m L量瓶中,加入缓冲液2m L、A l(Ⅲ)溶液1m L、氯化钠溶液1m L,加水定容,得溶液E6~E10(对照品质量浓度分别为0.132、0.264、0.396、0.528、0.660μg/m L),作为标准加入集。取上述溶液各适量,按“2.2.1”项下试验条件进样测定,记录荧光强度,并按“2.1.4”项下计算方法校正。结果,丹皮酚平均含量的RSD=0.02%(n=5),表明仪器精密度良好。
2.2.8 稳定性试验 取“2.2.5”项下供试品溶液适量,置于10m L量瓶中,加缓冲液2m L、Al(Ⅲ)溶液1m L、氯化钠溶液1m L,加水定容,分别于室温下放置10、20、30、50、60、80、100、120min时按“2.2.1”项下试验条件进样测定,记录荧光强度。结果,丹皮酚荧光强度的RSD=2.77%(n=8),表明供试品溶液室温下放置120 min内基本稳定。
2.2.9 重复性试验 以“2.2.3”项下溶液C1~C5为校正样;分别取“2.2.5”项下供试品溶液适量,分别置于10m L量瓶中,加缓冲液2m L、Al(Ⅲ)溶液1m L、氯化钠溶液1m L,加水定容,得溶液P1~P5(系列质量浓度),作为待测样。取上述溶液各适量,按“2.2.1”项下试验条件进样测定,记录荧光强度并计算含量,并按“2.1.4”项下计算方法校正。结果,丹皮酚平均含量为1.16μg/m L,RSD=0.03%(n=5),表明本方法重复性良好。
2.2.10 加样回收率试验 取已知含量样品0.3m L,共9份,分别加入低、中、高质量的丹皮酚对照品,按“2.2.5”项下方法制备供试品溶液,再按“2.2.1”项下试验条件进样测定,记录荧光强度并计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=9)Tab 1 Resultsof recovery tests(n=9)
2.2.11 药材样品含量测定 以“2.2.3”项下溶液C1~C5为校正样,“2.2.9”项下溶液P1~P5为待测样,按“2.2.1”项下试验条件进样测定,记录荧光强度并按“2.1.4”项下计算方法校正,计算样品含量,结果见表2。
3 验证试验(HPLC法)
3.1 色谱条件
色谱柱:ZORBAX SB-C18(150mm×4.6mm,5μm);流动相:甲醇-水(50∶50,V/V);流速:1m L/m in;检测波长:270 nm;柱温:25℃;进样量:15μL。
3.2 专属性试验
取“2.2.5”项下对照品溶液、供试品溶液各适量,按“3.1”项下色谱条件进样测定,记录色谱,详见图3。结果,对照品色谱峰保留时间为9.405m in,而药材样品在9.406m in出现色谱峰。

表2 药材样品含量测定结果(n=6)Tab 2 Contentdeterm ination ofsamples(n=6)

图3 高效液相色谱图Fig 3 HPLC chromatography
3.3 线性关系考察
精密量取“2.2.5”项下对照品溶液5、7.5、10、12.5、15μL,按“3.1”项下色谱条件进样测定。以丹皮酚进样量(x,μg)为横坐标、峰面积积分值(y)为纵坐标进行线性回归,得线性回归方程y=4 606.5x-2.5(r=0.999 9)。结果表明,丹皮酚检测进样量线性范围为0.165~0.495μg。
3.4 方法学考察
按相关方法学要求进行精密度、稳定性、重复性试验。结果,上述试验中丹皮酚的RSD分别为0.86%(n=6)、1.83%(n=3)、0.83%(n=5),表明仪器精密度良好,供试品溶液室温下放置3 d内基本稳定,本方法重复性良好。
3.5 样品含量测定
取药材样品适量,分别按“2.2.5”项下方法制备供试品溶液,再按“3.1”项下色谱条件进样测定,记录峰面积并计算样品含量。结果,药材样品中丹皮酚平均含量为1.12%(n=31),与三维荧光光谱结合ATLD算法的测定结果十分相近。
4 讨论
本试验分别采用三维荧光光谱结合ATLD算法和HPLC法测定了徐长卿药材中丹皮酚的含量,两种方法得到的结果基本一致。基于ATLD算法经校正能在干扰共存的条件下对一种或几种目标分析物进行同时解析测定,对于成分复杂的中药中有效成分研究是一种很好的方法,避免了烦琐的预分离步骤,实现了快速、简便、准确的定量测定,在其他复杂体系的定性与定量分析研究中也具有广阔的应用前景。
[1] 金贤兰.徐长卿药理作用及临床应用研究进展[J].现代医药卫生,2010,26(19):2947-2948.
[2] 刘雁丽,韦柳成,沈振国,等.丹皮酚的药理作用、提取及含量测定方法研究进展[J].安徽医药,2011,15(7):896-898.
[3] 耿帅,赵育林,曾凯,等.丹皮酚的研究进展[J].中国新药与临床杂志,2016,35(5):310-313.
[4]TaoWW,Wang HQ,Su Q,etal.Paeonolattenuates lipopolysaccharide-induced depressive-like behavior in m ice [J].Psychiatry Res,2016,238(30):116-121.
[5] 郭丽冰,梁锦基,杨其蓝.气相色谱法测定徐长卿中丹皮酚含量[J].中国中药杂志,1996,21(8):484-485.
[6] 石向群.气相色谱法测定桂枝茯苓胶囊中丹皮酚的含量[J].广州化工,2015,43(4):145-146.
[7] 贺敬霞,杨滨,柯华香,等.近红外光谱法快速测定丹皮中丹皮酚和水分的含量[J].中国实验方剂学杂志,2015,21(22):64-67.
[8] 黄丽丹.徐长卿中丹皮酚含量测定方法研究[J].安徽医药,2008,12(7):599-600.
[9] 宋钦兰,林海青.HPLC法测定糖肾康颗粒中丹皮酚的含量[J].中国药房,2015,26(12):1700-1701.
[10] 李向阳,屠万倩,张留记.RP-HPLC法测定不同产地的牡丹皮中芍药苷和丹皮酚的含量[J].中药新药与临床药理,2011,22(5):563-565.
[11] 高锦红,张学英,朱海燕.徐长卿中药中丹皮酚含量的测定[J].光谱实验室,2012,29(2):1207-1209.
[12] Zhang SR,Wu HL,Chen Y,et al.An investigation on hydrogen bonding between 3-methylindole and ethanolusing trilinear decomposition of fluorescence excitationemissionmatrices[J].Chemometr Intell Lab Syst,2013,15(121):9-14.
[13] Escandar GM,Goicoechea HC,Muñoz de la Peña A,et al.Second-and higher-order data generation and calibration:a tutorial[J].AnalChim Acta,2014(806):8-26.
[14] Wu HL,Shibukawa M,Oguma K.An alternating trilinear decomposition algorithm w ith application to calibration of overlapped chlorinated aromatic hydrocarbons[J].J Chemometr,1998,12(1):1-26.
[15] Kompany-Zareh M,AkhlaghiY,Bro R.Tuker core consistency for validation of restricted Tucker 3 models[J]. AnalChim Acta,2012(723):18-26.
[16] Luciani X,Mounier S,Redon R,et al.A simple correctionmethod of inner filter effects affecting FEEM and its application to the PARAFAC decomposition[J].Chemom Intell Lab Sys,2009,96(2):227-238.
Content Determ ination of Paeonol in Cynanchum paniculatum by Three-dimensional Fluorescence Coupled w ith ATLD Algorithm
BAIXuemei,LIU Delong,WEIYongju(College of Chem istry and Material Science,Hebei Normal University,Shijiazhuang 050024,China)
OBJECTIVE:To determ ine the content of paeonol in Cynanchum paniculatum by three-dimensional fluorescence coupled w ith ATLD algorithm.METHODS:The trilinearmodel was established.The principle of least square was used for ATLD. The component value was fitted by core consistency diagnosis,and inner filter effect was corrected by mathematical correction method.Fluorescence scanning condition included excitation wavelength of 250-400 nm,emission wavelength of 410-600 nm,wavelength interval of 5 nm,slit w idth of 5.0/5.0 nm,scanning speed of 1 200 nm/m in.Determ ination and absorption spectrum condition included scanning wavelength of 250-600 nm,scanning speed of 600 nm/m in;A l(Ⅲ)was used as the sensitizer to increase the fluorescence intensity of paeonol.The content of paeonolwas determ ined by HPLC.RESULTS:The linear range of pae-onol was 0.132-1.188μg/m L(r=0.999 9).RSDs of precision,stability and reproducibility testswere less than 3.0%.The recoveries were 100.1%-104.7%(RSD=2.39%,n=6).The analysis spectrum of paeonol was almost completely overlapped w ith the actual spectrum.The results of HPLC method are very sim ilar to those of ATLD algorithm.CONCLUSIONS:The three-dimensional fluorescence coupled w ith ATLD algorithm is simple,rapid,efficient and accurate,and can be used for the qualitative and quantitative analysis of complex system.
Three-dimensional fluorescence;ATLD;Cynanchum paniculatum;Paeonol;HPLC
R927.2
A
1001-0408(2017)15-2089-04
2016-06-20
2016-09-21)
(编辑:张 静)
国家自然科学基金资助项目(No.81173496、20975029)
*硕士研究生。研究方向:药物与生物分析化学。E-mail:550393676@qq.com
#通信作者:教授,硕士生导师。研究方向:药物与生物分析化学。E-mail:delongliu9012@sina.com
DOI 10.6039/j.issn.1001-0408.2017.15.21

