奈达铂联合紫杉醇治疗晚期宫颈癌的临床观察
孙桂霞,杨少琴(河南大学淮河医院妇产科,河南开封 475000)
奈达铂联合紫杉醇治疗晚期宫颈癌的临床观察
孙桂霞*,杨少琴(河南大学淮河医院妇产科,河南开封 475000)
目的:观察奈达铂联合紫杉醇治疗晚期宫颈癌的疗效和安全性。方法:100例晚期宫颈癌患者随机分为对照组(50例)和观察组(50例)。两组患者均采用6MV直线加速器外放射联合腔内后装照射。在此基础上,对照组患者静脉滴注顺铂注射液20 mg/m2,d1+紫杉醇注射液35mg/m2,d1,3 h内滴完;观察组患者静脉滴注注射用奈达铂20mg/m2,d1+紫杉醇注射液(用法用量同对照组)。两组均以1周为1个周期,共治疗6个周期。观察两组患者的近期疗效,治疗前后血管内皮生长因子A(VEGF-A)、VEGFC、VEGF-D水平和微淋巴管密度(LVD)、微血管密度(MVD)及毒副反应发生情况。结果:观察组患者总有效率(52.00%)、疾病控制率(86.00%)均显著高于对照组(分别为32.00%、66.00%),差异均有统计学意义(P<0.05)。治疗后,两组患者VEGF-A、VEGFC、VEGF-D水平和LVD、MVD均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05)。观察组患者血小板减少发生率显著高于对照组,恶心呕吐发生率显著低于对照组,差异均有统计学意义(P<0.05)。结论:奈达铂联合紫杉醇可提高晚期宫颈癌患者的近期疗效,降低VEGF水平及抑制肿瘤血管生成,减少胃肠道反应,但应注意血小板毒性反应。
晚期宫颈癌;奈达铂;紫杉醇;顺铂;疗效;安全性
宫颈癌是临床常见的妇科恶性肿瘤,治疗方法包括手术切除、放化疗等。晚期宫颈癌患者伴有淋巴转移、血行转移和直接浸润[1],因此对晚期宫颈癌患者进行放化疗可取得相对较好的疗效[2]。顺铂因其毒副反应较大,而使临床应用受到限制,而有研究认为奈达铂联合紫杉醇治疗宫颈癌疗效确切[3]。血管内皮生长因子(VEGF)在恶性肿瘤进展及预后中具有重要作用[4],而微血管密度(MVD)和微淋巴管密度(LVD)与肿瘤的分期、病理分级等密切相关[5]。目前,奈达铂联合紫杉醇治疗晚期宫颈癌相关文献较多,观察指标不尽相同[6-7]。在本研究中,笔者观察了奈达铂联合紫杉醇治疗晚期宫颈癌的疗效和安全性以及对VEGF、LVD和MVD的影响,旨在为临床提供参考。
1 资料与方法
1.1 研究对象
选择2013年2月-2014年2月我院收治的100例晚期宫颈癌患者,年龄(52.47±4.61)岁,肿瘤直径(5.79± 1.32)cm,CT或磁共振成像(MRI)检测未发现腹主动脉等淋巴结转移,根据国际妇产科联盟(FIGO)分期标准分为ⅡB期16例、ⅢA期55例、ⅢB期29例,功能状态(Karnofsky)评分均≥70分。按随机数字表法将所有患者分为观察组(50例)和对照组(50例)。两组患者年龄、肿瘤直径、FIGO分期、病理类型等基本资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,所有患者或其家属均签署了知情同意书。
表1 两组患者基本资料比较(±s)Tab 1 Comparison ofgeneraldatabetween 2 groups(x± s)

表1 两组患者基本资料比较(±s)Tab 1 Comparison ofgeneraldatabetween 2 groups(x± s)
项目年龄,岁肿瘤直径,cm FIGO分期,例ⅡBⅢAⅢB病理类型,例鳞癌腺癌腺鳞癌观察组(n=50)52.49±4.36 5.81±0.65对照组(n=50)52.45±4.44 5.78±0.74 7 9 27 16 28 13 4345 52 32
1.2 纳入与排除标准
纳入标准:(1)均经病理活检确诊;(2)年龄39~68岁;(3)治疗前无放化疗史者;(4)FIGO分期ⅡB~ⅢB;(5)心、肝、肾等重要脏器功能正常。排除标准:(1)同时存在其他恶性肿瘤者;(2)妊娠期及哺乳期妇女;(3)病理类型非宫颈鳞癌、腺癌、腺鳞癌者;(4)不能耐受治疗或不能配合定期随访者。
1.3 治疗方法
两组患者均采用6MV直线加速器外放射联合腔内后装照射:先行全盆腔放疗(1.8~2.0Gy,每日1次,每周5次,至宫旁总剂量25~30 Gy),再行盆腔四野外放射(1.8~2.0 Gy,每日1次,每周4次,至宫旁总剂量15~20 Gy),同时行高剂量192Ir腔内后装照射(6 Gy,每周1次,总剂量36~42Gy)[8]。在此基础上,对照组患者静脉滴注顺铂注射液(云南植物药业有限公司,规格:6m L∶30mg,批准文号:国药准字H53021741)20mg/m2,d1+紫杉醇注射液(北京双鹭药业股份有限公司,规格:5m L∶30mg,批准文号:国药准字H20066640)35mg/m2,d1,3 h内滴完。观察组患者静脉滴注注射用奈达铂(齐鲁制药有限公司,规格:10 mg,批准文号:国药准字H20050563)20mg/m2,d1+紫杉醇注射液(用法用量同对照组)。两组均以1周为1个周期,共治疗6个周期。两组患者化疗前12 h均口服醋酸地塞米松片(中国药科大学制药有限公司,规格:0.75mg/片,批准文号:国药准字H32022676)3.75mg,化疗前30m in肌内注射盐酸苯海拉明注射液(西安利君制药有限公司,规格:1m L∶20 mg,批准文号:国药准字H61021679)20mg,防止过敏反应,并静脉注射西咪替丁注射液(上海第一生化药业有限公司,规格:2 m L∶0.2 g,批准文号:国药准字H31022471)0.4 g、盐酸格拉司琼注射液(太极集团四川太极制药有限公司,规格:3m L∶3mg,批准文号:国药准字H20030161)3mg,预防呕吐。化疗过程中严密观察生命体征,化疗药滴注完毕后12 h再次口服醋酸地塞米松片3.75mg。
1.4 观察指标
1.4.1 治疗前后VEGF-A、VEGF-C、VEGF-D水平 采用日立7600型全自动生化分析仪(日本株式会社日立高新技术公司),以酶联免疫吸附法(ELISA)检测血中VEGF-A、VEGF-C、VEGF-D水平(试剂购自武汉博士德生物工程有限公司)。
1.4.2 治疗前后LVD、MVD LVD、MVD参照El-Gohary法和Weidner法[9]计算。
1.4.3 毒副反应 根据世界卫生组织(WHO)抗癌药物急性与亚急性毒性分级标准[10]分为Ⅰ~Ⅳ度,包括贫血、白细胞减少、血小板减少、恶心呕吐、腹泻、尿素氮或肌酐升高等。分级越高表示毒副反应越严重。
1.5 疗效判定标准
根据实体瘤疗效评价标准(RECST)[11]分为——完全缓解(CR):肿瘤完全消失,无新病灶出现,持续时间>1个月;部分缓解(PR):肿瘤最大直径和最大垂直直径乘积缩小≥50%,持续时间>1个月;稳定(SD):肿瘤最大直径和最大垂直直径乘积缩小<50%,或增大≤25%;进展(PD):肿瘤最大直径和最大垂直直径乘积增大>25%。总有效率=(CR例数+PR例数)/总例数× 100%。疾病控制率=(CR例数+PR例数+SD例数)/总例数×100%。
1.6 统计学方法
采用SPSS 20.0统计软件对数据进行分析。计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期疗效比较
观察组患者总有效率、疾病控制率均显著高于对照组,差异均有统计学意义(P<0.05),详见表2。
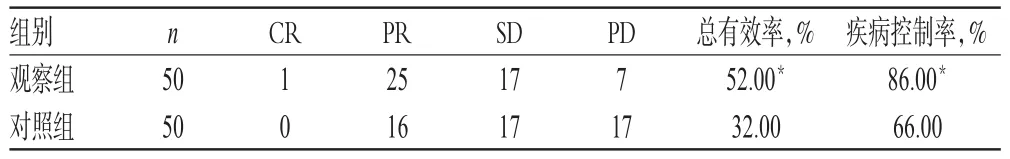
表2 两组患者近期疗效比较(例)Tab 2 Comparison of short-term efficacies between 2groups(case)
2.2 两组患者治疗前后VEGF-A、VEGF-C、VEGF-D水平比较
治疗前,两组患者VEGF-A、VEGF-C、VEGF-D水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者VEGF-A、VEGF-C、VEGF-D水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表3。
表3 两组患者治疗前后VEGF-A、VEGF-C、VEGF-D水平比较(±s)Tab 3 Comparison of VEGF-A,VEGF-C and VEGF-D levels between 2 groups before and after treatment(±s)

表3 两组患者治疗前后VEGF-A、VEGF-C、VEGF-D水平比较(±s)Tab 3 Comparison of VEGF-A,VEGF-C and VEGF-D levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.controlgroup,#P<0.05
VEGF-D,pg/mL 42.83±5.60 29.23±3.66*#43.27±5.41 33.85±4.09*组别观察组n 50对照组50时段治疗前治疗后治疗前治疗后VEGF-A,pg/mL 729.54±64.78 208.15±35.37*#736.29±66.53 279.48±41.52*VEGF-C,pg/mL 53.74±6.61 28.05±3.39*#53.28±6.43 33.97±4.26*
2.3 两组患者治疗前后LVD、MVD比较
治疗前,两组患者LVD、MVD比较,差异均无统计学意义(P>0.05)。治疗后,两组患者LVD、MVD均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表4。
表4 两组患者治疗前后LVD、MVD比较(±s)Tab 4 Comparison of LVD and MVD between 2 groupsbefore and after treatment(±s)

表4 两组患者治疗前后LVD、MVD比较(±s)Tab 4 Comparison of LVD and MVD between 2 groupsbefore and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.controlgroup,#P<0.05
组别观察组MVD,个/高倍视野19.13±2.09 14.58±1.81*#19.50±2.27 16.37±1.79*n 50对照组50时段治疗前治疗后治疗前治疗后LVD,个/高倍视野6.91±0.72 4.23±0.61*#7.04±0.80 5.14±0.59*
2.4 毒副反应
观察组患者血小板减少发生率显著高于对照组,恶心呕吐发生率显著低于对照组,差异均有统计学意义(P<0.05)。两组患者贫血、白细胞减少、腹泻、尿素氮或肌酐升高发生率比较,差异均无统计学意义(P>0.05),详见表5。
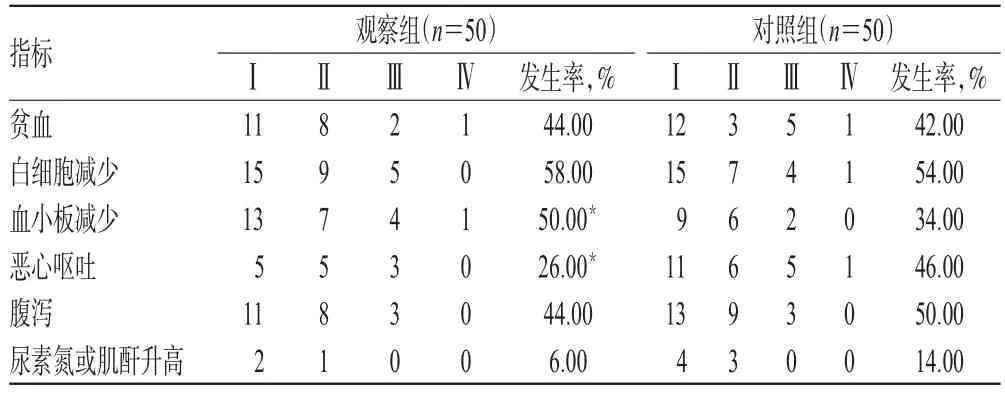
表5 两组患者毒副反应发生率比较(例)Tab 5 Comparison of the incidence of toxic reaction between 2 groups(case)
3 讨论
同步放化疗是治疗中晚期宫颈癌的标准方案,美国国立癌症研究所推荐对局部晚期宫颈癌采取以顺铂为基础的同步放化疗方案治疗[12]。紫杉醇为新型抗微管药物,可促进微管蛋白聚合,抑制细胞有丝分裂,可使细胞周期停滞于对放疗敏感的G2/M期,同时具有放射增敏作用。顺铂联合紫杉醇化疗方案是既往临床常采用的方案,其疗效也得到了临床的肯定[13]。
奈达铂是新一代的铂类抗肿瘤药物,具有抗癌谱广、治疗指数高、肾毒性和胃肠反应低等特点。奈达铂联合紫杉醇治疗宫颈癌,可大大增强杀伤肿瘤细胞的能力。Yin M等[14]研究报道,采用奈达铂+紫杉醇同步放化疗治疗中晚期宫颈癌能够提高患者生存率,且奈达铂较顺铂的毒性相对较小。本研究结果显示,观察组患者总有效率、疾病控制率均显著高于对照组,差异均有统计学意义;观察组患者恶心呕吐发生率显著低于对照组,差异有统计学意义。两组患者贫血、白细胞减少、腹泻、尿素氮或肌酐升高发生率比较,差异均无统计学意义。这与国内外学者文献报道结果一致[7,15]。但本研究中,观察组患者血小板减少发生率显著高于对照组,差异有统计学意义,与Shimada M等[16]报道一致。这提示奈达铂联合紫杉醇治疗时应注意血小板毒性反应。
在宫颈癌的发生发展过程中,血管新生是导致宫颈癌细胞增殖、侵袭、转移的最重要病理环节,因此抑制血管新生可有效阻断疾病的发展[17]。VEGF亦称血管通透因子,可促进血管内皮细胞分化、增殖,增加血管通透性,有利于肿瘤侵袭与转移[18]。其中,VEGF-A是一种促肿瘤生长因子,其水平与肿瘤分期呈正相关;血管内皮生长因子受体3(VEGFR-3)的亲和力较VEGF-C、VEGF-D逐渐增强,可促进肿瘤新生血管的生成。本研究结果显示,治疗后,两组患者VEGF-A、VEGF-C、VEGF-D水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义。这提示奈达铂联合紫杉醇可降低晚期宫颈癌患者VEGF水平。
肿瘤的生长和转移与血管的生成和富集密切相关,肿瘤血管的生成直接参与宫颈癌的发生发展过程,而MVD是评估肿瘤血管生成及患者预后的重要指标,LVD是直接反映肿瘤转移的指标[19]。本研究结果显示,治疗后,两组患者LVD、MVD均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义。这与王静等[20]研究结果一致。
综上所述,奈达铂联合紫杉醇可提高晚期宫颈癌患者的近期疗效,降低VEGF水平及抑制肿瘤血管生成,减少胃肠道反应,但应注意血小板毒性反应。由于本研究纳入的样本量较小,且未对复发率、转移率进行观察,故此结论有待大样本、多中心研究进一步证实。
[1] 余建云,李林均,陈萍.紫杉醇脂质体联合奈达铂同步放疗在中晚期宫颈癌中的临床研究[J].临床肿瘤学杂志,2014,19(10):929-931.
[2]Sugiyama T,M izuno M,AokiY,etal.A single-arm study evaluating bevacizumab,cisplatin,and paclitaxel followed by single-agent bevacizumab in Japanese patients w ith advanced cervical cancer[J].Jpn JClin Oncol,2017,47(1):39-46.
[3]Tsubamoto H,Yamamoto S,Kanazawa R,etal.Prognostic factors for locally advanced cervical cancer treated w ith neoadjuvant intravenousand transuterine arterial chemotherapy followed by radical hysterectomy[J].Int JGynecolCancer,2013,23(8):1470-1475.
[4] 谢丽,忙尼沙汗·阿不都拉,才层,等.维汉族中晚期宫颈癌患者治疗前后血清VEGF变化的临床特征及意义[J].中华检验医学杂志,2013,36(4):365-368.
[5] Xiong Y,Cao LP,Rao HL,et al.Clinicalsignificance of peritumoral lymphatic vessel density and lymphatic vessel invasion detected by D2-40 immunostaining in FIGOⅠb1-Ⅱa squamous cell cervical cancer[J].Cell Tissue Res,2012,348(3):515-522.
[6] 龙婷婷.奈达铂联合紫杉醇同步放疗治疗中晚期宫颈癌的疗效及不良反应观察[J].安徽医药,2016,20(5):965-968.
[7] Takekuma M,Hirashima Y,Ito K,etal.PhaseⅡtrial of paclitaxel and nedaplatin in patientsw ith advanced/recurrent uterine cervical cancer:a Kansai clinical oncology group study[J].GynecolOncol,2012,126(3):341-345.
[8] 叶伟军,曹新平,刘宏英,等.奈达铂与顺铂同期放化疗治疗中晚期宫颈癌的疗效观察[J].广东医学,2013,34(21):3323-3325.
[9] Weidner N.Tumour vascularity and proliferation:clear evidence of a close relationship[J].JPathol,1999,189(3):297-299.
[10] Kinoshita T,Azuma K,Sasada T,et al.Chemotherapy for non-small cell lung cancer complicated by idiopathic interstitial pneumonia[J].Oncol Lett,2012,4(3):477-482.
[11] Edeline J,Boucher E,Rolland Y,etal.Comparison of tumor response by Response Evaluation Criteria in Solid Tumors(RECIST)andmodified RECIST in patients treated w ith sorafenib for hepatocellular carcinoma[J].Cancer,2012,118(1):147-156.
[12] Green JA,Kirwan JM,Tierney JF,etal.Survivaland recurrecce after concom itant chemotherapy and radiotherapy for cancer of uterine cervix:a systematic review and meta-analysis[J].Lancet,2001,358(9284):781-786.
[13] 权丽丽.紫杉醇联合顺铂辅助治疗中晚期宫颈癌近期疗效与安全性的Meta分析[J].中国药房,2015,26(24):3389-3392.
[14] Yin M,Zhang H,LiH,etal.The toxicity and long-term efficacy of nedaplatin and paclitaxel treatmentas neoadjuvant chemotherapy for locally advanced cervical cancer [J].JSurg Oncol,2012,105(2):206-211.
[15] 高薇薇,姚微,叶霖.紫杉醇脂质体联合奈达铂治疗中晚期宫颈癌放疗患者的临床疗效[J].肿瘤药学,2016,6(3):203-207.
[16]ShimadaM,ItamochiH,Kigawa J.Nedaplatin:a cisplatin derivative in cancer chemotherapy[J].Cencer Manag Res,2013(5):67-76.
[17] 徐利珍,游爱平,刘岑.宫颈癌组织中VEGF、Galectin-1的检测意义[J].海南医学院学报,2015,21(2):259-261.
[18] IwasakiK,Yabushita H,Ueno T,etal.Role of hypoxiainducible factor-1α,carbonic anhydrase-IX,glucose transporter-1 and vascular endothelial grow th factor associated w ith lymph nodemetastasis and recurrence in patients w ith locally advanced cervical cancer[J].Oncol Lett,2015,10(4):1970-1978.
[19] Biedka M,Makarew icz R,Marszafek A,et al.Labeling of m icrovessel density,lymphatic vessel density and potential role of proangiogenic and lymphangiogenic factors as a predictive/prognostic factors after radiotherapy in patients w ith cervical cancer[J].Eur J Gynaecol Oncol,2012,33(4):399-405.
[20] 王静,罗小琼,陈升才.紫杉醇联合奈达铂动脉介入栓塞治疗宫颈鳞癌的疗效及其对微血管和微淋巴管密度的影响[J].实用药物与临床,2016,19(3):287-291.
(编辑:陈 宏)
ClinicalObservation of Nedaplatin Combined w ith Paclitaxel in the Treatment of Advanced Cervical Cancer
SUN Guixia,YANG Shaoqin(Dept.of Obstetrics and Gynecology,Huaihe Hospital of Henan University,Henan Kaifeng 475000,China)
OBJECTIVE:To observe therapeutic efficacy and safety of nedaplatin combined w ith paclitaxel in the treatment of advanced cervical cancer.METHODS:Totally 100 patientsw ith advanced cervical cancer were random ly divided into observation group(50 cases)and control group(50 cases).Both groupswere given 6MV linear accelerator radiotherapy combined w ith intracavitary irradiation.Based on it,control group was additionally given Cisplatin injection 20mg/m2,d1+Paclitaxel injection 35mg/m2,d1intravenously w ithin 3 h.Observation group wasadditionally given Nedaplatin for injection 20mg/m2,d1+Paclitaxel injection intravenously(same usage and dosage as control group).A treatment course lasted for a week,and both groups
6 courses of treatment. Short-term efficacies of 2 groupswere observed,and the levels of vascular endothelial grow th factor A(VEGF-A),VEGF-C and VEGF-D,lymphatic m icrovessel density(LVD),m icrovessel density(MVD),toxic reaction were also observed before and after treatment.RESULTS:Total response rate(52.00%vs.32.00%)and disease control rate(86.00%vs.66.00%)of observation group were significantly higher than those of control group,w ith statistical significance(P<0.05).After treatment,the levels of VEGF-A,VEGF-C and VEGF-D,LVD,MVD in 2 groupswere significantly lower than before treatment,and the observation group was significantly lower than the control group,w ith statistical significance(P<0.05).The incidence of thrombocytopenia in observation group was significantly higher than control group,and the incidence of nausea and vom iting was significantly lower than control group,w ith statistical significance(P<0.05).CONCLUSIONS:Nedaplatin combined w ith paclitaxel can improve short-term efficacy of patientsw ith advanced cervical cancer,reduce gastrointestinal reaction,VEGF level and inhibit the generation of tumor vessel,but great importance should be attached to platelet toxic reaction.
Advanced cervical cancer;Nedaplatin;Paclitaxel;Gsplatin;Therapeutic efficacy;Safety
R737.3
A
1001-0408(2017)15-2046-04
2016-09-06
2017-03-16)
*主治医师,硕士。研究方向:妇科肿瘤。电话:0371-23906679。E-mail:woshitaiyang1982@163.com
DOI 10.6039/j.issn.1001-0408.2017.15.09

