淋巴细胞亚群对晚期非小细胞肺癌患者化疗效果及远期生存的影响
魏智民,张维强,高 峰,吴云波,张国庆,刘哲峰,焦顺昌
1中国人民解放军总医院肿瘤科,北京 1008532中国人民解放军联合参谋部警卫局保健处,北京 100017
·论 著·
淋巴细胞亚群对晚期非小细胞肺癌患者化疗效果及远期生存的影响
魏智民1,2,张维强2,高 峰2,吴云波1,张国庆2,刘哲峰1,焦顺昌1
1中国人民解放军总医院肿瘤科,北京 1008532中国人民解放军联合参谋部警卫局保健处,北京 100017
目的 评估淋巴细胞亚群对晚期非小细胞肺癌(NSCLC)患者化疗效果及远期生存的影响。方法 以125例接受紫杉醇±铂类、培美曲塞±铂类或其他一线化疗方案的晚期NSCLC患者为研究对象,采用流式细胞仪检测化疗前及化疗2个周期后的外周血21项淋巴细胞亚型的表达情况,根据影像学检查结果评价化疗疗效,分析淋巴细胞亚群对患者疗效和无进展生存时间(PFS)及总生存时间(OS)的影响。结果 不同化疗疗效组患者化疗前的淋巴细胞亚群间差异均无统计学意义(P均>0.05);2周期化疗后,完全缓解(CR)+部分缓解(PR)组、疾病稳定(SD)组和疾病进展(PD)组患者的CD4+CD29+细胞百分比分别为(22.42±7.88)%、(21.88±6.81)%和(16.87±5.28)%,其中,PD组明显低于CR+PR组(P=0.013)和SD组(P=0.009)。中位PFS为7.07个月,中位OS为23.00个月。COX多因素回归分析结果显示,化疗前HLA-DR+细胞(HR:1.03,95%CI:1.01~1.05,P<0.001)及CD3+HLA-DR+细胞(HR:1.05,95%CI:1.01~1.08,P<0.001)表达水平与患者的OS呈显著正相关。结论 化疗后CD4+CD29+T淋巴细胞水平升高可能提示患者的化疗效果较好。化疗前HLA-DR+细胞及CD3+HLA-DR+细胞在外周血中所占百分比越高,可能提示患者的预后越好。
淋巴细胞亚群;非小细胞肺癌;化疗;远期生存
ActaAcadMedSin,2017,39(3):371-376
外周血淋巴细胞亚群分析是评价患者机体免疫功能状态方法之一。手术、放疗、化疗等抗肿瘤治疗对肿瘤患者免疫功能影响的报导已有很多[1- 3],但以往研究所涉及的淋巴细胞亚群指标较少,难以全面、准确地评估患者的免疫功能状态,而淋巴细胞亚群对晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者化疗疗效及远期生存的影响却鲜有报导。本研究以125例晚期NSCLC患者为研究对象,对21项外周血淋巴细胞亚群的表型进行了检测,评估了淋巴细胞亚群对晚期NSCLC患者化疗效果及远期生存的影响。
对象和方法
对象 2008年11月至2013年12月在中国人民解放军总医院肿瘤内一科收治的经组织病理学或细胞学检查确诊的晚期NSCLC患者,入选标准:(1)疾病分期为ⅢB期或Ⅳ期,既往未行化疗。(2)有影像学可评估病灶,根据实体瘤疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors,RECIST Version 1.1),至少有1个单径可测量病灶,其最长径采用螺旋CT测量≥10 mm;任何接受过放疗的病灶均不能作为靶病灶。(3)年龄18~75岁,预期生存时间大于12周。(4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)状态评分为0~2分。(5)器官功能水平必须符合下列要求:中性粒细胞绝对计数(absolute neutrophil count,ANC)≥1.5×109/L,血小板≥100×109/L,血红蛋白≥9000 g/L;肝脏:血清胆红素≤1.5倍正常值上限,谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)≤2.5倍正常值上限;肾脏:血清肌酐≤1.5倍正常值上限;肌酐清除率≥50 ml/min。排除标准:(1)有影像学或是脑脊液病理检查证实的脊髓、脊膜或是脑膜的肿瘤转移(无症状的脑转移除外);(2)任何不稳定系统性疾病(包括活动性感染、控制不佳高血压、不稳定性心绞痛、充血性心力衰竭、肝、肾或代谢性疾病);(3)5年内患有任何其他恶性肿瘤(完全治愈的宫颈原位癌、基底细胞、鳞状上皮细胞皮肤癌除外)。所有研究对象均按照美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中推荐的给药剂量给予多西他赛/紫杉醇+顺铂/卡铂、培美曲塞二钠+顺铂/卡铂或其他方案(包括吉西他滨+顺铂/卡铂、长春瑞滨+顺铂/卡铂、依托泊苷+顺铂/卡铂等)化疗。本研究经中国人民解放军总医院医学伦理委员会批准,所有患者均签署知情同意书。
淋巴细胞亚群的检测 所有患者均于第1周期化疗前1 d及第2周期化疗后第20天清晨空腹取EDTA-Na2外周静脉抗凝血2~3 ml,检测前取患者EDTA-Na2抗凝血100 μl,分别加入各表型相应的荧光标记抗体10 μl(CD8-FITC/CD4-PE/CD3-PC5标记三色荧光素抗体及其同型阴性对照,CD3-FITC/CD56-PE/CD16-PC5标记三色荧光素抗体及其同型阴性对照,CD8-FITC、CD45RO-FITC、CD28-FITC、CD29-FITC、CD25-PE、CD45RA-PE、HLA-DR-PE、CD8-ECD、CD19-ECD、CD3-PC5、CD4-PC7标记单色荧光素抗体及FITC、PE、ECD、PC5、PC7单色同型阴性对照均购自美国Bechman-Coulter公司),振荡混匀后避光20 min,采用Q-prep自动溶血仪溶血(美国Bechman-Coulter公司),5 min后采用Cytometer FC 500 MPL流式细胞仪(美国Bechman-Coulter公司)进行检测,流式细胞仪分析功能软件进行双参数获得数据分析。激光光源为15 mW的氩离子激光,波长为488 nm。测定前用质控微球(直径5 μm,Immunothech)调校仪器,以保证其荧光检测的变异系数(coefficient of variance,CV)值<2%。计数10 000个细胞,每个标本用同型抗体作自身阴性对照,然后检测各细胞表型的阳性表达率。
疗效评价 根据影像学检查结果评价化疗疗效,疗效评价标准依据RECIST Version 1.1。无进展生存时间(progression-free survival,PFS)的计算为患者诊断明确至第1次发生疾病进展或任何原因死亡的时间。总生存时间(overall survival,OS)的计算为患者诊断明确至死亡或失访时间。
随访 定期门诊、住院或电话随访研究对象,最后随访截止时间为2016年11月18日。共入组患者154例,其中29例患者一线化疗后回当地继续化疗而失访,最后实际获得病例资料完整的研究对象为125例。
统计学处理 采用SPSS 17.0统计软件,正态分布的数据以均数±标准差表示,非正态分布数据以中位数及四分位数间距表示,组间差异比较采用方差分析,PFS和OS的计算采用Kaplan-Meier法,PFS及OS的影响因素分析采用Cox比例风险回归分析,P<0.05为差异有统计学意义。
结 果
一般情况 共有125例患者入组,其中,男80例,女45例,平均年龄(52.9±11.1)岁;腺癌111例,鳞癌14例;ECOG评分0、1、2分分别为8、105、12例;EGFR、Alk、T790M、C-Met、K-ras突变、突变阴性和未检测到突变分别为18、1、1、1、1、20、87例;脑转移5例,无脑转移120例;使用酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)93例,未使用32例;采用紫杉醇±铂类一线化疗方案61例,培美曲塞二钠±铂类方案47例,其他方案17例;2周期化疗后部分缓解(partial remission,PR)46例,疾病稳定(stable disease,SD)64例,疾病进展(progressive disease,PD)15例;随访结束时死亡110例。
化疗前后不同化疗疗效组患者淋巴细胞亚群的差异 不同化疗疗效组患者化疗前的淋巴细胞亚群间差异均无统计学意义(P均>0.05);2周期化疗后,完全缓解(complete remission,CR)+PR组、SD组和PD组患者的CD4+CD29+细胞百分比分别为(22.42±7.88)%、(21.88±6.81)%和(16.87±5.28)%,其中,PD组明显低于CR+PR组(P=0.013)和SD组(P=0.009)(表1)。
淋巴细胞亚群对PFS和OS的影响 截至最后一次随访时间为止,125例患者均完成随访,中位PFS为7.07个月,中位OS为23.00个月(图1、2)。在校正了年龄、性别、EGFR突变情况、化疗方案、TKI使用情况和TKI使用时间等因素后,COX多因素回归分析结果显示,化疗前HLA-DR+细胞(HR:1.03,95%CI:1.01~1.05,P<0.001)及CD3+HLA-DR+细胞(HR:1.05,95%CI:1.01~1.08,P<0.001)表达水平与患者的OS呈显著正相关。
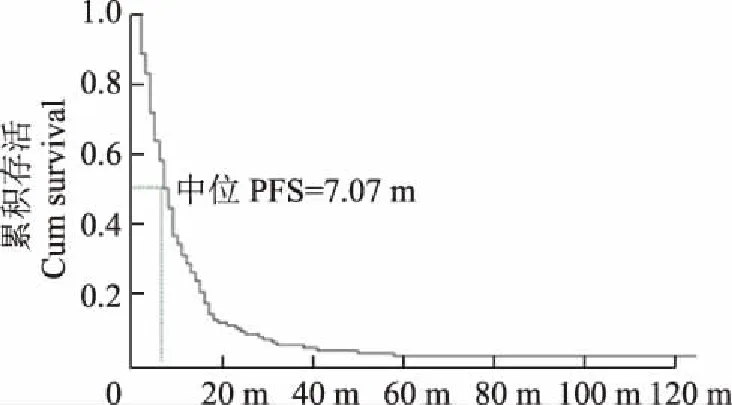
图 1 晚期非小细胞肺癌患者的无进展生存曲线
Fig 1 Progression-free survival curve of patients with advanced non-small cell lung cancer

图 2 晚期非小细胞肺癌患者的总生存时间曲线
Fig 2 Overall survival curve of patients with advanced non-small cell lung cancer
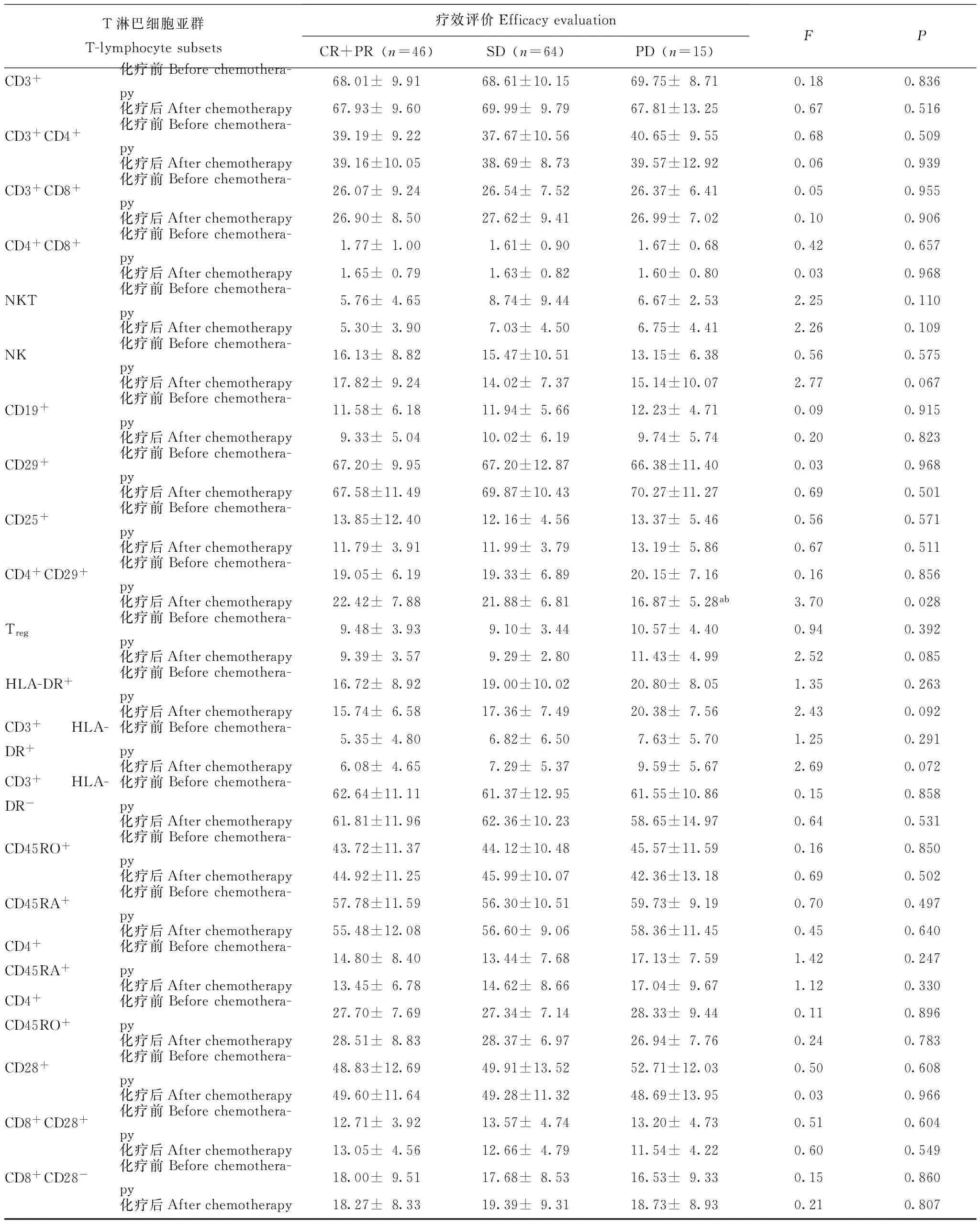
表 1 不同化疗疗效患者淋巴细胞亚群的差异(x-±s,%)
CR:完全缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展;与CR+PR组比较,aP=0.013;与SD组比较,bP=0.009
CR:complete remission;PR:partial remission;SD:stable disease;PD:progressive disease;aP=0.013 compared with CR+PR group;bP=0.009 compared with SD group
讨 论
肺癌是全球范围内发病率和死亡率均高居榜首的恶性肿瘤。随着肿瘤免疫学的发展以及“免疫编辑”学说的兴起和完善[4- 5],越来越多的研究表明,肺癌的发生、发展以及预后与机体的免疫功能状态、肿瘤免疫微环境等因素密切相关。淋巴细胞亚群是机体免疫系统中非常重要的细胞群,在机体免疫功能调节和特异性细胞免疫杀伤等方面起重要的作用。检测肺癌患者外周血淋巴细胞亚群对于判断患者免疫功能状态具有一定的临床价值,对于监视肿瘤复发、评估预后、指导免疫治疗等亦具有重要的临床意义[6]。但是外周血中淋巴细胞并不是单一的细胞群。随着免疫学研究的发展,除了经典的CD3+、CD4+和CD8+T细胞亚群外,更多的在机体免疫功能调节方面起着非常重要作用的淋巴细胞亚群,比如Treg(CD4+CD25+)、CD45RA、CD45RO、CD28、HLA-DR、CD4+CD29+细胞等被陆续发现[7- 8]。仅分析经典的淋巴细胞变化并不能客观、准确地反映机体免疫功能变化情况。本研究检测和分析了125例晚期NSCLC患者化疗前后外周血21项淋巴细胞亚群的表型,拟通过多指标淋巴细胞亚群检测体系来评估免疫功能相关指标对化疗疗效及远期生存的影响。
CD29是整合素家族中的β1链,该分子是多种细胞外基质蛋白的受体。CD4+T细胞为辅助性T细胞,若该类细胞表面同时表达CD29分子即被认为是辅助诱导T细胞。有研究认为,CD4+CD29+细胞是机体Th1类细胞的一种,炎性物质或炎性因子的刺激可以激活CD4+CD29+细胞,后者活化后可分泌Th1类细胞因子γ干扰素和肿瘤坏死因子α,进而上调机体的免疫应答,增强患者免疫功能[9]。而CD4+CD29+细胞若在某种病理生理状态下出现减低则被认为是早期反映机体免疫功能下降的标志之一,并与患者的预后相关[10]。本研究结果显示,经一线化疗方案2周期化疗后,CR+PR/SD患者化疗后的CD4+CD29+细胞百分比例较化疗前升高,而PD患者化疗后CD4+CD29+细胞百分比例较化疗前降低;PD组患者外周血淋巴细胞亚群中CD4+CD29+细胞的百分比明显低于CR+PR组和SD组,提示2周期化疗后若患者的肿瘤得到控制,那么机体的免疫功能则可以通过化疗对机体免疫格局的调整和对肿瘤抗原调变的双重作用而得以增强[11];若2周期化疗后若患者的肿瘤持续进展,那么肿瘤细胞本身与化疗药物的不良反应对机体免疫功能将出现双重打击,患者的免疫功能势必被削弱。本研究中其他反映机体免疫功能的淋巴细胞亚群无明显变化,推测其原因可能有以下3种:(1)本研究只分析了2周期化疗前后淋巴细胞亚群的变化情况,故只观察到早期反映机体免疫功能变化的CD4+CD29+T细胞的在不同化疗疗效组的表达差异,而其他可以反映免疫功能远期影响的淋巴细胞亚群的变化差异并未显现。(2)其他淋巴细胞亚群指标对晚期NSCLC患者化疗疗效没有影响。(3)本研究样本量有限,不足以发现这种趋势,今后需进一步研究评估。
本研究还观察了淋巴细胞亚群对患者PFS和OS的影响,结果显示,在21项淋巴细胞亚群中,仅化疗前HLA-DR+细胞及CD3+HLA-DR+细胞的高低与患者的OS呈正相关,其余指标与患者的PFS和OS均无明显相关性。HLA-DR抗原是HLA-Ⅱ 类抗原中的一种,可表达于多种免疫活性细胞的表面,如巨噬细胞、单核细胞、B淋巴细胞,以及活化的T淋巴细胞。该类细胞的主要功能是将抗原性多肽片段提呈给CD4+辅助性T细胞,从而帮助机体免疫细胞识别外来抗原并启动免疫反应。目前多数学者认为HLA-DR+细胞在一定程度上可以反映机体T淋巴细胞的活化程度,HLA-DR+细胞百分比越高提示淋巴细胞的活化程度越高,机体的免疫应答则越容易被外来抗原所激活[12]。本研究结果提示化疗前HLA-DR+细胞以及CD3+HLA-DR+细胞的水平可以作为晚期NSCLC患者的预后指标,HLA-DR+细胞以及CD3+HLA-DR+细胞在外周血中所占的百分比越高则患者的预后越好。推测其原因,考虑可能为淋巴细胞活化状态下患者的免疫功能经化疗后可得以进一步增强,而更好的免疫功能状态延长了患者的生存时间。
既往有研究报道化疗可降低患者的免疫功能[13],但亦有研究认为适度的化疗可增强患者的免疫功能[11]。此外,也有研究认为不同的化疗方案将对肿瘤患者的免疫功能产生不同的影响[14]。本研究未分析化疗以及不同化疗方案对晚期NSCLC患者免疫功能的影响,今后将在后续研究中将进一步探索这部分内容。
[1]Schneider T,Hoffmann H,Dienemann H,et al. Immune response after radiofrequency ablation and surgical resection in non-small cell lung cancer [J].Semin Thorac Cardiovasc Surg,2016,28(2):585- 592.doi:10.1053/j.semtcvs.2016.02.008.
[2]Talebian Yazdi M,Schinkelshoek MS,Loof NM,et al. Standard radiotherapy but not chemotherapy impairs systemic immunity in non-small cell lung cancer [J].Oncoimmunology,2016,5(12):e1255393.doi:10.1080/2162402X.2016.1255393.
[3]Pircher A,Gamerith G,Amann A,et al. Neoadjuvant chemo-immunotherapy modifies CD4(+)CD25(+)regulatory T cells(Treg)in non-small cell lung cancer(NSCLC)patients [J].Lung Cancer,2014,85(1):81- 87.doi:10.1016/j.lungcan.2014.04.001.
[4]Muenst S,Läubli H,Soysal SD,et al. The immune system and cancer evasion strategies:therapeutic concepts [J].J Intern Med,2016,279(6):541- 562.doi:10.1111/joim.12470.
[5]Merlo A,Santa SD,Dolcetti R,et al. Reverse immunoediting:When immunity is edited by antigen [J].Immunol Lett,2016,175:16- 20.doi:10.1016/j.imlet.2016.04.015.
[6]Ma QY,Huang DY,Zhang HJ,et al. Function of follicular helper T cell is impaired and correlates with survival time in non-small cell lung cancer [J].Int Immunopharmacol,2016,41:1- 7.doi:10.1016/j.intimp.2016.10.014.
[7]Hou PF,Zhu LJ,Chen XY,et al. Age-related changes in CD4+CD25+FOXP3+regulatory T cells and their relationship with lung cancer [J].PLoS One,2017,12(3):e0173048.doi:10.1371/journal.pone.0173048.
[8]Paulsen EE,Kilvaer T,Khanehkenari MR,et al. CD45RO(+)memory T lymphocytes-a candidate marker for TNM-immunoscore in squamous non-small cell lung cancer [J].Neoplasia,2015,17(11):doi:839- 848.10.1016/j.neo.2015.11.004.
[9]Zhu Y,Feng Y,Liu H,et al. CD4+CD29+T cells are blamed for the persistent inflammatory response in ulcerative colitis [J].Int J Clin Exp Pathol,2015,8(3):2627- 2637.
[10]李姝君,吴艳霞,陈华林,等.非小细胞肺癌患者CD4+CD29+T细胞含量与复发及生存期的关系[J].南方医科大学学报,2016,36(9):1215- 1220.
[11]谢治军,薛重重,杨丽萍.化疗后肿瘤免疫格局的改变及其意义的研究进展[J].中国全科医学,2011,14(3):320- 322.
[12]Laheurte C,Galaine J,Beziaud L,et al. Immunoprevalence and magnitude of HLA-DP4 versus HLA-DR-restricted spontaneous CD4+Th1 responses against telomerase in cancer patients [J].Oncoimmunology,2016,5(5):e1137416.doi:10.1080/2162402X.2015.1137416.
[13]张锦英,朱陵君,卢凯华,等.非小细胞肺癌患者化疗前后外周血T淋巴细胞亚群的变化[J].现代生物医学进展,2012,35(12):6814- 6818.
[14]张国庆,赵宏,温新宇,等.大肠癌患者化疗前后淋巴细胞亚群变化[J].中国医学科学院学报,2013,35(2):155- 160.
Impact of Lymphocyte Subsets on Chemotherapy Efficacy and Long-term Survival of Patientswith Advanced Non-small-cell Lung Cancer
WEI Zhimin1,2,ZHANG Weiqiang2,GAO Feng2,WU Yunbo1,ZHANG Guoqing2,LIU Zhefeng1,JIAO Shunchang1
1Department of Medical Oncology,Chinese PLA General Hospital,Beijing 100853,China2Department of Health Care,Chinese PLA Joint Staff Headquarters Guard Bureau,Beijing 100017,ChinaCorresponding author:JIAO Shunchang Tel:010- 66939761,E-mail:jiaosc@vip.sina.com
Objective To analyze the impact of lymphocyte subsets on chemotherapy efficacy and long-term survival of patients with advanced non-small cell lung cancer(NSCLC).Methods Totally 125 NSCLC patients who had received first-line chemotherapy including paclitaxel and pemetrexed with/without platinum were enrolled in this study.Lymphocytes from peripheral blood were collected before and after two cycles of first-line chemotherapy.Flow cytometry was performed to determine the expressions of 21 fluorescence-labeled lymphocyte subsets.Based on the imaging findings,chemotherapy efficacy was evaluated,and impact of the lymphocyte subsets on progression-free survival(PFS)and overall survival(OS)were analyzed.Results The baseline peripheral lymphocyte subsets showed no significant difference among groups receiving different treatment protocols(allP>0.05).After 2 cycles of chemotherapy,the percentage of CD4+CD29+lymphocytes was(16.87±5.28)% in progressive disease group,which was significantly lower than those in complete remission+partial remission group [(22.42±7.88)%,P=0.013] and stable disease group [(21.88±6.81)%,P=0.009].The median PFS was 7.07 months and median OS was 23.00 months.Cox multivariable regression analysis showed that the percentages of HLA-DR+(HR:1.03,95%CI:1.01-1.05,P<0.001) and CD3+HLA-DR+lymphocytes (HR:1.05,95%CI:1.01-1.08,P<0.001)were positively correlated with OS.Conclusions The rise of CD4+CD29+T lymphocytes in patients after chemotherapy indicates good chemotherapy efficacy.Higher percentage of HLA-DR+and CD3+HLA-DR+lymphocytes in peripheral blood before chemotherapy predicts favorable prognosis.
lymphocyte subsets;non-small cell lung cancer;chemotherapy;long-term survival
总后勤部卫生部保健专项科研课题(14BJZ47)Supported by the Specific Subjects on Healthcare by the Healthcare Division of the General Logistics Department of the People’s Liberation Army(14BJZ47);第一、二位作者对本文贡献一致 The first two authors contributed equally to this article
焦顺昌 电话:010- 66939761,电子邮件:jiaosc@vip.sina.com
R734.2
A
1000- 503X(2017)03- 0371- 06
10.3881/j.issn.1000- 503X.2017.03.012
2017- 05- 23)

