降柠檬酸菌株的筛选及鉴定
张 铎
毛 勇4
毛 健1,2,3,5,6
刘双平1,2,3,5,6
周志磊1,2,3,5,6
(1. 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 江南大学食品安全与营养协同创新中心,江苏 无锡 214122;4. 中国酒业协会,北京 100831;5. 国家黄酒工程技术研究中心,浙江 绍兴 312000;6. 江南大学﹝如皋﹞食品生物技术研究所,江苏 如皋 226500)
降柠檬酸菌株的筛选及鉴定
张 铎1,2,3
毛 勇4
毛 健1,2,3,5,6
刘双平1,2,3,5,6
周志磊1,2,3,5,6
(1. 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 江南大学食品安全与营养协同创新中心,江苏 无锡 214122;4. 中国酒业协会,北京 100831;5. 国家黄酒工程技术研究中心,浙江 绍兴 312000;6. 江南大学﹝如皋﹞食品生物技术研究所,江苏 如皋 226500)
为筛选具有降柠檬酸能力的酵母菌株,对一柠檬酸厂废水废渣中的微生物进行培养分离纯化保藏,共获得具有耐柠檬酸的菌株15株。对15株菌株的降柠檬酸能力进行测试,发现5株菌的降柠檬酸能力较强,发酵5 d可降解柠檬酸培养基中70%以上的柠檬酸。测定5株菌的酒精耐受性,菌株NS2、NL2的酒精耐受能力较强。观察该两株菌的形态学及生理生化特性,将NS2鉴定为毕赤酵母菌,NL2鉴定为热带假丝酵母菌。进一步通过分子生物手段进行18S rDNA PCR测序分析,将NS2鉴定为Pichiakudriavzevii,NL2鉴定为Candidatropicalis。研究成果可为今后应用生物降酸法降低山楂酒等果酒中有机酸含量提供指导。
酵母菌;降酸;毕赤酵母菌;筛选;测序;鉴定
山楂(CrataeguspinnatifidaBunge)属蔷薇科山楂属,又名山里果、山里红,是中国北方地区重要的栽培水果[1]。由于其丰富的营养价值和酸甜可口的风味特点,山楂也常用于酿造果酒。酸度是果酒的酿造过程中的重要指标之一,适量的有机酸有助于丰富果酒风味,营造出清爽可口的口感,同时降低酒体中的pH,起到抑制杂菌生长的作用。但有机酸含量过高则会产生酒体酸涩,难以入口等[2]。发酵型果酒的有机酸主要来自于发酵原料,研究[3]发现不同种类果酒中所含有机酸不同,主要为酒石酸、苹果酸和柠檬酸。葡萄酒中的有机酸主要为酒石酸[4],苹果酒中富含大量苹果酸[5],而山楂酒、橙酒等果酒中的有机酸主要为柠檬酸[6]。目前传统的果酒降酸方法主要分为物理降酸法如离子交换树降酸法[7]、电渗析降酸法[8-9]、低温冷冻降酸法等和化学降酸法[10],以及生物降酸法[11]等。这些降酸方法各有优劣,有研究[12]表明冷冻降酸法不添加其他物质,对葡萄酒原有的风味营养影响较小,但降酸幅度较小,一般可以降低葡萄酒中0.5~2.0 g/L的酒石酸。有报道[13]采用电渗析降酸法对杨梅果酒进行降酸处理,可以降低约42%的可滴定酸,但其是一个连续的降酸过程,动力消耗大,成本高。化学降酸法的原理是利用偏碱性盐与酒体中的有机酸反应从而达到降酸目的,常用的降酸剂有Na2CO3、K2CO3、KHCO3等,其降酸效果较为明显[14]。但由于引入了化学添加剂,会导致果酒酒体浑浊,产生苦涩口味等不利影响。生物降酸法中最常见的为苹果酸—乳酸发酵,这种方法普遍应用于葡萄酒的后酵阶段[15],不仅能显著降低酸度,还可以改善酒体风味,提升葡萄酒的品质[16]。山楂酒中的柠檬酸含量过高,亟需解决,目前山楂酒的化学降酸法研究报道较多,而利用生物降酸法降低柠檬酸含量的研究报道相对较少,王立芳等[17]研究获得一株陆生伊萨酵母(Isstchenkiaterricola),在苹果酸和柠檬酸为唯一碳源的培养基中可降解79.9%的苹果酸和73.1%的柠檬酸,但未继续探究菌株在果酒中的实际降酸效果。由于生物降酸避免了化学试剂的加入,在显著降低酸度的同时还可以部分改善果酒品质,符合消费者追求天然的、无添加剂的消费心理。本研究拟通过以柠檬酸为唯一碳源的培养基培养筛选可降解柠檬酸的菌株,旨在今后可以应用于发酵山楂酒降酸工艺。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
柠檬酸废水废渣样品:取自江苏省宜兴市一柠檬酸厂;
dNTP、琼脂糖等分子生物试剂:加拿大BBI公司;
其他试剂为国产分析纯;
YPD培养基:20 g葡萄糖,20 g鱼粉蛋白胨,20 g酵母提取物,自然pH,溶于1 L蒸馏水中;
WL培养基:酵母提取物4 g,胰蛋白胨5 g,葡萄糖50 g,磷酸氢二钾0.55 g,氯化钾0.425 g,氯化钙0.125 g,硫酸镁0.125 g,氯化铁0.002 5 g,硫酸锰0.002 5 g,溴甲酚绿0.022 g,pH 6.5,溶于1 L蒸馏水中;
柠檬酸液体培养基:酵母提取物2.5 g,鱼粉蛋白胨2.5 g,磷酸二氢钾 0.55 g,氯化钙 0.125 g,硫酸镁 0.125 g,硫酸锰0.002 5 g,柠檬酸12 g,pH 2.8,溶于1 L蒸馏水中。固体培养基则在上述配方基础上加入20 g/L的琼脂,121 ℃高压灭菌20 min[18]。
1.1.2 主要仪器设备
台式高速冷冻离心机:5810R型,德国 Eppendorf 公司;
恒温水浴锅:HH-S2型,江苏金坛市环宇科学仪器厂;
pH计:FE20k型,梅特勒-托利多仪器有限公司;
鼓风干燥箱:DGG-9240B型,上海森信实验仪器有限公司;
电子天平:EL3002型,梅特勒-托利多仪器(上海)有限公司;
立式压力蒸气灭菌锅:YXQ-LS-50SII型,上海博迅实业有限公司;
PCR仪:ProFlex型,美国 Life 公司;
电泳仪:DYY-6C型,北京六一仪器厂;
凝胶成像仪:Gel Doc XR型,美国伯乐公司;
紫外分光光度计:UV-2100型,尤尼科(上海)仪器有限公司。
1.2 方法
1.2.1 菌株的分离纯化
(1) 采样富集培养:从柠檬酸厂生产过程中采集废渣样品4份分别记为S1、S2、S3、S4,废水样品4份,分别记为L1、L2、L3、L4。取4份废渣样品各1 g,分别接入50 mL YPD培养基中,吸取废水样品各1 mL,分别接入50 mL YPD培养基中,放置于恒温摇床中培养48 h,培养条件30 ℃,摇床转速150 r/min。
(2) 柠檬酸培养基筛选培养:若菌株具有降解柠檬酸的能力,其在柠檬酸培养基中必定可以生长,吸取富集培养液2 mL,分别接种于50 mL柠檬酸培养基,放置于恒温摇床培养48 h,培养条件30 ℃,摇床转速150 r/min。
(3) 菌株的分离纯化培养:将8个锥形瓶中的菌液分别进行梯度稀释后涂布于WL平板培养基上,梯度稀释的比例分别为10-3,10-4,10-5,10-6,10-7。置于恒温培养箱中培养,培养条件30 ℃,48 h。挑取培养基上疑似酵母菌的菌株划线接种于平板培养基中,继续挑取单菌落重复平板划线培养。
1.2.2 菌株保藏 将菌株平板划线纯化培养2代后,挑取单菌落接入50 mL YPD液体培养基中,恒温摇床培养36 h,静置10 min,移液枪吸取1 mL培养基底部较浓菌液于规格为2 mL的甘油保藏管中,再加入已灭菌的30%甘油1 mL,旋紧管盖后振荡混匀,注明菌株名称和保藏日期,置于菌种保藏盒,上述操作均在超净台无菌完成。将菌种保藏盒放入-80 ℃超低温冰箱保藏。
1.2.3 降柠檬酸菌株筛选
(1) 菌株降柠檬酸能力试验:活化菌株接种于柠檬酸液体培养基,置于恒温培养箱中培养,培养条件30 ℃,培养时间5 d,培养结束后测定柠檬酸浓度,比较菌株降解柠檬酸能力。测定方法采用滴定法,以柠檬酸计。
(2) 菌株酒精耐受性试验:将活化好的种子液以4%的接种量接种于50 mL 含有5 g/L柠檬酸的YPD液体培养基中,分别加入无水乙醇,调整初始酒精体积分数为0%~10%,30 ℃培养5 d,利用紫外分光光度计在600 nm波长处测定吸光度,每组做3个平行样。
1.2.4 菌株形态学鉴定 对酵母菌进行平板培养及镜检,观察菌株形态学特征。
(1) 菌落培养特征:将菌株活化后挑取单菌落划线接种于YPD平板培养基,置于恒温培养箱中培养,培养条件30 ℃,培养时间2~3 d,观察平板培养基上菌落形态。
(2) 液体培养基培养特征:将菌株活化后挑取单菌落接种于50 mL YPD液体培养基,置于恒温摇床培养,培养温度30 ℃,摇床转速150 r/min,培养时间2~3 d,观察液体培养基中菌体培养状态。
(3) 细胞镜检:使用显微镜观察40×10倍下细胞形态。
1.2.5 菌株生理生化鉴定
(1) 糖发酵试验:鉴定所需发酵的碳源为葡萄糖、麦芽糖、乳糖、蔗糖、D-半乳糖。分别将碳源加入含有杜氏发酵管的氮源基础培养基中,添加量为0.5%,过滤除菌(0.20 μm)。活化菌株NS2后分别接入不同碳源培养基中,放置于恒温培养箱中培养,培养温度25 ℃,每2 d观察一次,连续观察2周,于4周后再次观察。主要观察杜氏小管中是否产生气体从而判断能否发酵该种碳源,若有气泡则记为阳性,若无气泡则记为阴性,每种碳源做3次重复[19]19[20]15。
(2) 碳源同化试验:葡萄糖、乳糖、蔗糖、D-半乳糖、可溶性淀粉、麦芽糖、甘油、甲醇、乙醇、肌醇、甘露醇、柠檬酸、琥珀酸15种碳源。分别将碳源加入氮源基础培养基中,添加量0.5%,另取一不添加碳源的基础培养基作为对照,过滤除菌(0.20 μm)。在YPD液体培养基中活化菌株NS2,取灭菌离心管,倒入培养液离心获得菌沉淀,离心条件10 000×g,5 min。以无菌水洗涤沉淀,重复2次,加入无菌水制得菌悬液。将菌悬液接种于上述培养基中,接种量5%,置于恒温培养箱中培养3周,培养温度25 ℃。每周观察一次,将试管振荡均匀仔细观察菌液是否浑浊,若浑浊则记为阳性,若澄清则记为阴性[19]18[20]15。
(3) 氮源同化试验:鉴定为硝酸钾、硝酸钠、硝酸铵、尿素,试验操作与碳源同化试验相同,因为pH值小于6时形成的亚硝酸对酵母存在毒性,因此调节初始pH至6.5[19]19[20]15-16。
1.2.6 菌株分子生物鉴定
(1) 菌株DNA提取:吸取1.5 mL菌液于2 mL EP管中,10 000×g离心10 min;收集沉淀,加2 mL ddH2O混悬均匀;10 000×g离心2 min,得菌沉淀,重复1次。用细胞破碎仪破碎,每破碎15 s后将EP管置于冰水浴60 s,重复5次。加1.5 mL ddH2O混悬均匀,10 000×g离心10 min,得菌沉淀。菌沉淀中加入0.5 mL DNA抽提液(100 mmol/L Tris-HCl pH 8.0,100 mmol/L EDTA,pH 8.0,100 mmol/L Na3PO4,1.5 mol/L NaCl)混悬,37 ℃条件下静置30 min;加入125 μL 10% SDS后,立即加入5 μL 蛋白酶K(浓度为20 mg/mL),混均后65 ℃水浴1 h,每隔15 min上下颠倒混均样品;加入700 μL CTAB缓冲液,混均后65 ℃水浴1 h,每隔15 min上下颠倒混均样品。
所得样品用等体积的氯仿—异戊醇(体积比24∶1)混均后于4 ℃条件下,12 000×g离心10 min,抽提2~3次;以0.6倍体积的异丙醇于-20 ℃沉淀1 h;4 ℃,12 000×g离心10 min,收集核酸沉淀;加入1 mL 70%的乙醇于4 ℃条件下,12 000×g离心10 min,洗涤沉淀2~3次,倒扣去除过量水分,于37 ℃干燥DNA约5 min;加50 μL ddH2O溶解沉淀,加入终浓度为0.5 μL/mL的RNA酶,并在37 ℃下水浴消化30~60 min,以去除RNA;得到的DNA样品置于-20 ℃ 冰箱保存备用。
(2) PCR检测方法:将得到的菌株DNA进行Touch down PCR扩增,对菌株的18S rDNA区进行PCR扩增,真菌采用张霞等[21]在相关研究中所使用的通用引物,上游引物为NS1:5’-GTAGTCATATGCTTGTCTC-3’,下游引物为NS8:5’-TCCGCAGGTTCACCTACGCGA-3’,扩增的片段大小约为1 700 bp。PCR体系为(50 μL):Taq PCR master mix 25 μL,上下引物各0.5 μL,模板2.5 μL,补无菌水至50 μL。相应 PCR 反应条件为:95 ℃预变性 5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min(Touch down PCR,10个循环,每个循环降低1 ℃);94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min(共20个循环);72 ℃终延伸7 min[22]。
(3) 电泳检测:接通电泳仪,设定电流45 mA,电压80 V,当指示染料前沿迁移至胶体的2/3处停止电泳,整个电泳持续约30 min,跑胶验证。
(4) PCR产物检测:将PCR产物送至南京金斯瑞生物技术有限公司测序,比对测序结果对微生物进行鉴定。
2 结果与分析
2.1 降柠檬酸酵母的筛选
2.1.1 降酸酵母菌的筛选与保藏 通过对柠檬酸厂废水废渣中菌株的富集培养,分离纯化,共得到可在柠檬酸培养基中生长的疑似酵母菌15株。按1.2.2中方法对这些菌株进行保藏。
2.1.2 降酸菌株在柠檬酸培养基中的筛选 配制柠檬酸液体培养基,以柠檬酸为唯一碳源培养菌株,筛选具有较强降柠檬酸能力的菌株,测得柠檬酸培养基中柠檬酸初始含量为11.3 g/L。对15株保藏菌株进行平板活化,另取两株商业酿酒酵母菌作为对照。挑取平板单菌落接入50 mL YPD液体培养基中培养,获得种子培养基,将种子培养基接入柠檬酸培养基,接种量4%。恒温摇床培养5 d,培养条件30 ℃,150 r/min。发酵结束后培养基的残余柠檬酸含量见图1。
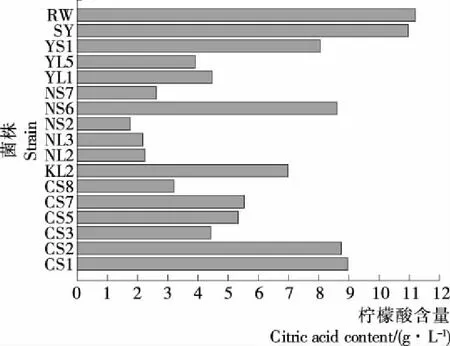
图1 菌株的柠檬酸降解能力Figure 1 The capability of reducing citric acid
由图1可知,各个菌株的降柠檬酸能力强弱不一。菌株NS2、NS7、NL2、NL3、CS8具有较强的柠檬酸降解能力,发酵5 d后可降解培养基中70%以上的柠檬酸,其余菌株的降柠檬酸能力相对较弱,而商业酿酒酵母菌RW和SY在该条件下生长受到明显抑制,难以降解利用柠檬酸。其中菌株NS2的降柠檬酸能力最强,在发酵5 d后柠檬酸含量从11.2 g/L 下降到1.76 g/L,降解培养基中约84%的柠檬酸,对降柠檬酸能力较强的菌株NS2、NS7、NL2、NL3、CS8进行进一步研究。
2.2 菌株酒精耐受性试验
由于菌株需应用于山楂酒酿造中,因此需要对菌株的酒精耐受性进行试验,确定菌株的酒精耐受能力后选取具有较强酒精耐受性的菌株,将其应用于山楂酒酿造的适当阶段。
由图2可知,5株菌株对酒精耐受性有所差异。在酒精度为0%vol时,5株菌的生长情况均良好,但随着酒精度的升高,菌液浓度逐渐下降。酒精度在1%~4%vol时,5株菌均可以生长,其中NS2酒精耐受能力最强,NL2次之,这两株菌生长情况良好,其余3株菌的生长则受到明显抑制。当酒精度上升到5%vol时,5株菌的菌液浓度均处在较低水平,当酒精度达到6%vol时,菌株都已经难以生长。可以看出菌株NS2、NL2的酒精耐受能力相对较强,可以耐受0%~4%vol的酒精度。初步判断这5株菌均非酿酒酵母,选取酒精耐受能力相对较强的NS2、NL2进行培养观察鉴定。
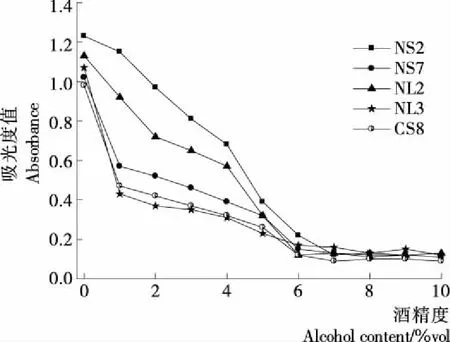
图2 菌株酒精度耐受性测试结果Figure 2 The stress resistance of ethanol
2.3 菌株形态学鉴定
酵母菌的菌落培养特征与个体形态特征,是酵母菌种鉴定的重要依据之一[23]7-8。
2.3.1 菌落培养特征 菌株NS2的菌落大而厚,表面不光滑,具有细微褶皱,菌落边缘呈细小的锯齿状;菌落颜色呈乳白色,正反面及内外颜色一致;易用针挑起,菌落质地均匀。菌株NL2的菌落呈圆形,大且中间略有凸起,菌落边缘呈锯齿状,颜色呈白色,质地均匀。
2.3.2 液体培养基培养特征 两株菌的菌液均明显浑浊,静置后表面均形成一层较薄的白色醭膜。
2.3.3 个体形态特征 对菌株进行40×10倍显微镜镜检,镜检结果见图3。

图3 菌株NS2、NL2的细胞形态Figure 3 The Cell morphology ( × 400) of the strain NS2 and NL2
菌株NS2的细胞形态为椭圆形,细胞大小(长×宽)约为 3.0~4.5 μm×3.5~6.0 μm;菌株NL2的细胞形态为圆形,细胞大小(长×宽)约为4~5 μm×4~5 μm。
2.4 菌株生理生化试验
2.4.1 糖发酵试验结果 一半以上的酵母菌在半厌氧条件下至少可以发酵D-葡萄糖,若菌株可以利用该化合物,则菌株可以通过无氧机制对糖类化合物进行分解代谢,释放气体。通过寻找收集形成的CO2气体可以鉴定菌株对该发酵糖的利用能力[23]25-26。菌株NS2、NL2的糖发酵试验结果见表1。

表1 糖发酵试验结果†Table 1 The ability of the strains to ferment sugars
† “+”表示阳性,“-”表示阴性。
2.4.2 碳源同化试验 不同酵母菌对某种有机化合物作为单一碳源的利用能力存在差异,通过这些差异可以在一定程度上区分不同酵母菌。这些化合物包括糖类、多羟糖醇和有机酸类。碳源同化试验即为鉴定酵母菌在好氧环境下利用这些化合物的能力[23]20-24。菌株NS2、NL2碳源同化试验结果见表2。
2.4.3 氮源同化试验 有研究[23]24-25发现大约有1/4的酵母菌可以利用硝酸盐及其他含氮化合物,因此氮源同化试验对于鉴定酵母具有重要的应用价值。菌株NS2、NL2的氮源同化试验见表3。

表2 碳源同化试验†Table 2 Carbon Assimilation of the strains
† “+”表示阳性,“-”表示阴性。

表3 氮源同化试验†Table 3 Nitrogen Assimilation of the strains
† “+”表示阳性,“-”表示阴性。
综合以上试验结果对菌株NS2、NL2的形态学特征及生理生化进行分析比对,对照文献[23]34-44中对于酵母菌的描述,菌株NS2符合毕赤酵母菌的生理生化及形态学特征,菌株NL2符合热带假丝酵母的生理生化及形态学特征,因此初步判断这两株菌分别为毕赤酵母菌、热带假丝酵母菌。
2.5 菌株分子生物学鉴定
按1.2.6中方法提取菌株的DNA,进行18S rDNA PCR扩增,电泳图见图4,两株菌的PCR产物均在1 700 bp处有明亮条带,判断得到的产物为目的产物。
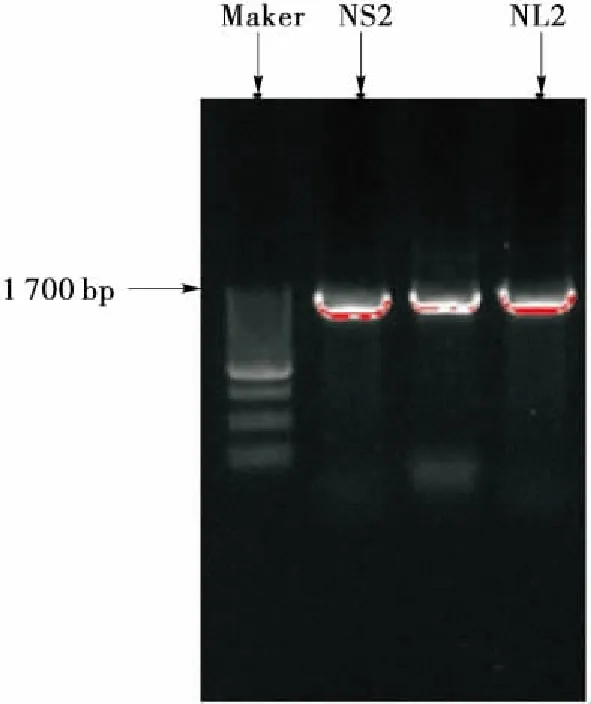
图4 菌株NS2和NL2的18S rDNA PCR扩增电泳图Figure 4 Result of 18S rDNA PCR amplify of NS2 and NL2
将扩增产物送至金斯瑞公司测序,NS2、NL2的测序结果见附录1。菌株NS2、NL2经PCR扩增获得的18S rDNA序列全长为1 700 bp左右,在NCBI中BLAST比对进行序列同源性分析,菌株NS2的18S序列与Pichiasp.的18S序列同源性最高,相似性达99%。根据18S序列使用MAGE软件的Neighbor-Joining法构建系统发育树,见图5。由图5可知,NS2与库德里阿兹威毕赤酵母(Pichiakudriavzevii)亲缘关系最近,同源性极高,因此将菌株NS2鉴定为Pichiakudriavzevii。
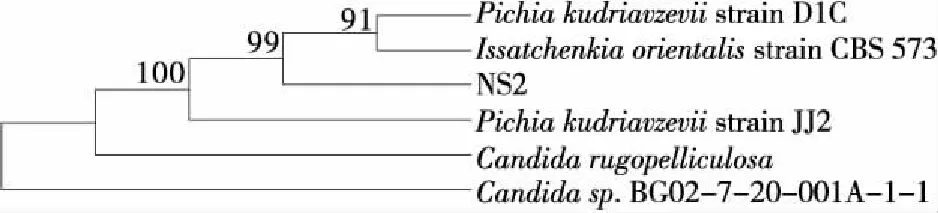
图5 基于菌株NS2的18S rDNA序列同源性构建 的系统发育树Figure 5 Phylogenetic tree of NS2 based on 18S rDNA sequences
菌株NL2的18S序列与Candidasp.的18S序列同源性最高,相似性达99%。根据18S序列使用MAGE软件的Neighbor-Joining法构建系统发育树,见图6。由图6可知,NL2与热带假丝酵母(Candidatropicalis)亲缘关系最近,同源性极高,因此将菌株NL2鉴定为Candidatropicalis。
3 结论
本研究从柠檬酸废水废渣中分离培养纯化获得15株耐柠檬酸菌株,测定降柠檬酸能力发现其中5株菌株具有较强的降柠檬酸能力,发酵5 d后柠檬酸含量从11.3 g/L下降到1.8~2.8 g/L,降解了培养基中70%以上的柠檬酸。测试这5株菌的酒精耐受性,发现菌株NS2和NL2的酒精耐受能力相对较强,最高可以耐受4%vol的酒精度,可以考虑将其应用于山楂酒酿造初期阶段。对这两株菌进行形态学观察和生理生化性质分析,结合分子生物学手段初步鉴定菌株NS2为Pichiakudriavzevii,菌株NL2为Candidatropicalis,为今后研究生物降酸法降低山楂酒中柠檬酸提供了理论支持。

图6 基于菌株NL2的18S rDNA序列同源性构建的 系统发育树Figure 6 Phylogenetic tree of NL2 based on 18S rDNA sequences
[1] ZHU Ru-gang, SUN Yan-di, LI Tuo-ping, et al. Comparative effects of hawthorn (Crataegus pinnatifida Bunge) pectin and pectin hydrolyzates on the cholesterol homeostasis of hamsters fed high-cholesterol diets[J]. Chemico-Biological Interactions, 2015, 238: 42-47.
[2] 文连奎, 赵薇, 张微, 等. 果酒降酸技术研究进展[J]. 食品科学, 2010, 31(11): 325-328.
[3] 张方艳, 蒲彪, 陈安均. 果酒降酸方法的研究现状[J]. 食品工业科技, 2014, 35(1): 390-393.
[4] 莫燕霞, 殷居易, 顾晓俊, 等. 葡萄酒有机酸研究现状及应用展望[J]. 食品工业科技, 2015, 36(6): 380-384.
[5] 孙慧烨. 不同方法降解苹果酒中有机酸的比较和优化[D]. 杨凌: 西北农林科技大学, 2015: 13-14.
[6] 梁国伟, 徐亮, 张宝荣, 等. 山楂酒酿造工艺研究及山楂酒中有机酸的HPLC测定[J]. 酿酒科技, 2009(7): 106-108.
[7] 胡楠, 刘晓兰, 郑喜群, 等. 发酵型五味子果酒离子交换树脂降酸工艺研究[J]. 食品与机械, 2013, 29(5): 29-32.
[8] VERA E, RUALES J, DORNIER M, et al. Deacidification of clarified passion fruit juice using different configurations of electrodialysis[J]. Journal of Chemical Technology & Biotechno-logy, 2003, 78(8): 918-925.
[9] FIDALEO M, MORESI M. Electrodialysis Applications in The Food Industry[J]. Advances in Food & Nutrition Research, 2006, 51(51): 265-360.
[10] VERA E, RUALES J, DORNIER M, et al. Comparison of different methods for deacidification of clarified passion fruit juice[J]. Journal of Food Engineering, 2003, 59(4): 361-367.
[11] VILJAKAINEN S K, LAAKSO S V. The use of malolactic Oenococcus oeni (ATCC 39401) for deacidification of media containing glucose, malic acid and citric acid[J]. European Food Research and Technology, 2000, 211(6): 438-442.
[12] 陈继峰, 杨美容, 李绍华. 葡萄酒酿造过程中调酸方法研究[J]. 酿酒, 2005, 32(1): 35-39.
[13] 季建生. 干型杨梅果酒降酸的研究[J]. 酿酒科技, 2008(7): 73-75.
[14] 赵燕, 任美燕, 李帅. 猕猴桃果酒降酸研究[J]. 粮食科技与经济, 2012, 37(1): 55-57.
[15] MILLER B J, FRANZ C M, CHO G S, et al. Expression of the malolactic enzyme gene (mle) from Lactobacillus plantarum under winemaking conditions[J]. Current Microbiology, 2011, 62(6): 1 682-1 688.
[16] GAO Chong-xiao, FLEET G H. The degradation of malic acid by high density cell suspensions of Leuconostoc oenos[J]. Journal of Applied Microbiology, 2010, 76(6): 632-637.
[17] 王立芳. 一株可降解L-苹果酸和柠檬酸菌株的鉴定及降解特性研究[D]. 长春: 吉林农业大学, 2011: 37-38.
[18] MAIO S D, POLIZZOTTO G, PLANETA D, et al. A method to discriminate between the Candida stellata and Saccharomyces cerevisiae in mixed fermentation on WLD and lysine agar media[J]. South African Journal for Enology & Viticulture, 2011, 32(1): 35-41.
[19] 薛军侠. 酿酒酵母的筛选鉴定及耐受性初步研究[D]. 杨凌: 西北农林科技大学, 2007.
[20] 韩阳. 高产酒精酵母的筛选鉴定及生长和发酵特性研究[D]. 哈尔滨: 哈尔滨工业大学, 2007.
[21] 张霞, 武志芳, 张胜潮, 等. 贵州浓香型白酒大曲中霉菌的18S rDNA系统发育分析[J]. 应用与环境生物学报, 2011, 17(3): 334-337.
[22] 薛景波. 黄酒接种生麦曲微生物群落结构及分离培养微生物的产酶、产香性质分析[D]. 无锡: 江南大学, 2016: 12-13.
[23] 巴尼特. 酵母菌的特征与鉴定手册[M]. 青岛: 青岛海洋大学出版社, 1991.
Study on isolation and identification of reducing citric acid strains
ZHANGDuo1,2,3
MAOYong4
MAOJian1,2,3,5,6
LIUShuang-ping1,2,3,5,6
ZHOUZhi-lei1,2,3,5,6
(1.NationalEngineeringLaboratoryforCerealFermentationTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 2.SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 3.SynergeticInnovationCenterofFoodSafetyandNutrition,JiangnanUniversity,Wuxi,Jiangsu214122,China; 4.ChinaAlcoholicDrinksAssociation,Beijing100831,China; 5.NationalEngineeringResearchCenterofChineseRiceWine,Shaoxing,Zhejiang312000,China; 6.JiangnanUniversityandRugaoInstituteofFoodTechnology,Rugao,Jiangsu225004,China)
In order to screen the strains which have the capability of reducing the citric acid, 15 strains of yeasts were isolated from the materials of waste water and waste residue. The waste water and residue were collected in the citric acid factory. The yeasts were screened based on the capability of fermenting the citric acid. It was found that the 5 strains had good capability of reducing the citric acid. They could reduce at least 70% citric acid of the culture medium after 5 d fermentation. The 5 strains were tested the stress resistance of ethanol. The strain NS2 and NL2 have strong stress resistance. The morphological and physiology characteristics of NS2 and NL2 were measured by microscopic observation, assimilation of carbon and nitrogen. Then the two strains were identified by 18S rDNA sequencing and the phylogenetic analysis. In the end, NS2 was identified asPichiakudriavzevii, NL2 was identified asCandidatropicalis. They can be used in the technology of acid reduction in the hawthorn wine in the future.
Yeast; Acid Reduction;Pichia; Screen; Sequencing; Identification
国家自然科学基金-面上项目(编号:31571823);江苏省自然科学基金-面上研究项目(编号: BK20161293);2015年度区科技重点研发计划项目(镇江市丹徒区,编号:NY2015009)
张铎,男,江南大学在读硕士研究生。
毛健(1970—),男,江南大学教授,博士研究生导师,博士。E-mail:maojian@jiangnan.edu.cn
2017—03—10
10.13652/j.issn.1003-5788.2017.05.001

