4组沙漠绿藻分子生物学鉴定及其生物学特性研究
卡丽比努尔·艾依提
艾山江1,2
努尔古丽·热合曼1,2
(1. 新疆师范大学生命科学学院,新疆 乌鲁木齐 830054;2. 新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐 830054)
4组沙漠绿藻分子生物学鉴定及其生物学特性研究
卡丽比努尔·艾依提1,2
艾山江1,2
努尔古丽·热合曼1,2
(1. 新疆师范大学生命科学学院,新疆 乌鲁木齐 830054;2. 新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐 830054)
对从塔克拉玛干沙漠中分离的4组沙漠绿藻进行形态特征鉴定,绘制生长曲线,考察pH对其生长的影响,并进行系统发育分析。形态特征结果显示a组为椭圆形藻,b、c和d组为球状藻。a组沙漠藻最适pH值为6.0,c组的最适pH值以原BG-11培养基为准,b和d组最适pH值为8.0。采用分子生物学18S rDNA序列分析法鉴定出代表性4株沙漠藻的基因序列,结果表明:a组的3YS16①和c组3YS21-1的序列跟Chlamydomonasincerta亲缘关系很近;b组的 KXII(2)序列跟Chlorosarcinopsisbastropiensis亲缘关系很近;d组的YS2-3的序列跟Chlorosarcinopsiscommunis亲缘关系很近。该研究确定了4组藻的分类地位和最佳生长pH条件,可为沙漠绿藻分子生物学和食品应用方面的研究提供理论依据。
沙漠绿藻;18S rDNA;形态特性
新疆塔克拉玛干沙漠作为典型的内陆干旱地区沙漠,是中国最大的沙漠,也是世界第二大流动沙漠[1]。藻类在世界荒漠地区广泛分布,是荒漠、半荒漠系统的生物结皮先行者[2]。生物结皮主要包括蓝藻、绿藻、衣藻、苔藓及微小节肢动物等[3-4]。结皮在沙漠中对固定土壤和养分循环发挥着重要的作用,也是固沙的首要标志[5]。沙漠绿藻通过光合作用为土壤提供碳源和有机质[6],还随着藻细胞数量的增加,藻结皮转化为地衣结皮。张建成[7]、李芳芳[8]等通过藻细胞形态观察和分子生物学等方法对古尔班通古特沙漠结皮藻类进行研究,发现沙漠中有小球藻、衣藻、克里藻等藻种。目前关于塔克拉玛干沙漠结皮藻类的研究较少,依里夏提等[5]对塔克拉玛干沙漠藻进行分子生物学鉴定,发现沙漠中存在衣藻、丝状藻、绿藻等藻种。
绿藻除对生物结皮有重要的作用以外,还因富含生长因子(CGF)、碱性多糖、不饱和脂肪酸、膳食纤维等成分得到了广泛关注。随着人们对高品质生活及对绿色健康食品的追求,藻类保健也逐渐得到开发[9]。绿藻含有多种维生素、胡萝卜素、烟碱酸、泛酸、叶酸、叶绿素(约3%)、蛋白质(约60%)、纤维等,是维持健康和养颜相当理想的健康食品,被称为“21世纪最佳食品”[10]。
目前关于藻类研究主要集中于海洋藻和淡水藻[11-13],塔克拉玛干沙漠藻类的研究和其食品应用的相关报道尚未见。本研究运用形态学观察、分子鉴定,研究其生物学特性及沙漠藻生长最适pH,为塔克拉玛干沙漠藻类在分子生物学和后续藻类保健品应用方面提供基础性理论依据。
1 材料与方法
1.1 土壤样品
从新疆塔克拉玛干沙漠采集,提供单位:新疆叶希丽生物科技有限公司。
1.2 培养基
藻种用的BG-11培养基:K2HPO4· 3H2O 0.04 g/L,NaNO31.5 g/L,MgSO4· 7 H2O 0.075 g/L,柠檬酸铁铵 0.006 g/L,CaCl2· 2 H2O 0.036 g/L,柠檬酸0.006 g/L,EDTANa20.001 g/L,Na2CO30.02 g/L,H3BO32.86 g/L,MnCl4· 4H2O 1.81 g/L,ZnSO4·7H2O 0.222 g/L,Na2MoO4·2H2O 0.39 g/L,CuSO4·5H2O 0.079 g/L,Co(NO3)2·6H2O 0.049 g/L。
1.3 主要仪器
超净工作台:Boxun SW-CJ-2FD型,昆山广测仪器设备有限公司;
成像仪:ChampGel6000型,北京赛智创业科技有限公司;
PCR仪:PEQSTAR型,德国Peqlab公司;
台式冷冻离心机:SIGMA 3K30型,德国Sigma公司;
制冰机:SIM-F140AY65-PC型,日本上海公司;
紫外/可见分光光度计:4802UV/VIS型,上海龙尼柯仪器有限公司;
智能人工气候箱:RTOP-260Y型,浙江托普仪器有限公色;
pH计:pH-220型,厦门国岛科技有限公司。
1.4 方法
1.4.1 藻种的培养与分离 称取30 g沙样置于盛有100 mL BG-11培养基的三角瓶中静置培养,温度30 ℃,光照强度 2 500 Lx,光暗比为14∶10。光照培养设置为两个工作段:6:00~20:00,光强 2 500 Lx;20:00~6:00,光强 0 Lx,培养2周后,采用稀释涂布法进行纯化,定期观察藻液,并用光学显微镜拍照记录。
1.4.2 光学显微镜观察 处于生长周期的藻细胞,用倒置显微镜观察并拍照。
1.4.3 扫描电镜观察 采用Hohn等[14]的方法,收集对数生长期的藻细胞,用10 000 r/min离心10 min,弃上清液,加入PBS缓冲液清洗2遍,4%的戊二醛固定,依次用50%,70%,80%,90%,100%叔丁醇逐级脱水,采用冷冻干燥仪干燥5 min,真空喷金,扫描电镜下拍照观察。
1.4.4 藻株生长曲线的绘制 取5 mL处于指数生长期的藻液,置于盛有200 mL灭菌BG-11培养基的三角瓶中,在温度为30 ℃,光照强度 2 500 Lx,光暗比为14∶10,光照培养设置为两个工作段:6:00~20:00,光强 2 500 Lx;20:00~6:00,光强 0 Lx,培养1个月,做3个重复,且每2 d于680 nm[15]下测定吸光度。
1.4.5 pH对沙漠藻生长的影响 取5 mL处于指数生长期的藻液,加入pH值为 6.0,7.0,8.0(用0.1 mol/L HCl 和0.1 mol/L NaOH 调节)的BG-11液体培养基中,原培养基(pH为自然)为对照组,培养2周,做3个重复,且每24 h于680 nm下测定吸光度值。每天早晚将培养瓶振动一次,防止藻细胞贴壁生长。
1.4.6 基因组DNA的提取 用天根植物基因组DNA提取试剂盒提取DNA。
1.4.7 PCR扩增 用于真核绿藻18SrRNA基因的上游引物MA1(5`-CGGGATCCGTAGTCATATGCTTGTCTC-3`)和下游引物MA2(5`-CGGAATTCCTTCTGCAGGTTCACC-3`)[16],由上海生工生物技术有限公司进行合成;PCR反应体系为25 μL,dd H2O 8.5 μL,上下引物各0.5 μL,DNA模板3 μL,2×TAP PCR Master Mix (TIANGEN) 12.5 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,30个循环;72 ℃延伸10 min,4 ℃保存。PCR产物经1%(1×TAE)琼脂糖凝胶电泳检测后,观察并成像[17]。扩增产物由上海生工生物技术有限公司进行测序。
1.4.8 系统发育树分析 测序结果与NCBI已知的数据库进行比较,并用Genetyx软件进行多重序列对齐排列比较,通过MEGA 7.0软件邻接(NJ)法绘制系统发育树,基于Kimura2-Prameter方法计算遗传距离值,计算Bootstrap值,重复1 000次[18]。
2 结果与分析
2.1 4组沙漠藻的光学显微镜观察结果
按颜色、形状、大小将分离纯化的藻类分为a、b、c、d 4个组,其形态结构见图1。其中a组的细胞形态为绿色、黏稠、油性、细胞呈椭圆形、细胞比较小;b组的黄色、干燥、难挑取、细胞呈球状、细胞偏大;c组的绿色,油性,细胞形态为球状;d组的偏黄色、干燥、难挑取、细胞接近球状。
2.2 4组沙漠藻的扫描电镜观察
由图2可知,a和c组是正处于分裂期的藻细胞,a组为椭圆形藻;b组为球状藻,表面光滑;c组为球状藻,表面粗糙;d组的形状接近球状。
通过光学显微镜和扫描电镜观察结果表明4组沙漠藻的形态结构与李芳芳等[19]和龚春霞等[20]从古尔班通古特沙漠和塔克拉玛干沙漠分离纯化和分子鉴定的藻种形态不一致,说明因地理位置的差异也能导致藻类形态的多样性。对比徐娜等[21]分离纯化的海洋微藻有很大的区别,应该是新疆塔克拉玛干沙漠气候干旱、降水量少、温度高、蒸发量高等原因形成的特殊形态结构。

图1 4组沙漠藻细胞的光学显微镜观察照片
Figure 1 Morphological observations of four groups Desert algae cells under optical microscope (×40)

图2 4组沙漠藻细胞的扫描电镜照片
Figure 2 Morphological observations of four groups Desert algae cells under electron microscope
2.3 4组沙漠藻的生长曲线
在培养初期藻体数量随时间变化不大;进入对数生长期后,生长速率迅速增加[22],藻液也由浅绿色变为暗绿色;进入衰亡期后,藻体逐渐死亡并下沉,藻液颜色开始变黄,最后至无色、腐烂。
由图3可知,a组藻类的适应期较短,第3天进入对数生长期,第25天进入稳定期;b组前3 d是适应期,第4天进入对数生长期,第21天进入稳定期;c组的适应期也短,第3天进入对数生长期,第23天进入稳定期;d组的适应期最短,第2天进入对数生长期,第25天进入稳定期。比较4组藻的生长情况均表现出较长的生长周期,1个月内均没有进入衰亡期,a和c组生长最好,b组生长不好;d组的适应期最短,对数生长期最长。
通过生长曲线结果可知,4组沙漠藻培养期间表现出对数生长期长,不易发生腐烂等特性,因此藻种在塔克拉玛干沙漠长期得以生存下来。
2.4 pH对4组沙漠藻生长的影响
由图4可知,a组藻类前8 d在pH 8.0的培养基上生长较好,从第9天开始pH 6.0和pH 7.0的生长明显优于对照组,14 d开始pH 6.0的生长占优势,表明沙漠藻a组的适应pH为6.0~7.0。比较生长速率表明pH 6.0>对照组>pH 7.0>pH 8.0,得出a组藻类最适生长pH为6.0,说明a组沙漠藻适合生长在酸性环境。

图3 4组沙漠藻的生长曲线Figure 3 Growth curve of four groups Desert algae

图4 pH对a组沙漠藻生长的影响Figure 4 Effects of pH on the growth of group a
由图5可知,前9 d藻细胞在3种培养基上的生长与对照组没有明显的差异,但从第10天开始藻在pH值为8.0培养基上生长速度大于其它pH水平。比较生长速率表明pH 8.0>pH 6.0>对照组>pH 7.0,可知b组藻类最适生长pH为8.0,说明b组沙漠藻适合生长在碱性环境。

图5 pH对b组沙漠藻生长的影响Figure 5 Effects of pH on the growth of group b
由图6可知,第10天pH 7.0和pH 8.0的藻细胞的生长与对照组接近;第12天后pH 8.0的生长开始变缓,pH 6.0和pH 7.0的生长开始增长但生长速率小于对照组。比较生长速率表明对照组>pH 6.0>pH 7.0>pH 8.0,可知c组藻类最适生长pH为原培养基(pH 为自然),说明c组沙漠藻适合生长在酸性环境。
由图7可知,第6天藻细胞在3种pH值的培养基中生长情况没有明显的差异,第8天开始pH 8.0和pH 6.0培养基的生长明显增长,但藻细胞在pH 6.0培养基的生长小于pH 8.0,比较生长速率表明pH 8.0>pH 6.0>对照组>pH 7.0,可知d组沙漠藻类最适生长pH为8.0,说明d组沙漠藻适合碱性环境。

图6 pH对c组沙漠藻生长的影响Figure 6 Effects of pH on the growth of group c
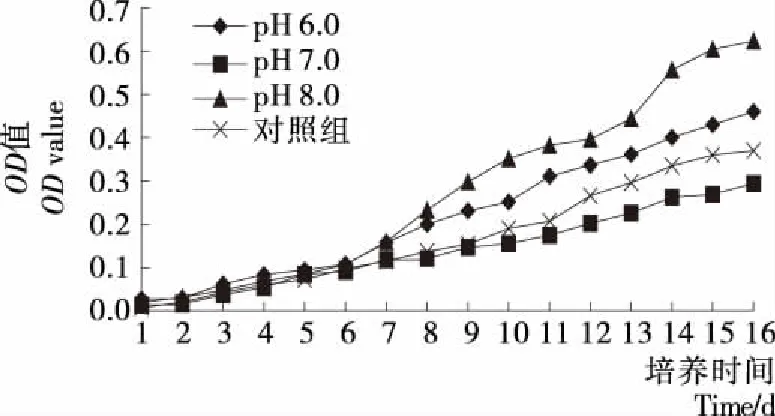
图7 pH对d组沙漠藻生长的影响Figure 7 Effects of pH on the growth of group d
培养基的 pH是直接影响藻类生长代谢等许多生理过程的重要因子,会影响藻类光合作用和呼吸作用,并影响培养基中藻细胞对离子的吸收和利用以及对代谢产物的利用[23],每一种藻类都有它自身适合的pH范围,改变pH值会影响藻类的生长和光合作用[24],沙漠藻a和c组在pH 5.0~6.0条件下生长最好,说明具有较好耐酸能力。b和d组在pH 8.0环境下生长最好,具有耐碱能力,可能是与培养液中盐类有关,这些盐类能使沙漠藻生长所需的pH 环境维持时间延长,利于细胞维持较好的分裂速度。袁丽娜等[25]研究表明:低pH值不利于藻生长,而在一定范围内,较高的pH值仍能促进藻细胞增殖;赵娜等[26-27]研究结果表明:小球藻的最适生长pH 为7.0,而斜生栅藻的最适生长pH值为 9.0。可知藻类生长环境酸性或碱性太强都会对藻细胞生长有伤害,只有在适宜的酸碱度范围内,才能正常生长繁殖。
2.5 4株沙漠藻的18S rDNA序列分析
对具代表性的4株沙漠藻3YS16①(a组)、KXII(2)(b组)、3YS21-1(c组)和YS2-3(d组)进行18S rDNA序列分析,扩增出长度分别为1 726,1 712,1 708,1 723 bp(图8)的基因片段。
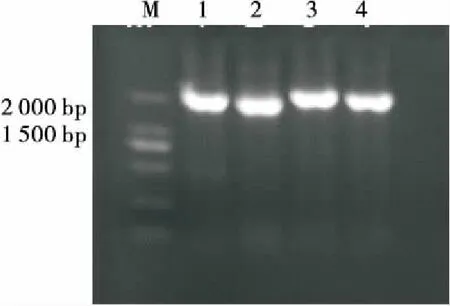
1. 3YS16①(a组) 2. KXII(2)(b组) 3. 3YS21-1(c组) 4. YS2-3(d组)
图8 4株代表性沙漠藻的18S rDNA PCR电泳图
Figure 8 Electrophoresis of PCR products 18S rDNA four Representative strains of Desert algae
NCBI中BLAST结果表明,3YS16①和3YS21-1的序列与GenBank上的Chlamydomonasincerta(KR349061.1)的同源性高,相似率达99%,比对序列中有2个碱基不同。由图9可以看出3YS16①和3YS21-1跟衣藻属聚簇成一支,跟Chlamydomonasincerta(KR349061.1)的节点支持率为95,遗传距离值为0.00,说明3YS16①和3YS21-1与Chlamydomonasincerta(KR349061.1)亲缘关系很近。扩增得到的YS2-3的序列与GenBank上的Chlorosarcinopsiscommunis(AB218705.1)同源性高,相似率为97%,比对序列中有50个碱基不同,YS2-3与Chlorosarcinopsis聚簇成一支,与Chlorosarcinopsiscommunis(AB218705.1)的节点支持率为100,遗传距离为0.00,说明YS2-3与Chlorosarcinopsiscommunis(AB218705.1)的亲缘关系很近。扩增得到的KXII(2)的序列与GenBank上属于绿囊藻目的Chlorosarcinopsisbastropiensis(AB218703.1)同源性高,相似率达99%,比对序列中有14个碱基不同,KXII(2)与Chlorosarcinopsis聚簇成一支,与Chlorosarcinopsisbastropiensis(AB218703.1)的节点支持率为100,遗传距离值为0.00,说明亲缘关系很近,沙漠藻KXII(2)属于Chlorosarcinopsisbastropiensis。

图9 4株代表性沙漠绿藻的18S rDNA序列的系统发育树Figure 9 Phylogenetic Tree based on 18S rDNA Sequencing of Four Representative Desert Algae
鉴定藻的传统方法是通过观察藻细胞形态进行鉴定,但由于藻类的生长范围广,且生活史复杂导致相同的藻细胞形态不一样,所以鉴定误差较大。基于 18S rRNA基因序列进行藻类鉴定已经有广泛的报道[28-31]。李芳芳[17]、龚春霞[19]等应用18S rRNA基因分子鉴定和形态学结合进行鉴定。研究结果表明:a组的3YS16①和c组的3YS21-1属于衣藻。这个跟龚春霞等[32]从塔克拉玛干沙漠分离鉴定出来的结果一致。b组的KXII(2)和d组的YS2-3属于绿囊藻目的Chlorosarcinopsisbastropiensis和Chlorosarcinopsiscommunis。本试验结果与Lewis等[33]报道沙漠中的绿藻主要包含3大类群,绿藻纲、共球藻纲和轮藻纲吻合。
3 结论
目前中国对沙漠藻类的研究,主要以形态观察为主,此方法需要丰富的分类经验,对有些形态结构简单、外部形态特征不明显的种类鉴定困难。本试验利用分子生物学鉴定及生物学特性研究4组沙漠绿藻。结果表明,4组沙漠藻属于衣藻和绿囊藻,具有较好的耐酸、耐碱、耐高温、生长周期长且不容易腐烂等生物学特性。这些生物学特性将赐予这些藻类在沙漠干旱环境中能生存的能力。为了将沙漠藻应用于生物结皮和食品方面,其光强度和温度对藻类生长的影响和藻类食品安全方面需要进一步研究。
[1] SMITH S M, ABED R M M, GARCIA PICHEL F, et al. Biological soil crusts of sand dunes In cape cod national seashore Massachusetts, USA[J]. Microbial Ecology, 2004, 48: 200-208.
[2] HAWKES C V, FLECHTNER V R. Biological soil crosts In a Xeric Florlda Shrubland: composition, abundance, and spatial heterogeneity of crusts with different disturbance histories[J]. Microbial Ecology, 2002, 43(1): 1-12.
[3] 王静, 林向阳, 李麒龙, 等. 环保型微藻絮凝剂的制备及应用[J]. 食品与机械, 2014, 30(2): 206-210.
[4] 唐翱. SY绿藻产品推广项目营销策略研究[D]. 成都: 西南交通大学, 2006: 14-15.
[5] 依里夏提·地里夏提, 艾山江, 吾甫尔·米吉提. 3株塔克拉玛干沙漠藻的分子鉴定与分析[J]. 安徽农业科学, 2015, 43(18): 41-44, 48.
[6] 李芳芳, 隋正红, 龚春霞. 5种沙漠微藻的分离鉴定及其18S rDNA保守区片段差异分析[J]. 石河子大学学报: 自然科学版, 2012, 30(3): 265-270.
[7] 赵建成, 张丙昌, 张元明. 新疆古尔班通古特沙漠生物结皮绿藻研究[J]. 干旱区研究, 2006, 23(2): 189-194.
[8] 李芳芳, 隋正红, 龚春霞, 等. 5种沙漠微藻的分离鉴定及其18S rDNA保守区片段差异分析[J]. 石河子大学学报: 自科版, 2012, 30(3): 265-270.
[9] SHIELDS L M, DURREL LW. Algae in relation to soil fertility[J]. The Botanica Review, 1964, 30(1): 92-128.
[10] EVANS C T, RATLEDGE C. Influence of nitrogen metabolism of lipid accumulation by rhodosporidium tor loides CBS14[J]. Journal of General Microbiology, 1984, 130(7): 1 704-1 705.
[11] 林玉艳. 一株海洋微藻的分离鉴定及环境因素对其生长的影响[D]. 青岛: 中国海洋大学, 2015.
[12] 刘欣, 姚卫蓉. 藻类食品卫生指标解析[J]. 食品科技, 2013(12): 299-303.
[13] 吉宏武, 赵素芬. 南海3种可食绿藻化学成分及其营养评价[J]. 广东海洋大学学报, 2005, 25(3): 19-23.
[14] HOHN S, HALLMANN A.There is more than one way to turn aspherical cellular monolayer inside out: Type B embryo inversion in Voluox globator[J]. Biomedcentral, 2011, 29(9): 89.
[15] 周楠. 水体中微囊藻毒素的分析提纯及去除实验研究[D]. 哈尔滨: 哈尔滨工业大学, 2009: 31.
[16] OLMOS J, PANIAGUA J, CONTRERAS R. Molecular identication ofDunaliellasp. utilizing the 18S rDNA gene[J]. Letters in Applied Microbiology, 2000, 30: 80-84.
[17] 卢梦瑶, 刘书亮, 胡凯弟, 等. 酵素中一株高产酸醋酸菌的鉴定及其产酸特性[J]. 食品与机械, 2016, 32(12): 64-69, 114.
[18] KUMAR S, NEI M, DUDLEY J, et al. MEGA: A biologistcentric software for evolutionary analysis of DNA and protein sequences[J]. Briefings in Bioinformatics, 2008, 9(4): 299-306.
[19] 李芳芳, 隋正红, 周伟. 两种沙漠微藻的形态学和分子生物学鉴定[J]. 干旱区资源与环境, 2013(3): 167-172.
[20] 龚春霞, 王丹, 苟亚峰. 4株沙漠土壤衣藻的分离培养及形态和分子鉴定[J]. 石河子大学学报: 自然科学版, 2013, 31(3): 294-300.
[21] 徐娜, 逄少军. 三种海洋浮游微藻的分子鉴定及培养条件研究[J]. 海洋科学, 2012, 36(10): 13-25.
[22] 尹乐斌, 张臣飞, 孙菁, 等. 一株产细菌素乳酸菌的分离、鉴定及生物学特性研究[J]. 食品与机械, 2016, 32(3): 12-15, 64.
[23] 王雪青, 赵培, 胡萍, 等. 金藻3011的培养条件优化及扩大培养研究[J]. 食品科学, 2006(12): 253-259.
[24] 李艳红. 环境因子对铜绿微囊藻生长和光合作用的影响[D]. 南昌: 南昌大学, 2010: 40.
[25] 袁丽娜, 宋炜, 肖琳. 多环境因素全面正交作用对铜绿微囊藻生长的效应研究[J]. 南京大学学报: 自然科学版, 2008(4): 408-414.
[26] 赵娜, 冯鸣凤, 朱琳. 不同pH值条件下Cr6+对小球藻和斜生栅藻的毒性效应[J]. 东南大学学报: 医学版, 2010(4): 382-386.
[27] 欧阳峥嵘, 温小斌, 耿亚红. 光照强度、温度、pH、盐度对小球藻(Chlorella)光合作用的影响[J]. 武汉植物学研究, 2010(1): 49-55.
[28] 侯建军, 赖红艳, 黄邦钦. 几种典型藻华生物的分子分类学分析[J]. 水生生物学报, 2008, 32(5): 711-719.
[29] 林子杰. 三种绿藻的ITS和18S rDNA序列及系统发育分析[D]. 苏州: 苏州大学, 2011: 23-31.
[30] 胡乐琴, 唐晨, 汪卿. 前沟藻18S rDNA序列克隆和分子鉴定分析[J]. 生物技术通报, 2011(12): 92-95.
[31] 庄丽, 陈月琴, 李钦亮. 赤潮叉角藻18S rDNA和ITS区序列测定与分析[J]. 海洋与湖沼, 2001, 32(2): 148-154.
[32] 王丹, 龚春霞, 苟亚峰. 塔克拉玛干沙漠生物结皮中几种藻类的系统发育分析[J]. 草业学报, 2014(3): 97-103.
[33] LEWIS L A, LEWIS P O. Unearthing the molecular phylodiversity of desert soil green algae (Chlorophyta)[J]. Systems Biology, 2005, 54(6): 936-947.
Morphological and molecular identification of four groups desert green algae
QELBINUREyit1,2
AISHANJIANG1,2
NURGULRahman1,2
(1.SchoolofLifeScience,XinjiangNormalUniversity,Urumqi,Xinjiang830054,China;2.XinjiangKeyLaboratoryofSpecialSpeciesConservationandRegulatoryBiology,Urumqi,Xinjiang830054,China)
Four groups of algas, isolated from the Taklimakan desert, were identified by morphological characters in this study. The pH effect of the growth of algae is analyzed according to the growth curve, and the phylogenetic tree was pictured. It shows that the group a belongs to the oval algae, and group b, c and d belong to the spherical algae. The optimum suitable pH values for the group a desert algae was 6.0, 8.0 for the group b and d; the same value of original BG-11 for the group c. Four representative strains of desert algae gene sequences were identified by using the 18S rDNA sequence analysis method. It shows that the strain of 3YS16① (group a) and the strain of 3YS21-1 (group c) have close genetic relationship with theChlamydomonasincerta; the strain of KXII(2) (group b) has close genetic relationship with theChlorosarcinopsisbastropiensi; the Strain of YS2-3 (group d) has close genetic relationship withChlorosarcinopsiscommunis. This study determined the classification status of four groups of algae and the optimal pH growth conditions, and provided theoretical basis to the molecular biology studies of desert algae and applications in food industry.
Desert algae; 18S rDNA; Morphological Characteristics
国家自然科学基金(编号:31460448,31160333)
卡丽比努尔·艾依提,女,新疆师范大学在读硕士研究生。
努尔古丽·热合曼(1972—),女,新疆师范大学副教授,博士。E-mail:nurgulum@163.com
2017—04—03
10.13652/j.issn.1003-5788.2017.05.005

