构巢曲霉内切纤维素酶A10在毕赤酵母中的表达及重组蛋白质的表征
李建军,李小连,王自强,杜昱光
构巢曲霉内切纤维素酶A10在毕赤酵母中的表达及重组蛋白质的表征
李建军1,2,李小连1,王自强1,杜昱光1,2
1 中国科学院过程工程研究所生化工程国家重点实验室国家生化工程技术研究中心 (北京),北京 100190 2 中国科学院过程工程研究所全军生物药制造与剂型工程重点实验室,北京 100190

李建军, 李小连, 王自强, 等. 构巢曲霉内切纤维素酶A10在毕赤酵母中的表达及重组蛋白质的表征. 生物工程学报, 2017, 33(5): 757–765.Li JJ, Li XL, Wang ZQ, et al. Overexpression and characterization of endo-cellulase A10 from Aspergillus nidulans in Pichia pastoris. Chin J Biotech, 2017, 33(5): 757–765.
内切纤维素酶是纤维素酶高效降解纤维素的一个关键因子,已广泛应用于工业生物技术领域。对来源于腐生真菌构巢曲霉的一个内切纤维素酶进行过表达及详细的酶学性质研究,研究结果表明:该内切纤维素酶在摇瓶和发酵罐条件下都成功获得表达,发酵罐条件下的蛋白质表达量达到0.89 mg/mL;该酶的最适反应pH和温度分别为4.0和80 ℃,在pH 2.0–12.0之间表现出了很好的稳定性;在温度£60 ℃时,该酶非常稳定,当温度³70℃,酶的稳定性大大降低;Co2+、Mn2+和Fe2+促进了CMCase活性,而Pb2+、Ni2+和Cu2+等金属离子表现出了一定的抑制作用。因此,该构巢曲霉内切纤维素酶表现出了非常好的耐酸、耐碱以及一定的耐热性等性能,具有开发为商品酶的潜力,为深入开发构巢曲霉来源糖苷酶的应用奠定了基础。
构巢曲霉,内切纤维素酶,酶学性质,二价金属离子,发酵
植物细胞壁主要由木质素、纤维素和半纤维素组成,其中纤维素大约占40%–50%,是植物细胞壁的主要成分。纤维素酶是所有能参与纤维素降解并最终将其转化为葡萄糖的酶类的总称[1-4]。纤维素酶酶系主要包括:内切-b-1,4-葡聚糖酶或内切纤维素酶 (EC 3.2.1.4,bg),随机水解纤维素链的内部连接;纤维二糖水解酶或外切纤维素酶或 外切-b-1,4-葡聚糖酶 (Cellulose 1,4-β-cellobiosidaseor exo-cellobiohydrolase) 特异地从纤维素链的还原端 (EC 3.2.1.176,cellulose 1,4-β-cellobiosidase,reducing end,CBH I) 或非还原端 (EC 3.2.1.91,cellulose 1,4-β-cellobiosidase,non-reducing end,CBH II) 降解纤维二糖单位;β-D-葡萄糖苷酶 (EC 3.2.1.21,β-glucosidase) 将纤维二糖水解为葡萄糖基[1–4]。内切纤维素酶的剪切是纤维素酶水解的第一步,同时也是整个纤维素水解反应的限速步骤[1,4]。内切-b-1,4-葡聚糖酶已被广泛用于工业生物技术领域,包括生物燃料、发酵、酿造、纺织、洗涤剂和改善纸浆性能及脱墨处理,在动物饲料中提高植物材料的利用效率等,具有很大的应用价值[1–4]。
内切-b-1,4-葡聚糖酶或纤维素酶主要存在于细菌和真菌中[1–3],除此之外,还存在于一些动物 (包括软体动物、白蚁、鲤鱼、紫贻贝和玻璃海鞘等) 中[5–6]。微生物是内切-b-1,4-葡聚糖酶的重要来源,具有活力高、成本低、来源稳定、提取方便等优点。但天然菌所产的内切-b-1,4-葡聚糖酶产量低,不能满足工业化生产的需要。随着分子生物学的发展,许多内切-b-1,4-葡聚糖酶基因已被成功克隆并进行了异源表达[5,7–10]。根据氨基酸序列及蛋白质的结构特点,内 切-b-1,4-葡聚糖酶可划分为糖苷水解酶家族5、6、7、8、9、10、12、26、44、45、48、51、74和124等[11–12]。
腐生真菌构巢曲霉能降解多种多糖,和基因组测序的结果一致:该真菌编码许多种降解多糖的基因[13–14]。来源于构巢曲霉的72个糖苷酶已被Bauer等克隆并成功在毕赤酵母X-33中表达,但是Bauer等只对部分糖苷酶进行了简单表征[13–14]。
由于内切-b-1,4-葡聚糖酶的广泛应用,寻找新型、高效、稳定的内切-b-1,4-葡聚糖酶是工业酶制剂的热点之一。构巢曲霉一共编码了4个内切-b-1,4-葡聚糖酶,其中内切-b-1,4-葡聚糖酶A10 (GenBank Accession No. AN1285.2) 对可溶性羧甲基纤维素钠表现出了最高活性[14]。本文对该内切纤维素酶进行了表达 (摇瓶与发酵罐) 与详细表征 (最优pH与反应温度,pH与热稳定性,二价金属离子对CMCase活性的影响,动力学参数等)。另外,虽然构巢曲霉编码了72个糖苷酶基因,但是对构巢曲霉来源糖苷酶研究的报道还比较少。因此,本文对内切纤维素酶A10的酶学性质研究,将为构巢曲霉来源糖苷酶的深入研究与应用开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂
无氨基酸酵母氮源 (Yeast nitrogen base W/O amino acid,YNB) 来自Difco公司;羧基甲纤维素钠 (CMC-Na) 购自百灵威公司;其余试剂均为进口或国产分析纯。
1.1.2 菌株与质粒
过表达来源于构巢曲霉的内切-b-1,4-葡聚糖酶A10 (GenBank Accession No. AN1285.2) 的毕赤酵母来自美国真菌遗传保藏中心 (Fungal Genetics Stock Center,FGSC)。
1.1.3 培养基
YPD培养基 (g/L):葡萄糖20,蛋白胨20,酵母提取物10;YPD平板 (g/L):YPD培养基添加琼脂15。
BMGY生长培养基 (g/L):YNB 13.4,甘油10,生物素0.000 4,磷酸钾缓冲溶液0.1 mol/L,pH 6.0。
BMMY诱导培养基 (g/L):YNB 13.4,甲醇0.5% (/),生物素0.000 4,磷酸钾缓冲溶液 (0.1 mol/L,pH 6.0)。
发酵罐发酵培养基:采用无机盐培养基,配方参考(http://tools.thermofisher.com/content/ sfs/manuals/pichiaferm_prot.pdf) (mL,g/L):H3PO426.7,CaSO40.93,K2SO418.2,MgSO4·7H2O 14.9,KOH 4.13,甘油40,PTM1 4.35,pH 5.0,121 ℃,0.1 Mpa,30 min灭菌。
PTM1微量元素溶液 (g/L):CuSO4·5H2O 6.0, KI 0.08, MnSO4·H2O 0.5, NaMoO4·2H2O 0.2, H3BO30.02, CoCl20.5, ZnCl220.0, FeSO4·7H2O 65, Biotin 0.2, H2SO45,混匀过滤除菌,4 ℃避光保存。
甘油补料培养基:甘油50%,PTM1 4.35 mL/L。
甲醇补料培养基:甲醇100%,PTM1 4.35 mL/L。
1.2 方法
1.2.1 蛋白质的摇瓶表达
平板培养:从甘油管中接菌并在YPD平板上划线,30 ℃培养3–4 d。
种子培养:从YPD平板上挑单菌落并接种到BMGY中,250 mL三角瓶装50 mL培养基,30 ℃、200 r/min回转式摇床培养过夜。
诱导产酶:当600达到3–4左右时,离心收集全部菌体,转入BMMY中,使600至1.0左右,250 mL挡板三角瓶 (Baffled flasks) 装50 mL培养基,30 ℃、200 r/min培养,每24 h补加0.5 % (/) 甲醇,诱导120 h。
1.2.2 蛋白质的发酵罐表达
种子培养:从YPD平板上挑单菌落并接种到YPD培养基中,30 ℃、250 r/min振荡培养20 h,得到一级种子,再将一级种子10%接种到1 L的YPD培养基中,30 ℃、250 r/min振荡培养10 h,得到二级种子。
A10的发酵罐发酵培养:将二级种子按10%的接种量接种至10 L发酵罐中,初始培养参数为:转速200 r/min,培养温度30 ℃,pH 5.0。随着菌体的生长,DO (Dissolved oxygen,溶氧量) 逐渐下降,通过调节搅拌转速、通气量和罐压,使DO维持在20%–30%,发酵过程中采用氨水自动控制pH值在5.0。当DO回升时,按照20–36 mL/min的速度流加甘油,使菌体继续生长至湿重约200 g/L,停止流加甘油。当DO回升至100%时,继续饥饿培养30 min,然后流加甲醇进行诱导,流加速度为:0–4 h,3.5 mL/(L·h);5–24 h,逐渐提高流加速度到10 mL/(L·h),并一直维持该速度至发酵结束。发酵过程中,每隔一定时间取样检测,测定发酵液的光密度600及菌体湿重,并留上清用于蛋白质的SDS-PAGE及CMCase活性分析和观察。
1.2.3600及细胞湿重的测定
发酵液稀释后于波长600 nm处进行比色测定,600=600读数×稀释倍数;取4 mL发酵液在10 000 r/min离心10 min,吸尽上清液后,称得的细胞重量换算为每升的克数即细胞 湿重。
1.2.4 聚丙烯酰胺凝胶电泳SDS-PAGE检测
为了检测内切-b-1,4-葡聚糖酶A10的表达情况,采用SDS-PAGE检测,浓缩胶浓度为5%,分离胶浓度为12%,用考马斯亮蓝G-250染色。
1.2.5 蛋白质浓度测定
参照Bradford 的方法采用考马斯亮蓝G-250法进行可溶性蛋白质含量测定。以牛血清白蛋白 (BSA) 作为标准蛋白质,配制标准溶液,制作标准曲线[15]。
1.2.6 CMCase活性分析
参考饲料行业对内切纤维素酶的CMCase活性分析方法 (NY/T 912-2004),对表达的内切纤维素酶A10进行CMCase活性分析。使用5 mg/mL的羧甲基纤维素钠 (CMC-Na) 作为底物,加入一定量、稀释过的酶,反应体积为1 mL,在37 ℃、pH值为5.5 (0.1 mol/L醋酸钠) 的条件下反应15 min,加入1.5 mL DNS (3,5-二硝基水杨酸) 试剂终止反应,沸水浴加热5 min,用自来水冷却至室温,然后加入2.5 mL蒸馏水,以标准空白样为空白对照,在540 nm处测定吸光度。根据葡萄糖的标准曲线,计算还原糖的含量,并计算内切纤维素酶比酶活。一个酶活单位U定义为每分钟释放的还原糖等同1mmol葡萄糖所需要的酶量。
1.2.7 最适反应pH与pH稳定性
使用5 mg/mL的CMC-Na作为底物,在 50 mmol/L、pH 2.0–12.0的B & R (Britton and Robinson) 缓冲溶液中测定A10的最优反应pH。不同pH条件下的CMCase活性分析都在37 ℃下反应15 min,分别计算比酶活。
A10的pH稳定性按照下面的过程测定:首先把A10在4 ℃、不同pH值 (pH 2.0–11.0) 分别孵育1 h、5 h、24 h及120 h,然后立即在标准条件下 (最优pH 4.0、37 ℃,反应15 min) 进行CMCase活性分析。把A10在最优pH 4.0时的初始比酶活作为100%,在不同pH、时间点的残余比酶活和pH 4.0时的初始比酶活进行比较,即得到不同pH、时间点的残余CMCase活性的百分比。
1.2.8 最适反应温度与热稳定性
使用5 mg/mL的CMC-Na作为底物,在 50 mmol/L、最优pH 4.0的B & R缓冲溶液中测定A10的最优反应温度。不同温度下的CMCase活性分析都反应15 min,分别计算比酶活。
A10的热稳定性按照下面的过程测定:首先把A10在不同温度 (50 ℃、60 ℃、70 ℃、80 ℃及90 ℃) 分别孵育15 min、30 min、1 h及2 h,然后立即在标准条件下 (最优pH 4.0、37 ℃,反应15 min) 进行CMCase活性分析。如果A10在某一温度失活速度太快,将在该温度孵育5 min和10 min。把A10在标准条件下的初始比酶活作为100%,在不同温度、时间点的残余比酶活和标准条件时的初始比酶活进行比较,即得到不同温度、时间点残余CMCase活性的百分比。
1.2.9 二价金属离子对CMCase活性的影响
二价金属离子对A10 CMCase活性影响的分析过程:在上述标准CMCase活性分析体系中,分别加入1 mmol/L的二价金属离子 (Pb(CH3COO)2,NiSO4,MnSO4,CuSO4,BaCl2,ZnSO4,CoCl2,CaCl2,MgCl2,FeSO4),在标准条件下 (最优pH 4.0、37 ℃,反应15 min) 进行CMCase活性分析。把A10在标准条件下的初始比酶活作为100%,在添加不同金属离子时的比酶活和标准条件时的初始比酶活进行比较,即得到添加不同金属离子时比酶活的百 分比。
1.2.10 动力学参数测定
使用0.15%–2% (/) 的CMC-Na作为底物,在50 mmol/L、最优pH 4.0的B & R缓冲溶液中测定A10的动力学参数,根据Lineweaver-Burk方程推算m和max。
2 结果与分析
2.1 蛋白质的摇瓶表达
首先在摇瓶中培养过表达内切纤维素酶A10 (GenBank Accession No. AN1285.2) 的毕赤酵母,用0.5%的甲醇连续诱导120 h,进行SDS-PAGE分析 (图1)。结果表明,在44 kDa左右出现明显条带。基于该蛋白质的氨基酸序列预测该蛋白质的分子量为35.8 kDa,44 kDa条带的分子量远高于预测分子量,可能是由于在毕赤酵母中表达蛋白质时的糖基化所致。随着诱导时间的延长,主要蛋白质的表达量也逐渐增加,并通过CMCase活性分析进一步验证。

图1 摇瓶表达A10的SDS-PAGE分析w
2.2 蛋白质的发酵罐表达
我们用10 L发酵罐 (5 L发酵液) 对内切纤维素酶A10进行了大量表达。过表达内切纤维素酶A10毕赤酵母工程菌株的生长曲线如图2所示,菌体湿重和600的结果一致,随着发酵时间的延长,两者都呈现逐渐递增的趋势。当菌体湿重达到238 g/L即第37 h时开始用甲醇诱导,连续诱导70 h。
从蛋白质的浓度变化来看 (图2),随着诱导时间的延长,蛋白质的表达量呈现逐渐递增的趋势,117 h时发酵产量达到0.89 mg/mL。并进行了CMCase活性分析。
2.3 蛋白质的酶学性质分析
2.3.1 最适反应pH与pH稳定性
pH-活性曲线的结果表明 (图3):pH 4.0时A10表现出了最高CMCase活性,pH 2.0–8.0时CMCase活性为最高CMCase活性的50%以上,而pH 9.0–12.0时CMCase活性大大降低,仅为最高CMCase活性的10%左右。因此pH对A10的CMCase活性有非常大的影响,该酶为一酸性内切纤维素酶。

图2 过表达A10工程菌体的生长曲线、蛋白质浓度与CMCase活性
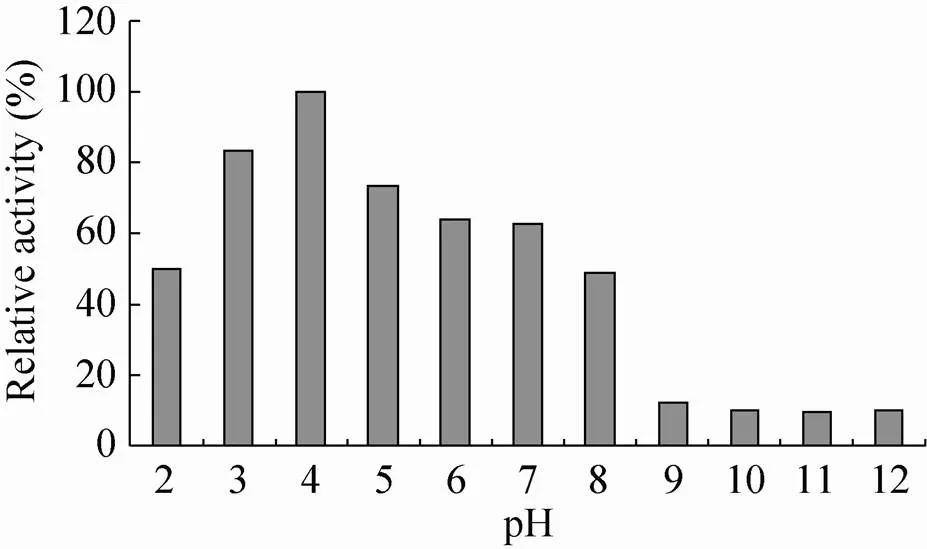
图3 pH对CMCase活性的影响
pH稳定性研究发现 (图4),A10在pH 2–12表现出了非常高的稳定性,在pH 9–12孵育10 d后,CMCase活性也仅仅失去10%左右。
2.3.2 最适反应温度与热稳定性
研究了温度对A10 CMCase活性的影响 (图5),结果发现,80℃时A10表现出了最高CMCase活性;20℃时CMCase活性也比较高,为最高CMCase活性的70%左右;在100℃时,CMCase活性为最高CMCase活性的80%左右。
同时也考察了A10的热稳定性 (图6),结果发现,A10在50℃和60℃时非常稳定,在50℃孵育2 h后,几乎没有丢失CMCase活性,在60℃孵育2 h后,仅仅丢失5%左右的CMCase活性。但是,在70℃时,A10孵育15 min后,仅保留20%左右的初始CMCase活性,而孵育1 h后,A10几乎完全失活。在80℃和90℃时,A10的失活速度加快,孵育5 min后,丢失95%左右的CMCase活性。
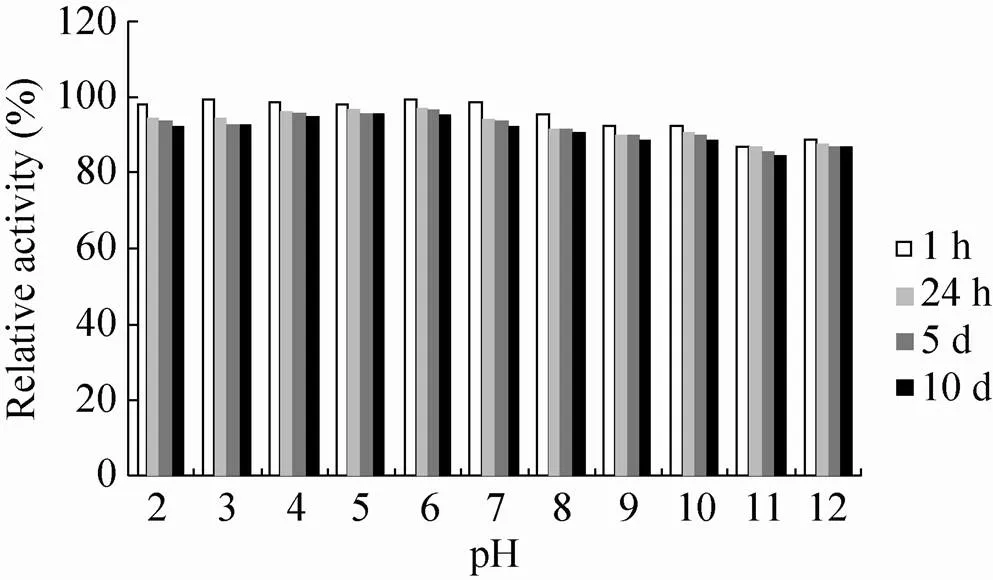
图4 A10的pH稳定性
2.3.3 金属离子对CMCase活性的影响
研究了二价金属离子对A10 CMCase活性的影响 (图7)。结果发现,Co2+、Mn2+、Fe2+促进了A10的CMCase活性,尤其Co2+,将CMCase活性提高了25%左右。Pb2+、Ni2+、Cu2+、Zn2+和Mg2+表现出了一定的抑制作用。Ba2+和Ca2+对CMCase活性没有太大影响。

图5 温度对CMCase活性的影响

图6 A10的热稳定性

图7 二价金属离子对CMCase活性的影响
2.3.4 动力学参数测定
使用0.15%–2% (/) 的CMC-Na作为底物,根据Lineweaver-Burk方程计算了A10的 动力学参数,m和max分别为6 mg/mL和 45.4mmol/(min×mg)。
3 讨论
由于来源于里氏木霉纤维素酶在第二代生物乙醇生产中的重要性,目前对里氏木霉纤维素酶的研究非常多,包括异源表达、酶学性质研究、规模化培养以及蛋白质工程改造等[4,7–10,16]。相比而言,对来源于构巢曲霉的纤维素酶及其他糖苷酶的研究比较少。构巢曲霉也是一种重要的丝状真菌,按照基因组序列,至少编码了72种糖苷酶基因。虽然学者已经克隆、表达、纯化了一些来源于构巢曲霉的糖苷酶,但是针对这些糖苷酶的酶学性质研究 (包括最优pH与温度、pH与热稳定性,金属离子对CMCase活性的影响等) 方面的报道还比较少[14,17–19]。本文比较系统研究了构巢曲霉来源的内切-b-1,4-葡聚糖酶A10 (GenBank Accession No. AN1285.2) 的酶学性质。
来源于构巢曲霉的内切-b-1,4-葡聚糖酶A10在摇瓶及发酵罐中都成功获得表达,在10 L发酵罐中的最高表达量达到了0.89 mg/mL。针对内切-b-1,4-葡聚糖酶A10的酶学性质研究表明,该酶的最适pH为4.0,和文献报道的一致,属于酸性内切纤维素酶[14];该酶的最适反应温度为80 ℃,在100 ℃时仍保留了较高的CMCase活性,而文献报道的最优温度为57 ℃[14]。该酶在很宽的pH范围内 (pH 2.0–12.0) 表现出了非常高的稳定性,孵育10 d后,仍保留90%以上的CMCase活性,该酶表现出了非常强的耐酸、耐碱能力;该蛋白质在50 ℃和60 ℃时表现出了非常高的稳定性,但是在³70 ℃时,其耐热性大大降低。和里氏木霉的内切纤维素酶Cel5A相比,两种酶的最适pH及热稳定性很接近,但二者的最适反应温度差别比较大:Cel5A在60 ℃时CMCase活性最高[10],而构巢曲霉内 切-b-1,4-葡聚糖酶A10在80 ℃时CMCase活性最高。来自木霉C-4的天然内切纤维素酶在pH 2.0–8.0之间也表现出了很高的稳定性[20]。内切酶A10的m和里氏木霉来源内切纤维素酶Cel5A的m(4.93 mg/mL) 相当,但是max比Cel5M的[275.9mmol/(min×mg)] 低很多[10]。需要指出的是:我们是在37 ℃时测定的动力学参数,而Cel5A的动力学参数是在60 ℃时测定的[10]。
众所周知,金属离子作为一种辅酶因子或抑制因子对酶的水解有很大影响[21]。本研究发现:Co2+、Mn2+和Fe2+促进了A10的CMCase活性,而Pb2+、Ni2+和Cu2+等金属离子对A10有一定的抑制作用。同样有研究报道Co2+和Mn2+提高了一些纤维素内切酶的CMCase活性[22–23];Fe2+既能促进纤维素内切酶的CMCase活性,也能抑制其他纤维素酶的CMCase活性[22,24];Pb2+提高了来源于类芽胞杆菌属sp. BME-1的Cel9的CMCase活性[23],但是抑制了来源于酵母的内切纤维素酶的CMCase活性[25];Ni2+抑制纤维素酶的CMCase活性[24];Cu2+也对一些内切纤维素酶表现出了抑制作用[22–23]。因此,综合金属离子对内切纤维素酶CMCase活性影响的结果表明:不同的金属离子对CMCase活性有不同的影响,同一种金属离子对不同微生物来源的内切纤维素酶有不同的影响。
目前市场上的纤维素酶产品通常是内切葡聚糖酶、外切葡聚糖酶、b-葡萄糖苷酶等的复合酶,而市售的单一内切葡聚糖酶产品还比较少。构巢曲霉内切-b-1,4-葡聚糖酶A10表现出了非常好的性能 (耐酸、耐碱及一定的耐热性),因此具有开发为商品酶的潜力。同时,本研究也拓宽了人们对构巢曲霉来源糖苷酶的认识,将为构巢曲霉糖苷酶的深入研究以及应用开发提供指导。
[1] Himmel ME, Xu Q, Luo Y, et al. Microbial enzyme systems for biomass conversion: emerging paradigms. Biofuels,2010, 1(2): 323–341.
[2] Dashtban M, Schraft H, Qin W.Fungal bioconversion of lignocellulosic residues; opportunities & perspectives. Int J Biol Sci,2009, 5(6): 578–595.
[3] Maki M, Leung KT, Qin W. The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass. Int J Biol Sci,2009, 5(5): 500–516.
[4] Zhang YHP, Himme ME, Mielenz JR. Outlook for cellulase improvement: screening and selection strategies. Biotechnol Adv, 2006, 24(5): 452–481.
[5] Ni J, Takehara M, Watanabe H. Heterologous overexpression of a mutant termite cellulase gene inby DNA shuffling of four orthologous parental cDNAs. Biosci Biotechnol Biochem, 2005, 69(9): 1711–1720.
[6] Kim D, Baik KS, Park SC, et al. Cellulase production fromsp. NO3isolated from the sea squirt. J Ind Microbiol Biotechnol, 2009, 36(11): 1375–1382.
[7] Qin Y, Wei X, Liu X, et al. Purification and characterization of recombinant endoglucanase ofexpressed inwith higher glycosylation and stability. Protein Expr Purif, 2008, 58(1): 162–167.
[8] Akbarzadeh A, Ranaei Siadat SO, Motallebi M, et al. Characterization and high level expression of acidic endoglucanase in. Appl Biochem Biotechnol, 2014, 172(4): 2253–2265.
[9] Boonvitthya N, Bozonnet S, Burapatana V, et al. Comparison of the heterologous expression ofendoglucanase Ⅱand cellobiohydrolase Ⅱin the yeastsand. Mol Biotechnol, 2013, 54(2): 158–169.
[10] Bai RH, Zhang YB, Wang CD, et al. Gene optimization and efficient expression ofCel5A inChin J Biotech, 2016, 32(10): 1381–1394 (in Chinese).白仁惠, 张云博, 王春迪, 等. 里氏木霉Cel5A基因优化及其在毕赤酵母中的高效表达. 生物工程学报, 2016, 32(10): 1381–1394
[11] Cantarel BL, Coutinho PM, Rancurel C, et al. The carbohydrate-active enzymes database (CAZy): an expert resource for glycogenomics. Nucleic Acids Res, 2009, 37: D233–D238.
[12] Henrissat BA. Classification of glycosyl hydrolases based on amino acid sequence similarities. Biochem J, 1991, 280 (Pt 2): 309–316.
[13] Galagan JE, Calvo SE, Cuomo C, et al. Sequencing ofand comparative analysis withandNature, 2005, 438:1105–1115.
[14] Bauer S, Vasu P, Persson S, et al. Development and application of a suite of polysaccharide-degrading enzymes for analyzing plant cell walls. Proc Natl Acad Sci USA, 2006, 103(30): 11417–11422.
[15] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989.
[16] Qin Y, Wei X, Song X, et al. Engineering endoglucanase II fromto improve the catalytic efficiency at a higher pH optimum. J Biotechnol, 2008, 135(2): 190–195.
[17] Bauer S, Vasu P, Mort AJ, et al. Cloning, expression, and characterization of an oligoxyloglucan reducing end-specific xyloglucano- biohydrolase from. Carbohydr Res, 2005, 340(17): 2590–2597.
[18] Pérez-González JA, van Peij NNME, Bezoen A, et al. Molecular cloning and transcriptional regulation of thegene encoding a β-xylosidase. Appl Environ Microbiol, 1998, 64(4): 1412–1419.
[19] Pérez-Gonzalez JA, De Graaff LH, Visser J, et al. Molecular cloning and expression inof twoxylanase genes. Appl Environ Microbiol, 1996, 62(6): 2179–2182.
[20] Sul OJ, Kim JH, Park SJ, et al. Characterization and molecular cloning of a novel endoglucanase fromsp. C-4. Appl Microbiol Biotechnol, 2004, 66(1): 63–70.
[21] Jabbar A, Rashid MH, Javed MR, et al. Kinetics and thermodynamics of a novel endoglucanase (CMCase) fromproduced under solidstate condition. J Ind Microbiol Biotechnol, 2008, 35(6): 515–524.
[22] Yang J, Dang H. Cloning and characterization of a novel cold-active endoglucanase establishing a new subfamily of glycosyl hydrolase family 5 from a psychrophilic deep-sea bacterium. FEMS Microbiol Lett, 2011, 325(1): 71–76.
[23] Fu X, Liu P, Lin L, et al. A novel endoglucanase (Cel9P) from a marine bacteriumsp. BME-14. Appl Biochem Biotechnol, 2010, 160(6): 1627–1636.
[24] Tejirian A, Xu F. Inhibition of cellulase-catalyzed lignocellulosic hydrolysis by iron and oxidative metal ions and complexes. Appl Environ Microbiol, 2010, 76(23): 7673–7682.
[25] Oikawa T, Tsukagawa Y, Soda K. Endo-β-glucanase secreted by a psychrotrophic yeast: purification and characterization. Biosci Biotechnol Biochem, 1998, 62(9):1751–1756.
(本文责编郝丽芳)
Overexpression and characterization of endo-cellulase A10 fromin
Jianjun Li1,2, Xiaolian Li1, Ziqiang Wang1, and Yuguang Du1,2
1 National Key Laboratory of Biochemical Engineering, National Engineering Research Center for Biotechnology (Beijing),Institute of Process Engineering,Chinese Academy of Sciences, Beijing 100190, China 2Key Laboratory of Biopharmaceutical Production & Formulation Engineering, The People’s Liberation Army,Institute of Process Engineering,Chinese Academy of Sciences, Beijing 100190, China
Endo-cellulases are important to efficiently hydrolyze cellulose, and widely used in biotechnology. In this study, we overexpressed and characterized an endo-cellulase from. This endo-cellulase was successfully overexpressed in flasks and fermentor, and its concentration in fermentor reached 0.89 mg/mL. The optimal pH and temperature of the were 4.0 and 80℃ respectively, and it was very stable between pH 2.0 and 12.0. It was thermally stable below 60 ℃, whereas it was inactivated very quickly above 70 ℃. Its CMCase activity could be enhanced by Co2+, Mn2+and Fe2+, whereas it was inhibited byPb2+, Ni2+and Cu2+. Therefore, this endo-cellulase exhibited good pH stability and thermostability below 60 ℃, and has the potential as commercial enzymes.
,endo-cellulase, enzymological properties, divalent metal ion, fermentation
November 11, 2016; Accepted:February 6, 2017
Jianjun Li. Tel/Fax: +86-10-82545039; E-mail: jjli@ipe.ac.cn Yuguang Du. Tel: +86-10-82545070; Fax: +86-10-82545039; E-mail: ygdu@ipe.ac.cn
10.13345/j.cjb.160442
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2014AA093511).
国家高技术研究发展计划(863计划) (No. 2014AA093511) 资助。
2017-02-16
http://www.cnki.net/kcms/detail/11.1998.Q.20170216.1027.003.html

