川秋葵1号采后菌核病病原菌鉴定及其生物学特性研究
, ,, ,
(1.四川农业大学食品学院,四川雅安 625014; 2.四川旅游学院食品学院,四川成都 610100; 3.四川省植物工程研究院,四川成都 611700)
川秋葵1号采后菌核病病原菌鉴定及其生物学特性研究
辛松林1,2,焦露2,徐晓雪2,王辉3,秦文1,*
(1.四川农业大学食品学院,四川雅安 625014; 2.四川旅游学院食品学院,四川成都 610100; 3.四川省植物工程研究院,四川成都 611700)
为明确引起川秋葵采后菌核病的病原菌种类及其主要生物学特性,从自然发病的川秋葵上分离到1株丝状致病真菌,经形态学特征观察及rDNA ITS序列分析确定为腐皮镰孢霉菌(Fusariumsolani),并对其进行了生物学特性研究。结果表明:该菌生长的最适温度为28 ℃,最适为pH7,最适生长NaCl浓度为0.5%;所考察的碳源、氮源、微量元素中,乳糖、天冬酰胺、柠檬酸铁能显著增加(p<0.05)腐皮镰孢霉菌的菌落直径,表明其对腐皮镰孢霉菌的生长有益。
川秋葵1号,菌核病,鉴定,生物学特性
秋葵[Abelmoschusesculentus(L.)Moench]又名补肾草、羊角豆,属于锦葵科秋葵属一年生草本植物,原产于非洲,是一种广泛种植于热带及亚热带的植物。2006~2015年,四川省植物工程研究院引种非洲黄秋葵成功,并从中选育出适合四川省栽培的黄秋葵新品种——川秋葵1号[1-2]。由于秋葵栽培范围小、上市时间较为集中、不耐贮运、民众认知度较低等原因,造成了秋葵在推广、应用的困难[3-4]。
菌核病病原菌属[真菌子囊菌亚门盘菌纲(Discomycetes)核盘菌属(Sclerotinia)核盘菌(Sclerotiorum)],寄主范围十分广泛,菌核病一旦传入,很难根除。菌核病主要危害植物的茎秆,其次危害叶片和荚果,发病率为10%~30%,高者达80%以上。一般减产10%以上,高者达30%~50%,甚至绝产,给农村农业经济造成了巨大的损失。菌核病常见的重要寄主包括油菜、向日葵、大豆等油料作物和莴苣、胡萝卜及多种十字花科、豆科蔬菜[5]。关于秋葵菌核病病原菌的报道比较鲜见,秋葵菌核病发病初期,在病部产生绵絮状白霉;随着病害发展,病部萎蔫干腐;发病后期,常在干腐的髓腔内形成鼠粪状菌核[6]。本实验拟通过形态学特征和rDNA ITS序列分析对其病原菌进行鉴定,分析致病菌种类并研究其代谢特点,以期为有效优化秋葵采后保鲜工艺、研究秋葵果实对病原菌侵染的响应机制提供理论基础和科学数据[7-11]。
1 材料与方法
1.1材料与仪器
菌株 分离于采后贮藏过程中自然发病的川秋葵1号果实(2016年5~6月采自四川省植物工程研究院川秋葵1号种植基地);PDA培养基 马铃薯200 g,琼脂粉15 g,葡萄糖20 g,蒸馏水1000 mL,不加琼脂粉的为液体培养基。
真菌基因组DNA提取试剂盒Fungal DNA Kit(50) 购自Omega Bio-tek;CJ100净化工作台 北京赛博乐实验仪器有限公司;恒温水浴锅、电子天平、培养箱等。
1.2实验方法
1.2.1 菌种的分离与回接验证 以秋葵病害样本为对象,进行常规组织分离,经过单孢分离、纯化,纯化菌株经回接实验确定其致病力后,于斜面PDA、4 ℃下保存待用[12]。
1.2.2 基因组DNA提取、PCR扩增以及序列测定 采用试剂盒提取菌株的 DNA,并对其ITS r DNA序列进行PCR扩增,PCR产物测序。测序由科标技术(青岛)研发中心完成,IT54、IT55序列如下:
IT54

IT55

1.2.3 菌株形态的显微观察 化供试菌株4 d后,取菌落边缘新鲜菌饼(直径5 mm),移植于PDA平板上,28 ℃恒温箱中培养,逐日观察、记录病原菌的培养性状;同时镜检、观察菌丝的形态。
1.2.4 不同生长条件对菌株生理特性的影响
1.2.4.1 温度对菌株生长的影响 采用打孔器无菌制备直径为5 mm的菌饼,将菌饼分别置于18、23、28、33、38 ℃恒温培养 72 h后用十字交叉法测定菌落直径[13]。每组设置 5 个平行实验。
1.2.4.2 pH对菌株生长的影响 采用1 mol/L HCl和1 mol/L NaOH调节PDA培养基pH,分别为5、6、7、8、9,菌种于28 ℃下培养72 h后测定菌落直径,测定方法同1.2.4.1。
1.2.4.3 盐度对菌株生长的影响 采用含NaCl质量分数为0%、0.5%、1.0%、1.5%、2.0%的PDA培养基,28 ℃恒温培养72 h后测定菌落直径,测定方法同1.2.4.1。
1.2.4.4 不同碳源条件下菌株的生长 以PDA基础培养基为空白组,分别用鼠李糖、蔗糖、果糖、海藻糖、甘露糖、乳糖、半乳糖、鼠李糖+葡萄糖、鼠李糖+蔗糖替换基础培养基中的葡萄糖,28 ℃恒温培养72 h后测定菌落直径,测定方法同1.2.4.1。
1.2.4.5 不同氮源条件下菌株的生长 以PDA基础培养基为空白组,测试硝酸钙、硝酸钾、硝酸铵、硝酸钠、硫酸铵、草酸铵、氯化铵、天冬酰胺、尿素和碳酸铵10种氮源对菌株生长的影响,28 ℃恒温培养72 h后测定菌落直径,测定方法同1.2.4.1。
1.2.4.6 不同微量元素条件下菌株的生长 以PDA基础培养基为空白组,测试微量元素硫酸锌、硫酸亚铁、四硼酸钠、硫酸锰、钼酸钠、硫酸铜和柠檬酸铁对菌株生长的影响,每1000 mL培养基中分别加入15 μg上述微量元素,28 ℃恒温培养72 h后测定菌落直径,测定方法同1.2.4.1。
1.3数据处理
采用SPSS 17.0统计分析软件进行处理。
2 结果与分析
2.1菌株分离与回接验证
在自然发病的川秋葵上取病健交界处的组织在PDA培养基上28 ℃培养7 d后(图1a),得到1株簇生绒毛状、无褶皱的丝状真菌。将菌株在PDA培养基上纯化后回接至川秋葵,在接种部位出现同样的病症(图1b):病部表面生出白色霉层,并能从该病害部位再次分离得到该菌。因此,可以确定丝状真菌为秋葵的致病菌。

图1 自然发病川秋葵(a)与致病菌回接川秋葵(b)Fig.1 Isolation(a)and re-inoculation(b)of pathogenic bacteria from Abelmoschus esculentus(L.)Moench
2.2病原菌形态结构学分析
2.2.1 病原菌菌落形态分析 由图2可知,28 ℃条件下PDA培养基上菌落生长较快,菌落呈圆形,边缘整齐,正面为乳白色,背面初期为乳白色,逐渐变为淡黄色,最终变为黄色,培养到第15 d仍无孢子产生。培养到第4 d时(图2a),菌落直径达到4.35~4.45 cm,菌落质地松散,菌丝呈乳白色、绒絮状,菌丝渗透到培养基表面浅层,菌饼中心周围1 cm内菌丝中附着少量微小的白色透明颗粒;培养5 d时(图2b),菌落直径达到5.50~5.60 cm,培养基开始出现明显的圆形沟纹,表面呈淡黄色;培养8 d(图2c、2d),菌落长满整个平板,直径达到8.70~8.90 cm,白色透明微小颗粒增多,菌落圆形沟纹增多,背面黄色加深。
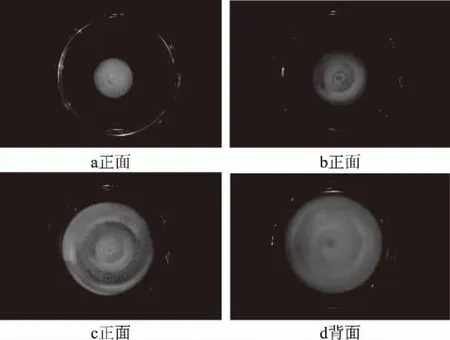
图2 致病菌株的菌落形态Fig.2 Pathogenic strains of colony morphology
2.2.2 病原菌显微形态结构观察 图3显微形态观察显示,分离菌株在PDA培养基上培养至15 d仍无孢子产生,菌丝分枝较多且内部隔膜观察清晰,具有多个隔膜。

图3 致病菌株的显微形态(400×)Fig.3 Microscopic morphology of pathogenic strain(400×)
2.3 rDNA ITS区的PCR、同源性比对与系统发育分析
图4显示了以致病菌基因组DNA为模板,以ITS4和ITS5为引物PCR扩增,得到PCR产物大小约1500~2000 bp。

图4 病原菌的rDNA ITS区电泳检测图谱Fig.4 PCR product of pathogenic bacteria rDNA ITS
将 ITS rDNA 序列通过NCBI网站与GenBank中的已知序列进行同源性比较,发现其与Fusariumsp.自然聚类。通过邻接法构建的系统发育树结果(图5)进一步表明,菌株与Fusariumsp.的亲缘关系最近。此外,形态学观察表明致病菌株形态特征与腐皮镰孢霉菌(Fusariumsolani)基本一致,因此可将本研究分离到的致病菌株确定为腐皮镰孢霉菌(Fusariumsolani)。

图5 以rDNA ITS序列为分子标记的病原菌系统进化树Fig.5 Phylogenetic tree of pathogenic bacteria based on the sequences of ITS-r DNA
2.4腐皮镰孢霉菌菌株的生物学特性
2.4.1 温度对菌株生长的影响 由图6可见,腐皮镰孢霉菌菌株在18~38 ℃培养 72 h菌株均能生长,温度越高菌株生长的越旺盛,在28 ℃时菌落直径达到最大值,且菌落直径与其他温度处理差异显著(p<0.05),由此表明28 ℃是腐皮镰孢霉菌的最适生长温度。
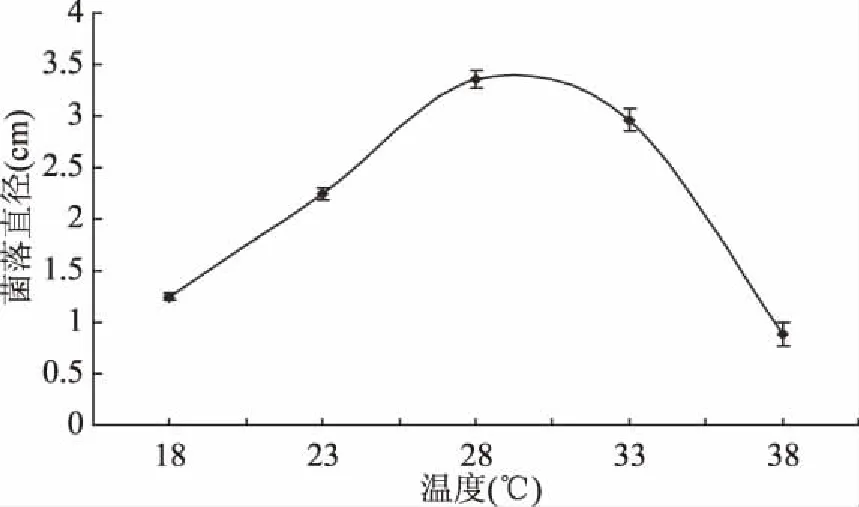
图6 温度对菌落生长的影响Fig.6 Effects of temperature on colony growth
2.4.2 pH对菌株生长的影响 腐皮镰孢霉菌菌株在pH 5~9内恒温培养72 h菌株均能生长。如图7所示,pH在5~9时,随着pH的增大菌株生长越快,当pH为7时,腐皮镰孢菌的生长速度最快,随着pH进一步增大,腐皮镰孢菌的生长速度下降。由此表明腐皮镰孢菌的最适生长pH为7。

图7 pH对菌落生长的影响Fig.7 Effects of pH on colony growth
2.4.3 NaCl对菌株生长的影响 如图8所示,在NaCl浓度为0%~2.0%时均可生长,在NaCl浓度为0%~1.0%范围内,随着NaCl浓度的升高,菌株生长显著降低;而在NaCl浓度为1.0%~2.0%范围内,随着NaCl浓度的升高,抑菌效果变化并不明显,可见,NaCl对腐皮镰孢霉菌的生长在特定浓度范围内具有明显的抑制作用。

图8 NaCl 浓度对菌落生长的影响Fig.8 Effects of NaCl concentration on colony growth

图9 不同碳源对菌落生长的影响Fig.9 Effects of different carbon sources on colony growth
2.4.4 碳源对菌株生长的影响 在腐皮镰孢霉菌对碳源利用的实验中,菌株利用碳源的能力依次为乳糖>半乳糖>鼠李糖>海藻糖>果糖>蔗糖>蔗糖+鼠李糖>葡萄糖>葡萄糖+鼠李糖>甘露醇,且各处理组间差异不显著(p>0.05),可见菌株对碳源的利用范围较广。
2.4.5 氮源对菌株生长的影响 如图10所示,菌株培养72 h的测定结果显示,在供试的10种氮源中,腐皮镰孢菌利用氮源的能力依次为天冬酰胺>硝酸铵>硝酸钠>硫酸铵>硝酸钙>硝酸钾>尿素>氯化铵>碳酸铵>草酸铵,且各处理组间差异极显著(p<0.01),可见氮源对腐皮镰孢菌生长的影响较显著。

图10 不同氮源对菌落生长的影响Fig.10 Effects of different nitrogen sources on colony growth
2.4.6 不同微量元素对菌株生长的影响 如图11所示,在供试的8种微量元素中,与对照比较,菌株可以利用除四硼酸钠、钼酸钠和硫酸锰以外的其他微量元素,腐皮镰孢菌利用能力依次为柠檬酸铁>硫酸亚铁>硫酸铜>硫酸锌>对照组,且各处理组间差异显著(p<0.05),可见铁元素对促进腐皮镰孢菌的生长是有益的。

图11 不同微量元素对菌落生长的影响Fig.11 Effects of different micronutrient on colony growth
3 讨论与结论
腐皮镰孢霉菌是常见的土壤习居菌,发病后产生菌丝,受害病叶与邻近健株接触即可传病。近年来,随着分子生物学技术的发展,通过对ITS区进行测序,诊断和检测植物病原菌的方法得到了广泛的应用。一方面是由于rDNA的ITS区段具有保守性,此外,ITS区段在科、属、种水平上均有特异性序列。核盘菌是兼性寄生菌,在5~30 ℃的温度范围内均可形成菌核,适宜温度为15~25 ℃。菌核为休眠结构,在土壤、病残体和种子中均可存活。孙敬贤研究发现,在陕西杨凌地区,菌核越冬打破休眠后,4、5月份日均温达到20 ℃左右,适合菌核萌发,释放大量的子囊孢子,导致菌核病大范围的发生[14]。黄娟研究发现温度和湿度是菌核病流行的关键因子,并认为核盘菌菌丝的最适生长温度为25 ℃,在相对湿度超过85%的时候才能够生长发育[15]。Smith认为低温能够诱导菌核萌发[16]。刘勇和布朗、特伯德在油菜菌核病菌室内子囊孢子诱导和收集研究中发现菌核在10 ℃黑暗、湿润条件下经过2个月以上的低温诱导处理后,在15~20 ℃下即可在室内产生子囊盘[17]。
本实验研究发现,PDA培养基有利于菌落生长和孢子的产生,28 ℃、pH7条件有利于菌丝的生长;菌株对NaCl比较敏感,特别是在NaCl浓度为0%~1.0%范围内,随着NaCl浓度的升高,菌株生长显著降低;而在NaCl浓度为1.0%~2.0%范围内,随着NaCl浓度的升高,抑菌效果变化并不明显,但对腐皮镰孢霉菌的生长仍具有较明显的抑制作用。菌株对碳源的适应性比较强,所有测试碳源均可利用;不同氮源对菌株生长的影响可以达到极显著(p<0.01),腐皮镰孢菌利用氮源的能力依次为天冬酰胺>硝酸铵>硝酸钠>硫酸铵>硝酸钙>硝酸钾>尿素>氯化铵>碳酸铵>草酸铵;在供试的8种微量元素中,菌株可以利用除四硼酸钠、钼酸钠和硫酸锰以外的其他微量元素。
[1]叶昌华,卓明,韩菊兰,等.黄秋葵新品种‘川秋葵1号’选育及栽培技术要点[J]. 南方农业,2015,34:44-45.
[2]Shaoli HUANGA,Taotao LI,Guoxiang JIANG,et al. 1-Methylcyclopropene reduces chilling injury of harvested okra(HibiscusesculentusL.)pods[J]. Scientia Horticulturae,2012(141):42-46.
[3]Saranpuetti C,Tanaka M,Sone T,et al. Determination of enzymes from Colletotrichum sp.AHU9748 essential for lepidimoide production from okra polysac charide[J]. Journal of Bioscience and Bioengineering,2006,102(5):452-456.
[4]Prommakool A,Sajjaanantakul T,Janjarasskul T,et al. Whey protein-okra polysaccharidefraction blend edible films-tensile properties,water vapor permeability and oxygen permeability[J]. Journal of the Science of Food and Agriculture,2011,91(2):362-369.
[5]郑建秋,师迎春,胡铁军. 蔬菜菌核病的识别与防治[J]. 中国蔬菜,2005(2):57-58+2.
[6]曹福祥,戚佩坤. 腐皮镰孢霉的现代分类学[J]. 华南农业大学学报,1991(2):66-73.
[7]练冬梅,姚运法,赖正锋,等.黄秋葵果实加工利用研究进展[J].中国农学通报,2016,32(27):161-164.
[8]洪建基,曾日秋,姚运法,等.黄秋葵种质资源遗传多样性及相关性分析[J].中国农学通报,2015,31(28):79-84.
[9]黄捷,陈晓斌,叶花兰,等.黄秋葵基因组DNA提取及鉴定[J].中国农学通报,2008,24(4):99-103.
[10]Akira TOHYAMA,Kunihiro HAYASHI,Naoki TANIGUCHI,et al. A New Post-Harvest Disease of Okra Pods Caused by Alternaria Alternata[J]. 日植病報1995,61:340-345.
[11]薛志忠,刘思雨,杨雅华. 黄秋葵的应用价值与开发利用研究进展[J]. 保鲜与加工,2013(2):58-60.
[12]方中达.植病研究方法[M].第三版. 北京:中国农业出版社,1998:124-343.
[13]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:28-30.
[14]孙敬贤,张鲁刚. 大白菜菌核病病原菌鉴定及其主要生物学特性[J]. 华北农学报,2015(S1):321-328.
[15]黄娟.核盘菌致病机制的关键因子分析[D].武汉:华中农业大学,2006.
[16]Smith E A,Boland G J. A reliable method for the production and maintenance of germinated sclerotia of sclerotinia sclerotiorium[J]. Canadian Journal of Plant Pathology,1989,11(1):45-48.
[17]刘勇,布朗,特伯德.油菜菌核病菌室内子囊孢子诱导和收集[J].西南农业学报,1993,6(S1):92-94.
ResearchonpathogenidentificationandbiologicalcharacteristicsofsclerotiniafromSichuanokra
XINSong-lin1,2,JIAOLu2,XUXiao-xue2,WANGHui3,QINWen1,*
(1.College of Food Science,Sichuan Agricultural University,Ya’an 625014,China; 2.College of Food Science,Sichuan Tourism College,Chengdu 610100,China; 3.Sichuan Academy of Botanical Engineering,Chengdu 611700,China)
In order to confirm the species and the major biological characteristics of the pathogen of sclerotinia on Sichuan okra. One pathogenic filamentous fungi was isolated from Sichuan okra,based on morphological observation and ITS rDNA sequence analysis,the pathogen was identified asFusariumsolani,the biological characteristics also was researched. The results showed that the optimum temperature of pathogen growth was 28 ℃,the optimum pH was 7,the optimum NaCl concentration was 0.5%. Among the carbon sources,nitrogen sources and trace elements,lactose,asparagine and ferric citrate could significantly increase the colony diameter ofFusariumsolani(p<0.05). It was beneficial to the growth ofFusariumsolani.
Sichuan okra;sclerotinia;pathogen identification;biological characteristics
2016-06-29
辛松林(1981-),男,在读博士研究生,副研究员,主要从事农产品加工与贮藏方面的研究,E-mail:23016024@qq.com。
*通讯作者:秦文(1967-),女,博士,教授,主要从事果蔬采后生理方面的研究,E-mail:qinwen1967@aliyun.com。
四川省科技厅应用基础计划项目(2016JY0119);四川省教育厅自然科学重点项目(16ZA0351)资助。
TS201.2
:A
:1002-0306(2017)12-0186-06
10.13386/j.issn1002-0306.2017.12.034

