Cr-MIL-101-NH2的手性后合成修饰
王萍萍 陈旦平 汪淑华 陈超*,
(1遵义医学院药学院,遵义563000)
(2南昌大学化学学院应用化学研究所,南昌330031)
Cr-MIL-101-NH2的手性后合成修饰
王萍萍*,1,2陈旦平2汪淑华2陈超*,2
(1遵义医学院药学院,遵义563000)
(2南昌大学化学学院应用化学研究所,南昌330031)
采用后合成修饰技术(postsynthetic modification,PSM)设计并合成手性金属-有机框架化合物(metal-organic frameworks,MOFs),将L型脯氨酸衍生物Boc-L-ProCl,后修饰到金属有机-框架化合物Cr-MIL-101-NH2孔道中,制得手性金属有机-框架化合物Cr-MIL-101-PaB2。经核磁(1H NMR)结果证实,修饰产率高达64%,固体圆二色谱(CD)测试结果表明经后合成修饰后的Cr-MIL-101-PaB2具有旋光性。红外光谱(IR)、氮气脱附-吸附、热重(TGA)、粉末X射线衍射(PXRD)手段对其进行表征。实验结果证实,为避免金属-有机框架化合物自组装的不确定性,采用后合成修饰技术,可按需合成手性金属有机-框架化合物。
金属-有机框架化合物;后合成修饰;Cr-MIL-101-NH2;手性
近年来,具有手性结构特征的金属-有机框架化合物(Metal-Organic Frameworks,简称MOFs)在手性对映体拆分、选择性吸附、不对称催化等方面[1-8],表现出了巨大的应用潜能。目前,合成手性金属-有机框架化合物的方法有以下3种:(1)手性配体和金属盐合成,即直接采用光学纯手性配体或同分异构体与金属盐自组装形成手性金属-有机骨架化合物[9-11];(2)非手性配体和金属盐自组装合成,即用非手性但有一定空间(扭曲)构型的有机配体和金属自组装形成手性晶体[12]。(3)手性模板剂诱导合成,即采用手性模板剂诱导,合成具有手性MOFs材料[13]。由于MOFs的晶体工程学合成理论还不够完善,以上3种方法合成手性MOFs材料随机性较大,且合成的MOFs结构不够稳定,有时还伴随着结构穿插现象,导致无孔,限制了手性MOFs在手性分子吸附、拆分、不对称催化等方面的应用。因此,寻求一种合适、高效并按需设计手性MOFs材料的合成方法具有重要意义。后合成修饰(postsynthetic modification,简称PSM,指采用经典的有机合成方法,以化学键键合形式,对金属-有机骨架材料孔道内表面进行功能化修饰。)技术的产生,为按需合成手性MOFs材料提供了一个崭新而快捷的方法。而脯氨酸类衍生物为典型手性有机小分子,多用于模拟酶的催化,且催化效果较好[14-18],但通常为均相反应,难回收且合成成本较高,若将其固载,不仅可回收再利用,还可降低成本、绿色环保。因此本文采用PSM方法,设计制备脯氨酸类手性MOFs材料。选用脯氨酸衍生物Boc-L-ProCl,将其后修饰到具有大孔径、高比表面积的Cr-MIL-101-NH2的上制得手性MOFs材料Cr-MIL-101-PaB2。分别用核磁(1H NMR)、红外光谱(IR)、氮气脱附-吸附、固体圆二色谱(CD)等手段对手性Cr-MIL-101-PaB2进行表征,证实以PSM方法成功设计并制备出手性MOFs材料Cr-MIL-101-PaB2,且在设计、合成手性MOFs材料方面,PSM方法可避免直接合成手性晶体结构的不确定性,是可行且具有潜力的方法。
1 实验部分
1.1 试剂与仪器
试剂:对苯二甲酸(分析纯)、硫酸(分析纯)、发烟硝酸(分析纯)、九水硝酸铬(分析纯)、无水乙醇(分析纯)、氯化亚锡(分析纯)、浓盐酸(分析纯)、草酰氯(化学纯)、二氯甲烷(分析纯)、吡啶(分析纯)、二甲亚砜(分析纯)、三乙胺(分析纯)、碳酸氢钠(分析纯)、BOCL-Proline(纯度≥98.5%)、三氟乙酸(分析纯)。
实验仪器:ASAP-2020物理化学吸附仪(BET,美国麦克公司),脱气处理5℃·min-1,由25℃升至140℃,脱气至666.4 Pa即可检测,高纯氮为吸附质,比表面积的计算方法采用BJH法。普析多晶X射线衍射仪(PXRD,北京普析通用公司),以Cu Kα为辐射源,λ=0.154 06 nm,工作电压为40 kV,电流30 mA,扫描范围(2θ)和扫描速率分别为:小角1°~5°,扫描速度0.5°·min-1,大角4°~40°,扫描速度1°· min-1。SDTQ600同步热分析仪(TGA,美国TA公司),N2氛围,升温速率为5℃·min-1,升温范围28~750℃。Nicolet 5700型红外光谱仪(美国热电公司),光谱纯KBr压片,扫描范围400~4000 nm,扫描次数32次。圆二色谱仪(JASCO J810(S)),扫描范围200~600 nm。
1.2 Cr-MIL-101-NH2的手性后合成修饰
1.2.1 Cr-MIL-101-NH2的制备
配体硝基对苯二甲酸和Cr-MIL-101-NO2均参照文献方法合成[19]。然后取0.1 g干燥的Cr-MIL-101-NO2放入50 mL三颈瓶内,加入30 mL乙醇和0.7 g氯化亚锡,80℃回流6 h后,冷至室温,加入10 mL浓HCl搅拌过夜。次日过滤得黄绿色固体,用乙醇和水洗至pH值约为6~7,放入100℃烘箱干燥,既得Cr-MIL-101-NH2。
1.2.2 手性Cr-MIL-101-PaB2的合成
0℃下,在100 mL三颈瓶内通入氮气并加入40 mL CH2Cl2,0.3 g 100℃真空干燥7 h的Cr-MIL-101-NH2,开始搅拌,加入192 μL三乙胺,0℃下缓慢滴加Boc-L-ProCl溶液[20],滴加完毕后,升至室温搅拌过夜。次日离心反应液,得到修饰后的Cr-MIL-101-Pro-amino-Boc-1(简写为Cr-MIL-101-PaB1),向其中加入40 mL 10%NaHCO3溶液搅拌20 min,离心出固体,分别用水、乙醇洗至pH值为中性后,55℃真空干燥。经1H NMR判断,后修饰的比率为30%。将Cr-MIL-101-PaB1重复上述步骤,经过2次后合成修饰过程,得到手性后修饰比率为50%的MOFs材料Cr-MIL-101-Pro-amino-Boc-2(简写为Cr-MIL-101-PaB2)。

图1Cr-MIL-101-NH2手性后修饰合成图Fig.1Chiral PSM synthetic route of Cr-MIL-101-NH2
2 结果与讨论
2.1 合成及表征
由于元素Cr具有顺磁性,会干扰核磁共振谱仪的固有磁场,致使测得的1H NMR谱图不准确,因此,采用20%HCl和2%NaOH溶液消解Cr-MIL-101以除去Cr3+离子,丙酮重结晶后得到相应MOFs的配体,利用配体中苯环特征质子峰位置的不同,判断Cr-MIL-101系列MOFs材料的合成效果和后修饰比率。如图2a中Cr-MIL-101-PaB2配体核磁图谱所示,化学位移2.02、4.28和4.46为Cr-MIL-101-PaB2配体中吡咯环的质子峰,2.67是吡咯环NH的质子峰。图2a中并未发现Cr-MIL-101-PaB2配体的叔丁基质子峰,经文献证实是因为消解Cr-MIL-101-PaB2材料过程中,所用到的强酸HCl和强碱NaOH,导致部分叔丁氧羰基(BOC)键断裂。但图3红外光谱图可佐证叔丁氧羰基(BOC)存在于Cr-MIL-101-PaB2骨架中。图2b是等比例缩放范围在δ=6.5~9.6之间的Cr-MIL-101-PaB2、Cr-MIL-101-NO2、Cr-MIL-101-NH2配体核磁图谱,可知经过后修饰还原反应,Cr-MIL-101-NO2的配体BDC-NO2质子峰δ=8.39、8.28、7.95,完全转化为Cr-MIL-101-NH2的配体BDC-NH2苯环上3个质子峰δ=7.75、7.37和7.00,产率为100%。δ=8.76、8.0、7.71处为新生成的质子峰,说明通过后修饰过程Cr-MIL-101-NH2与Boc-L-ProCl发生反应,生成Cr-MIL-101-PaB2的配体上苯环质子峰,另外δ=7.75、7.37和7.00依然存在,但强度大为降低,说明Cr-MIL-101-NH2骨架上仅有部分氨基与Boc-L-ProCl发生酰基化反应,通过质子峰积分计算,可得出有64%氨基转化成脯氨酸酰胺类化合物,即Cr-MIL-101-PaB2产率有64%。本次后修饰达到产率较高且反应次数少的程度,与常规合成MOFs材料方法相比,目的更明确。

图2 化合物核磁图Fig.21H NMR spectra of the compounds
如图3所示,与Cr-MIL-101-NH2红外光谱比较,Cr-MIL-101-PaB2新增3个特征峰,其峰位置及归属分别为:特征峰701 cm-1归属于酰胺V峰即仲酰胺的N-H键面外弯曲振动产生的峰。特征峰2 971 cm-1归属于叔丁氧羰基(BOC)中甲基特征吸收峰,1 627 cm-1归属于叔丁氧羰基(BOC)羰基的伸缩振动峰。因此通过分析1H NMR谱图和红外谱图表明,以后合成修饰方法,使Boc-L-ProCl键合在Cr-MIL-101-NH2骨架中,从而生成Cr-MIL-101-PaB2。
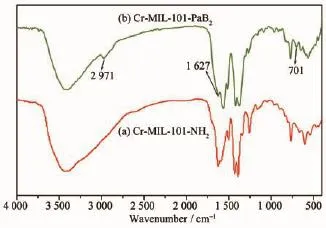
图3 Cr-MIL-101-NH2、Cr-MIL-101-PaB2的红外光谱图Fig.3IR spectra of Cr-MIL-101-NH2,Cr-MIL-101-PaB2
由氮气吸附-脱附曲线图(图4)可知,Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB1、Cr-MIL-101-PaB2比表面积分别为2 507、2 989、1 688、1 163 m2·g-1。且Cr-MIL-101系列的MOFs材料的吸附脱附曲线均在p/p0=0.9处左右出现滞后环,表明后修饰前后的MOFs材料均具有有序的介孔结构。氮气吸附、脱附的量大小顺序为:Cr-MIL-101-NH2≥Cr-MIL-101-NO2≥Cr-MIL-101-PaB1≥Cr-MIL-101-PaB2,表明随着后修饰官能团分子尺寸的增大和后修饰次数增多,氮气吸附、脱附的量依次减小,这是因为经过后合成修饰,MOFs材料骨架原本的孔空间被新增加的有机分子占据,余留下的孔空间就会减小,导致吸附氮气的能力相应减小;而Cr-MIL-101-NO2经过后修饰的还原反应,原本骨架中的硝基分子全部转换成了氨基分子,氨基分子尺寸小于硝基分子,因此释放出多余孔空间,利于氮气进出MOFs骨架内外。
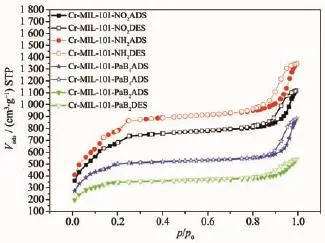
图4 Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB1、Cr-MIL-101-PaB2氮气脱附-吸附曲线图Fig.4Nitrogen adsorption-desorption isotherms of Cr-MIL-101-NO2,Cr-MIL-101-NH2,Cr-MIL-101-PaB1, Cr-MIL-101-PaB2
图5 孔径分布图所示,佐证氮气脱附-吸附曲线图得出的结论,由于氨基分子尺寸小于硝基分子尺寸,因此Cr-MIL-101-NH2孔径尺寸2.33 nm较Cr-MIL-101-NO2孔径尺寸为2.19 nm多出0.14 nm。且Cr-MIL-101-NH2孔径尺寸多集中于介孔范围,经过2次后修饰,由于Boc-L-ProCl分子尺寸较大且键合到介孔上,导致Cr-MIL-101-PaB2几乎无介孔,大部分孔径尺寸集中于微孔范围。

图5 Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB2孔径分布图Fig.5Pore size distribution of Cr-MIL-101-NO2,Cr-MIL-101-NH2,Cr-MIL-101-PaB2
从化合物的粉末X射线衍射(PXRD)数据(图6)可知,小图为Cr-MIL-101系列小角粉末衍射(0°< 2θ<5°)的PXRD图,大图为Cr-MIL-101系列小角粉末衍射(4°<2θ<30°)的PXRD图。合成的Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB2的晶体衍射图与模拟的PXRD图一致,可知均为单一相固体,是符合设计需求的目标产物,并且通过后合成修饰,Cr-MIL-101-PaB2晶型保持不变,骨架完整未坍塌。同时,可知选用的后修饰反应条件较温和,对Cr-MIL-101材料整体晶体骨架没有造成破坏。
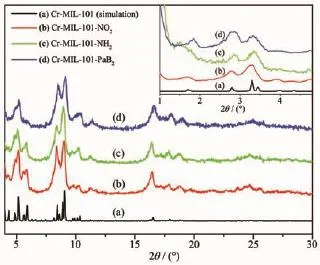
图6 Cr-MIL-101、Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB2的粉末衍射图Fig.6Powder XRD patterns of Cr-MIL-101-NO2,Cr-MIL-101-NH2,Cr-MIL-101-PaB2
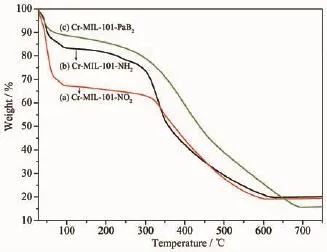
图7 Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB2的热重曲线Fig.7TGA curves of Cr-MIL-101-NO2,Cr-MIL-101-NH2, Cr-MIL-101-PaB2
图7 为Cr-MIL-101-NO2、Cr-MIL-101-NH2、Cr-MIL-101-PaB2在氮气氛围下测定的热重曲线图,以5℃·min-1升温速率从28℃升至750℃,合成的Cr-MIL-101系列材料表现出相似的失重过程:在28~300℃温度范围内的失重,归属于Cr-MIL-101系列材料中孔道内吸附的客体分子水、乙醇等溶剂的失去。Cr-MIL-101-NH2的热重曲线在315℃迅速下降,表明Cr-MIL-101-NH2骨架开始坍塌,600℃完全分解。Cr-MIL-101-NO2、Cr-MIL-101-PaB2均在300℃骨架开始坍塌,骨架完全分解温度分别为619、711℃。表明经过后合成修饰,Cr-MIL-101系列MOFs材料骨架坍塌温度和骨架完全分解温度区别不大,基本上保持一致,且仍具有良好的热稳定性。
2.3 Cr-MIL-101-PaB2的手性鉴定
由固体圆二色谱图8可知,BOC-L-Proline在224 nm处出现正科顿效应。Cr-MIL-101-PaB2在253 nm处出现负科顿效应。并且科顿效应的出峰位置和强度均不相同,表明BOC-L-Proline和Cr-MIL-101-PaB2都是具有单一手性的化合物。

图8 BOC-L-Proline、Cr-MIL-101-PaB2的圆二色谱图Fig.8CD spectra of BOC-L-Proline and Cr-MIL-101-PaB2
2.4 Cr-MIL-101-Pa2催化不对称aldol反应评估
将Cr-MIL-101-PaB2脱保护处理制成手性催化剂Cr-MIL-101-Pa2,具体步骤如下:0℃在100 mL三颈瓶中,充入氮气保护气,加入0.111 g Cr-MIL-101-PaB2,10 mL干燥的CH2Cl2,缓慢滴加1.56 mL三氟乙酸,0℃反应6 h。反应后处理:离心固体将其放入烧杯中加水搅拌20 min,离心出固体,加入10%碳酸氢钠溶液20 mL搅拌20 min,离心,用水洗固体,至上层清液的pH值为中性,固体放入70℃干燥,得到手性催化剂Cr-MIL-101-Pa2如图9,用于催化不对称aldol反应。
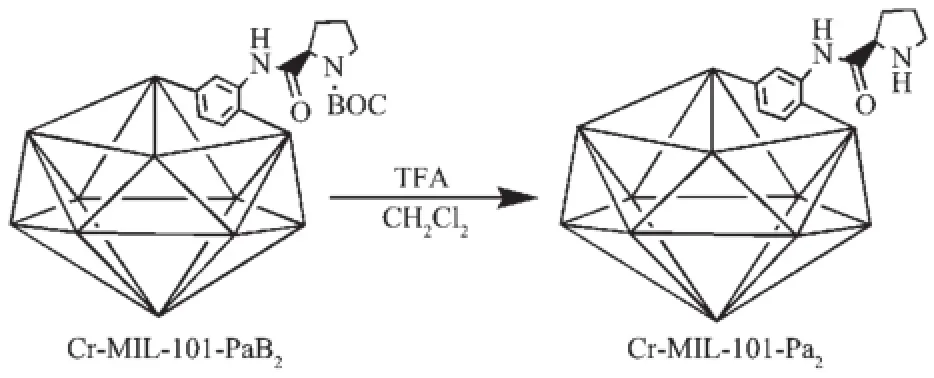
图9 Cr-MIL-101-Pa2制备过程Fig.9Cr-MIL-101-Pa2preparation process
催化效果如表1所示,Cr-MIL-101-Pa2手性催化效果较低,经吸附实验表征氮气脱附-吸附量减少,Cr-MIL-101-Pa2比表面仅有432 m2·g-1,断定在脱除保护基叔丁氧羰基的过程中产生某种物质,堵住Cr-MIL-101-Pa2孔道。利用程序升温脱附-质谱联用检测MOFs材料孔道内的物质,将温度从室温25℃升至750℃,Cr-MIL-101-Pa2在297℃骨架开始分解,在此期间用氮气不间断吹扫Cr-MIL-101-Pa2,将其分解后的物质带入质谱检测器,从而分析出Cr-MIL-101-Pa2孔道内的物质。如图10可看出,三氟乙酸质谱的三强峰45、69、51,因此判断在MOFs材料Cr-MIL-101-Pa2孔道内含有三氟乙酸,因此证实我们的猜想:Cr-MIL-101-Pa2脱除保护基过程中,碳酸氢钠未能将Cr-MIL-101-PaB2孔道内的三氟乙酸洗净,致使碱化不完全。孔道中的三氟乙酸与保护基叔丁氧羰基接触后,极易生成粘稠的中间体,从而堵塞Cr-MIL-101-PaB2孔道,致使Cr-MIL-101-PaB2催化不对称aldol反应效果较差。
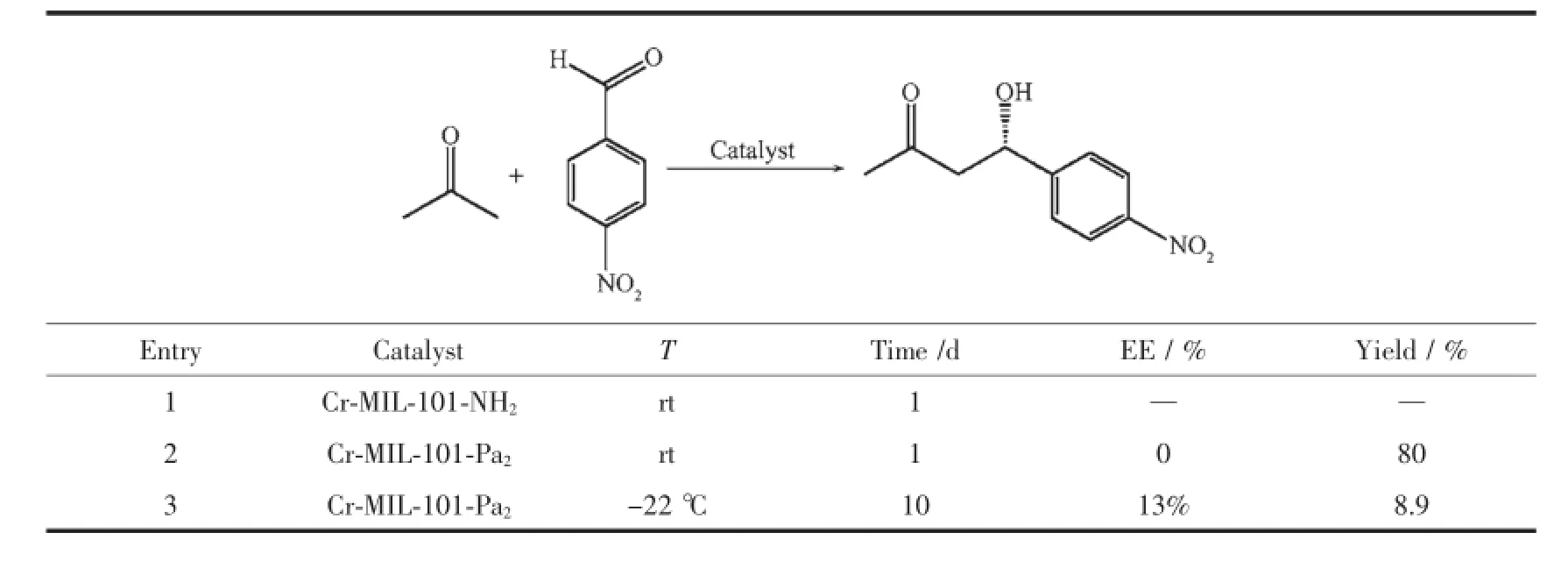
表1 Cr-MIL-101-Pa2不对称催化效果Table 1Cr-MIL-101-Pa2asymmetric catalytic effect

图10 Cr-MIL-101-Pa2程序升温脱附-质谱联用分析Fig.10Temperature-programmed desorption-mass spectrometry analysis of Cr-MIL-101-Pa2
3 结论
以按需求设计并合成手性MOFs材料为出发点,选用PSM技术,有效回避了合成过程中由自组装带来的不确定性,成功制备带有脯氨酸衍生物类的手性Cr-MIL-101-PaB2,结合材料的表征手段,证实仅重复后修饰1次,后修饰产率高达64%,且手性小分子在Cr-MIL-101-PaB2孔道中以键合形式存在,不易脱除。虽然催化不对称aldol反应效果不尽人意,但该研究结果为后修饰方法设计、合成手性MOFs方面,提供了强有力的实验依据,开辟出一条高效、快捷合成手性MOFs的新途径。
[1]Zhang J P,Zhang Y B,Lin J B,et al.Chem.Rev.,2012,112 (2):1001-1033
[2]Férey G.Chem.Soc.Rev.,2008,37(1):191-214
[3]Ma L Q,Abneya C,Lin W B.Chem.Soc.Rev.,2009,38(1): 1248-1256
[4]An H Y,Wang E B,Xiao D R,et al.Angew.Chem.,2006, 118:918-922
[5]Liu T F,Liu Y,Xuan W M,et al.Angew.Chem.Int.Ed., 2010,49:4121-4124
[6]Gao Q,Jang F L,Wu M Y,et al.Cryst.Growth Des.,2010, 10(1):184-190
[7]Chen B L,Eddaoudi M.Science,2001,291(9):1021-1023
[8]Liu Y,Xi X B,Ye C C,et al.Angew.Chem.Int.Ed.,2014, 53:13821-13825
[9]Lun D,Waterhouse G,et al.J.Am.Chem.Soc.,2011,133: 5806-5809
[10]Peng Y W,Gong T F,Zhang K,et al.Nat.Commun.,2014, 5:4406
[11]Mo K,Yang Y H,Cui Y.J.Am.Chem.Soc.,2014,136: 1746-1749
[12]Prior T,Rosseinsky M.Inorg.Chem.,2003,42(5):1564-1575
[13]Tian G,Zhu G S,Yang X Y.Chem.Commun.,2005:1396-1398
[14]Tan R,Li C Y,Luo J Q,et al.J.Catal.,2013,298:138-147
[15]Zhu W T,Wu X,He C,et al.Tetrahedron,2013,69:1047-10481
[16]Fotaras S,Kokotos C,Kototos G.Org.Biomol.Chem.,2012, 10:5613-5619
[17]He L,Tang Z,Cun L F,et al.Tetrahedron,2006,62:346-351
[18]Chen X H,Yu J,Gong L Z.Chem.Comm.,2010,46:6437-6448
[19]GAO Xin-Qin(高欣钦),WANG Fu-Dong(王福东),YANG Jin-Zong(杨锦宗).Dyestuff Industy(染料工业),1996,33(4): 22-24
[20]Wu X,He C,Wu X,et al.Chem.Commun.,2011,47:8415-8417
Chiral Postsynthetic Modification of Cr-MIL-101-NH2
WANG Ping-Ping*,1,2CHEN Dan-Ping2WANG Shu-Hua2CHEN Chao*,2
(1Zunyi Medical College,Zunyi,Guizhou 563000,China)
(2Institute of Applied Chemistry,Nanchang University,Nanchang 330031,China)
By postsynthetic modification method(PSM),chiral metal-organic frameworks(MOFs)were designed and synthesized.The L-proline derivative(Boc-L-ProCl)was anchored on the pore of Cr-MIL-101-NH2by PSM method to gain a chiral MOFs(Cr-MIL-101-PaB2).1H NMR spectra confirmed the yield up to 64%by twice process of PSM,and solid circular dichroism(CD)result showed that Cr-MIL-101-PaB2was a chiral compound. Their structures were characterized by infrared spectroscopy(IR),nitrogen desorption-adsorption,thermogravimetry (TGA),powder X-ray diffraction(PXRD).The experimental results confirmed that synthesized chiral MOFs by PSM method for the needed purpose can avoid the self-assembly uncertainty of MOFs.
MOFs;PSM;Cr-MIL-101-NH2;chiral
O614.61+1
A
1001-4861(2017)05-0817-06
10.11862/CJIC.2017.095
2016-12-28。收修改稿日期:2017-03-22。
国家自然科学基金(No.21561020,21261017),江西省自然科学基金(No.20122BAB213003,20132BAB203009,20132BAB213004,20133ACB20001)和江西省教育厅自然科学基金(No.GJJ11012)资助项目。
*通信联系人。E-mail:chaochen@ncu.edu.cn,chouchongbaobao@163.com
- 无机化学学报的其它文章
- 火焰辅助热解方法制备Ag2O/TiO2及其光催化制氢性能
- Tm3+/Er3+/Ho3+共掺SiO2-Bi2O3-AlF3-BaF2玻璃发光性能
- 一种三足四齿Schiff碱的Cu(Ⅱ)、Co(Ⅲ)配合物的合成、晶体结构与表征
- Syntheses, Crystal Structures and Insulin-like Activity of Maltolato- and Ethylmaltolato-Coordinated Oxovanadium(Ⅴ) Complexes Derived from 4-Fluoro-N′-(3-ethoxy-2-hydroxybenzylidene)benzohydrazide
- Electrochemically Self-Assembled Fe/Cu Nanocomposite with Improved High-Rate and Low-Temperature Performances for Nickel-Iron Alkaline Battery
- 碳化硅衍生碳的制备及其超级电容性能

