紫苏醇对肺癌A549细胞增殖和侵袭的抑制作用机制的研究①
刘行仁 白义凤 梁 良 冯 静 邓 菲
(四川省医学科学院·四川省人民医院呼吸科,成都610072)
紫苏醇对肺癌A549细胞增殖和侵袭的抑制作用机制的研究①
刘行仁 白义凤②梁 良②冯 静③邓 菲④
(四川省医学科学院·四川省人民医院呼吸科,成都610072)
目的:探讨紫苏醇(Perillyl alcohol,PA)对肺癌A549细胞增殖和侵袭的抑制作用机制,并阐明其对肿瘤血管生成信号的影响。方法:不同浓度PA和厄洛替尼加入到A549细胞中,利用溴化3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑(MTT)法测定药物组对A549细胞的抑制作用,Transwell法检测PA对A549细胞侵袭的抑制作用,采用间接荧光标记法测定细胞内活性氧(ROS)水平的变化;分光光度法检测PA对细胞凋亡蛋白Caspase-3活性的影响,Western blot法检测A549中VEGF、HIF-1α及COX-2的表达,凝胶迁移或电泳迁移率实验测定A549细胞中NF-κB活性。结果:与空白对照组比较,随着浓度的增加(10、50、100 μg/ml),PA和厄洛替尼对A549细胞生长的抑制率在不断地增加,差异均有统计学意义(P<0.05),A549细胞侵袭能力呈现不断下降的趋势,差异均有统计学意义(P<0.05),A549细胞内活性氧水平随厄洛替尼浓度的增加变化不大,而ROS水平随着PA的浓度的增加而增加,在100 μg/ml浓度的PA下引起的ROS百分率达到了(80.43±6.92)%,差异均有统计学意义(P<0.05)。细胞活力检测结果显示,随着PA和厄洛替尼浓度的增加和作用时间的延长,A549细胞中凋亡蛋白Caspase-3活性明显增加(P<0.05),随着紫苏醇浓度的增加,COX-2、VEGF和HIF-1α的表达呈不断降低的趋势,EMSA检测结果显示,随着PA浓度的增加,NF-κB的条带面积不断减少。结论:PA可能参与并促进了ROS的生成和Caspase-3活性增加,最终诱导A549细胞的凋亡,PA可能通过降低NF-κB的表达,进而诱导COX-2、VEGF等的表达减少,使血管生成滞后,能够有效地使细胞的穿透能力下降和凋亡发生。
紫苏醇;肺癌A549细胞;增殖抑制作用;活性氧(ROS)水平;Caspase-3活性;血管生成信号通路
剂量、疗效和药物毒性等因素在肺癌常规的放化疗方案上已累积达到了极限,人们往往急需寻求低毒、高效性的作用机制上有别于现有化疗药物的物质,进而对肿瘤产生更强的杀伤力。肿瘤免疫治疗在奥地利召开的2015年“欧洲癌症大会上成为一个亮点,核因子NF-κB蛋白家族与多种基因的启动子和增强子序列位点特异性结合,调节基因的转录和表达,参与免疫、炎症、应激等反应,同时也参与调控细胞分化、增殖、凋亡等过程。NF-κB的激活途径主要有经典途径和旁路途径两条,这两条途径的激活最终都是通过磷酸化IκBα蛋白,并解除其对NF-κB的抑制来实现,因此NF-κB与慢性炎症及肿瘤的形成有着至关重要的关系。
紫苏醇 (Perillyl alcohol,PA) 主要以游离态或酯的形式天然存在于柑橘、樱桃、薄荷、香柠檬、姜草、杂薰衣草等多种植物中,具有多种生物活性[1]。近年来紫苏醇作为一种高效、广谱、低毒的抗癌药物,已经受到广泛关注和研究。研究表明,PA对食管癌[2]、胰腺癌[3]、结肠直肠癌[4]、卵巢癌和乳腺癌[5]等肿瘤均有预防和治疗作用,李询等[6]研究了PA体外对NCI-H1299和A549细胞的生长和低毒性,李明潺等[7]研究了槐定碱对肺癌A549 细胞体外增殖和侵袭抑制作用及机制的研究,但是相关的PA抗肺癌A549细胞机制没有进行探讨,因此,本实验拟以肺癌A549细胞为研究对象,通过体外和细胞实验初步探讨PA对肺癌A549细胞增殖和侵袭的作用机理,并检测和探讨抗NF-κB血管生成信号通路的机制。
1 材料与方法
1.1材料
1.1.1细胞系 人肺癌A549细胞购买于中国科学院上海细胞库,在本实验室进行培养。
1.1.2药物与试剂 紫苏醇(高效液相鉴定纯度>98%, 含量20 mg),购自阿拉丁试剂(上海)有限公司,4℃保存,待用。盐酸厄洛替尼片购自瑞士罗氏有限公司,国药准字J20090116;四甲基偶氮唑盐(MTT)购买于上海生工生物工程有限公司;小牛血清购买于杭州四季青生物试剂公司;胰蛋白酶、RPMI1640 培养基购自美国Gibco公司;FITC/PI双染试剂盒购买于碧云天生物试剂公司;活性氧试剂盒购买于美国Sigma公司等。
1.1.3仪器 pHS-3C型酸度计购自上海雷磁仪器厂;二氧化碳培养箱(RCO3000TVBA)购自美国REVCO公司;流式细胞仪(FACSAria)购自美国Becton Dikinson公司;酶联免疫检测仪(MULTISKAN MK3)购自芬兰Labsystems公司;Bio-Rad680型酶联检测仪购自北京普析通用仪器有限责任公司。
1.2方法
1.2.1A549细胞增殖抑制试验测定 200 μl/孔的对数生长期A549细胞(1×105/孔)接种于96孔板中,进行培养。培养24 h后,分别加入PA和厄洛替尼(10、50、100 μg/ml)培养基,设定空白对照组,每个药物3个平行孔。分别培养24 h,每孔加入20 μl 的5 mg/ml MTT试剂,在培养箱中继续培养4 h。之后把培养基吸出,加入150 μl 的DMSO试剂,充分振荡后,充分溶解结晶,在570 nm处用酶标仪测定各孔的吸光度(OD)。计算细胞活性=实验组OD值/对照组OD值×100%。
1.2.2A549细胞转移的抑制能力测定 准备Transwell小室的滤膜内表面涂细胞外基质胶(50 μg/室)。小室干燥后重新加入含有0.1%胎牛血清的细胞培养基水化。4.0 × 105ml-1的重悬浮细胞在Transwell小室的下室中加入新鲜10%胎牛血清培养基,而在上室中加入PA和厄洛替尼(10、50、100 μg/ml)培养基组,设定空白对照组,每个药物3个平行孔,培养24 h,每孔中加入100 μl细胞悬浮液。常规细胞培养24 h。取出小室后,使用PBS溶液冲洗滤膜,使用PBS棉棒吸除和擦除上室的细胞,再根据Transwell小室使用说明进行染色观察从而计算穿膜的细胞数,从而反映各组细胞的侵袭能力。实验为3次重复实验。
1.2.3A549细胞内ROS检测 A549细胞接种后,在恒温恒湿培养箱培养24 h后,分别加入PA(10、50、100 μg/ml)的培养基,3个平行组。加入400 μl DCFH-DA(二氯氢化荧光素,10 μg/ml),充分混匀后,避光孵育15 min后,用 PBS洗去除细胞外荧光剂。并用PBS重悬细胞10 min后对荧光强度进行检测。
1.2.4凋亡蛋白Caspase-3活性的检测 分析前将Caspase-GlooR3试剂与96孔板置于室温平衡,选取(10、50、100 μg/ml)浓度的PA处理6、12和24 h 后,向细胞培养物中加Caspase-GlooR3试剂,轻轻震荡30 s,室温孵育1 h后,用酶标仪405 nm处OD值检测。
1.2.5A549细胞中VEGF、HIF-1α和COX-2的表达 收集对数生长期的A549细胞进行相应的空白对照组和PA组处理24 h,进行各组细胞总蛋白的提取,通过Bradford的方法调整相同的蛋白浓度后,进行电泳获得根据分子量分离的蛋白条带,根据pierce公司Western blot显像试剂盒的指导说明来进行,蛋白的NC膜电转,进行蛋白封闭和一抗结合。本研究一抗包括:大鼠抗人HIF-1α(1∶1 000)、VEGF(1∶1 000)和COX-2(1∶1 000)多克隆抗体。一抗结合后洗脱,再进行二抗孵育标记兔抗大鼠的多克隆抗体(1∶10 000)。ECL试剂盒显色后,暗室发光拍照,以β-Actin为内参进行系统软件分析。
1.2.6EMSA法测定NF-κB活性 接种2×106ml-1的对数生长期A549细胞于培养瓶,置于5%CO2、37℃培养箱培养24 h,加入PA浓度为10、50和100 μg/ml,混合24 h后对各组细胞核蛋白进行提取,并应用购买的试剂盒对蛋白浓度测定。本实验经凝胶电泳后,将提取蛋白转移至结合膜上,并用封闭液对结合膜封闭后,加Streptavidin-HRP反应液进行反应,并用洗涤液洗膜多次,最后用Lighten® HRP底物液进行压片和显影。
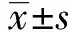
2 结果
2.1PA对A549细胞生长的抑制作用 图1显示,不同浓度PA对A549细胞生长的抑制曲线,选取10、50、100 μg/ml 3个浓度作为研究对象。表1所示,解析PA和厄洛替尼对A549细胞生长和侵袭的抑制作用,与空白对照组比较,随着PA和厄洛替尼浓度的增加(10、50、100 μg/ml),PA和厄洛替尼对A549细胞生长的抑制率在不断地增加,差异具有统计学意义(P<0.05)。
2.2PA对A549细胞侵袭转移能力的抑制作用 从表1中看出,与空白对照组相比,随着PA和厄洛替尼浓度的增大,细胞侵袭能力呈现不断下降的趋势,差异具有统计学意义(P<0.05)。
2.3PA诱导的A549细胞内ROS的产生 用不同浓度PA和厄洛替尼作用A549细胞48 h 后,表2所示,与空白对照组相比,细胞内活性氧水平随厄洛替尼浓度的增加变化不大,而随着PA浓度的增加而增加,图2中细胞内的ROS荧光随浓度增加而变多,在100 μg/ml浓度下的PA引起的ROS百分率达到了(80.43±6.92)%,与空白对照组比较,具有显著性差异(P<0.05)。
2.4A549细胞凋亡蛋白Caspase-3活性检测 细胞活力检测结果显示,随着PA和厄洛替尼(10、50、100 μg/ml)浓度的增加和作用时间的延长,A549细胞中凋亡蛋白Caspase-3活性明显增加(P<0.05)。

图1 不同浓度PA对A549细胞生长的抑制作用Fig.1 Inhibitory effect of PA on growth of A549 cell
2.5A549细胞中VEGF、HIF-1α和COX-2的表达 如图3,在不同浓度紫苏醇的存在下, 与空白对照组相比,随着紫苏醇浓度的增加,COX-2、VEGF和HIF-1α的表达呈不断降低的趋势。

表1 PA对A549细胞生长和侵袭能力的抑制作用
Note:Compared with control group,1)P<0.01;2)P<0.05.

表2 PA对A549细胞内ROS产生的影响
Note:Compared with control group,1)P<0.01;2)P<0.05.

图2 PA对A549细胞内ROS产生的影响Fig.2 Effect of PA on production of ROS in A549 cell

表3 PA对细胞Caspase-3活性的影响
Note:Compared with control group,1)P<0.01;2)P<0.05.

图3 PA对肿瘤细胞A549中COX-2、VEGF和HIF-1α表达的影响Fig.3 Expression of COX-2,VEGF and HIF-1α of PA on A549

图4 NF-κB 蛋白表达的 EMSA结果Fig.4 EMSA result chart of protein expression of NF-κB
2.6PA对核转录因子蛋白NF-κB 活化的调节 图4的EMSA检测结果显示:随着PA浓度的增加,NF-κB的条带面积在不断地减少。
3 讨论
信号通路的下放与肿瘤的发生、转移息息相关,报道显示众多癌症预后不良反应均与肿瘤喜好通路有关[8],同时肿瘤组织也会通过内源性因子的调控促进肿瘤细胞的生长[9]。因此,阻截信号通路下放已成为肿瘤靶向治疗的重要手段之一。众所周知,在细胞凋亡过程中,Caspase-3和Caspase-9共同组成了酶联反应的终末因子[10,11],在肿瘤的凋亡通路中起到开关作用[12-14],在PA的存在下,Caspase-3和Caspase-9蛋白表达的增加是导致细胞凋亡的重要原因,进而对酶联反应进行有效的调控,能够使细胞的穿透能力下降,从而达到阻碍A549细胞侵袭的效果。实验结果显示,PA能够参与并影响Caspase级联反应诱导凋亡通路的活性。
考察了不同浓度的PA对细胞内ROS的影响,发现PA可以诱导细胞内ROS水平升高,而ROS是由细胞内氧代谢或外源性氧化剂产生的具有生物活性的氧分子[15,16],其在启动和调节细胞凋亡中具有重要作用,而ROS的检测手段能够通过DCF荧光强度,试验中发现厄洛替尼未引起细胞内ROS水平的上升,这和刘晓敏等[17]的研究结论是一致的,细胞凋亡的机制可能与细胞内ROS水平升高有关,此外刘胜姿等[18]也发现5,7-DMF通过促进A549细胞内活性氧生成从而增强TRAIL诱导肺癌细胞的凋亡。因此可以说明参与PA并促进了ROS诱导A549细胞的凋亡。隋文文等[19]研究表明,肿瘤在缺氧状态下促进血管生成因子COX-2、VEGF等的表达,而缺氧过程中也可以通过调节HIF-1α/HRE的结合来调节COX-2基因的表达;进而参与血管的形成,而以上三种都受NF-κB基因调控,故NF-κB信号通路可能就是肿瘤血管生成的主要通路之一,甲基化酶的突变可以造成肿瘤的发生,而NF-κB信号通路的活性降低在免疫系统发育和诱导肿瘤细胞凋亡发生等过程中,起着关键作用。因此PA诱导了ROS水平的升高和NF-κB信号通路表达的降低,会显著降低COX-2、VEGF等的表达,进而使血管生成滞后。此外,NF-κB同时也具有介导免疫应答的正常生理功能。机体受感染后的炎症反应需要启动NF-κB信号通路,转录一些细胞因子来介导免疫应答,以清除入侵的病原菌。对NF-κB的抑制在缓解肿瘤发生发展的同时,也将抑制正常的免疫应答,所以如何平衡这两者的关系,也是以后必须考虑的重点。
本实验为肺癌细胞体外实验,故PA对于人肺癌的治疗作用还需要进一步的动物体内实验以及临床实验。而在分子水平需要进行进一步的信号通路基因的检测,如基因或者微小RNA芯片的检测,再通过蛋白质印迹等手段进行进一步的基因下游表达论证。在后续的实验中,PA将作为一种新型的抗肺癌的化疗药物,被进一步论证和研究。
[1] 华海婴,归振华,乔淑会,等.紫苏醇软膏的制备及其体外经皮渗透研究[J].中草药,2013,44(14):1911-1917.
[2] Liston BW,Nines R,Carlion PS,etal.Perillyl alcohol as a chemopreventive agent in N-nitrosomethylvenzylamine-induced rat esophageal tumorigenesis[J].Cancer Res,2003,63(10):2399-2403.
[3] Lebedeva IV,Suzz A,Vozhilla N,etal.Mechanism of in vitro pancreatic cancer cell growth inhibition by melanoma differentiation-associated gene-7/interleukin-24 and perillyl alcohol[J].Cancer Res,2008,68(18):7439-7447.
[4] Meadows SM,Mulkerin D,Berlin J,etal.Phase II trial o f perillyl alcohol with metastatic colorectal cancer[J].Int J Gastrointest Cancer,2002,32 (23):125-128.
[5] Yuri T,Danbara N,Tsujita-Kyutoku M,etal.Perillyl alcohol inhibits human breast cancer cell growth in vitro and in vivo[J].Breast Cancer Res Treat,2004,84(32):251-260.
[6] 李 询,罗军强,周 捷,等.紫苏醇对肺癌细胞的体外药效作用及毒理学评价[J].广东药学院学报,2010,26(3):287-291.
[7] 李明潺,王玉丽,董林易,等.槐定碱对肺癌A549 细胞体外增殖和侵袭抑制作用及机制的研究[J].中国药学杂志,2015,50(13):1111-1116.
[8] 刘敬弢,袁 霞,徐 波,等.新型蛋白酶体抑制剂YSY-01A 对肿瘤细胞促血管生成作用的抑制及其机制初探[J].生物化学与生物物理进展,2013,40(8):748-756.
[9] 倪晓辰,赵志红,马永良.桧木醇诱导人肾透明细胞癌786-O细胞凋亡及其机制研究[J].中国肿瘤临床,2015,42(1):43-46.
[10] 王 晶.秦皮甲素对人肺癌细胞A549凋亡影响[J].中国公共卫生,2015,31(4):464-466.
[11] Senger DR,Galli SJ,Dvorak AM,etal.Tumor cells secrete a vascular permeability factor that promotes accumulation of ascites fluid[J].Science,1983,219(4587):983-985.
[12] Al-Najar A,Al-Sanabani S,Korda JB.Microvessel density as a prognostic factor in penile squamous cell carcinoma[J].Urol Oncol,2012,30(3):325-329.
[13] Belotte J,Fletcher NM,Alexis M,etal.Sox2 gene amplification significantly impacts overall survival in serous epithelial ovarian cancer[J].Reprod Sci,2015,22(1):38-46.
[14] Tan WF,Zhang XW,Li MH,etal.Pseudolarix acid B inhibits angiogenesis by antagonizing the vascular endothelial growth factor-mediated anti-apoptotic effect[J].Eur J Pharmacol,2004,499(3):219-228.
[15] 刘 仪,王 凯,王介非.氧化应激诱导细胞凋亡的机制[J].中华临床感染病杂志,2008,1(3):123-126.
[16] Sepúlveda M,Gonano LA,Back TG,etal.Role of CaMKII and ROS in rapid pacing-induced apoptosis[J].J Mol Cell Cardiol,2013,63(2):135-145.
[17] 刘小敏,王晓娟,张 杨,等.活性氧改变在PIG11高表达诱导人肝癌HepG-2细胞凋亡中的作用[J].肿瘤,2009,29(12):1116-1119.
[18] 刘胜姿,何丽华,杨小红,等.活性氧介导5,7-二甲氧基黄酮增敏TRAIL诱导肺癌细胞凋亡[J].肿瘤药学,2012,2(1):40-43.
[19] 隋文文,张维东.缺氧诱导因子促进肿瘤血管生成的研究[J].国际肿瘤学杂志,2013,40(6):416-418.
[收稿2016-07-26 修回2016-12-29]
(编辑 张晓舟)
Anti-lungcancereffectandanti-angiogenesistherapystudyofperillylalcohol
LIUXing-Ren,BAIYi-Feng,LIANGLiang,FENGJing,DENGFei.SichuanAcademyofMedicalScience﹠DepartmentofRespiration,SichuanProvincialPeople′sHospital,Chengdu610072,China
Objective:To investigate the inhibitory effect of perillyl alcohol (PA) on the proliferation and invasion of lung cancer cell A549,and the influence of PA on tumor angiogenesis was studied.Methods:Different concentrations of PA and erlotinib were added into lung cancer cell A549,the inhibiting effect of drug group on lung cancer cell A549 was found by MTT assay.The inhibiting effect of PA on lung cancer cell A549 invasion was measured by Transwell assay.ROS changes of PA on lung cancer cell A549 was detected by fluorescent.Influence of PA on Caspase-3 activity of lung cancer cell A549 was measured by spectrophotometry,VEGF,HIF-1α,COX-2 expression in lung cancer cell A549 was measured by Western blot,and the NF-κB activity of lung cancer cell A549 was measured by EMSA.Results:Compared with blank control group,cell growth inhibition rate of PA and erlotinib on lung cancer cell A549 was increasing with the increased concentrations (10,50,100 μg/ml),the difference was statistically significant (P<0.05),the invasion ability of lung cancer cell A549 was decreased continuously,the difference was statistically significant (P<0.05).The ROS level of lung cancer cell A549 had no obvious change with the increasing density of erlotinib,but obviously increased with the increasing concentrations of PA (10,50,100 μg/ml).With the increasing concentrations of PA,the expression of COX-2,VEGF and HIF-1α were continuously decreased.EMSA assay showed that NF-κB was continuously decreased with the increasing concentrations of PA.Conclusion:The antitumor mechanism of PA on lung cancer cell A549 might be related to increase the expression level of ROS and reduce the expression of activity of NF-κB,COX-2,VEGF and HIF-1α with angiogenesis signaling pathway.
Perillyl alcohol;Lung cancer A549 cell;Anti-proliferative effect;ROS level;Caspase-3 activity;Angiogenic signaling pathways
10.3969/j.issn.1000-484X.2017.06.011
①本文受国家自然科学基金(No.81301910)和四川省卫计委科研课题(No.110137)资助。
②四川省医学科学院·四川省人民医院肿瘤科,成都610072。
③四川省医学科学院·四川省人民医院中医科,成都610072。
④四川省医学科学院·四川省人民医院肾内科,成都610072。
刘行仁(1980年-),男,硕士,主治医师,主要从事肺部感染及肺部肿瘤治疗研究,E-mail:syyliudoc@sina.com。
R285.5
A
1000-484X(2017)06-0859-05

