CXCR1、CXCR2及CXCL8在乙肝相关肝癌中的表达及临床意义①
毕惠娟 陈建民 陈静静 王 健
(安徽医科大学第四附属医院检验科,合肥230000)
CXCR1、CXCR2及CXCL8在乙肝相关肝癌中的表达及临床意义①
毕惠娟 陈建民 陈静静 王 健②
(安徽医科大学第四附属医院检验科,合肥230000)
目的:探讨乙肝相关肝癌患者外周血单个核细胞及肝活检组织CXCR1、CXCR2及CXCL8表达及其临床意义。方法:用实时荧光定量PCR法检测36例乙肝相关肝癌患者外周血PBMCs中CXCR1、CXCR2及CXCL8 mRNA水平;SP法检测肝活检组织CXCR1、CXCR2及CXCL8蛋白表达水平;化学发光免疫分析法检测血清CRP水平,并对各指标进行相关性分析。结果:乙肝相关肝癌患者PBMCs中CXCR1、CXCR2及CXCL8 mRNA水平分别为(0.952 7±0.197 2)、(0.896 9±0.173 0)、(1.771 9±0.248 9),较正常对照组明显升高,差异有统计学意义(P<0.01)。SP结果提示,CXCR1、CXCR2及CXCL8的蛋白水平较对照组明显升高(P<0.05)。乙肝相关肝癌患者血清CRP水平与PBMC内CXCR1(r=0.54,P<0.01)、CXCR2(r=0.49,P<0.01)及CXCL8(r=0.63,P<0.01)呈正相关。结论:乙肝相关肝癌患者外周血PBMCs及肝活检组织CXCR1、CXCR2及CXCL8表达明显升高,且与血清CRP呈正相关,推测CXCR1、CXCR2及CXCL8介导的信号转导过程可能在乙肝相关肝癌发病过程中发挥重要作用,为肝癌免疫干扰治疗提供新的靶点。
肝癌;CXCR1;CXCR2;CXCL8;mRNA;单个核细胞;肝活检组织
肝细胞癌是严重危害人类健康的全球性肿瘤,我国高发,每年发病率为28.71/105,占所有恶性肿瘤第4位(10.04%),死亡率为26.04/105,占所有癌症死亡率第2位(14.42%)。众多流行病学资料显示,慢性乙型肝炎病毒(Hepatitis B virus,HBV)感染是肝细胞癌的主要病因,但其具体机制不清。目前肝癌的防治仍面临严峻的挑战,传统的放、化疗早期疗效不明显,毒副作用大,手术切除率低,复发率和转移率高。因此,阐明乙肝相关肝癌发病的分子机制,研发针对肝癌组织局部的分子靶向治疗是肝癌治疗的新方向[1]。近年来,趋化因子受体及其配体在肿瘤中的作用引起了人们的关注。它们广泛参与了细胞生长、分化、凋亡、组织损伤、肿瘤生长和转移等各种疾病的病理生理过程[2]。多数肿瘤细胞均可表达广泛的趋化因子受体,并受趋化因子受体及其配体主导的网络调控。CXCR1、CXCR2作为CXC趋化因子受体家族最重要的两个成员,分别由Holmes等[3]和Murphy等[4]先后成功克隆获得,均定位于染色体2q35,二者同源性高达77%,拥有共同配体CXCL8,在多种肿瘤性疾病中均表达升高,在肿瘤的生长、侵袭转移、耐药及血管新生等方面发挥着极其重要的作用。为了探讨CXCR1、CXCR2及其配体CXCL8在肝癌的增殖生长、侵袭转移中扮演何种作用,本文通过筛选典型的乙肝相关性肝癌患者,检测其外周血PBMCs及肝活检组织中CXCR1、CXCR2及CXCL8的表达,现将结果报道如下。
1 材料与方法
1.1材料
1.1.1临床资料 乙肝相关肝癌患者:筛选我院2014年10月至2015年9月收治的36例乙肝相关肝癌患者,其中男21例,女15例,年龄37~70岁。临床诊断均符合原发性肝癌诊疗规范(2011年版)[5]。另选28例本市中心血站体检正常的献血者为正常对照,其中男16例,女12例,年龄28~69岁。肝活检组织:收集安徽医科大学附属医院2013年8月至2015年10月收治的乙肝相关肝癌患者肝穿与肝外伤手术切除病理标本30例(男18例,女12例),年龄29~73岁。入选病例病理分级均符合2015年原发性肝癌规范化病理诊断指南[6]。正常对照:同期医院收治的肝移植供肝者,经病理诊断证实肝细胞正常患者12例(男9例,女3例),年龄28~53岁。
1.1.2试剂与仪器 ABI7900荧光定量PCR仪(美国Bio-Rad公司);实时聚合酶联反应试剂盒(TaKaRa公司);鼠抗人hCXCR1单克隆抗体(sc-7303,SANTA公司);鼠抗人hCXCR2单克隆抗体(sc-7304,SANTA公司);鼠抗人hCXCL8单克隆抗体(MAB208,R&D公司)。
1.2方法
1.2.1PBMC标本收集 抽取乙肝相关肝癌患者及健康对照者早晨空腹肝素抗凝全血5 ml,加入等体积Hank′s液稀释后置含2 ml Ficoll-Hypaque分离液试管中,2 500 r/min密度梯度离心20 min,收集云雾状单个核细胞层,用RPMI1640完全培养液1 500 r/min离心10 min洗涤细胞2次,收集沉淀细胞,以RPMI1640完全培养液调整悬浮细胞至1×106ml-1。
1.2.2实时荧光定量PCR(qRT-PCR) 采用SYBR Green染料法,以cDNA为模板,在ABI7900荧光定量PCR仪上进行PCR扩增,以GAPDH作为内参,每个样本设3个复孔。根据GenBank中人CXCR1、CXCR2及IL-8 mRNA序列,以Primer Express软件设计基因的特异性引物和探针,由上海生工生物工程技术服务有限公司合成(见表1)。PCR反应条件:95℃预变性30 s;95℃ 20 s,60℃ 20 s,72℃ 30 s,40个循环;72℃ 5 min。反应结束读取循环阈值(Ct)。根据公式ΔCt= Ct目的基因-Ct内参基因和ΔΔCt=ΔCt肝癌组-ΔCt对照组,计算2-ΔΔCt对目的基因的表达进行相对定量。
1.2.3CXCR1、CXCR2及CXCL8蛋白检测 常规切取3~4 μm厚的切片, 60℃烤片1 h,置于新鲜二甲苯中脱蜡后过2次蒸馏水,将切片置于3%双氧水中,微波低热3 min,阻断内源性过氧化物酶,微波修复抗原,滴加50 μl CXCR1/CXCR2/CXCL8(1∶200 稀释)单克隆抗体,置湿盒中4℃过夜(阴性对照以PBS代替一抗),滴加50 μl HRP二抗,孵30.0%(9/30)和56.7%(17/30);CXCR2表达阳性率为76.7%(23/30),其中弱表达和强表达占总病例数的比例分别为26.7%(8/30)和50.0%(15/30);CXCL8表达阳性率为93.3%(28/30),其中弱表达和强表达占总病例数的比例分别为33.3%(10/30)和60.0%(18/30);12例正常肝组织中CXCR1、CXCR2及CXCL8表达阳性率分别为33.3%(4/12)、25.0%(3/12)、41.6%(5/12),阳性染色强度均较HCC组弱(见图4)。通过统计学分析,发现HCC患者肝活检组织CXCR1、CXCR2及IL-8蛋白表达较对照组升高,差异有统计学意义(P<0.01,见表2)。

表1 CXCR1、CXCR2和GAPDH引物和探针序列

图3 CXCR1、CXCR2及CXCL8 mRNA与血清CRP相关性Fig.3 Relation between serum CRP and CXCR1,CXCR2,CXCL8 mRNA

表2 CXCR1、CXCR2及CXCL8在肝癌组织中的表达
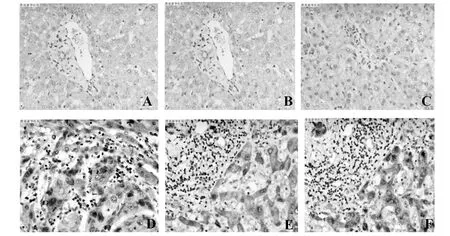
图4 肝癌患者肝活检组织CXCR1、CXCR2及CXCL8蛋白表达Fig.4 Protein expression of CXCR1,CXCR2 and CXCL8 in liver biopsy of liver cancerNote:A-C.The protein expression of CXCR1,CXCR2 and CXCL8 in normal liver;D-F.The protein expression of CXCR1,CXCR2 and CXCL8 in liver cancer tissues.
3 讨论
CXCR1和CXCR2是CXC趋化因子受体(CXC chemokine receptor,CXCR)家族中的两个重要成员,二者同源性高达77%,主要表达于中性粒细胞、淋巴单核细胞等各种炎症细胞表面,它们拥有共同配体CXCL8,当CXCR1/2与CXCL8特异性结合,可诱导大量炎症细胞迁移至特定感染部位,产生局部炎症免疫应答,是一类重要的非可控炎症因素[7]。机体非可控性炎症在肿瘤的发生发展进程中扮演着重要角色,如慢性胃炎与胃癌、乙型肝炎与肝癌等[8],CXCR1/2作为肿瘤相关炎症重要参与者,在肿瘤的生长、侵袭转移、血管新生等方面发挥不可忽视的作用[9]。大量研究发现,CXCR1/2在恶性黑色素瘤、结肠癌、前列腺癌、乳腺癌、卵巢癌等多种肿瘤的发生、增殖、生长、侵袭转移、血管新生等方面发挥重要调控作用[10-12]。
肝癌是我国常见的恶性肿瘤之一,恶性程度高、预后差,其中,HBV的慢性感染一直被认为是肝癌发生的高危因素之一,但是其具体的分子生物学机制尚不清楚。本课题旨在研究CXCR1、CXCR2及CXCL8在乙肝相关性肝癌中的表达情况和临床意义,初步阐明其在乙肝相关性肝癌发生中的作用,为乙肝相关性肝癌的防治提供可靠的理论依据和新的治疗靶点。
在本研究中,通过实时定量PCR法检测36例乙肝相关性肝癌患者PBMCs内CXCR1/2及CXCL8 mRNA水平,发现肝癌患者PBMCs内CXCR1、CXCR2及CXCL8 mRNA均较正常对照组显著升高,差异有统计学意义(P<0.01)。Welling等[13]比较了90例肝癌和180例肝硬化患者血清多种细胞因子表达,发现只有IL-8表达水平有显著差异,并且IL-8水平越高,疾病进展越快,预后越差,这说明高水平的IL-8可能促进肝硬化向肝癌的发展。Ren等通过ELISA法检测59例肝癌患者和15例体检健康者血清IL-8浓度,结果发现血清IL-8水平与肿瘤大小,疾病分期呈明显正相关,综上所述,推测高水平CXCL8可能通过上调其受体CXCR1/2表达,调控肝癌患者局部及全身炎症免疫反应,参与乙肝相关性肝癌的发生发展进程[14]。
本研究进一步通过SP免疫组化法检测HCC患者肝活检组织CXCR1、CXCR2及CXCL8蛋白水平,结果显示,肝癌患者肝活检组织CXCR1、CXCR2及CXCL8蛋白水平较正常对照均明显升高(P<0.01),此与王吉荣等[15]研究结果一致。Xue等[16]通过对比观察四种转移潜能由低到高人肝癌细胞株(SMMC-7721,MHCC97-L,MHCC97-H,HCCLM6)趋化因子受体谱表达,发现高转移潜能组HCCLM6表达谱中CXCR1(P=0.006)表达明显高于低转移潜能组SCMMC-7721,提示 CXCR1与HCC侵袭转移密切相关。以上结果都进一步证实肝癌细胞可通过分泌高水平的CXCL8,诱导CXCR1/2高表达,在肝癌的发生发展、侵袭转移等方面发挥着极其重要的作用。
CRP是一种急性时相反应蛋白,当机体炎症、感染或急性组织损伤时,由肝脏迅速合成,激活补体,活化免疫细胞,具有调理素作用。近年来大量研究发现恶性肿瘤患者血清中CRP均有不同程度升高,目前已广泛应用于临床肿瘤的辅助诊断、病情活动评估与疗效判断[17]。本研究通过相关性分析,发现HCC患者血清CRP与CXCR1、CXCR2及CXCL8 mRNA呈明显正相关,这表明CXCR1/2与CXCL8与肝癌患者肝组织的炎症活动程度和损伤程度密切相关,随着肝损伤程度增大和炎症活动程度的增强,CXCR1/2与CXCL8表达升高,提示CXCR1/2与CXCL8参与肝癌患者疾病进程,通过动态监测CXCR1/2与CXCL8水平,有助于了解肝细胞损伤程度,对早期发现肝癌、减少肝癌漏诊及判断预后意义重大。
综上所述,乙肝相关性肝癌患者体内CXCR1、CXCR2与其配体CXCL8明显升高,可能通过激活下游信号通路,诱导机体局部及全身炎症反应,调节肿瘤血管新生,在肝癌的发生、增殖生长、侵袭转移等方面发挥重要调控作用,同时也为乙肝相关肝癌的免疫干预治疗提供新的方向。
[1] Chen W,Zheng R,Zeng H,etal.The updated incidences and mortalities of major cancers in China,2011[J].Chin J Cancer,2015,34(11):502-507.
[2] Campbell LM,Maxwell PJ,Waugh DJ.Rationale and means to target pro-inflammatory interleukin-8 (CXCL8) signaling in cancer[J].Pharmaceuticals (Basel),2013,6(8):929-959.
[3] Holmes WE,Lee J,Kuang WJ,etal.Structure and functional expression of a human interleukin-8 receptor.Science.1991.253:1278-1280.[J].J Immunol,2009,183(5):2895-2897.
[4] Murphy PM,Tiffany HL.Cloning of complementary DNA encoding a functional human interleukin-8 receptor.Science.1991.253:1280-1283[J].J Immunol,2009,183(5):2898-2901.
[5] 中华人民共和国卫生部.原发性肝癌诊疗规范年版[J].中华肝脏病杂志,2012,20(6):419-426.
[6] 中国抗癌协会肝癌专业委员会.原发性肝癌规范化病理诊断指南(2015年版)[J].临床肝胆病杂志,2015,31(6):833-839.
[7] Bi HJ,Wang J,Huang HS,etal.Influence of IFN on expression of chemokine receptor CXCR1,CXCR2 and their ligand IL-8 in the patients with chronic hepatitis B[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2012,28(4):422-425.
[8] Sandra S,McAllister Robert A,Weinberg.The tumour-induced systemic environment as a critical regulator of cancer progression and metastasis[J].Nature Cell Biology,2014,16(8):717-727.
[9] Li H,Xu F,Li S,etal.The tumor microenvironment:An irreplaceable element of tumor budding and epithelial-mesenchymal transition-mediated cancer metastasis[J].Cell Adh Migr,2016,10(4):434-446.
[10] Sun Q,Sun F,Wang B,etal.Interleukin-8 promotes cell migration through integrin αvβ6 upregulation in colorectal cancer[J].Cancer Lett,2014,354(2):245-253.
[11] Tang KH,Ma S,Lee TK,etal.CD133(+) liver tumor-initiating cells promote tumor angiogenesis,growth and self-renewal through neurotensin IL-8CXCL1 signaling[J].Hepatology,2012,55(3):807-820.
[12] Li Z,Wang Y,Dong S,etal.Association of CXCR1 and 2 expression with gastric cancer metastasis in ex vivo and tumor cell invasion in vitro[J].Cytokine,2014,69(1):6-13.
[13] Welling TH,Fu S,Wan S,etal.Elevated serum IL-8 is associated with the presence of hepatocellular carcinoma and independently predicts survival[J].Cancer Invest,2012,30(10):689-697.
[14] Nojima H,Konishi T,Freeman CM,etal.Chemokine receptors,CXCR1 and CXCR2,differentially regulate exosome release in hepatocytes[J].PLoS One,2016,11(8):e0161443.
[15] 王吉荣,武传星.IL-8及其受体在原发性肝癌中表达及其意义[J].中华临床医师杂志(电子版),2013,7(1):378-379.
[16] Xue TC,Chen RX,Ye SL,etal.Different expressions of chemokine receptors in human hepatocellular carcinoma cell lines with different metastatic potentials[J].Zhonghua Gan Zang Bing Za Zhi,2007,15(4):261-265.
[17] Kinoshita A,Onoda H,Imai N,etal.C-reactive protein as a prognostic marker in patients with hepatocellular carcinoma[J].Hepatogastroenterology,2015,62(140):966-970.
[收稿2016-10-13 修回2016-11-23]
(编辑 张晓舟)
ExpressionsandclinicalsignificanceofCXCchemokinereceptor1and2andCXCL8inhepatitisBrelatedhepatocellularcarcinoma
BIHui-Juan,CHENJian-Min,CHENJing-Jing,WANGJian.DepartmentofClinicalLaboratory,theFourthAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230000,China
Objective:To investigate the expression levels of CXCR1,CXCR2 and their common ligand CXCL8 in peripheral blood mononuclear cells (PBMCs) and liver biopsy from the patients with hepatitis B related hepatocellular carcinoma and their clinical significances.Methods:Quantitative real time polymerase chain reaction (qRT-PCR) was used to detect the mRNA levels of CXCR1,CXCR2,CXCL8 in the peripheral blood mononuclear cells of thirty-six hepatitis B related hepatocellular carcinoma and the protein levels of CXCR1 and CXCR2 and CXCL8 in liver biopsy were detected by SP immunohistochemical method.The level of C-reactive protein in serum was determined by chemiluminescence immunoassay respectively.Then,the correlations between CRP and the mRNA of CXCR1,CXCR2 and CXCL8 were analyzed.Results:The mRNA levels of CXCR1 (0.952 7±0.197 2),CXCR2 (0.896 9±0.173 0),CXCL8 (1.771 9±0.248 9) in the PBMCs of hepatitis B related hepatocellular carcinoma were significantly higher than those in controls (P<0.01).And the protein levels of CXCR1,CXCR2 and CXCL8 were also obviously increased in liver biopsy of hepatitis B related hepatocellular carcinoma (P<0.05).In addition,there was positive correlations between the level of serum C-reactive protein and the mRNA expression of CXCR1(r=0.54,P<0.01),CXCR2(r=0.49,P<0.01),CXCL8(r=0.63,P<0.01).Conclusion:The levels of CXCR1,CXCR2 and CXCL8 significantly increased in hepatitis B related hepatocellular carcinoma patients and positively correlated with serum CRP,suggesting that CXCR1,CXCR2 and their common ligand CXCL8 signal transduction process may play a key role in the pathological process of hepatitis B related hepatocellular carcinoma,which may provide a new direction for the immune intervention therapy of hepatocellular carcinoma.
Hepatocellular carcinoma;CXCR1;CXCR2;CXCL8;mRNA;PBMC;Liver biopsy
10.3969/j.issn.1000-484X.2017.06.018
①本文为安徽医科大学校级基金(2015xkj049)、安徽省自然科学基金(1308085MH148)和安徽省教育厅自然科学研究项目(KJ2016SD20)。
②安徽理工大学医学院病原学与免疫学教研室,淮南232001。
毕惠娟(1987年-),女,硕士,主管技师,主要从事病毒性肝炎与分子免疫方面的研究。
及指导教师:王 健(1962年-),男,硕士,教授,硕士生导师,主要从事病毒性肝炎与免疫学方面研究,E-mail:wangjian8237@sina.com。
R392.1
A
1000-484X(2017)06-0895-05

