基于“多基因聚合-早世代组配”策略的水稻分子改良研究
陈立凯,郭 涛,刘永柱,王 慧,陈志强
(华南农业大学 国家植物航天育种工程技术研究中心,广东 广州 510642)
基于“多基因聚合-早世代组配”策略的水稻分子改良研究
陈立凯,郭 涛,刘永柱,王 慧,陈志强
(华南农业大学 国家植物航天育种工程技术研究中心,广东 广州 510642)
传统水稻育种技术最主要瓶颈是选择效率低和周期长。为了提高水稻优异材料选育和杂交稻组配效率,创新水稻分子育种策略,利用分子标记辅助选择多基因聚合和早世代杂交组配,展开水稻恢复系分子改良和杂交新组合的调查评价。供体亲本H318与恢复系亲本华占进行杂交,通过选择和设计关键有利基因的分子标记,利用毛细管电泳基因分型技术,将Wxb、fgr、Xa23、Pi2、Pi46以及Pita6个稻米品质、香味、抗白叶枯病和抗稻瘟病相关功能基因进行聚合利用。通过多世代的田间生物学性状调查,米质、抗性等表型鉴定,获得14份以恢复系华占为遗传背景,目标基因纯合的优质、双抗和香型稳定的水稻株系。依据材料稳定遗传特性,将改良后代株系与生产应用的不育系进行测配和组合的调查评价,筛选获得潜在优良杂交稻。在育种进程中采用“多基因聚合-早世代组配”策略,实现多个有利基因快速聚合,定向改良稻米品质和抗病性等关键性状,并且促进杂交水稻组合的高效选育。
水稻;分子改良;多基因聚合;杂交组配;恢复系
中国是世界上最大的水稻生产国和消费国,杂交水稻的成功培育,为保障粮食的安全供给做出了巨大贡献[1]。传统的育种手段中,对于优良性状的选择主要是依赖个体的表现型,选择效率偏低[2]。近年来,分子辅助选择(MAS)技术与传统育种手段相结合,在育种低世代完成标记的辅助选择过程,大大缩短育种周期[2]。结合水稻传统育种的技术经验,充分借助各种新型有效的分子育种技术,从而搭建水稻高效生物育种技术体系,已成为国际水稻育种主流趋势[3]。不同基因位点的聚合改良受到育种家的普遍推崇[4],对于多个控制水稻不同优良性状的基因或QTL同时杂交导入亲本受体,实现多个位点有利等位基因的高效聚合,可以达到综合改良水稻多个重要性状的育种目标[5-9]。与传统育种技术比较,分子设计育种能够实现从“经验育种”到“定向、高效、精确育种”的转变[10]。
在杂交育种中,不育系和恢复系的选择是配置强优势杂交组合的关键环节[11]。以恢复系为着手点,选育高抗稻瘟病的恢复系对于培育抗病优质杂交稻具有重要的意义[12]。周黎军等[12]研究表明,利用水稻早世代稳定亲本进行水稻恢复系的选育在时间和方法上都可能取得重大突破。利用早世代稳定亲本作为多基因聚合的快速稳定载体,在杂交后代早世代中发现和获得稳定株系,并通过分子标记辅助选择手段检测恢复性分子标记位点,田间鉴定配合力,是一种恢复系选育的新途径[12]。
Wx和fgr基因分别调控水稻直链淀粉含量和香气形成[13]。稻米的直链淀粉含量是影响稻米食用口感最重要的因素之一,研究表明Wx基因对于稻米直链淀粉含量的高低具有决定性的作用[13]。香味是高品质稻米的一个重要特性,香稻因其优良的香味品质为人们所喜爱,在国际稻米市场中占有重要地位,稻香味性状和香稻育种的研究也日益受到重视。稻米香味性状育种选择环节中,最直接有效的是直接对香味基因型进行选择,香味功能基因的鉴定和功能性分子标记的出现为这种直接选择提供了可能[14-15]。稻瘟病(PyricutariaoryzaeCav.)和白叶枯病(Xanthomonascampestrispv.oryzae)分别是世界范围内对水稻生产危害最严重的真菌性病害和细菌性病害[16],给水稻的生产造成极大的危害,严重时甚至会造成绝收。实践证明,在众多的防治措施中抗病品种的培育和种植是控制该病害最为经济、安全和有效的方法[8,11,17]。目前已报道的白叶枯抗病基因及稻瘟病抗性基因分别有38,83个[7]。Xa23是已报道对白叶枯抗性最好的基因之一,其对10个菲律宾小种、3个日本小种以及7个中国小种都表现出很好的抗性[7]。Pi46、Pi2和Pita基因是3个显性广谱抗稻瘟病基因,对我国各稻区菌株表现广谱抗性[11,17-19 ]。应用分子标记辅助选择聚合多个抗性基因,拓宽抗谱,增强抗性,是培育具有持久抗性和综合抗性品种的有效策略。
本研究提出“多基因聚合-早世代组配”的分子改良策略,通过选择和设计关键有利基因的分子标记,将Wxb、fgr、Xa23、Pi2、Pi46以及Pita6个稻米品质、香味、抗白叶枯病和抗稻瘟病相关功能基因进行聚合改良应用;依据材料稳定遗传特性,将低世代改良后代株系与生产应用的不育系进行测配。对杂交组合进行调查评价,以期促进优异杂交水稻组合的高效选育。
1 材料和方法
1.1 试验材料
本研究使用水稻材料包括恢复系华占(含Wxb和Pi2基因)和多基因聚合系H318(含Wxb、Xa23、Pi46、Pita以及fgr基因)。2013年以华占为轮回亲本进行杂交和回交,展开基因型分析和MAS,获得改良后代株系。用于组合测配的不育包括三系不育系宁A和两系不育系C815S。此外,本研究等位基因分型使用的对照样品包括:H4:Pi46;丽江新团黑谷:pi46;粤丰新占:Wxa、pita及xa23;IR-BB 64:Wxb、Pita及Xa23;象牙香占:fgr及pi2;粤晶丝苗2号:Pi2;航恢173:Fgr、Rf3及Rf4;H4:rf3及rf4。水稻不育系C815S由湖南农业大学提供,其他材料均来自于国家植物航天育种工程技术研究中心种质资源库。
1.2 试验方法
1.2.1 水稻田间种植和农艺、品质性状调查 水稻种植于国家植物航天育种工程技术研究中心试验基地(广州),田间管理按大田常规栽培要求实施。全生育期观察田间株叶形态,参考《农作物品种区域试验技术规范 水稻》(NY/T 1300-2007),植株成熟后随机选取3株,调查农艺性状包括株高、剑叶长、剑叶宽、单株穗重、穗数、实粒数、空粒数、总粒数,十粒长、十粒宽、长宽比,千粒质量等。随机取整精米100粒,逐粒目测,拣出明显的白色不透明的垩白米粒,并计数统计垩白粒率;后用垩白度统计软件计数出垩白度,2次重复。香味测定采用KOH浸泡的感官品评法,参考Jin等[20]的操作步骤。根据农业部部颁标准NY147-88(稻米品质评价方法)测定直链淀粉含量,以直链淀粉占淀粉总量的百分率表示。
1.2.2 水稻抗病性鉴定 按照广东农科院植物保护研究所方法培养,接种菌液浓度为9×108个/mL。孕穗期内,参照“剪叶法”进行白叶枯病抗性鉴定,菌株为广东省优势致病生理小种Ⅳ型菌。在田间条件下,选取播种60 d后的水稻单株,每株接种4~5片叶。21 d后调查病情,测量病斑长度,并统计分析、分级,3组重复。病情分级按照国际标准0~9级分级。采用自然病圃鉴定稻瘟病抗性。选择广东省稻作区的阳江稻瘟病鉴定圃,叶瘟和穗颈瘟的调查按国际水稻研究所的分级标准。
1.2.3 DNA提取和分子标记检测 取苗期水稻的叶片,参照磁珠法快速提取水稻总DNA[21],并溶解于1×TE中,用NanoDrop 1000 (Thermo,USA)定量后以超纯水稀释至75 ng/μL,-20 ℃保存。PCR扩增体系含2×PCR Reaction Mix 10 μL(含100 mmol/L KCl、20 mmol/L Tris-HCl、3 mmol/L MgCl2、400 mmol/L dNTP)、TaqDNA聚合酶(5 U/μL)0.2 μL、引物(10 μmol/L)各1 μL、模板DNA 1 μL,超纯水补至20 μL。反应条件为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。本研究所用分子标记信息见表1。参照Chen等[21]方法步骤,利用毛细管电泳进行扩增产物的检测。
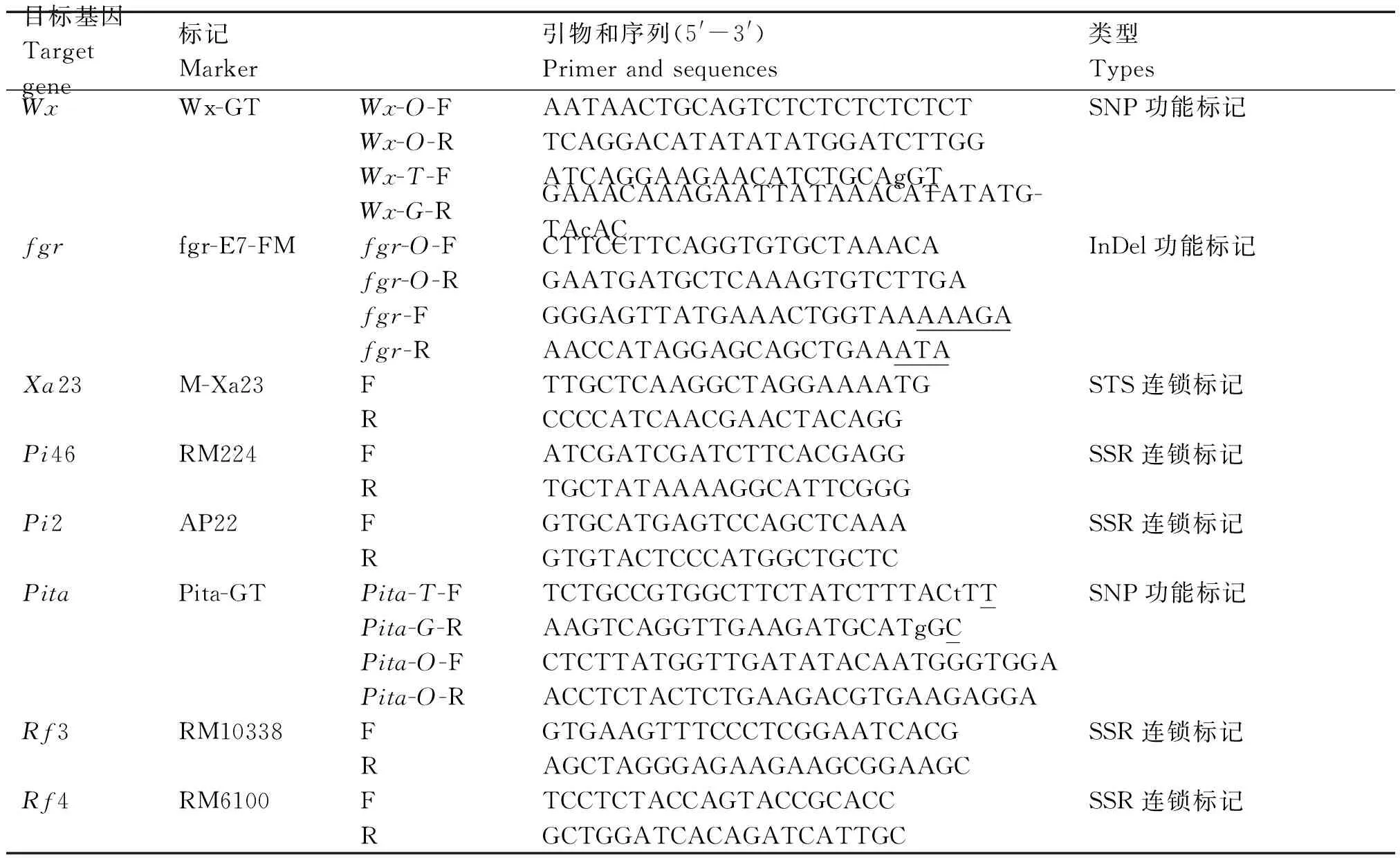
表1 分子标记信息
注:引物序列中小写字母的碱基为引入的错配碱基;带下划线字母的碱基为等位变异碱基。
Note:The bases of lowercase letter in the primer sequences are the introduced mismatch bases;Bases underlined are the allelic variation bases.
2 结果与分析
2.1 基因分型和多基因聚合设计
本研究所利用的分子标记,包括前人已鉴定的目标基因连锁标记,与广谱抗稻白叶枯病基因Xa23紧密连锁的STS标记M-Xa23、与稻瘟病主效抗病基因Pi46紧密连锁的SSR标记RM224和与稻瘟病抗病基因Pi2连锁的特异分子标记AP22。同时,利用ARMS-PCR技术[21],针对水稻蜡质基因Wx功能突变位点(G/T)设计开发了SNP分型标记Wx-GT、稻米香味基因fgr的功能插入缺失位点,开发了InDel分型标记fgr-E7-FM以及稻瘟病抗病基因Pita功能突变位点设计了SNP分型标记Pita-GT。此外,为了辅助育性恢复力性状的分子筛选,分别引入了2个最主要的恢复基因位点Rf3和Rf4的连锁标记。上述分子标记的等位分型电泳图谱如图1所示。通过基因分析,确认恢复系华占含Wxb和Pi2基因,多基因聚合系H318含Wxb、Xa23、Pi46、Pita以及fgr基因。
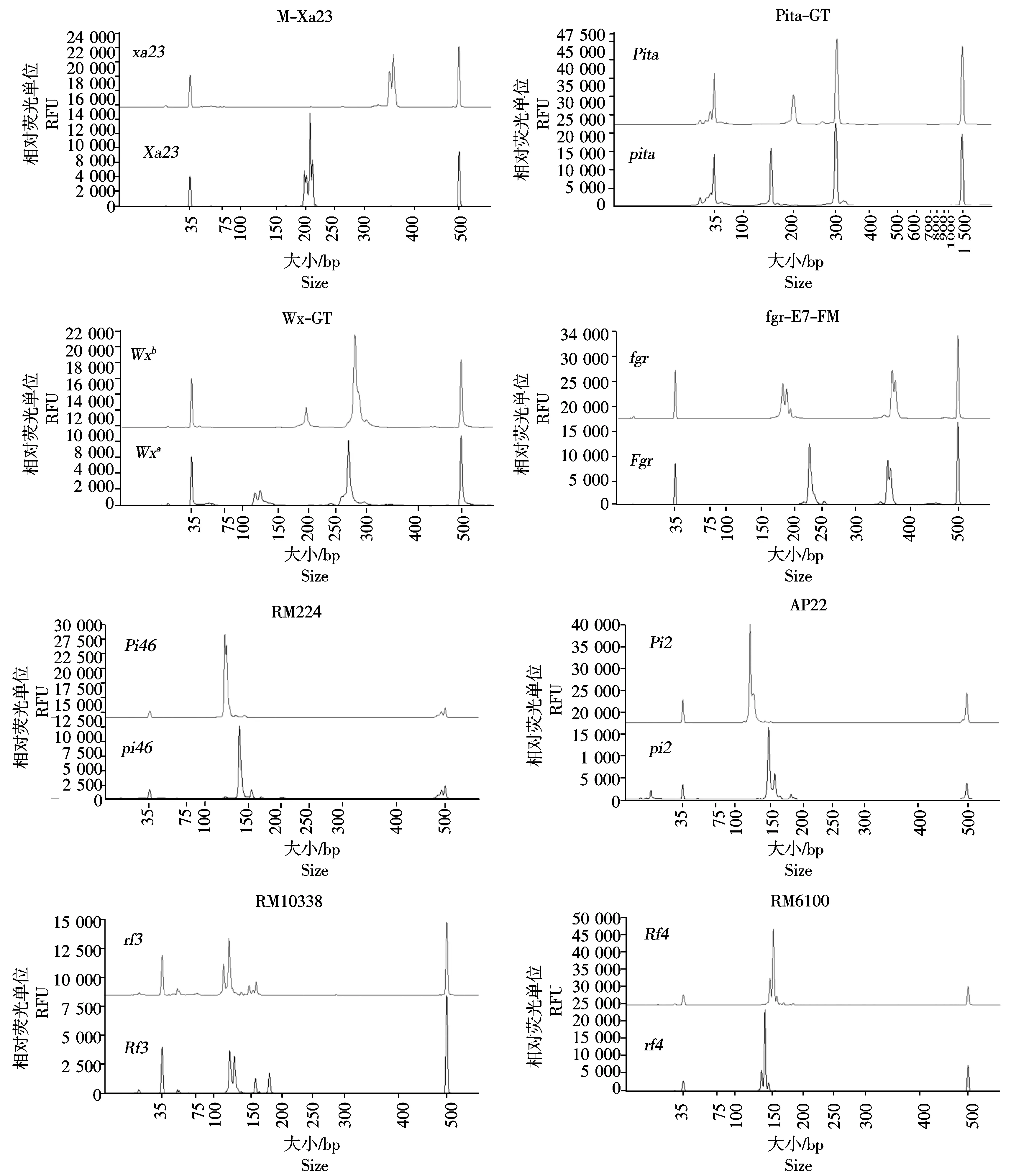
横坐标.PCR产物大小;纵坐标.RFU相对荧光单位。
供体亲本H318与恢复系亲本华占进行杂交,在F1中去除假杂种后与华占进行回交。2014年晚季种植株BC1F1,利用分子标记fgr-E7-FM、M-Xa23、RM224、AP22、Pita-GT、RM10338和RM6100检测,确保目标基因位点全部导入,并且同时保留恢复基因位点。随后,选择目标基因位点尽多纯合、农艺性状接近轮回亲本(华占)的17个单株进行自交收种(表2)。
2015年早季,种植回交后代BC1F2,并继续展开分子标记筛选。继而获得6个目标基因性状均纯化同时保留2个恢复基因位点的株系。结合株叶型进行农艺性状选择,共14个株系入选进行自交加代。2015年晚季形成BC1F3株系,田间性状观察发现大部分株系整体株叶形态整齐、生育期一致,表明株系内遗传物质已经较为相似、稳定。据此,对这些株系展开农艺性状和米质性状鉴定、抗病性调查和杂交组配,筛选获得稳定的、农艺性状优良的多基因聚合改良恢复系材料。整个分子改良过程的育种程序如图2所示。
2.2 改良恢复系的主要性状评价
亲本材料华占和H318以及多基因纯化聚合改良株系的主要稻米品质性状如表3所示。所有多基因聚合系携带亲本共有的Wxb等位基因,遗传其直链淀粉含量低-中的优良特性,大部分(64.3%)株系AC值13%~14%,最高值为18.01%,最低值10.05%。受体亲本恢复系华占的fgr基因等位类型为野生型,籽粒无香味;利用供体H318导入fgr香味基因,后代改良株系的籽粒均鉴定获得香味特性,各株系受环境和小部分遗传背景影响,香气程度有所差异。粒型方面,改良株系与亲本之间的长宽比差异不明显。但是与恢复系华占相比,大部分改良株系垩白性状有明显改善,分别有78.6%和92.9%的株系垩白粒率和垩白度性状降低,外观品质得到改良。其中,株系R-19862和R-21064兼备低直链淀粉含量、香气浓以及垩白外观品质优异的特点,具有较大育种利用价值。
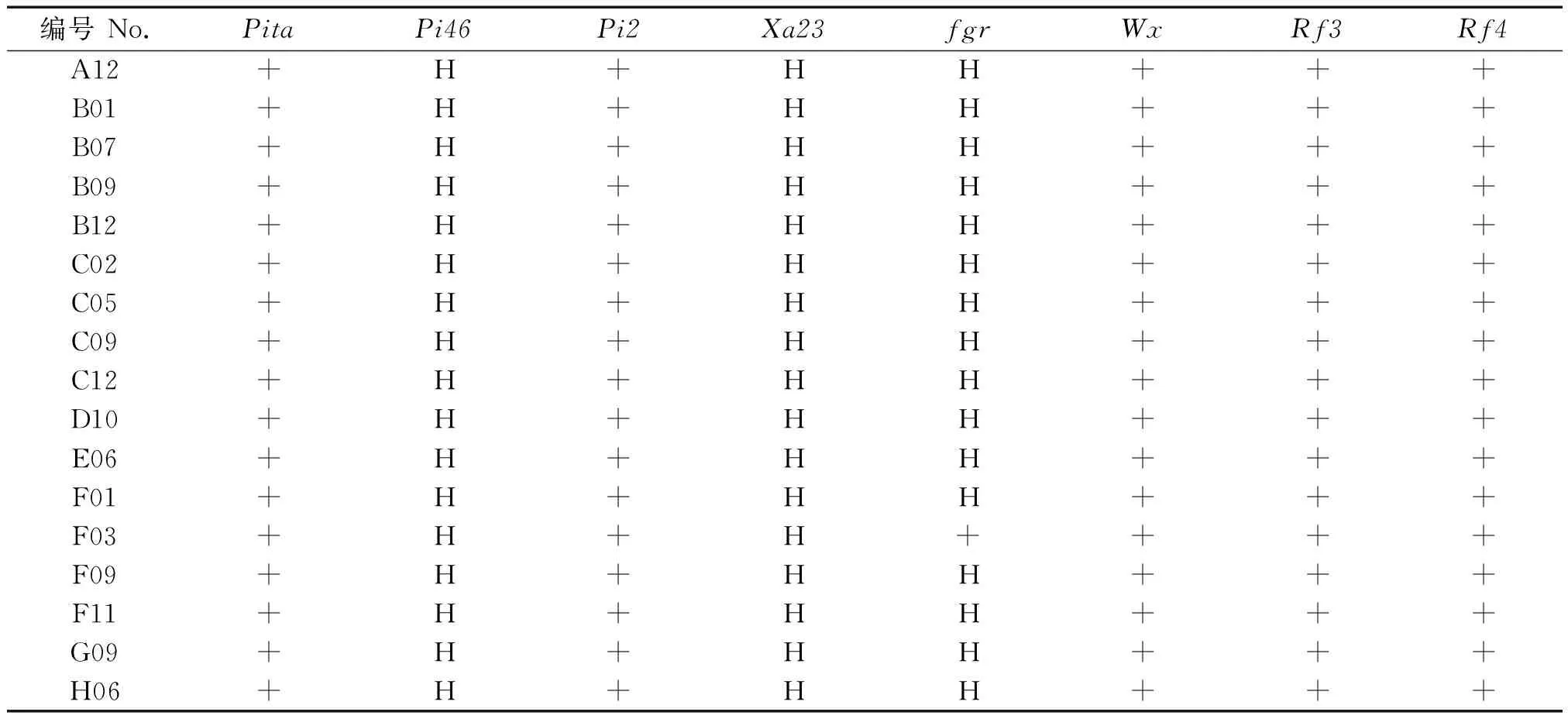
表2 多基因聚合入选回交后代单株及其基因型
注:+.携带优异等位基因;H.杂合子。
Note:+.Elite allele; H.Heterozygote.

图2 “多基因聚合-早世代组配”策略的水稻分子改良简要流程图
14份改良株系均携带来自供体亲本H318的白叶枯病主效抗性基因Xa23,其白叶枯病抗性鉴定结果(BC1F4)如表3所示。除了3份株系未获得调查结果,其余11份改良株系的抗性级别均为抗,而受体亲本华占的白叶枯病抗性水平则鉴定为感。结果表明,导入Xa23基因,能够高效、一致地提高白叶枯病抗性水平,改良效果显著。2016年的2个种植季节分别对改良株系(BC1F4和BC1F5)连续进行田间自然诱发病圃的稻瘟病抗性鉴定,结果如表3所示。由表可知,恢复系华占在2016年早季稻瘟病抗性水平为中抗,2016年晚季为抗;供体亲本材料H318表现为两季均表现为抗水平。鉴定结果表明,聚合了3个稻瘟病抗病基因的13个株系抗性水平均表现为抗或高抗,抗性稳定(表3)。与华占比较,改良株系抗性水平表现明显提高。R-20314和R-20321两季分别鉴定为抗和高抗;R-21064两季均鉴定为高抗。通过分子标记辅助选择技术聚合Pi46、Pi2和Pita基因能有效提高受体亲本的稻瘟病抗性,并且抗性水平稳定。

表3 亲本品种和改良株系主要米质性状和抗病性调查
注:AC.直链淀粉含量;LWR.长宽比;PGWC.垩白粒率; DEC.垩白度;+.香味;Ⅰ.2016早季;Ⅱ.2016晚季。
Note:AC.Amylose content;LWR.Length-width ratio;PGWC.Percentage of grain with chalkiness; DEC.Degree of endosperm chalkiness;+.Indicates fragrant;Ⅰ.Early season of 2016;Ⅱ.Late season of 2016.
2.3 改良株系组配和杂交组合的表现
根据本研究早世代组配以提高杂交组合选育效率的策略,通过观察BC1F3和BC1F4株系田间农艺性状表现,将整体株叶型态趋于一致的改良株系分别与生产上的不育系宁A和C815S进行组配。考察杂交组合F1主要的农艺、品质、产量及经济性状,包括株高、单株穗重、有效穗数、结实率、研磨品质和外观品质等,结果如表4所示。
株高方面,组配的杂交组合与CK相比有正反方向变异波动,宁A所配组合株高增加占主要,而C815S所配组合主要表现株高降低。产量方面,大部分改良株系所配组合在千粒质量上得到改良,特别是与C815S所组配的F1千粒质量均高于CK。宁A/R-19862、C815S/R-20765和C815S/R-21056在总粒重明显高于CK,分别提高了3.82%,12.48%和15.47%,表明这3个株系具有潜在的优良高产配合力。结实率方面,三系不育系宁A所配组合为68.57%~85.57%。而C815S所配组合则偏低,在58.50%~73.46%。研磨品质调查结果表明,改良株系与C815S杂交F1在精米率和整精米率均得到提高。此外,新的杂交组合在粒型和垩白的外观品质性状上获得不同类型,丰富遗传多样性和满足不同品种选育需求。
3 讨论
随着生物技术的快速发展,分子标记辅助育种在缩短育种年限、提高育种效率等方面发挥了极其重要的作用[10,22-23]。然而,对于MAS改良后代的表型,其预测度一方面取决于基因的效应水平,另一方面和分子标记与目标基因的连锁程度有直接关联[21]。有利等位基因的鉴定和选择,是有效预测评估分子改良成效的前提。本试验中,蜡质基因Wx编码颗粒淀粉合成酶(GBSS),是控制直链淀粉合成的主效基因,直接影响稻米胚乳中直链淀粉的含量[24]。水稻香味是由于编码甜菜醛脱氢酶基因突变所致,丧失功能的fgr基因使甜菜醛脱氢酶的作用底物2-乙酰基-1-吡咯啉的代谢途径中断,香味物质2-乙酰基-1-吡咯啉不断积累,致使水稻籽粒产生香味[25]。白叶枯病抗性基因Xa23对现有国内外白叶枯病鉴别菌系都表现高抗,且完全显性、全生育期抗病[26-27]。而Pi2、Pi46和Pita均为具广谱抗性的稻瘟病显性抗性基因,抗性都较好,已被广泛验证和利用[8-9,11,18-19]。此外,本研究设计Wx、fgr和Pita基因的分子标记,直接靶向基因内部多态性位点,实现直接对目的基因的选择。基于此,低世代材料并未进行稻米品质和抗病性筛选,仅利用分子标记选择目标基因,结合农艺性状进行选择。在较高代稳定株系中进行米质、香味和抗病性鉴定,获得多份同时具备双抗、低支链淀粉含量的香型恢复系材料,所利用的基因和分子标记体现出MAS的精准性和高效率。

表4 改良株系杂交组配F1的主要农艺性状表现
注:CMS line.细胞质雄性不育系;PH.株高;PWPP.单株穗重;PNPP.单株穗数;TGW.总粒重;KGW.千粒质量;SR.结实率;BRR.糙米率;MRY.精米率;HRY.整精米率;GL.粒长;GW.粒宽;LWR.长宽比;PGWC.垩白粒率;DEC.垩白度。
Note: CMS line.Cytoplasmic male-sterile line; PH.Plant height;PWPP.Panicles weight per plant; PNPP.Panicles number per plant; TGW.Total grain weight; KGW.1000 grain weight; SR.Seed setting rate; BRR.Brown rice rate;MRY.Milled rice rate; HRY.Head rice yield; GL.Grain length; GW.Grain width;LWR.Length-width ratio; PGWC.Percentage of grain with chalkiness; DEC.Degree of endosperm chalkiness.
多基因聚合在水稻综合性状分子改良中具有无以比拟的优势。田大刚等[7]将Pi9和Xa23聚合导入杂交水稻恢复系闽恢3189、闽恢3229和闽恢6118,获得兼抗稻瘟病和白叶枯病的水稻恢复系分子改良系。姜洁锋[6]利用MAS将抗稻瘟病基因Pi2和抗白叶枯病基因Xa7、Xa21和Xa23渗入到3个优良的水稻光温敏核不育系C815S、广占63-4S和华328S背景中,创建了一系列抗病性得到明显改良的光温敏核不育系新材料。肖武名等[18]通过MAS将Pi46与Xa23展开有效聚合,实现了创制双抗水稻种质的目的。本研究结果表明,广谱白叶枯病抗性基因Xa23的导入明显提高了水稻分子改良系的白叶枯病抗性,抗性鉴定结果都达到了抗级水平。而3个稻瘟病抗性基因Pi2、Pi46和Pita的同时聚合,使得改良株系表现出更强、更持久的抗病性。连同Wx和fgr基因,共6个功能基因的MAS聚合效果显著,这些分子改良系有望升级原有亲本,在生产中具有良好应用前景。
对于早世代稳定改良株系,利用恢复基因分子标记辅助选择恢复力性状,结合田间鉴定配合力,可提高杂交组合选育效率,促进育种进程。目前,已通过本研究获得一批BC1F6的综合性状优良、稳定的株系及其杂交组合。其中R-19862、R-21064、R-19913、R-20765和R-21056入选新双抗和低直链淀粉含量的香型恢复系,展开大规模组配和育种利用。综上可知,充分利用分子标记辅助选择,多基因聚合分子改良选育稳定优异株系,结合早世代田间观察,同时开展多个性状的鉴定评价和杂交组配,进而可快速、准确的选育出综合性状优良的新的改良株系和杂交组合。
[1] 程式华.中国超级稻育种技术创新与应用[J].中国农业科学,2016(2):205-206.
[2] Yu H,Xie W,Li J,et al.A whole-genome SNP array (RICE6K) for genomic breeding in rice[J].Plant Biotechnology Journal,2014,12(1):28-37.
[3] 王建康,李慧慧,张学才,等.中国作物分子设计育种[J].作物学报,2011,37(2):191-201.
[4] Zong G,Wang A,Wang L,et al.A pyramid breeding of eight grain-yield related quantitative trait loci based on marker-assistant and phenotype selection in rice (OryzasativaL.) [J].Journal of Genetics and Genomics,2012,39(7):335-350.
[5] 李玉营,李声春,李晓方.分子标记辅助选择聚合水稻抗虫抗病基因育种研究进展[J].广东农业科学,2016,43(6):119-126.
[6] 姜洁锋.分子标记辅助选择培育抗稻瘟病和白叶枯病水稻光温敏核不育系[D].武汉:华中农业大学,2015.
[7] 田大刚,陈在杰,陈子强,等.分子标记辅助选育聚合抗稻瘟病基因和抗白叶枯病基因的水稻改良新恢复系[J].分子植物育种,2014,12(5):843-852.
[8] 李锦江,肖友伦,孟秋成,等.水稻抗稻瘟病和抗白叶枯病基因聚合品系抗性分析[J].杂交水稻,2012(5):59-66.
[9] 王 军,杨 杰,陈志德,等.利用分子标记辅助选择聚合水稻抗病基因Pi-ta、Pi-b和Stv-bi[J].作物学报,2011,37(6):975-981.
[10] 张分云,李 宏,周向阳,等.水稻产量分子设计育种研究进展[J].分子植物育种,2013,11(6):663-672.
[11] 孙大元,周丹华,肖武名,等.利用MAS技术培育高抗稻瘟病的杂交水稻恢复系航恢1173[J].华北农学报,2014,29(6):121-125.
[12] 周黎军,王 丽,魏 琴,等.利用水稻早世代稳定特性选育杂交水稻恢复系[J].中国水稻科学,2007,21(3):265-269.
[13] 陈深广,周屹峰,赵 霏,等.利用Wx和fgr基因双功能性标记高效选育优质水稻保持系[J].中国水稻科学,2011,25(1):31-36.
[14] Phing Lau W C,Latif M A,Y Rafii M,et al.Advances to improve the eating and cooking qualities of rice by marker-assisted breeding[J].Critical Reviews in Biotechnology,2016,36(1):87-98.
[15] Luo W L,Guo T,Yang Q Y,et al.Stacking of five favorable alleles for amylase content,fragrance and disease resistance into elite lines in rice (Oryzasativa) by using four HRM-based markers and a linked gel-based marker[J].Molecular Breeding,2014,34(3):805-815.
[16] 倪大虎.利用分子标记辅助选择改良水稻对白叶枯病和稻瘟病抗性的研究[D].合肥:安徽农业大学,2006.
[17] 邓其明,周 鹏,林 琳,等.水稻稻瘟病抗性基因研究进展及其在育种上的应用[J].安徽农业科学,2009,37(4):1489-1492.
[18] 肖武名,孙大元,王 慧,等.分子标记选育稻瘟病和白叶枯病双抗种质[J].华北农学报,2014,29(1):203-207.
[19] 杨勤忠,林 菲,冯淑杰,等.水稻稻瘟病抗性基因的分子定位及克隆研究进展[J].中国农业科学,2009,42(5):1601-1615.
[20] Jin L,Lu Y,Shao Y,et al.Molecular marker assisted selection for improvement of the eating,cooking and sensory quality of rice(OryzasativaL.) [J].Journal of Cereal Science,2010,51(1):159-164.
[21] Chen L K,Gao W W,Guo T,et al.A genotyping platform assembled with high-throughput DNA extraction,codominant functional markers,and automated CE system to accelerate marker-assisted improvement of rice[J].Molecular Breeding,2016,36(9):1-12.
[22] Concepcion J C,Ouk M,Zhao D A.The need for new tools and investment to improve the accuracy of selecting for grain quality in rice[J].Field Crops Research,2015,182(SI):60-67.
[23] Spindel J,Wright M,Chen C,et al.Bridging the genotyping gap:using genotyping by sequencing (GBS) to add high-density SNP markers and new value to traditional bi-parental mapping and breeding populations[J].Theoretical and Applied Genetics,2013,126(11):2699-2716.
[24] Hirano H Y,Eiguchi M,Sano Y.A single base change altered the regulation of the waxy gene at the posttranscriptional level during the domestication of rice[J].Molecular Biology and Evolution,1998,15(8):978-987.
[25] Bradbury L M,Fitzgerald T L,Henry R J,et al.The gene for fragrance in rice[J].Plant Biotechnology Journal,2005,3(3):363-370.
[26] 王春连,戚华雄,潘海军,等.水稻抗白叶枯病基因Xa23的EST标记及其在分子育种上的利用[J].中国农业科学,2005,38(10):1996-2001.
[27] Wang C,Fan Y,Zheng C,et al.High-resolution genetic mapping of rice bacterial blight resistance geneXa23[J].Molecular Genetics and Genomics,2014,289(5):745-753.
Molecular Improvement Based on the Strategy of ′Multiple Genes Pyramiding-early-generation Hybridized Combination′ in Rice
CHEN Likai,GUO Tao,LIU Yongzhu,WANG Hui,CHEN Zhiqiang
(National Engineering Research Centre of Plant Space Breeding,South China Agricultural University,Guangzhou 510642,China)
Low selection-efficient and long cycle are the main bottle necks of conventional breeding technique.In order to make improvement of the efficiency of variety breeding and hybridized-combination,we innovated the molecular breeding strategy in rice.Then we carried out molecular improvement of restorer line and evaluation of new hybrid combination by multiple genes pyramiding and early-generation hybridized combination.The donor parent H318 was hybridized with restorer parent Huazhan,and we constructed the multiple genes pyramiding technology by selection and design molecular markers,and performed pyramiding-improvement application with 6 functional genes for grain quality,fragrance,and disease resistance,includingWxb,fgr,Xa23,Pi2,Pi46,andPita.As the result,we achieved a series of 14 stable rice lines with genetic background of restorer line Huazhan,homozygous target-genes,and high grain-quality,double-resistant,and fragrance.In accordance with stable-inheritance properties,ideas of early-generation hybridized combination was raised.Test cross of improved lines with CMS lines in production practice of NingA and C815S were carried out,and performance of new hybrid combination was evaluated,therefore,potential superior hybrid rice was screened and achieved.In this study,breeding programs adopted the strategy of multiple genes pyramiding-early-generation hybridized combination,this method could realize the quick pyramiding of multiple favorable genes,targeted improvement of key traits of grain quality and disease-resistant,promotion of high-efficiency breeding of hybrid rice.
Rice; Molecular improvement; Genes pyramiding; Hybridized combination; Restorer line
2017-04-21
国家高技术研究发展计划“863计划”项目(2016YFD0102102);广东省科技计划项目(2015B02031011);国家现代农业产业技术体系建设专项(CARS-01-12)
陈立凯(1986-),男,广东汕头人,博士,主要从事植物遗传和分子生物学研究。
陈志强(1956-),男,广东揭阳人,教授,硕士,主要从事水稻遗传育种相关研究。 郭 涛(1978-),男,河南驻马店人,教授,博士,主要从事水稻遗传育种相关研究。
S435.1;S511.03
A
1000-7091(2017)03-0077-08
10.7668/hbnxb.2017.03.012

