水稻阶段性温敏白化转绿突变体stgra254的特征和基因定位
邹金财,张维林,夏明辉,邱洋松,王长春,杨 玲,张小明
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江省农业科学院 作物与核技术利用研究所,浙江 杭州 310021)
水稻阶段性温敏白化转绿突变体stgra254的特征和基因定位
邹金财1,张维林1,夏明辉1,邱洋松1,王长春1,杨 玲1,张小明2
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江省农业科学院 作物与核技术利用研究所,浙江 杭州 310021)
为了挖掘和鉴定更多的水稻白化转绿突变体用于基因功能的研究。从粳稻品种秀水09的EMS突变体库中发现了一个阶段性温敏白化转绿突变体stgra254,该突变体在28 ℃恒温条件下,第6片完全展开叶出现白斑,至分蘖盛期融合成片,最终叶片枯萎死亡;在32 ℃条件下,第6片叶白斑数目及白化程度明显弱于28 ℃,且3 d后逐渐转绿;而24 ℃下的叶片表现正常。组织化学分析结果表明,白斑的形成和发展是一个程序性细胞死亡的过程,伴随着H2O2的积累。荧光仪分析显示,光系统Ⅱ的最大光能转化效率显著下降。遗传分析表明,该突变体叶色性状受1对隐性核基因控制。利用stgra254与珍汕97杂交得到F2群体,借助集团分离分析法和SSR分子标记连锁分析,将其定位在4号染色体上的RM17206与RM17277标记之间,遗传距离分别为0.48,5.22 cM。
水稻;白化转绿基因;温敏;基因定位
叶片是植物进行光合作用及多种代谢的主要器官[1]。在自然或者人工条件下,高等植物常出现叶色突变现象,其中许多白化突变体不能存活。阶段性白化转绿则属于非致死叶色突变,主要表现为苗期白化,随后叶色逐渐转绿,直至恢复正常,植株继续生长发育完成整个生育进程[2-3]。阶段性白化转绿突变体不仅在研究叶绿素合成代谢、叶绿体发育、光合作用机制、光形态建成等诸多方面具有独特作用[4-5],而且是可应用于作物遗传育种的一种理想的形态标记材料[5-7]。鉴于水稻阶段性白化转绿突变体的特殊表型及实际应用价值,其已受到了越来越多的关注[7]。
目前报道的40多个水稻白化转绿突变体绝大多数由单隐性核基因控制,其中的17个已被定位,除第7,12染色体外的10条均有分布[8]。水稻白化转绿可能与直接或间接影响光合色素的生物合成及代谢[4,9]、叶绿体的形成和发育[1,7]、叶绿体蛋白转运[10]、光系统异常[11]、核-质信号传导途径[12]等有关,其机制非常复杂[8]。目前,只有7个水稻白化转绿基因被克隆[1,3-4,7,9,12-14]。显然,有必要挖掘和鉴定更多的水稻白化转绿突变体用于基因功能研究,以进一步揭示其中的复杂机理。
笔者在粳稻品种秀水09的EMS突变体库中发现了1个阶段性温敏白化转绿突变体stgra254,本研究在分析该突变体表型、生理、白叶枯病抗性等特征的基础上,将基因stgra254定位在4号染色体上。本研究结果将为stgra254的克隆和分子机理研究奠定基础。
1 材料和方法
1.1 试验材料
水稻白化转绿突变体stgra254来源于晚粳稻秀水09种子经EMS(甲基磺酸乙酯)处理,经过8代自交繁殖和选择,突变体的白化转绿表型已经稳定。定位所用的2个分离群体的父本分别为籼稻珍汕97和9311。
1.2 白化转绿突变体苗期叶色特征鉴定
将突变体stgra254及其野生型秀水09的种子在28 ℃下浸种催芽,长到一叶一心后,分别置于3种不同温度(24,28,32 ℃)的PQX-450A-12H智能人工气候箱中(宁波莱福科技有限公司),12 h光照/12 h黑暗,用水稻营养液(国际水稻所)培养,观察叶色的变化。
1.3 叶绿素荧光动力学参数的测定
采用双通道Dual-PAM-100荧光仪(WALZ,德国)分别测定3种不同温度下第6叶的叶绿素荧光相关参数。首先对水稻进行约30 min的黑暗处理后照射检测光,荧光水平稳定后得到荧光参数Fo(初始荧光),然后给一个饱和脉冲光,一个脉冲后关闭,测得最大荧光Fm,从而得到荧光参数Fv/Fm(Fv=Fm-Fo)。
1.4 白斑形成机制的组织化学分析
1.4.1 细胞程序性死亡检测 分别将生长在28,32 ℃的突变体stgra254和秀水09的第6叶浸泡在0.4%台盼蓝染液中,于沸水浴中染色约10 min,室温放置12 h,然后用2.5 mg/mL水合三氯乙醛脱色3 d,观察细胞死亡情况。
1.4.2 细胞产生H2O2沉积反应检测 分别将生长在28,32 ℃的水稻第6叶浸泡在1 mg/mL二氨基联苯胺(pH值3.8)中,25 ℃光照8 h后,于95%乙醇中煮沸脱色约10 min,再将叶片置于25 ℃乙醇中浸泡4 h,观察叶片出现红褐色沉淀情况并拍照。
1.5 遗传分析和定位群体的构建
2009年夏季在浙江省农业科学院农场试验田用突变体stgra254作母本,分别与珍汕97、9311和野生型秀水09配制杂交组合,冬季到海南繁殖F1,苗期观察F1表型,成熟后单株收获种子。于2010年夏季在浙江省农业科学院农场试验田种植亲本和F2群体,对秀水09/stgra254 F2群体中的正常单株和白化转绿单株株数进行统计,用于遗传分析。对突变体/珍汕97 F2群体中具有正常绿叶和白化叶表型的植株分别取样,用于白化转绿基因的定位。
1.6 白化转绿基因stgra254的定位
采用CTAB法提取水稻叶片总DNA。以集团分离分析法构建正常绿叶和白化叶基因池。选择已公布的SSR标记(Simple sequence repeats)(http://www.gramene.org),SSR引物由上海生工生物工程技术服务有限公司合成。10 μL的PCR反应体系包括模板DNA(35 ng/μL)1 μL、引物(10 μmol/L)各1 μL、dNTP、2×TaqMasterMix (TaKaRa公司)3 μL、双蒸水4 μL。PCR扩增条件为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,38个循环;72 ℃ 5 min。3%琼脂糖凝胶或者6%非变性聚丙烯酰胺凝胶电泳检测[9]。寻找在2个基因池之间扩增片段有差异的分子标记。使用MAPMAKER (EXP3.0b) 软件进行连锁分析;利用Kosambi 作图函数计算遗传图距。
2 结果与分析
2.1 突变体表型和叶色温敏特性
水稻大田条件下,阶段性白化转绿突变体stgra254第1-5叶呈正常绿色,第6片叶完全展开时,近中部开始出现小的椭圆形白色斑点,在分蘖盛期,椭圆形白色斑点逐渐扩大并融合为一体(图1-A),随后逐渐变绿,至成熟期呈正常叶色。这暗示突变体叶色表型在常规的生长季节中受植株的生长发育调控。与野生型植株表型比较,白化时期的突变体植株矮小,叶片窄(图1-B、C);突变体转绿后株高为(91.1±5.6)cm、分蘖数为3.5个,比同期野生型的株高((58.8±3.9)cm、14.1个)更高、叶片更宽、分蘖减少(图1-B);孕穗期和抽穗期提前20 d左右。

图1 stgra254与秀水09在大田和不同温度生长箱的表型
对生长在3种不同恒温下幼苗的叶色观察显示,突变体与野生型相比,24 ℃下叶片颜色无明显差异(图1-C)。28 ℃下,突变体的1-5叶表现为正常绿色,第6叶完全伸展后,在其中上部、中脉与叶边缘的中间部位最先出现白色圆形斑点,随后中脉附近也陆续出现,白色斑点逐渐变大变多,沿维管束方向扩展,融合成长条状白色斑块(图1-C),5 d后整个叶片的中脉附近变成白色,而叶边缘仍为淡绿色,最终整片叶白化枯萎死亡;少数突变体的第7叶也会出现类似的情况,后继抽出的叶片均表现为正常绿色。32 ℃下,突变体的1-5叶同样为正常绿色,第6叶完全伸展后,白色圆形斑点最先在中上部、中脉与叶边缘中间区域出现,少数白色斑点会沿维管束方向连成长条状斑块,但斑点数目及白化程度明显弱于28 ℃下的突变体(图1-C),而且3 d后白色斑点或斑块逐渐消失,14 d后叶片最终恢复正常绿色。2013年5月27日将28 ℃恒温下培养至五叶期的突变体移栽到大田,当地气温已经比较高,第6叶片并没有出现白斑,进一步证实突变体的白化表型与温度密切相关,属于非致死温度敏感型突变体[7]。所以,突变体stgra254阶段性白化转绿表型同时受植株的生长发育和外界的温度调控。
2.2 突变体stgra254的PS Ⅱ活性
为了检测突变体stgra254中的光合机构是否受影响,比较了野生型和stgra254第6叶在不同温度下叶绿素荧光参数Fv/Fm(其表示PS Ⅱ的最大光量子产量,即光系统Ⅱ的最大光能转化效率)。如表1所示,stgra254与秀水09的叶绿素荧光参数Fv/Fm在24,32 ℃下并没有显著性差异;而28 ℃下stgra254的Fv/Fm极显著低于野生型秀水09,表明stgra254的PSⅡ反应中心受到损害,光合作用的原初反应受到抑制。
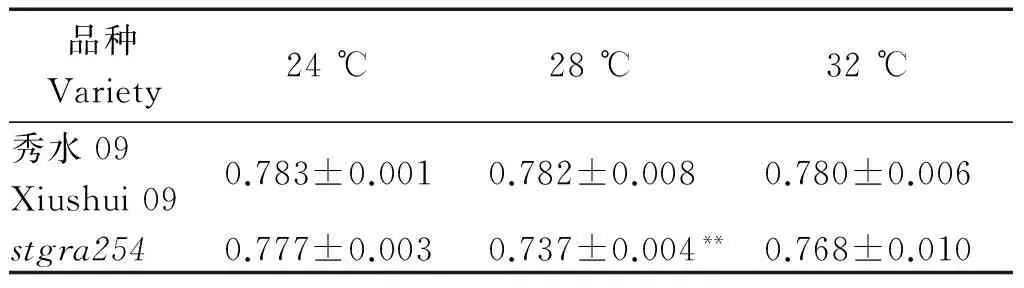
表1 不同温度下叶片的叶绿素荧光动力参数Fv/Fm
注:**.差异在0.01水平显著。
Note:**.Indicated significant difference at 0.01 level.
2.3 白化转绿突变体形成机制的组织化学分析
28 ℃下,突变体stgra254第6叶片白化部分虽然看不到组织坏死斑,但台盼蓝染色后呈现大量深蓝色的斑块,表明着色部位正在发生细胞程序性死亡,而野生型秀水09只在叶脉处有少量深蓝色点(图2-A),这是因为叶片在正常生长过程中,叶脉中导管细胞发生了细胞程序性死亡造成的。32 ℃下突变体stgra254出现白斑的叶片的深蓝色着色点面积较28 ℃明显减小(图2-A);继续培养14 d后,白斑已转为绿色时,深蓝色着色点变得稀疏。表明stgra254白斑的形成和发展是一个程序性细胞死亡的过程。
H2O2是植物细胞内主要的活性氧。经二氨基联苯胺染色后,28 ℃突变体stgra254的第6叶片出现明显的H2O2沉积产生红褐色沉淀,而秀水09几乎没有发生变化(图2-B),表明突变体细胞积累了大量的活性氧。32 ℃stgra254相应叶片只在主脉处有红褐色沉淀;待白斑转绿后,检测不出H2O2沉积。表明stgra254表达引起水稻细胞产生过敏性反应的活性氧迸发,由此推测,stgra254的白斑可能是由H2O2引起的。

图2 不同温度培养下秀水09(左)和stgra254(右)台盼蓝(A)或二氨基联苯胺(B)染色后的叶片局部
2.4 突变体的遗传分析
2.5 白化转绿基因stgra254的初步定位
以stgra254突变体与珍汕97杂交组合的F2为定位群体。构建白化叶基因池和正常绿叶基因池,利用分布在12条染色体上的278对SSR标记引物对2个基因池进行多态性分析,发现标记RM17101、RM17337、RM17468具有多态性。利用这3对标记引物对检测F2分离群体中的248个白化转绿单株,结果将基因stgra254定位于第4染色体的长臂上。为了缩小定位区间,在网站(www.gramene.org)上查找存在于RM17101和RM17337之间的SSR标记,并合成了20对引物,其中RM17154、RM17171、RM17182、RM17206和RM17277这5个标记在两亲本间有多态性且与基因stgra254连锁,进而用这些标记引物对F2定位群体进行连锁分析,结果表明,stgra254基因位于第4号染色体RM17206和RM17277之间,遗传距离分别为0.48,5.22 cM(图3)。
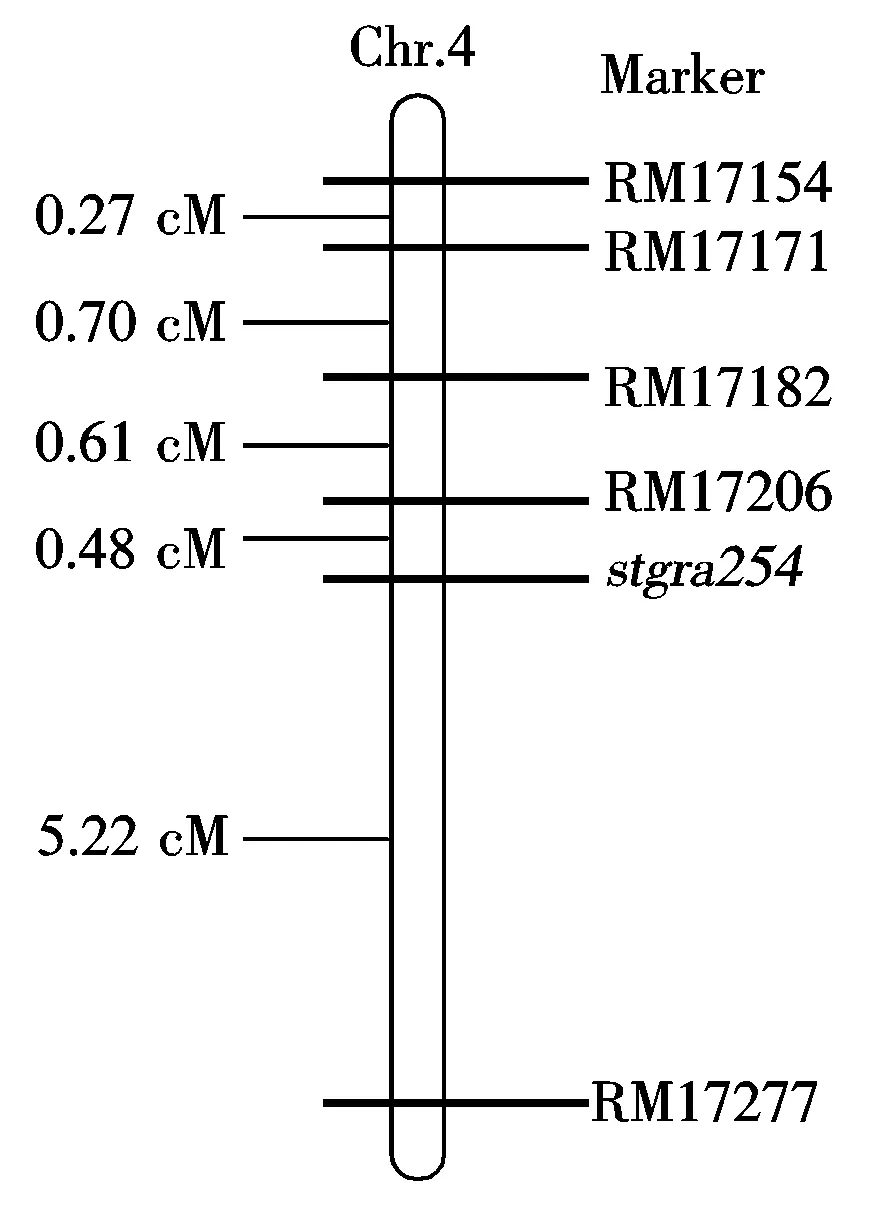
图3 stgra254基因在水稻第4号染色体上的初步定位
3 结论与讨论
突变体stgra254阶段性白化转绿表型同时受植株的生长发育和外界的温度调控。叶发育过程中,叶绿体的发育受质体和核基因协调表达的严格调控[4]。目前报道的40多个水稻白化转绿突变体,绝大多数由单隐性核基因控制,至少有17个被基因定位[8],其中定位于第4染色体上的只有白化转绿和多分蘖矮秆基因hw-1(t)[9]。hw-1(t)在三叶期之前第1,2片叶完全白化,随后转绿,其白叶、多蘖及矮秆表型与突变体stgra254少蘖高秆差异很大[2],并且定位区间相隔远,说明两者不是同一个基因,stgra254为1个新的白化转绿基因。
笔者根据叶绿素荧光动力学参数Fv/Fm及组织化学染色结果推测:突变体stgra254的PSⅡ反应中心受到损害,电子传递受阻,PSⅡ能量持续积累,产生大量活性氧分子,活性氧的大量积累诱导了叶片细胞程序性死亡的发生[15],从而进一步破坏叶绿素,造成失绿变白表型[2]。
突变体v3(virescent-3)在自然生长条件下第1,2叶呈正常绿色,从三叶期-分蘖盛期叶片退绿变白,抽穗后恢复正常,并且白化表型对温度和光周期敏感[4]。突变体gra75的1-3叶呈正常绿色,第4-7叶开始白化,从第8叶又恢复绿色,同时白化叶片叶转为绿色,光温环境条件对其影响较小[13]。基因V3编码核苷酸还原酶RNR的大亚基,RNR参与叶绿体的生物发生,其第5个外显子处发生了单碱基的突变,造成第291位G→S,影响了叶片发育过程中叶绿体的分化[4];gra75为V3的等位基因,由于单碱基突变造成279位氨基酸A→V[13]。这2个突变体白化性状出现的时期及对外界光温反应的差异,可能是由不同的氨基酸突变位点造成的[13]。V1编码一个叶绿体蛋白NUS1,在20 ℃低温下参与核糖体RNA转录和叶绿体的分化,此基因单碱基的突变使得257位R→终止子,阻碍了叶绿体早期的发育,从而产生v1突变体低温敏感型白化表型[1]。突变体gra(t)的白化转绿表型由叶绿体蛋白合成延伸因子基因编码区产生单碱基替换,456位错义突变(T→I)造成叶绿体发育异常[3]。YSA基因编码一个含有16个串联基序的三角状五肽重复蛋白(PPR),其5个核苷酸的缺失造成提前终止密码子的出现,妨碍了突变体ysa(Young seedling albino)幼叶和茎秆中叶绿素含量以及叶绿体发育,后期其他相关基因会补偿其功能的缺失,从而使幼苗表现出阶段性白化转绿表型[6]。突变体OsV4则是因编码4个串联基序的、参与叶绿体发育的PPR蛋白基因4个碱基的缺失引起,四叶期以前在20,24 ℃均表现为白化[16]。编码质体水解酪蛋白酶复合物组分基因的单碱基突变,造成其蛋白产物提前终止而缺失保守的催化域及多肽结合位点,影响叶绿体的早期发育,决定了突变体vyl(Virescent yellow leaf)的表型[14]。新型鸟苷酸激酶位于质体和线粒体上,调控叶绿体发育信号传输到细胞核,单碱基突变(162位V→I)使得质体基因丧失时期特异性表达,抑制核基因编码的质体蛋白表达,质体蛋白也不能正常翻译,最终影响了叶绿体分化,导致突变体v2叶片出现温敏白化表型[12]。IMMUTANTS蛋白参与类胡萝卜素的合成,该基因257bp处单碱基的突变(G→A) 形成终止密码子,造成翻译提前终止,叶片中胡萝卜素含量减少,叶绿体缺少类胡萝卜素保护而被单线态氧破坏,突变体hw-1(t)出现白化表型[2,9]。位于叶绿体被膜及类囊体膜上的J-类似蛋白与叶绿素生物合成中催化光依赖反应的原叶绿素酸酯氧还酶POR互作,起伴侣蛋白功能,当该J-类似蛋白基因发生单核苷酸突变(G→C)时,阻碍抽叶前和正在抽叶的叶片中POR的积累,降低了叶绿素的含量,使得OsV5A突变体三叶期幼苗的叶片缺绿[17]。RNA转录终止因子基因5′端一段核苷酸的缺失,妨碍了调控叶绿体发育某基因的功能,影响了v14第2,3片叶中的叶绿体发育,后期该基因家族其他成员被激活,取代了突变基因的功能,第4片叶叶色便恢复正常绿色[18]。stgra254在六叶期表现出特异及温敏的白化表型的机制尚不清楚。本研究结果为最终分离出该基因以及研究其作用机制奠定了基础。由于阶段性白化转绿突变体大多在分蘖期前就转绿,对水稻的正常生长发育影响很小,可用做杂交水稻制种的标记,确保杂种的纯度[18-20]。
[1]KusumiK,SakataC,NakamuraT,etal.AplastidproteinNUS1isessentialforbuild-upofthegeneticsystemforearlychloroplastdevelopmentundercoldstressconditions[J].ThePlantJournal:forCellandMolecularBiology,2011,68(6):1039-1050.
[2] 郭 涛, 黄永相, 黄 宣, 等.一个控制水稻叶色白化转绿及多分蘖矮秆基因hw-1(t)的鉴定[J].作物学报,2012,38(1):23-35.
[3] Chen T,Zhang Y,Zhao L,et al.Fine mapping and candidate gene analysis of a green-revertible albino genegra(t)inrice[J].JournalofGeneticsandGenomics,2009,36(2):117-123.
[4] Yoo S C,Cho S H,Sugimoto H,et al.Rice virescent3 and stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development[J].Plant Physiology,2009,150(1):388-401.
[5] Qin D,Dong J,Xu F,et al.Characterization and fine mapping of a novel barley stage green-revertible albino gene (HvSGRA) by bulked segregant analysis based on SSR assay and specific length amplified fragment sequencing[J].BMC Genomics,2015,16(1):838.
[6] Qi Y, Liu X, Liang S, et al. A putative chloroplast thylakoid metalloprotease VIRESCENT3 regulates chloroplast development inArabidopsisthaliana[J].Journal of Biological Chemistry, 2016, 291(7): 3319-3332.
[7] Su N,Hu M,Wu D,et al.Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J].Plant Physiology,2012,159(1):227-238.
[8] 董华林, 费震江, 魏 磊, 等.水稻苗期叶片白化转绿性状研究进展[J].湖北农业科学,2012,51(23):5241-5247.
[9] 郭 涛, 黄永相, 黄 宣, 等.水稻叶色白化转绿及多分蘖矮秆基因hw-1(t)的图位克隆[J].作物学报,2012,38(8):1397-1406.
[10] Reinbothe S,Pollmann S,Springer A,et al.A role of Toc33 in the protochlorophyllide-dependent plastid import pathway of NADPH:protochlorophyllide oxidoreductase (POR) A[J].The Plant Journal :for Cell and Molecular Biology,2005,42(1):1-12.
[11] Dai X B,Cao S Q,Xu X M,et al.Study on a mutant with low content chlorophyll b in a high yielding rice and its photosynthesis properties[J].Acta Botanica Sinica,2000,42(12):1289-1294.
[12] Sugimoto H,Kusumi K,Noguchi K,et al.The rice nuclear gene,VIRESCENT2,is essential for chloroplast development and encodes a novel type of guanylate kinase targeted to plastids and mitochondria[J].The Plant Journal :for Cell and Molecular Biology,2007,52(3):512-527.
[13] 王平荣, 王 兵, 孙小秋, 等.水稻白化转绿基因gra75的精细定位和生理特性分析[J].中国农业科学,2013,46(2):225-232.
[14] Dong H,Fei G,Wu C,et al.A rice virescent-yellow leaf mutant reveals new insights into the role and assembly of plastid caseinolytic protease in higher plants[J].Plant Physiology,2013,162(4):1867-1880.
[15] Kim H,Lee H,Oh C,et al.Postembryonic seedling lethality in the sterol-deficientArabidopsiscyp51A2 mutant is partially mediated by the composite action of ethylene and reactive oxygen species[J].Plant Physiology,2010,152(1):192-205.
[16] Gong X,Su Q,Lin D,et al.The rice OsV4 encoding a novel pentatricopeptide repeat protein is required for chloroplast development during the early leaf stage under cold stress[J].Journal of Integrative Plant Biology,2014,56(4):400-410.
[17] Liu H, Li Q, Yang F, et al. Differential regulation of protochlorophyllide oxidoreductase abundances by VIRESCENT 5A (OsV5A) and VIRESCENT 5B (OsV5B) in rice seedlings[J]. Plant and Cell Physiology, 2016, 57(11): 2392-240258.
[18] Zhang Q, Xue D, Li X, et al. Characterization and molecular mapping of a new virescent mutant in rice [J]. Journal of Genetics and Genomics, 2014, 41(6): 353-356.
[19] Liu J, Wang J, Yao X, et al. Characterization and fine mapping of thermo-sensitive chlorophyll deficit mutant1 in rice (OryzasativaL.) [J]. Breeding Science, 2015, 65(2): 161-169.
[20] Deng X J, Zhang H Q, Wang Y, et al. Mapped clone and functional analysis of leaf-color geneYgl7 in a rice hybrid (OryzasativaL. ssp. indica) [J]. PLoS One, 2014, 9(6): e99564.
Characterization and Gene Mapping of Stage Thermo-sensitive Green-revertible Albino Mutantstgra254 in Rice
ZOU Jincai1,ZHANG Weilin1,XIA Minghui1,QIU Yangsong1,WANG Changchun1,YANG Ling1,ZHANG Xiaoming2
(1.College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua 321004,China; 2.Institute of Crop and Nuclear Technology Utilization,Zhejiang Academy of Agricultural Sciences,Hangzhou 310021,China)
In order to explore and identify more albino mutants for studying gene functions,a stage thermos-sensitive green-revertible albino mutant in rice,designated asstgra254,was isolated by treating the seeds ofjaponicavariety Xiushui 09 using EMS.The phenotype ofgra254 is thermos-sensitive.Under a constant temperature of 28 ℃,the white spots appeared on the fully expanded sixth leaves,and gradually enlarged and merged into one at maximum tillering stage.Then the leaves withered to death.The sixth leaf blades showed milder expression of the mutant phenotype under 32 ℃ condition than that under 28 ℃ condition,and gradually turned green from the third day onward.Under 24 ℃ condition,however,thegra254 plants produced normal green leaves.Histochemical staining analysis indicated that the albino trait ofstgra254 was caused by the programmed cell death,which probably caused by oxidative burst accompanying by the accumulation of H2O2.Analysis by fluorescence analyzer presented that the maximal photochemical efficiency of PS Ⅱ decreased significantly.Genetic analysis indicated that the thermos-sensitive green-revertible albino trait was controlled by a single recessive nucleic gene.Based on the F2population derived from a cross betweenstgra254 and Zhenshan 97,thestgra254 was located between the SSR markers of RM17206 and RM17277 on chromosome 4 by bulked segregant analysis and linkage analysis.The genetic distance was 0.48,5.22 cM, respectively.
Rice; Green-revertible albino; Thermos-sensitive; Gene mapping
2017-02-14
浙江省水稻种业科技创新团队项目(2010R50024)
邹金财(1989-),男,江西赣州人,在读硕士,主要从事水稻分子生理研究。
杨 玲(1965-),女,湖南宁乡人,教授,博士,主要从事水稻逆境分子生理研究。
张小明(1962-),男,浙江杭州人,研究员,博士,主要从事水稻遗传育种研究。
Q78;S511.03;Q945
A
1000-7091(2017)03-0001-06
10.7668/hbnxb.2017.03.001

