萼脊兰MADS-box基因的克隆及表达载体构建
蒋素华,黄 萍,王默霏,梁 芳,许申平,崔 波
(1.郑州师范学院 生物工程研究所,河南 郑州 450044; 2.河南农业职业学院,河南 郑州 451450)
萼脊兰MADS-box基因的克隆及表达载体构建
蒋素华1,黄 萍2,王默霏1,梁 芳1,许申平1,崔 波1
(1.郑州师范学院 生物工程研究所,河南 郑州 450044; 2.河南农业职业学院,河南 郑州 451450)
为了研究“ABC”模型的B类PI基因,探究决定花瓣和雄蕊形成的基因特征。采用CTAB法提取萼脊兰花瓣总RNA,并通过RT-PCR法克隆萼脊兰PI基因的编码序列,该序列长度为633 bp,编码210个氨基酸,与小兰屿蝴蝶兰的氨基酸相似性最高。对PI所表达蛋白质的结构、亲水性和二级结构进行了分析,结果显示,该基因包含MADS-box和K-box保守结构域,属于MADS-box基因家族;该蛋白分子属于亲水性蛋白,包含56.19% α螺旋、13.81% 的延伸链以及30%的不规则折叠,实时荧光定量PCR结果显示,PI基因主要在花器官中表达,且表达量高,说明PI基因的表达具有组织特异性。构建植物表达载体的结果显示,目的基因和带启动子的片段已插入到表达载体pCAMBIA1301中,表明成功构建植物表达载体1301-PI,为最终获得新奇花型的萼脊兰奠定基础。
萼脊兰;PI基因;克隆;表达分析;表达载体
萼脊兰(Sedireajaponica)属单子叶植物兰科萼脊兰属,花瓣长圆状舌形,具橘子香气,具有较高的园艺价值以及一定的药用价值,养护简单且观赏期长,因而越来越受到人们的关注和喜爱[1-3]。花发育是高等植物生长发育过程中极为重要的环节,花的分化从生殖生长开始,即营养分生组织分化为花序分生组织,进而分化为花分生组织形成花器官原基,最终形成花器官[4-6]。随着分子生物学和细胞生物学等学科的发展,对花卉的基因研究以及育种研究越来越受到重视。兰科植物作为极度特化的开花植物,其花结构表现出独特的进化特征,如唇瓣的特化和合蕊柱的形成,这为人们研究新的变异基因以及花的形态建成提供了良好的组织材料[7-10]。花器官是植物生殖过程中重要的功能器官,花发育遗传机制的研究促进了人们对被子植物花结构进化的进一步了解[11-13]。被子植物的花从外向内分别为:萼片、花瓣、雄蕊、心皮和胚珠,人们在对拟南芥和金鱼草突变体的研究中发现了植物发育的同源异形现象以及产生同源异形突变的器官决定基因,这些基因在花发育过程中起着“开关”的作用[7]。“ABC模型”是最早提出的有关花器官形成的理论,其要点是,正常花器官结构的形成由A、B、C 3类基因的共同作用来完成,每一轮花器官特征的决定分别依赖A、B、C 3类基因中的一类或两类基因的正常表达,若其中任何一类或更多类的基因发生突变而丧失功能,则花的形态发生将出现异常,A类基因控制第1,2轮的发育,B类基因控制第2,3轮的发育,C类基因控制第3,4轮的发育。ABC模型中的基因大都属于MADS-box基因家族,它们的功能高度保守,多参与花发育的调控机制[14-16]。PI基因是调控植物花器官发育的B类基因,它控制植物花瓣和雄蕊的发育,含有一个高度保守的DNA结合结构域,属于MADS-box家族基因,其编码的转录因子能与相应的DNA区域结合从而调控该基因转录。它的突变能导致第2轮花瓣变为萼片,第3轮雄蕊变为心皮,所以,对PI基因进行研究意义重大[17-19]。为此,本研究采用RT-PCR法从萼脊兰花瓣中扩增PI基因,并对所扩增的基因进行序列检测与分析,利用实时荧光定量PCR技术分析该基因在盛花期不同部位的表达特性,构建高效植物载体pCAMBIA1301-PI,旨在为进一步研究兰科植物PI基因功能以及获得萼脊兰新品种奠定基础。
1 材料和方法
1.1 试剂
E.coliDH5α菌株、中间载体pBI221、表达载体pCAMBIA1301由郑州师范学院生物工程研究所保存,RNA提取试剂盒购自天根有限公司,实时荧光定量PCR试剂盒、克隆载体pMD19-T Vector、rTaqDNA聚合酶、限制性内切酶、T4DNA连接酶、普通琼脂糖凝胶DNA回收试剂盒(离心柱型)、质粒小提试剂盒、反转录试剂盒等购于TaKaRa公司,LB固体及液体培养基、抗生素卡那霉素、氨苄青霉素均购自TaKaRa公司。
1.2 试验材料
萼脊兰采自郑州师范学院兰花工程技术研究中心,在盛花期分别取萼脊兰的根、叶、萼片、花梗、花瓣、唇瓣、蕊柱,用液氮速冻,置于-80 ℃冰箱保存。
1.3 试验方法
1.3.1PI基因的克隆 按照CTAB法提取萼脊兰花瓣总RNA,以提取的总RNA为模板,用反转录试剂盒获得cDNA,置于-20 ℃备用。
根据NCBI上报道的PI基因序列设计引物:上游引物ORF-F为5′-ACGAGCTCATGGGTCGGGGGAAGATAGA-3′,下游引物ORF-R为5′-CATCTAGA
TTACTTATTTCCCTGCAAGTT-3′,在2个引物的5′端分别用下划线标明了酶切位点(SacⅠ和XbaⅠ)。
以cDNA为模板进行PCR反应,PCR反应体系为20 μL体系,其中包含dNTP Mix 2 μL、10×PCR Buffer 2 μL、上游引物ORF-F 1 μL、下游引物ORF-R 1 μL、萼脊兰cDNA 1 μL、rTaq酶0.2 μL,加灭菌水至总体积20 μL;PCR反应程序为94 ℃预变性5 min;94 ℃变性40 s,55 ℃复性40 s,72 ℃延伸40 s,32个循环;最后72 ℃延伸10 min。
电泳检测后进行凝胶回收,然后将扩增的cDNA克隆到pMD19-T载体中,转化E.coliDH5α感受态细胞,进行蓝白斑选择,挑出白色单菌落进行PCR检测,阳性克隆进行基因测序。
1.3.2PI基因的生物信息学分析 利用NCBI的Blast工具对已有PI基因序列进行检索,并使用Primer Premier 5.0进行引物设计;利用DNAMAN软件进行序列分析;利用ExPASy网站上的ProtScale程序对蛋白质进行亲疏水性分析,并利用该网站上的GOR工具对蛋白质的二级结构进行预测。
1.3.3PI基因的表达分析 以PI基因序列的ORF区设计实时荧光定量PCR引物,以萼脊兰EF1α作为内参基因设计引物(表1)进行PI基因在萼脊兰中的表达分析。分别提取萼脊兰盛花期的根、叶、萼片、花梗、花瓣、唇瓣、蕊柱的总RNA,使用TaKaRa的Prime Script RT reagent Kit With gDNA Eraser试剂盒反转录合成cDNA 第1链。采用三步法 qRT-PCR,20 μL 反应体系包括 10 μL 2×SYBR®Premix ExTaqTMⅡ(TaKaRa)、0.8 μL的上、下游基因特异性引物及各个样本的 cDNA 1.4 μL,并补 dH2O至20 μL。qRT-PCR所用仪器为Eppendorf Mastercycler ep realplex2,反应程序为:预变性95 ℃ 30 s;95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s,40个循环。每个样品重复3次,阴性对照为水。目的基因相对表达量Rel.Exp = 2-ΔΔCt,其中ΔCt =Ct (PI)-Ct (EF1α),ΔΔ Ct =植物各组织ΔCt-花梗ΔCt。
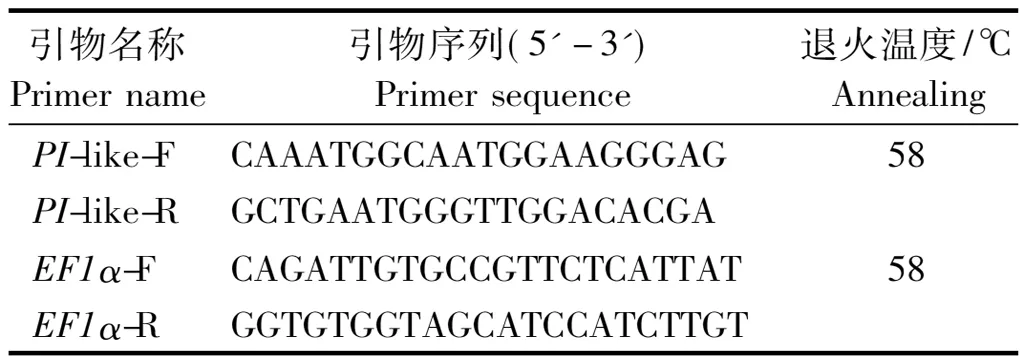
表1 实时荧光定量PCR引物序列
1.3.4 表达载体的构建 将测序正确的PI-ORF-T以及保存的载体pBI221和pCAMBIA1301按照质粒小提试剂盒的说明进行提质粒操作,然后用SacⅠ和XbaⅠ对PI-ORF-T进行双酶切后与同样经SacⅠ和XbaⅠ双酶切的pBI221载体进行连接,获得中间载体pBI221-PI,再用EcoRⅠ和Hind Ⅲ将目的基因从中间载体中切下,然后与同样经EcoRⅠ和Hind Ⅲ双酶切的pCAMBIA1301表达载体进行连接,从而构建成植物表达载体1301-PI。
2 结果与分析
2.1 萼脊兰总RNA的提取
提取萼脊兰盛花期的根、叶、花梗、萼片、花瓣、唇瓣、蕊柱总RNA,电泳检测显示(图1),总RNA具有完整的28S、18S、5S,3条条带均显示清晰,表明提取的总RNA质量好,完整性好,降解较少。
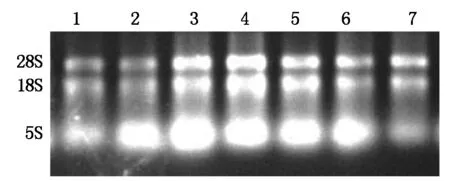
1~7.根、叶、花梗、萼片、花瓣、唇瓣、蕊柱。
2.2 萼脊兰PI基因的克隆
萼脊兰cDNA的PCR扩增产物片段,经琼脂糖凝胶电泳检测(图2),大小约为633 bp,这与预期结果一致。经DNAMAN进行序列多重分析比对(图3),发现PI基因编码的210个氨基酸序列与小兰屿蝴蝶兰的相似性最高,初步表明PI基因被成功克隆。
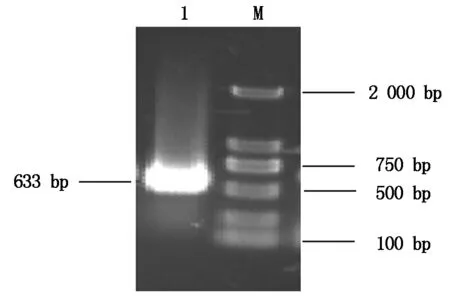
1.PI目的基因;M.Marker 2000。

图3 不同植物PI氨基酸序列多重比对
2.3 萼脊兰PI基因序列分析
利用生物信息学软件对PI的蛋白结构进行分析,结果显示,该基因属于MDAS-MEF2-like亚家族,具有完整的MADS-box和K-box保守结构域,属于MDAS-box基因家族(图4);蛋白质亲疏水性分析表明该基因所表达蛋白属于亲水性蛋白,蛋白质的二级结构由56.19%的α螺旋、13.81%的延伸链、30%的不规则折叠组成(图5)。
2.4 萼脊兰PI基因表达分析
萼脊兰PI基因表达分析结果表明,PI基因在盛花期不同部位虽都有表达,但表达丰度不一致,盛花期营养器官几乎不表达,生殖器官中表达量很高,说明PI基因的表达具有组织特异性,主要在花器官中表达。在盛花期,营养器官中根和叶表达最低,几乎为零;在生殖器官中,萼片的表达量最高,其次是花瓣,唇瓣和蕊柱次之,花梗的表达量较低,并且在萼片、花瓣、唇瓣和蕊柱中PI基因的表达量整体呈逐渐下降趋势(图6)。

图4 PI蛋白保守结构域

c.无规则卷曲;h.α螺旋;e.延伸链。
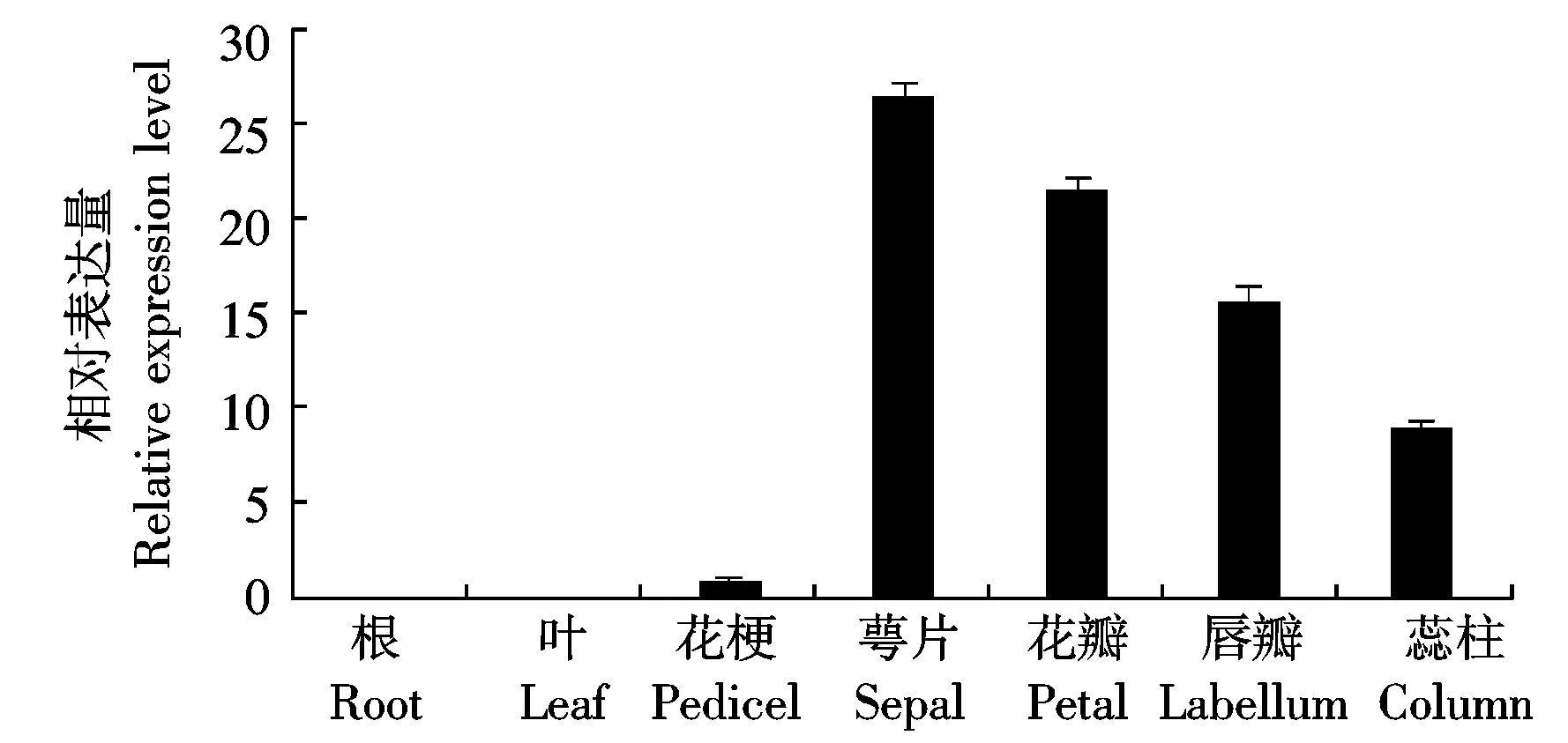
图6 萼脊兰PI基因的表达分析
2.5PI基因表达载体的构建
应用SacⅠ和XbaⅠ对PI-ORF-T质粒进行双酶切,能够切出633 bp的目的基因(图7)。应用EcoRⅠ和Hind Ⅲ对中间载体pBI221-PI进行酶切,能够切出符合预期的1.8 kb左右的片段(图8),说明中间载体pBI221-PI构建成功。应用SacⅠ和XbaⅠ对植物表达载体1301-PI进行酶切,切出约633 bp的目的基因片段(图9),表明植物表达载体1301-PI构建成功。

M.Marker 15000;1.质粒;2.双酶切。图8-9同。
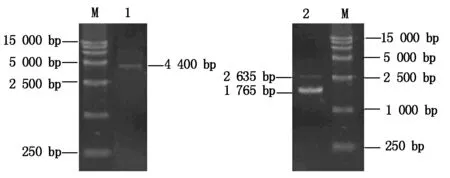
图8 pBI221-PI质粒及双酶切(EcoRⅠ、Hind Ⅲ)
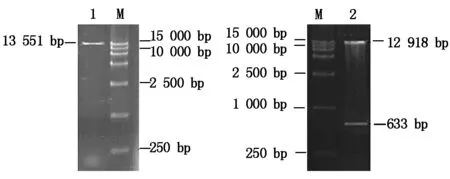
图9 1301-PI质粒及双酶切(SacⅠ、XbaⅠ)
3 结论与讨论
近年来有关开花调控基因的研究成为热点,而PI基因作为控制花发育的B类基因,其研究却刚刚起步[20]。本研究根据NCBI网站上报道的PI基因全长序列来设计引物,采用RT-PCR技术克隆了633 bp的PI基因ORF区域,利用qRT-PCR对PI基因的表达进行研究分析,并且构建了1301-PI表达载体。通过对PI基因的功能域进行分析,发现其具有完整的高度保守的MADS-box区和K-box区,这说明PI基因属于MADS基因家族。通过对PI基因所表达的蛋白进行亲疏水性分析,表明其所表达的氨基酸为亲水性蛋白。
PI基因作为MADS-box基因家族的成员,不仅参与花器官的形成,还参与根的形成、花的起始、胚的发育及种子和果实的形成等过程[21],且在植物生长的不同时期中发挥不同的作用,本研究的结果显示,在萼片、花瓣、唇瓣和蕊柱中的表达量最高,在根和叶中表达量很低,说明PI基因主要参与花器官的形成。
在构建载体的过程中,最重要的步骤就是酶切与连接体系的设计与操作。酶切位点和所采用的酶需要经过认真合理的筛选,必须注意两酶切位点的间距要合适,否则会影响酶对位点的识别而影响酶切效率[22]。连接的过程中应注意目的基因与载体之间的浓度比例,底物浓度应控制在载体浓度的3~10倍,底物浓度过高或过低都会影响连接的效率。另外,无论酶切还是连接,都应注意控制好反应的温度和时间。
[1] 王卜琼,李枝林,余朝秀.兰花育种研究进展[J].园艺学报,2005,32(3):551-556.
[2] 崔 波,马 杰.萼脊兰的组织培养和快速繁殖[J].植物生物学通讯,2008,44(2):22-23.
[3] 崔 波,沈俊辉.萼脊兰胚培养与快速繁殖研究[J].安徽农业科学,2009,37(13):5861-5863.
[4] 田云芳,蒋素华,袁秀云,等.兰科植物花发育相关基因的研究进展[J].北方园艺,2014(12):168-172.
[5] 田云芳,袁秀云,蒋素华,等.高等植物的花发育模型及其基因调控研究进展[J].贵州农业科学,2014,42(11):23-28.
[6] 崔 波,蒋素华,刘 佳,等.萼脊兰AP1-like基因的克隆与表达分析[J].西北植物学报,2013,33(9):1734-1744.
[7] Gopal S, Park J I, Jung H J, et al. Genome-wide identification and characterization ofMADS-boxfamily genes related to organ development and stress resistance inBrassicarapa[J].BMC Genomics , 2015 , 16 (1): 1-21.
[8] Alvarez-buylla E R,Liljegren S J,Pelaz S,et al.MADS-box gene evolution beyond flowers:expression in pollen,endosperm,guard cells,roots and trichomes[J].The Plant Journal,2000,24(4):457-466.
[9] Kyozuka J,Kobayashi T,Morita M,et al.Spatially and temporally regulated expression of rice MADS box genes with similarity toArabidopsisclass A,B and C genes[J].Plant & Cell Physiology,2000,41(6):710-718.
[10] Tsai W C,Kuoh C S,Chuang M H,et al.Four DEF-like MADS box genes displayed distinct floral morphogenetic roles inPhalaenopsisorchid[J].Plant & Cell Physiology,2004,45(7):831-844.
[11] Xu Yifeng,Teo Lailai,Zhou Jing,et al.Floral organ identity genes in the orchidDendrobiumcrumenatum[J].The Plant Journal,2006,46(1):54-68.
[12] Chang Yuyun,Chiu Y F,Wu Jiawei,et al.Four orchid (Oncidium Gower Ramsey) AP1/AGL9-like MADS box genes show novel expression patterns and cause different effects on floral transition and formation inArabidopsisthaliana[J].Plant & Cell Physiology,2009,50(8):1425-1438.
[13] Tsai W C,Lee Pei-fang,Chen H I,et al.PeMADS6,a GLOBOSA/PISTILLATA-like gene inPhalaenopsisequestrisinvolved in petaloid formation,and correlated with flower longevity and ovary development[J].Plant & Cell Physiology,2005,46(7):1125-1139.
[14] Yang Yingzhen,Fanning L,Jack T.The K domain mediates heterodimerization of theArabidopsisfloral organ identity proteins,APETALA3 and PISTILLATA[J].The Plant Journal,2003,33(1):47-59.
[15] Li L Y, Fang Z W, Li X F, et al. Isolation and characterization of the C-class MADS-box gene from the distylous pseudo-cerealFagopyrumesculentum[J]. Journal of Plant Biology,2017,60(2) :189-198.
[16] Elizabeth B, Neil1A. Ancestral and more recently acquired syntenic relationships of MADS-box genes uncovered by the Physcomitrella patens pseudochromosomal genome assembly[J]. Plant Cell Reports, 2016, 35(3):505-512.
[17] Kramer E M,Dorit R L,Irish V F.Molecular evolution of genes controlling petal and stamen development:duplication and divergence within the APETALA3 and PISTILLATA MADS-box gene lineages[J].Genetics,1998,149(2):765-783.
[18] Nakatsuka T, Saito M, Nishihara M. Functional characterization of duplicated B-class MADS-box genes in Japanese gentian[J]. Plant Cell Reports, 2016, 35(4): 895-904.
[19] Duan W, Song X, Liu T, et al. Genome-wide analysis of the MADS-box gene family inBrassicarapa(Chinese cabbage) [J]. Molecular Genetics and Genomics, 2015, 290(1): 239-255.
[20] Nakatsuka T, Saito M, Yamada E, et al. Isolation and characterization of the C-classMADS-boxgene involved in the formation of double flowers in Japanese gentian[J]. EMC Plant Biol ,2015 ,15:182.
[21] 蒋素华,袁秀云,崔 波,等.萼脊兰SeAP1-like基因的克隆与表达载体构建[J].河南农业科学,2015,44(1):105-109.
[22] 赵德征,罗兴录,唐娟娟,等.木薯AGPase基因的克隆与载体构建[J].中国农学通报,2012,28(21):76-80.
Cloning and Construction of Expression Vector ofMADS-boxGene fromSedireajaponica
JIANG Suhua1,HUANG Ping2, WANG Mofei1,LIANG Fang1,XU Shenping1,CUI Bo1
(1.Institute of Biotechnology,Zhengzhou Normal University,Zhengzhou 450044,China;2.Henan Vocational College of Agriculture,Zhengzhou 451450,China)
In order to study the B typePIgene of "ABC" model, and explore the gene characteristics of petals and stamen formation.In the study,using CTAB approach to extract the total RNA of the petal ofSedireajaponica,and cloning the part-length cDNA sequences ofPIgene ofSedireajaponicaby using RT-PCR approach.It found that the length of this gene sequence was 633 bp,it encoded 210 putative amino acid residues and the gene sequence had a high homology withPhalaenopsisequestrisafter sequence alignment.After analysis of the structure and the hydrophilic and the secondary structure of PI protein,it found that the gene sequence contained the MADS-box domain and K-box,it belonged to theMADS-boxsuper family,PI was hydrophilic protein,and it contained 56.19% Alpha helix,13.81% extended strand and 30% random coil.The expression was analysed by Real-time fluorescent quantitative PCR,PIgenes mainly expressed in floral organ,and high expression andPIgene expression had tissue specificity.During the construction of expression vector,it leads the sequence containing objective gene and promoter to the pCAMBIA1301 expression vector,it showed that the construction of expression vector 1301-PIwas succeed,which laied the fundation for getting new varieties ofSedireajaponica.
Sedireajaponica;PIgene; Cloning; Expression analysis; Expression vector
2017-04-12
郑州市科技发展计划项目(20150448);郑州市重大科技专项(141PZDZX038);河南省教育厅重点科研项目(14B180036)
蒋素华(1983-),女,河南漯河人,讲师,硕士,主要从事花卉分子生物学研究。
崔 波(1962-),男,河南泌阳人,教授,博士,主要从事植物分子生物学研究。
Q949.71+8.43;Q78
A
1000-7091(2017)03-0065-05
10.7668/hbnxb.2017.03.010

