花生膜联蛋白基因AhAnn1的克隆与表达分析
丁 红,戴良香,秦斐斐,慈敦伟,宋文武,张智猛
(山东省花生研究所,山东 青岛 266100)
花生膜联蛋白基因AhAnn1的克隆与表达分析
丁 红,戴良香,秦斐斐,慈敦伟,宋文武,张智猛
(山东省花生研究所,山东 青岛 266100)
为挖掘花生抗逆境胁迫相关基因,克隆抗逆相关膜联蛋白Annexin基因,以花生品种花育25号为试验材料,从已知抑制消减杂交文库中获得花生膜联蛋白Annexin类似基因片段,通过RACE技术获得Annexin基因5′-RACE片段。对5′-RACE序列和抑制消减杂交文库中已知基因片段进行拼接,设计特异引物通过逆转录-聚合酶链式反应(RT-PCR)扩增得到该基因,命名为AhAnn1。结果表明,AhAnn1全长为1 277 bp,开放阅读框为951 bp。根据编码区预测AhAnn1编码一条316个氨基酸组成的多肽,预测分子量为36.10 kDa,等电点为7.07。预测该基因编码的蛋白含有膜联蛋白Annexin保守结构域,定位于细胞质中。蛋白序列多重比对和系统发育分析表明,花生与大豆、苜蓿、鹰嘴豆等豆科植物中的膜联蛋白相似性最高,亲缘关系最近。荧光实时定量PCR结果显示,AhAnn1在根系和叶片中的表达量随干旱胁迫程度的增加而增加。由此推测AhAnn1是一种干旱胁迫应答基因,在花生逆境调控中发挥作用。结果为进一步研究花生AhAnn1基因的功能和花生抗逆境胁迫相关分子机理提供了理论基础。
花生;膜联蛋白基因;干旱;系统发育分析;荧光定量PCR
膜联蛋白(Annexins,Ann)是依赖钙离子与磷脂膜可逆结合的一种可溶性保守蛋白家族。Annexin蛋白在动植物及菌类等生物体内普遍存在,在各器官中几乎均有表达[1-2]。研究表明,植物膜联蛋白参与建成膜结构、生成细胞壁、响应逆境胁迫、转导细胞信号、膜泡运输及调控果实成熟等生理过程,对细胞生长、发育、分化及再生修复具有重要作用。目前已从大豆[3]、拟南芥[4]、玉米[5]、木薯[6]、黄瓜[7]及水稻[8]等植物中分离得到Annexin基因。植物Annexin与逆境胁迫的关系已有较多的报道,植物受到干旱、盐碱、低温及氧化胁迫等逆境时,Annexin蛋白表达能增加其对逆境的耐受力[9-14]。拟南芥AtANN1缺失突变株抗旱能力降低而过表达植株耐旱性明显提高,且该基因受盐胁迫诱导表达量显著上升[13]。低温胁迫能够上调水稻中膜联蛋白的表达[11]。将芥菜AnnBj1基因转入烟草幼苗后可增强烟草幼苗对非生物胁迫和生物胁迫的抵抗能力[15]。
花生是重要的油料作物和经济作物,干旱、盐碱等逆境对其产量和品质影响较大。Annexin在植物逆境胁迫应答中具有重要作用,但目前膜联蛋白Annexin在花生抗逆机制中的研究报道较少,其在花生抗逆境胁迫中所起的作用不甚明确。本研究克隆得到花生膜联蛋白AhAnn1基因,对其序列和系统发育进行分析,并对不同干旱胁迫程度下AhAnn1基因的表达进行了分析。
1 材料和方法
1.1 试验设计
以花生品种花育25号为试验材料,在光照16 h/8 h黑暗(28 ℃/22 ℃)的培养箱中进行盆栽试验。在培养盆内装土后浇水使其土壤含水量达饱和含水量,待湿度降低至田间持水量时进行播种,播种后25 d进行不同干旱胁迫处理。水分处理按Hsiao[16]和黎裕[17]的标准划分:设置正常供水处理:75%FC(Filed capacity,田间持水量);干旱胁迫分别设置中度干旱胁迫45%FC和重度干旱胁迫20%FC,胁迫时间为5 d。
1.2 试验试剂
总RNA 提取试剂盒、大肠杆菌DH5α感受态、凝胶回收试剂盒、质粒提取试剂盒购自天根生化科技有限公司。RACE(Rapid amplification of cDNA ends)试剂盒和50 BD Advantage 2 polymerase mix购自Clontech公司;M-MLV反转录酶购自Invitrogen公司。pMD18-T载体、SYBR®Premix Ex TaqTMⅡ聚合酶购自宝生物工程(大连)有限公司。
1.3 提取RNA与反转录合成cDNA
样品总RNA提取使用RNeasy Mini Kit,总RNA中残留基因组DNA用DNase Ⅰ酶处理去除。紫外分光光度法测定提取的RNA在260,280,230 nm处的吸光度值,确定RNA的浓度及纯度。按照1 OD=40 μg RNA计算RNA产率。OD260/280为1.8~2.0时视为RNA的纯度很高。吸取2 μg总RNA样品利用M-MLV反转录酶进行cDNA的合成,反应体系为20 μL。
1.4 5′-RACE片段和基因全长的获得
通过序列比对分析从构建得到的抑制消减杂交文库中获得花生膜联蛋白AhAnn1类似基因片段。序列分析结果表明,该已知序列缺少5′端序列,利用RACE(Rapid amplification of cDNA ends)试剂盒扩增其5′端序列。根据已经获得Ann1类似基因片段序列设计5′-RACE反应特异性引物为:5′-CTCGTAGCCACCACTCTTGT-3′。对获得5′端片段进行测序分析后与已知基因片段拼接得到花生膜联蛋白AhAnn1基因的全长。根据拼接结果找到基因的起始密码子和终止密码子,从两端设计特异性引物5′-ATGTCGACTCTGAGAATTCCTC-3′和5′-TCAAACATCATCATGTCCTAA-3′。利用50 BD Advantage 2 polymerase mix高保真DNA聚合酶通过PCR扩增得到花生中Ann1基因的开放阅读框。
1.5 序列分析
利用Blast工具(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对花生AhAnn1基因与其他基因的相似性进行查找,开放阅读框利用ORF finder(Open reading frame finder)在线进行分析。AhAnn1基因编码的氨基酸序列由所获得基因的cDNA序列推导得到,并利用下述软件对氨基酸序列进行分析:蛋白质的基本理化性质采用Protparam(http://web.expasy.org/protparam/)进行预测;亚细胞定位利用LOCtree3 (https://rostlab.org/services/loctree3)进行分析;蛋白质跨膜结构域分析通过TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM)进行;蛋白的保守结构域利用NCBI的CDSS(Conserved Domain Search Service)数据库进行分析。
1.6 系统发育分析
利用DNAMan软件的多重序列比对(Multiple alignment)对不同植物的膜联蛋白进行多重序列比对分析;利用MEGA 6.0软件进行系统发育和进化分析,采用邻接法NJ(Neighbour-joining)构建系统发育树。
1.7 荧光定量RT-PCR
采用Roche的LightCycler 2.0荧光定量PCR仪进行荧光定量PCR,以Actin11为内参基因[18],3次重复,采用2-ΔΔct方法分析数据。荧光定量PCR所用AhAnn1引物为5′-TTTGTGGCAGCGGTTATTATGT
C-3′和5′-ATCCCAACCCAAACCACCTACAT-3′;Actin11引物为5′-TTGGAATGGGTCAGAAGGATGC-3′和5′-AGTGGTGCCTCAGTAAGAAGC-3′。
2 结果与分析
2.1 花生AhAnn1基因5′序列的获得
通过序列分析从已知抑制消减杂交文库中获得花生膜联蛋白AhAnn1基因片段。序列分析结果表明该已知序列缺少5′端序列,通过5′-RACE技术扩增其5′端序列。扩增片段大小为813 bp(图1),与设计一致,测序后获得AhAnn1基因 5′序列,根据Kozak法则确定第一个ATG为起始密码子。
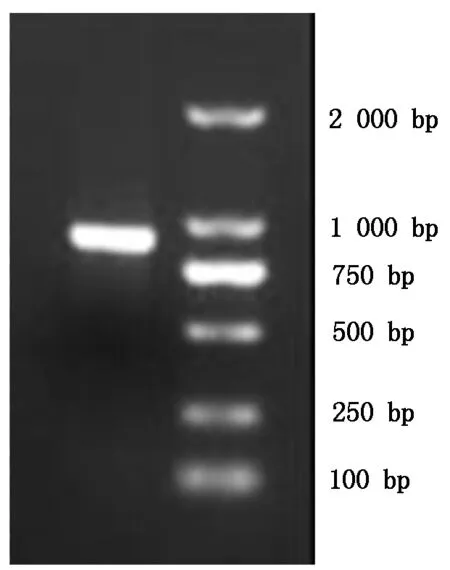
图1 AhAnn1基因5′-RACE PCR产物电泳分析
2.2 花生AhAnn1基因的克隆
将获得的5′端序列与抑制消减杂交文库内已知基因片段拼接得到花生膜联蛋白AhAnn1基因的全长,根据拼接得到的全长序列设计特异引物,通过RT-PCR反应扩增得到该基因。基因全长为1 277 bp,编码区两侧翼分别具有5′UTR (68 bp) 和3′UTR( 258 bp),用软件Polyadq预测到在poly (A) 尾前115位出现终止信号AATAAA,代表多聚核苷酸A 合成信号。AhAnn1基因开放阅读框为951 bp,编码316个氨基酸合成的多肽(图2)。利用NCBI网站的Protein Blast对该基因编码的蛋白进行蛋白质比对分析,结果表明,花生(Arachishypogaea)中膜联蛋白AhAnn1与大豆(Glycinemax)、苜蓿(Medicagotruncatula)、鹰嘴豆(Cicerarietinum)和木豆(Cajanuscajan)等双子叶植物中的膜联蛋白同源性达80%以上(图3)。
2.3 花生AhAnn1氨基酸序列分析
对花生膜联蛋白AhAnn1基因所编码的蛋白质序列进行ProtParam在线分析,结果表明,AhAnn1基因所编码的膜联蛋白AhAnn1的理论分子量为36.10 kDa,理论等电点PI(Isoelectric point)为7.07,亲水性平均系数GRAVY(Grand average of hydropathicity)为-0.483;通过LOCtree3预测其可能定位于细胞质中,根据跨膜结构域分析表明该蛋白无跨膜结构。保守结构域预测结果表明该蛋白有4个Annexin保守结构域,分别在16-80,87-152,172-232,245-310这4个氨基酸区域(图4)。利用MEG 6.0软件对花生膜联蛋白AhAnn1与其他物种膜联蛋白Annexin进行系统发育分析(图5)。蛋白序列聚类结果表明,AhAnn1与鹰嘴豆、木豆、大豆和苜蓿(Medicagotruncatula)中Annexin蛋白聚于同一个进化分支,说明它们具有较近的亲缘关系;与可可(Theobromacacao)、雷蒙德氏棉(Gossypiumraimondii)以及欧亚花魁(Lavaterathuringiaca)中的Annexin1

图2 AhAnn1基因的核苷酸及氨基酸序列

图3 Annexin氨基酸序列的多重比对
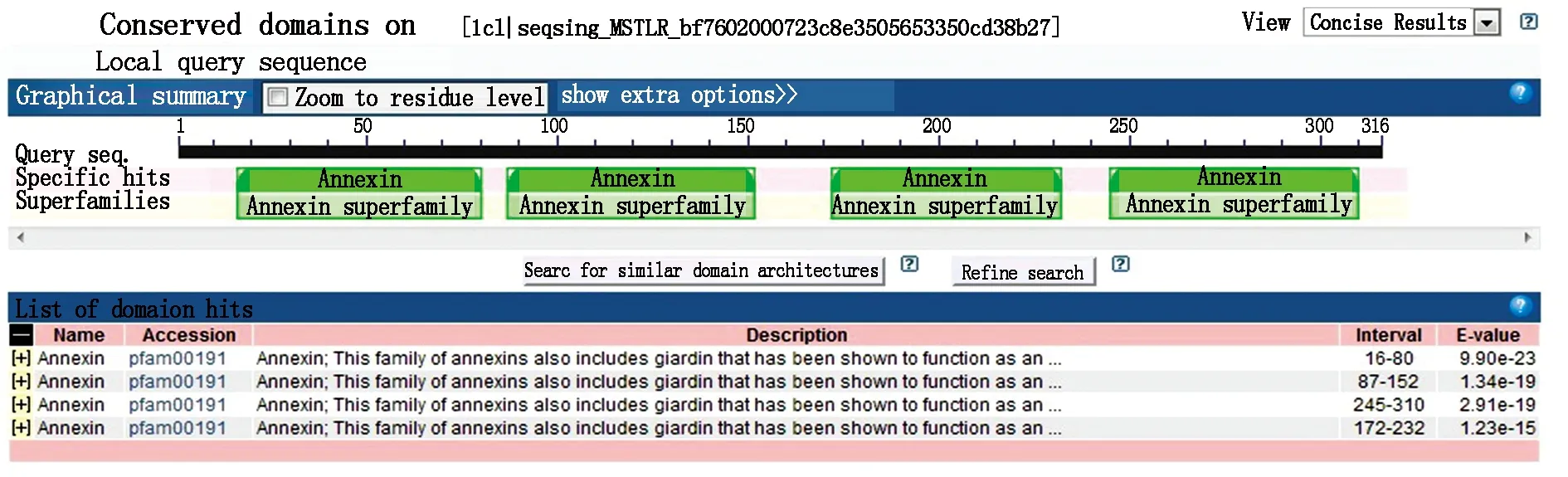
图4 膜联蛋白的保守结构域
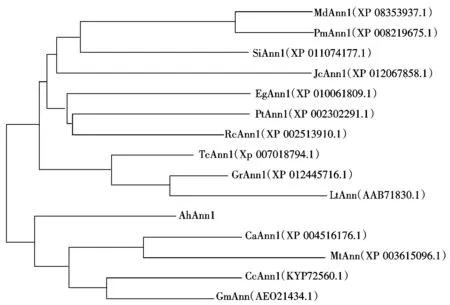
Md.苹果;Pm.梅花;Si.芝麻;Jc.桐油树; Eg.巨桉; Pt.毛果杨; Rc.蓖麻;Tc.可可树;Gr.雷蒙德氏棉;Lt.欧亚花魁;Ah.花生; Ca.鹰嘴豆;Mt.蒺藜苜蓿;Cc.木豆;Gm.大豆。
Md.Malusdomestica; Pm.Prunusmume; Si.Sesamumindicum; Jc.Jatrophacurcase; Eg.Eucalyptusgrandis; Pt.Populustrichocarpa; Rc.Ricinuscommunis;Tc.Theobromacacao;Gr.Gossypiumraimondii;Lt.Lavaterathuringiaca;Ah.Arachishypogaea;Ca.Cicerarietinum;Mt.Medicagotruncatula;Cc.Cajanuscajan;Gm.Glycinemax.
图5 不同物种Annexin蛋白的系统进化树分析
Fig.5 Phylogenetic analysis of Annexin proteins in different species
蛋白相距较远;与梅花(Prunusmume)、苹果(Malusdomestica)和芝麻(Sesamumindicum)中的Annexin1蛋白则相距更远。
2.4 花生中AhAnn1基因的表达分析
对不同组织中表达情况进行分析表明,根系中表达量最低,叶片中表达量是根系中表达量的近2倍,茎中表达量最高,分别是根系和叶片中的15.0,7.5倍(图6)。表1表明,随干旱胁迫程度的增加,根系中AhAnn1的表达量增加幅度高于叶片和茎中的表达量增加幅度。与对照相比,中度干旱胁迫45%FC时根系中表达量是对照的10倍,而重度干旱胁迫20%FC处理是中度干旱胁迫45%FC处理下的2.5倍,叶片中的表达与根系中的相似,随干旱胁迫程度的增加而增加,而在重度干旱胁迫20%FC下茎中的表达量低于中度干旱胁迫45%FC。
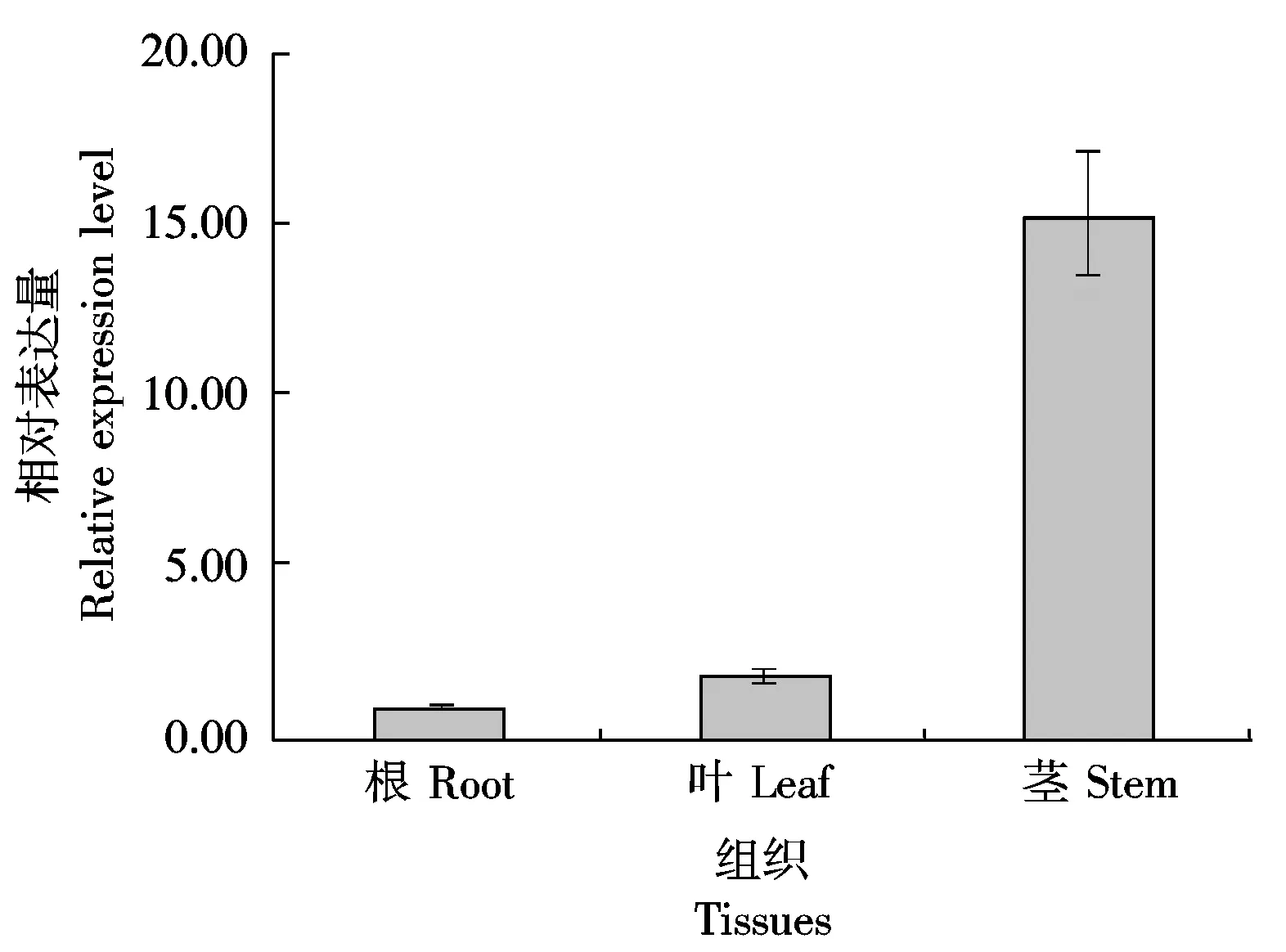
图6 AhAnn1基因在不同组织中的表达

组织Tissues对照Control中度干旱胁迫(45%FC)Moderatedroughtstress重度干旱胁迫(20%FC)Severedroughtstress根Root1.00±0.0610.14±0.9925.31±2.33叶Leaf1.00±0.045.25±0.3714.16±0.32茎Stem1.00±0.0712.22±0.2910.40±0.32
3 讨论与结论
植物膜联蛋白Annexin大小为32~34 kDa,其典型结构为4个重复单元,每一重复由大约70个氨基酸残基组成。动物膜联蛋白中至少有3个重复单元是高度保守的,而植物膜联蛋白只有第1个或第4个重复单元含有“K-G-X-G-T-(38个可变残基)-D/E”序列,该序列是典型的Ⅱ型Ca2+结合位点,为膜联蛋白的内联蛋白序列[19-22]。本研究从花生中克隆得到膜联蛋白AhAnn1基因,编码316个氨基酸。对蛋白序列进行分析表明,花生中Annexin蛋白在16-80,87-152,172-232,245-310这4个氨基酸区域具有典型的植物膜联蛋白结构域,第1个重复单元具有膜联蛋白的内联蛋白序列。利用NCBI的Protein Blast功能分析表明AhAnn1蛋白与大豆、苜蓿、鹰嘴豆等豆科植物膜联蛋白相似性高达80%以上,且通过进化树分析表明与以上豆科植物的膜联蛋白具有较近的亲缘关系。由此表明,本研究克隆得到的花生膜联蛋白AhAnn1基因属于植物Annexin基因家族的成员,与已有报道中的植物膜联蛋白Annexin基因在抵抗逆境胁迫中具有类似功能。
蛋白在细胞中的定位与其功能的发挥具有密切联系,多数研究表明植物膜联蛋白Annexin定位于细胞质中,但也有该类蛋白在质膜、内膜系统以及核膜定位的报道[20]。Peltier等[23]研究表明,拟南芥膜联蛋白AtAnn1定位于液泡膜和叶绿体上;豌豆和苜蓿的部分膜联蛋白被发现定位在核膜上[24-25]。通过蛋白质亚细胞定位工具预测花生中AhAnn1可能定位于细胞质中,下一步将通过基因枪轰击洋葱表皮观察GFP瞬时表达验证花生中AhAnn1的亚细胞定位情况。植物Annexin参与调节植物生长发育、参与细胞内信号转导以及应答逆境胁迫等重要的生理活动[26],通常表现为发育相关和组织特异性表达[27-28]。水稻体内膜联蛋白受低温胁迫诱导上调表达[11],拟南芥膜联蛋白表达和丰度受干旱胁迫的调节[9,13],ABA显著增加AtAnn1的表达量。油菜AnnBn1基因与干旱胁迫相关,在干旱胁迫下的表达水平随胁迫时间延长而升高[29]。本研究实时荧光定量PCR 结果显示,花生中AhAnn1基因在茎中表达量最高,这与前人的研究结果相一致[30]。根系和叶片中花生AhAnn1基因的表达量随干旱胁迫程度的增加而增加,而茎中的表达量在严重干旱胁迫下表达量低于中度干旱胁迫。下一步将利用实时荧光定量PCR技术研究不同逆境胁迫下基因表达分析,同时构建植物表达载体,研究AhAnn1过量和抑制表达时花生或拟南芥植株对逆境胁迫的响应。
本研究以花生为材料,克隆得到花生AhAnn1基因,该基因开放阅读框为951 bp,编码316个氨基酸。该基因编码的蛋白与大豆(Glycinemax)、苜蓿(Medicagotruncatula)、鹰嘴豆(Cicerarietinum)和木豆(Cajanuscajan)等双子叶植物中的膜联蛋白同源性达80%以上,具有4个Annexin保守结构域。AhAnn1基因在根系中的表达量最低,在茎中的表达量是根系中的15.0倍;根系和叶片中花生AhAnn1基因的表达量随干旱胁迫程度的增加而增加,而茎中的表达量在严重干旱胁迫下表达量低于中度干旱胁迫。由此表明,克隆得到的AhAnn1基因是一种干旱胁迫应答基因,在花生逆境调控中发挥作用。
[1] Moss S E,Morgan R O.The annexins[J].Genome Biology,2004,5(4):219-226.
[2] Clark G B,Morgan R O,Fernandez M P,et al.Evolutionary adaptation of plant annexins has diversified their molecular structures,interactions and functional roles[J].The New Phytologist,2012,196(3):695-712.
[3] 王 希, 李 勇, 朱延明, 等.野生大豆胁迫应答膜联蛋白基因的克隆及胁迫耐性分析[J].作物学报,2010,36(10):1666-1673.
[4] Jami S K,Clark G B,Ayele B T,et al.Genome-wide comparative analysis of annexin superfamily in plants[J].PLoS One,2012,7(11):e47801.
[5] Zhou M L,Yang X B,Zhang Q,et al.Induction of annexin by heavy metals and jasmonic acid inZeamays[J].Functional & Integrative Genomics,2013,13(2):241-251.
[6] 王雨晴, 张 帆, 李瑞梅, 等.木薯MeAnn1基因的克隆及表达分析[J].分子植物育种,2015,13(11):2477-2483.[7] 李殿波, 王晋芳, 石 锦, 等.黄瓜膜联蛋白基因CsANN2的克隆和表达分析[J].中国农业大学学报,2015,20(3):82-89.
[8] Jami S K,Clark G B,Ayele B T,et al.Identification and characterization of annexin gene family in rice[J].Plant Cell Reports,2012,31(5):813-825.
[9] Cantero A,Barthakur S,Bushart T J,et al.Expression profiling of theArabidopsisannexin gene family during germination,de-etiolation and abiotic stress[J].Plant Physiology and Biochemistry,2006,44(1):13-24.
[10] Kreps J A,Wu Y,Chang H S,et al.Transcriptome changes forArabidopsisin response to salt,osmotic,and cold stress[J].Plant Physiology,2002,130(4):2129-2141.
[11] Hashimoto M,Toorchi M,Matsushita K,et al.Proteome analysis of rice root plasma membrane and detection of cold stress responsive proteins[J].Protein and Peptide Letters,2009,16(6):685-697.
[12] Weber M,Trampczynska A,Clemens S.Comparative transcriptome analysis of toxic metal responses inArabidopsisthalianaand the Cd2+-hypertolerant facultative metallophyteArabidopsishalleri[J].Plant,Cell & Environment,2006,29(5):950-963.[13] Konopka-Postupolska D,Clark G,Goch G,et al.The role of annexin 1 in drought stress inArabidopsis[J].Plant Physiology,2009,150(3):1394-1410.
[14] Renaut J,Hausman J F,Wisniewski M E.Proteomics and low-temperature studies:bridging the gap between gene expression and metabolism[J].Physiologia Plantarum,2006,126(1):97-109.
[15] Jami S K,Clark G B,Turlapati S A,et al.Ectopic expression of an annexin fromBrassicajunceaconfers tolerance to abiotic and biotic stress treatments in transgenic tobacco[J].Plant Physiology and Biochemistry,2008,46(12):1019-1030.
[16] Hsiao T C.Plant responses to water stress[J].Annual Review of Plant Physiology,1973,24(1):519-570.
[17] 黎 裕.作物抗旱鉴定方法与指标[J].干旱地区农业研究,1993,11(1):91-99.
[18] 陈 娜, 潘丽娟, 迟晓元, 等.花生果糖-1,6-二磷酸醛缩酶基因AhFBA1的克隆与表达[J].作物学报,2014,40(5):934-941.
[19] Hofmann A,Delmer D P,Wlodawer A.The crystal structure of annexin Gh1 fromGossypiumhirsutumreveals an unusual S3 cluster-Implications for cellulose synthase complex formation and oxidative stress response[J].European Journal of Biochemistry,2002,270(12):2557-2564.
[20] Mortimer J C,Laohavisit A,Macpherson N,et al.Annexins:multifunctional components of growth and adaptation[J].Journal of Experimental Botany,2008,59(3):533-544.
[21] Creutz C E,Pazoles C J,Pollard H B.Identification and purification of an adrenal medullary protein (synexin) that causes calcium-dependent aggregation of isolated chromaffin granules[J].The Journal of Biological Chemistry,1978,253(8):2858-2866.
[22] 何美敬, 穆国俊, 侯名语, 等.植物膜联蛋白的结构及功能研究进展[J].西北植物学报,2013,33(12):2567-2574.
[23] Peltier J B,Cai Y,Sun Q,et al.The oligomeric stromal proteome ofArabidopsisthalianachloroplasts[J].Molecular & Cellular Proteomics,2006,5(1):114-133.
[24] Clark G B,Dauwalder M,Roux S J.Immunological and biochemical evidence for nuclear localization of annexin in peas[J].Plant Physiology and Biochemistry,1998,36(9):621-627.
[25] Niebel F D,Lescure N,Cullimore J V,et al.The medicago truncatulaMtAnn1 gene encoding an annexin is induced by nod factors and during the symbiotic interaction withRhizobiummeliloti[J].Molecular Plant-microbe Interactions:1998,11(6):504-513.
[26] Gerke V,Moss S E.Annexins:from structure to function[J].Physiological Reviews,2002,82(2):331-371.
[27] Jami S K,Dalal A,Divya K,et al.Molecular cloning and characterization of five annexin genes from Indian mustard (BrassicajunceaL.Czern and Coss) [J].Plant Physiology and Biochemistry,2009,47(11/12):977-990.
[28] Lu Y,Ouyang B,Zhang J,et al.Genomic organization,phylogenetic comparison and expression profiles of annexin gene family in tomato (Solanumlycopersicum) [J].Gene,2012,499(1):14-24.
[29] 肖庆生, 张学昆, 许本波, 等.甘蓝型油菜AnnBn1基因的克隆和表达分析[J].中国油料作物学报,2012,34(2):123-128.
[30] He M,Yang X,Cui S,et al.Molecular cloning and characterization ofannexingenes in peanut (ArachishypogaeaL.) [J].Gene,2015,568(1):40-49.
Cloning and Expression ofAhAnn1 Gene in Peanut
DING Hong,DAI Liangxiang,QIN Feifei,CI Dunwei,SONG Wenwu,ZHANG Zhimeng
(Shandong Peanut Research Institute,Qingdao 266100,China)
The aim of this study was to screenAnnexingenes related to stress resistance in peanut.AAnnexingene was cloned from the peanut (Huayu 25),namedAhAnn1 using RACE technology and RT-PCR.The peanut Annexin like gene was obtained from drought related suppression subtractive hybridization cDNA library in peanut root.The whole sequence ofAhAnn1 was 1 277 bp and its open reading frame was 951 bp,encoding a polypeptide of 316 amino acids,with a theoretical molecular weight of 36.10 kDa and an isoelectric point(pI) of 7.07.The protein was predicted to be located in cytoplasm,containing the conserved Annexin domain.Multiple sequence alignments and phylogenetic analysis of Annexin proteins indicated AhAnn1 was most similar with Annexin fromGlycinemax,MedicagotruncatulaandCicerarietinum.The results of Real-time RT-PCR showed that the expression ofAhAnn1 in roots and leaves increased with the increase of drought stress.This suggested thatAhAnn1 was a drought stress response gene,which played an important role in the regulation of peanut stress.This study provides a theoretical basis for further studying the peanutAhAnn1 gene function and elucidating the molecular mechanism of stress resistance in peanut.
Peanut;Annexin; Drought; Phylogenetic analysis; Real-time PCR
2017-02-27
山东省农业科学院青年英才培养计划项目;山东省优秀中青年科学家科研奖励基金项目(BS2012NY010);国家自然科学基金项目(31201171);山东省现代农业产业技术体系花生创新团队(SDAIT-04-06)
丁 红(1983-),女,江苏海安人,助理研究员,博士,主要从事花生逆境生理研究。
张智猛(1963-),男,河北衡水人,研究员,博士,主要从事花生栽培生理生态研究。
Q78;S565.03
A
1000-7091(2017)03-0021-06
10.7668/hbnxb.2017.03.004

