TSG-6对兔耳瘢痕形成过程中MMP-2、TIMP-2表达及瘢痕修复的影响
文科 虞冬梅 刘漪伦
TSG-6对兔耳瘢痕形成过程中MMP-2、TIMP-2表达及瘢痕修复的影响
文科1虞冬梅2刘漪伦3
目的 建立兔耳创面修复瘢痕模型,探讨在瘢痕形成过程中肿瘤坏死因子α刺激基因6(TSG-6)对基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶抑制剂-2(TIMP-2)表达和瘢痕修复的影响。方法 参照Morris方法,建立兔耳创面模型,设计实验组,注射TSG-6;对照组注射等量的无菌生理盐水。检测各组瘢痕指数及Ⅰ、Ⅲ型胶原的表达情况来评价瘢痕增生情况。同时检测MMP-2及TIMP-2基因的表达情况。结果 实验组的瘢痕指数及Ⅰ、Ⅲ型胶原含量低于对照组,MMP-2的表达较多,对应的TIMP-2表达降低,差异有统计学意义(P<0.05)。结论 TSG-6可以抑制瘢痕增生,可能是增多瘢痕组织中MMP-2表达来实现的。
瘢痕;肿瘤坏死因子α刺激基因6;基质金属蛋白酶-2;基质金属蛋白酶抑制剂-2
创面愈合过程机制复杂,创伤愈合后往往伴随着瘢痕的出现,瘢痕的出现给患者带来很大的精神和经济负担,同时,一些患者会出现瘙痒、疼痛、红肿等临床症状,给患者的生活和工作带来很大困扰。目前,瘢痕的确切机制尚不明确,治疗方法很多,但尚无标准的治疗指导原则,仍需要进行更加深入地研究。
肿瘤坏死因子α刺激因子6(tumor necrosis factor α-inducible protein 6,TSG-6)是由肿瘤坏死因子α诱导的抑制过度炎症反应的基因[1]。相关研究证实,其与炎症反应密切相关,可抑制炎性细胞迁移和粘附。炎症在创面愈合及瘢痕形成过程中具有重要的作用,早期炎症反应较强,可释放肿瘤坏死因子α、白细胞介素-6等炎性因子,诱导TSG-6产生,抑制炎症反应,减弱瘢痕的形成。1997年,DE Morris等成功建立了兔耳瘢痕模型[2],瘢痕可持续数月不退,为体内瘢痕研究实验提供了可能,此方法在国内外普遍开展。自2015年12月至2016年4月,成都医学院第一附属医院整形科采用Morris兔耳瘢痕模型,在瘢痕形成过程中进行人为药物干预,最后检测瘢痕厚度与面积,以及检测瘢痕组织块基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、基质金属蛋白酶抑制剂-2(metallopeptidase inhibitor,TIMP-2)基因的表达情况。
1 实验动物
新西兰雄性大白兔30只(购自成都医学院实验中心),月龄3个月,体质量为2.0~2.5 kg。
2 实验方法
2.1 兔耳瘢痕模型建立 30只新西兰雄性大白兔于标准条件下适应饲养7 d后,制作兔耳创面。用脱毛剂去除兔耳背部的兔毛。将3%戊巴比妥钠(30 mg/kg)行耳缘静脉注射麻醉,麻醉成功后彻底消毒。参照Morris方法于兔耳的腹侧用直径0.6 cm的活检穿孔器进行打孔,解剖纤维镜下,剥除皮下组织及软骨膜,形成直径为0.6 cm的圆形创面,左右耳各2个创面,按压止血,再次消毒并包扎,所有切口均选在耳后腹侧,深达全层,即至软骨膜层,避免毛发周期对创面愈合及瘢痕形成的影响。
2.2 分组处理 术后第4天,将30只大白兔随机分为对照组和实验组,每组15只(创面总数60个),实验组沿创面周边十字交叉选择4个点,分别注射0.5 ml的TSG-6(1μg),对照组注射等体积的生理盐水,连续注射14 d。本实验操作严格遵守《实验动物保护条例》。
2.3 观察记录并检测 术后28 d,切取兔耳瘢痕组织,测量瘢痕面积,并进行HE染色,计算瘢痕指数。PCR检测MMP-2及TIMP-2的表达。
2.4 统计学处理 采用SPSS 18.0软件对数据进行统计学分析,数据以±s表示。两组比较采用t检验。P<0.05为差异具有统计学意义。
3 结果
3.1 大体观察 创面在3 d左右已基本干燥结痂;13 d左右完全愈合。对照组在23 d左右瘢痕凸出皮肤,呈淡红色,术后28 d左右形成增生性瘢痕。实验组15只大白兔,2只感染,创面形成52个瘢痕,瘢痕高于体表,且有挛缩现象。对照组感染3只,创面形成有效瘢痕48个。实验组的瘢痕颜色较对照组淡,质地较对照组软。
3.2 兔耳瘢痕面积及瘢痕指数 对形成的瘢痕组织做HE染色,计算瘢痕指数[3](图1),其中实验组的瘢痕指数为2.03±0.45,对照组的瘢痕指数为1.98±0.70,两组比较,差异具有统计学意义(n=100, t=2.898,P=0.011)。实验组的瘢痕面积为21.83± 1.99,对照组瘢痕面积为25.5±1.33(n=100,t=6.866, P=0.001)。
3.3 基因检测 取术后28 d的瘢痕组织,PCR检测MMP-2、TIMP-2、COL1A1、COL1A3,结果表明,实验组MMP-2基因表达明显低于对照组,而实验组TIMP-2基因表达高于对照组,P<0.05为差异具有统计学意义(图2)。
4 讨论
随着我国工业、交通、能源等领域的发展,严重创伤毁形已成为一新的多发病。相关数据显示,我国每年仅车祸和烧伤已达100万余例,而增生性瘢痕作为外伤、烧伤及手术后的最常见的继发疾病,在创伤、手术后的发生率可达40%以上,烧伤后更可达91%[4]。瘢痕的过度增生或挛缩,往往导致丑陋外观并可严重损害肢体关节活动以及口鼻眼等体表器官的生理功能,对患者造成巨大的身心伤害。如何调控创伤后组织愈合过程,有效避免病理性愈合及瘢痕过度增殖,是烧创伤毁形治疗中的一个亟待解决的热点问题。
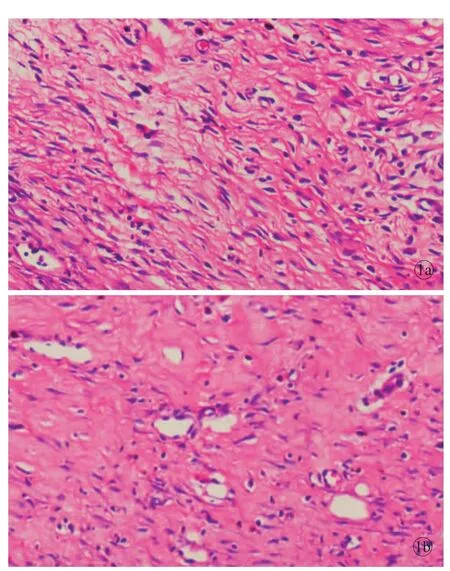
图1 实验组与对照组瘢痕组织HE染色(对照组胶原排列紊乱,出现旋涡状结节及胶原结节,×20) a.实验组b.对照组

图2 实验组与对照组相关基因表达对比分析
瘢痕产生原理是皮肤损伤后真皮成纤维细胞过度增生、纤维蛋白分泌积聚导致的,目前,瘢痕的治疗方法很多,如瘢痕内注射类固醇激素、激光治疗[5]、脂肪移植,外科手术切除等。
TSG-6无论是在细胞层面还是动物模型中均被证实其具有一定的抗炎作用,相关研究已经证实TSG-6能抑制白细胞介素6、白细胞介素1β和嗜中性粒细胞浸润迁移,保护角膜,避免物理化学损伤,同时可以抑制新毛细血管的生成[6]。在新西兰大白兔关节炎模型中,证实其可以减少炎症反应及水肿,保护关节[7]。由于炎症在瘢痕形成过程中具有重要的作用[8-10],前人在小鼠皮肤全层损伤模型中证实其具有抗纤维化作用[11]。相关文献证实,间质细胞分泌的TSG-6可以通过抑制巨噬细胞的的炎性信号表达及一些相关因子的分泌已达到抑制纤维化的作用[12]。应用TSG-6治疗瘢痕是个新的治疗方法。MMPs家族及其抑制剂在创面愈合部位的细胞外基质合成和降解具有机密的调控作用,外源性的MMP-2可以抑制成纤维细胞分化及炎症反应,减少胶原合成。TMMP-2则可促进胶原合成,促进愈合后瘢痕增生。其中MMP-2可以减少I型胶原纤维合成,抑制瘢痕增生提高创面愈合质量,TIMP-2抑制MMP-2的活性,促进一些纤维化基因的表达和纤维蛋白的分泌。
本实验制作的兔耳瘢痕模型[13],经过TSG-6注射后的实验组瘢痕形成厚度变小,MMP-2基因检测表达增多,而对应的对照组却无此改变,证实其具有促进MMP-2表达作用,同时检测出实验组的TIMP-2表达减少,MMP-2对于TIMP-2具有一定的调控作用,TIMP-2表达抑制具体机制则需要进一步详细地研究。未来治疗瘢痕也可以通过应用一些技术如创伤早期使用rsTSG-6蛋白达到早期预防治疗瘢痕的目的。
[1] 张苏文,李小静,陈钊,等.TSG-6对人病理性瘢痕成纤维细胞增殖与凋亡的影响[J].安徽医科大学学报,2016,51(1):102-105.
[2] 窦孝康,程代薇.雌三醇及拮抗剂三苯氧胺对兔耳瘢痕增生的影响[J].中国生化药物杂志,2014,(5):30-32,36.
[3] 洪艳玲.盐酸法舒地尔作用于增生性瘢痕的实验研究[J].检验医学与临床,2015,(z2):15-17.
[4] Gauglitz GG,Korting HC,Pavicic T,et al.Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies[J].Mol Med,2011,17(1-2):113-125.
[5] 向英,匡永琴,邹静,等.非剥脱性Lux1540nm点阵激光在浅表瘢痕治疗中的护理[J].激光杂志,2013,34(3):68-69.
[6] Le Blanc K,Mougiakakos D.Multipotent mesenchymal stromal cells and the innate immune system[J].Nat Rev Immunol,2012,12(5): 383-396.
[7] Oh JY,RoddyGW,Choi H,et al.Anti-inflammatory protein TSG-6 reduces inflammatory damage to the cornea following chemical and mechanical injury[J].Proc Natl Acad.Sci USA,2010,107(39): 16875-16880.
[8] Viera MH,Amini S,Valins W,et al.nnovative therapies in the treatment of keloids and hypertrophic scars[J].J Clin Aesthet Dermatol,2010,3(5):20-26.
[9] Choi H,Lee RH,Bazhanov N.Anti-inflammatory protein TSG-6 secreted by activated MSCs attenuates zymosan-induced mouse peritonitis by decreasing TLR2/NF-kappaB signaling in resident macrophages[J].Blood,2011,118(2):330-338.
[10] 李泰然,孟庆延,李万同,等.自体刃厚头皮联合负压封闭引流技术回植中厚供皮区的临床应用[J].中国临床实用医学, 2015,6(1):4-6.
[11] Su WH,ChengMH,Lee WL,et al.Nonsteroidal anti-inflammatory drugs for wounds:pain relief or excessive scar formation?[J].Mediators Inflamm,2010,2010:413238.
[12] Qi Y,Jiang D,Sindrilaru A,et al.TSG-6 released from intradermally injected mesenchymal stem cells accelerates wound healing and reduces tissue fibrosis in murine full-thickness skin wounds [J].J Invest Dermatol,2014,134(2):526-537.
[13] Liu S,Jiang L,Li H,Shi H,et al.Mesenchymal stem cells prevent hypertrophic scars formation via inflammatory regulation when undergoingapoptosis[J].JInvestDermatol,2014,134(10):2648-2657.
Effect of TSG-6 on MMP-2 and TIMP-2 expression and scar repairing in cicatrization
WEN Ke,YU Dong-mei,LIU Yi-lun.(Department of Plastic and Reconstructive Surgery,the First Affiliated Hospital of Chengdu University,Chengdu 610000,China)
ObjectiveTo investigate the influence of TSG-6 on MMP-2 and TIMP-2 expression and scar repairing in cicatrization in the model of rabbit ear scar.MethodsA rabbit ear scar model was established according to the Morris method.The left ear was selected as the experimental group and injected with TSG-6,and the right ear,as the control group,was injected with the same dose of sterile normal saline.The condition of scar hyperplasia was evaluated by scar index andⅠandⅢcollagen expression.The expression of MMP-2 and TIMP-2 gene was also tested.ResultsThe scar index andⅠandⅢcollagen content in the experimental group were less than that in the control group.MMP-2 expressed relatively higher and TIMP-2 expressed lower.The difference was statistically significant (P<0.05).ConclusionScar hyperplasia can be inhibited by TSG-6.The mechanism increased MMP-2 expression in cicatricial tissue.
Scar;TSF-6;Matrixmetalloproteinase-2;Matrix metallo-proteinase inhibitor
2016-11-23)
10.3969/j.issn.1673-7040.2017.03.014.
10.3969/j.issn.1673-7040.2017.03.014
四川省教育厅科研项目(16ZB0287)
成都医学院第一附属医院(1.烧伤整形科,3.中心实验室)四川 成都 610000;2.四川省平安医院 整形外科,四川 成都610000
本文引用格式:文科,虞冬梅,刘漪伦.TSG-6对兔耳瘢痕形成过程中MMP-2、TIMP-2表达及瘢痕修复的影响[J].中国美容整形外科杂志,2017,28(3):170-172.
参考文献中英文作者名的著录方法
在医学期刊的论文中,引用英文文献的比例很高,但有不少作者将英、美人的姓名搞错,以至检索核对时出现错姓、错名或姓名全错。英、美人姓名的习惯写法是:名-名-姓,“名”可以有1个、2个或3个,但“姓”只有1个。因此,从书籍或期刊中的姓名转录到文献时,要将次序调整为姓-名-名。“姓”是不可以简写的;“名”可以缩写,用第一个字母大写,不用缩写点。数据库在著录作者姓名时,已经调整为“姓-名-名”,可照录。

