分子印迹磁固相萃取/气相色谱法分析环境水样中5种酰胺类除草剂残留
孙日晗,王 涛,王 晓,,纪文华*
(1.山东农业大学 食品科学与工程学院,山东 泰安 271000;2.山东省科学院,山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南 250014)
分子印迹磁固相萃取/气相色谱法分析环境水样中5种酰胺类除草剂残留
孙日晗1,王 涛2,王 晓1,2,纪文华2*
(1.山东农业大学 食品科学与工程学院,山东 泰安 271000;2.山东省科学院,山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南 250014)
以丁草胺为假模板分子,丙烯酰胺为功能单体,利用四氧化三铁磁性纳米微球成功制备了具有特异性识别能力的磁性分子印迹聚合物。采用透射电子显微镜、红外光谱和振动样品磁强计对印迹聚合物进行表征,结果显示,分子印迹聚合物成功包裹在四氧化三铁表面。印迹聚合物对5种酰胺类除草剂均有特异性识别作用。以磁性分子印迹聚合物为基础,建立了酰胺类除草剂的气相色谱检测方法。方法学验证表明该方法具有良好的回收率(85.0%~99.5%)和精密度(RSD为2.8%~5.0%,n=5),线性范围为0.1~500 μg·L-1,检出限为0.02~0.05 μg·L-1。该方法能够应用于农田灌溉用水等环境水样的测定。
酰胺类除草剂;磁性分子印迹聚合物;磁固相萃取;吸附性能;气相色谱
酰胺类除草剂是目前生产中应用较为广泛的一类芽前除草剂,其除草效果较好,但具有较高的残留毒性,美国环境保护局已将乙草胺定为B-2类致癌物[1]。由于酰胺类除草剂的水溶性较高且易于淋溶,而土壤吸附常数又相对较低,所以施到农田的酰胺类除草剂易通过渗透转移到浅层地下水或随雨水径流进入地表水。欧盟规定环境水和饮用水中单个除草剂的最大残留量不超过0.1 μg·L-1,总除草剂的最大残留量不超过0.5 μg·L-1[2],因此对酰胺类除草剂的分析检测极为重要。目前酰胺类除草剂的检测方法主要有色谱法[3- 4]、色谱-质谱联用法[5-9]、酶联免疫吸附分析法[10],但这些方法的前处理主要采用传统的固相萃取或液液萃取,特异性差,易导致大量基质共萃取而影响目标分析物的测定。因此建立一种快速、高效的酰胺类除草剂分析方法具有重要意义。
磁性分子印迹固相萃取是近年快速发展起来的样品前处理技术,广泛应用于食品检测[11]、生物分离[12]、环境检测[13]等领域。磁性分子印迹聚合物(MMIPs)是融合磁性粒子特性与分子印迹技术的一种新型分离材料,它同时具有磁性粒子的磁响应性和分子印迹聚合物(MIPs)对目标分子的特定识别力与亲和力[14-18]。利用磁性粒子的特性,在外加磁场作用下可使聚合物达到快速富集,相比于传统固相萃取技术,该方法省去了复杂的离心过程,提高了聚合物的可控性。因此,将磁性分子印迹聚合物应用于固相萃取已得到学术界的广泛关注[19-21]。
本课题组在前期研究中,采用新的合成方法在四氧化三铁表面直接包裹功能单体和交联剂,成功制备了环烯醚萜苷磁性分子印迹聚合物[22]。本文利用该方法合成了酰胺类除草剂分子印迹聚合物,并将其作为磁性固相萃取材料应用于水质中酰胺类除草剂的检测,进而建立了一种基于磁性分子印迹固相萃取(MMISPE)的气相色谱(GC)快速检测方法。该方法目标化合物的回收率较高,重现性良好。
1 实验部分
1.1 仪器与试剂
布鲁克VERTEX 70红外光谱仪(美国,比勒利卡),SQUID VSM 磁强计(美国量子设计公司),JEM-2010F 透射电子显微镜(日本电子株式会社),FeCl3·6H2O(科密欧试剂公司),柠檬酸钠(克拉玛尔试剂公司),乙酸钠(国药集团化学试剂有限公司),5种酰胺类除草剂(乙草胺、丁草胺、丙草胺、异丙草胺、异丙甲草胺)标准溶液、敌稗、乙二醇、N,N′-亚甲基双丙烯酰胺(MBA)、丙烯酰胺(AM)和甲基偶氮二异丁腈(AIBN)均购自阿拉丁试剂公司。甲醇和乙腈为色谱纯,其余试剂为分析纯,实验用水为去离子二次蒸馏水。
1.2 四氧化三铁的制备
采用溶剂热法合成磁性纳米粒子,具体步骤如下:将3.6 g FeCl3·6H2O和0.72 g柠檬酸钠溶解在乙二醇-乙醇(9∶1,体积比)溶剂中,超声脱气,再加入4.8 g乙酸钠,搅拌5 min。将混合液转入容量为200 mL的水热合成反应釜中,在200 ℃下反应10 h,得到黑色反应产物,再用乙醇和水将反应产物分别洗3次。最后真空干燥12 h,得到Fe3O4磁性纳米粒子。
1.3 MMIPs的制备
在100 mL三颈瓶中加入0.05 g Fe3O4粒子和40 mL乙腈,超声脱气后,加入假模板分子丁草胺0.06 g,MBA 0.48 g,AM 0.24 g,AIBN 0.004 g。机械搅拌下回流4 h,聚合反应完成后在外加磁场的作用下分离得到反应产物。将反应产物放入索氏提取器中,用甲醇-乙酸(9 ∶1,体积比)为洗脱剂洗脱24 h以除去模板分子,再用甲醇洗脱除去乙酸,真空干燥24 h即可。空白磁性印迹聚合物(MNIPs)的合成无需添加假模板分子丁草胺,其余方法同上。
1.4 透射电镜分析
为了研究磁性分子印迹聚合物的结构特征,对 MMIPs 和 MNIPs 进行透射电镜分析,放大倍数为20 000倍。
1.5 等温吸附实验
在10 mL离心管中分别加入10 mg MMIPs和MNIPs,再加入5 mL不同浓度的丁草胺标准溶液(1~60 mg·L-1),室温振荡2 h后,加磁铁分离聚合物,用GC检测上清液中丁草胺的含量。采用下式计算吸附量:Qe=(Ci-Ce)V/m,式中,Qe为吸附平衡时MMIPs吸附酰胺类除草剂的量(mg·g-1);Ci(mg·L-1)和Ce(mg·L-1)分别为吸附前和吸附平衡后溶液中丁草胺的浓度;V(mL)为吸附液体积;m(mg)为聚合物的质量。
1.6 吸附动力学实验
将10 mg MMIPs加入5 mL 20 mg·L-1的丁草胺标准溶液中,室温下振荡100 min,在外加磁场作用下分离聚合物,采用GC检测上清液中丁草胺的含量,以考察MMIPs对酰胺类除草剂的吸附速率。
1.7 选择性实验
将10 mg MMIPs和MNIPs分别置于5 mL 20 mg·L-1的乙草胺、丙草胺、异丙草胺、异丙甲草胺、丁草胺标准溶液和敌稗标准溶液中,室温振荡2 h后,磁铁分离,取上清液用GC检测其中的乙草胺、丙草胺、异丙草胺、异丙甲草胺、丁草胺和敌稗含量。
1.8 GC色谱条件
色谱柱:DB-5 MS石英毛细管柱(30 m×0.32 mm×0.25 μm);进样口温度:230 ℃;检测器温度:280 ℃;柱温:初始温度:70 ℃,保持1 min,以15 ℃/min 升至200 ℃,保持1 min,再以5 ℃/min升至270 ℃,保持12 min;载气:高纯N2,流速:3 mL/min,尾吹气:30 mL/min;分流比为1∶10,进样量为1 μL。
2 结果与讨论

表1 假模板分子、功能单体以及交联剂的配比对平衡吸附量(Qe)及印迹因子(α)的影响
2.1 磁性分子印迹聚合物的制备与性能表征2.1.1 磁性聚合物制备条件的优化 采用沉淀聚合法在Fe3O4表面直接包裹分子印迹聚合物,以MBA为交联剂,AM为功能单体,AIBN为引发剂,丁草胺为假模板分子。其中,假模板分子、功能单体、交联剂之间的配比直接影响聚合物的印迹效率,所以在制备过程中有必要对三者的配比进行优化(表1)。由表1可知,当三者的质量比为1∶4∶8时,平衡吸附量(Qe)和印迹因子α(α=Qe MMIPs/Qe MNIPs)的值最高。因此选择在该比例下合成MMIPs和MNIPs。
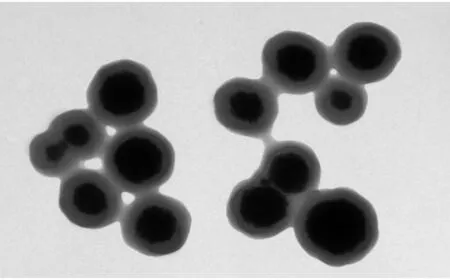
图1 MMIPs 的透射电镜图Fig.1 TEM image of MMIPs

图2 Fe3O4与MMIPs的饱和磁滞回线Fig.2 Magnetization curves of Fe3O4 and MMIPs
2.1.2 透射电镜分析 用透射电镜对MMIPs的形貌和粒径进行了考察。由图1可看出MMIPs的分散性良好,粒径约为720 nm,可以明显看到分子印迹层,此种核壳式结构有利于传质效率的提高。

2.1.4 磁饱和强度分析 由图2可看出 Fe3O4和 MMIPs的磁饱和强度分别为80.1 emu·g-1和36.2 emu·g-1,说明Fe3O4和MMIPs均具有良好的磁力度。因此,MMIPs可以用于快速磁分离。
2.2 选择性实验
利用酰胺类除草剂的结构类似物敌稗来评价MMIPs的特异性吸附性能。结果显示,MMIPs对乙草胺、丙草胺、异丙草胺、异丙甲草胺、丁草胺均具有较高的吸附量,且与MNIPs对酰胺类除草剂的吸附量差值较大(为1.6~2.1 mg·g-1),而MMIPs和MNIPs对敌稗的吸附量差值较小(为0.5 mg·g-1),由此说明MMIPs中存在酰胺类除草剂的特异性识别位点。
2.3 平衡吸附实验
利用等温吸附实验测定MMIPs和MNIPs对丁草胺的吸附量,如图3A所示,MMIPs和MNIPs的吸附量均随着丁草胺浓度的增加而增加,但MMIPs对目标分析物的吸附量远高于MNIPs的吸附量。由此说明MMIPs中存在特异性更强的结合位点。
2.4 吸附动力学实验
图3B为MMIPs和MNIPs对20 mg·L-1丁草胺的动态吸附曲线。由图可以看出,MMIPs对丁草胺有较高的传质速率,在开始的15 min内即可达最高吸附容量。

2.5 磁固相萃取(MMISPE)条件的优化
2.5.1 吸附剂的用量 考察了不同用量(20~100 mg)的吸附剂MMIPs对5种酰胺类除草剂的吸附效果。结果表明,当吸附剂的用量为60 mg时,目标分析物的回收率最高。因此选择60 mg为吸附剂的最佳用量。
2.5.2 样品体积的优化 样品体积是评价吸附剂吸附低浓度目标分析物的重要影响因素,分别对50~200 mL浓度为20 μg·L-1的5种酰胺类除草剂溶液进行吸附,发现目标物的回收率随样品体积在50~100 mL范围内增加而呈上升趋势。因此,实验选择100 mL为最佳样品体积。
2.5.3 洗脱液及用量的优化 加入洗脱液的目的是将目标分析物从吸附剂中洗脱。本实验分别采用甲醇、甲醇-醋酸(98∶2,体积比)、甲醇-醋酸(96∶4 ,体积比)和甲醇-醋酸(94∶6,体积比)为洗脱液进行洗脱,洗脱液用量为1~10 mL。结果显示,采用4 mL甲醇-醋酸(96∶4)溶液洗脱时,目标分析物的回收率最高。因此,选用4 mL甲醇-醋酸(96∶4)为洗脱溶液。
2.5.4 洗脱时间的优化 考察了不同洗脱时间(3,10,15,20 min)的洗脱效果。结果表明,15 min足以完全洗脱目标分析物。因此,实验选择洗脱时间为15 min。
2.6 方法学验证
将5种酰胺类除草剂标准溶液逐步稀释,得浓度为0.01,0.05,0.1,0.2,0.5,1,5,10,100,200,500 μg·L-1的标准溶液,进样测定,结果发现5种酰胺类除草剂在0.1~500 μg·L-1的浓度范围内线性关系良好,相关系数(r2)均不小于0.998 3(表2)。以3倍信噪比(S/N=3)时的浓度为检出限(LOD),得5种酰胺类除草剂的LOD为0.02~0.05 μg·L-1;S/N=10时的浓度为定量下限(LOQ),得到5种酰胺类除草剂的LOQ为0.06~0.17 μg·L-1(表2)。
将3种不同浓度水平(1.0,10,20 μg·L-1)的酰胺类除草剂标准溶液添加到不含酰胺类除草剂的地表水、地下水和河水中,分别进行加标回收率实验,结果见表3。采用MMISPE净化得的回收率为85.0%~99.5%,相对标准偏差(RSD)为2.8%~5.0%。

表2 5种除草剂的线性关系、LODs、 LOQs及不同添加水平下样品的回收率
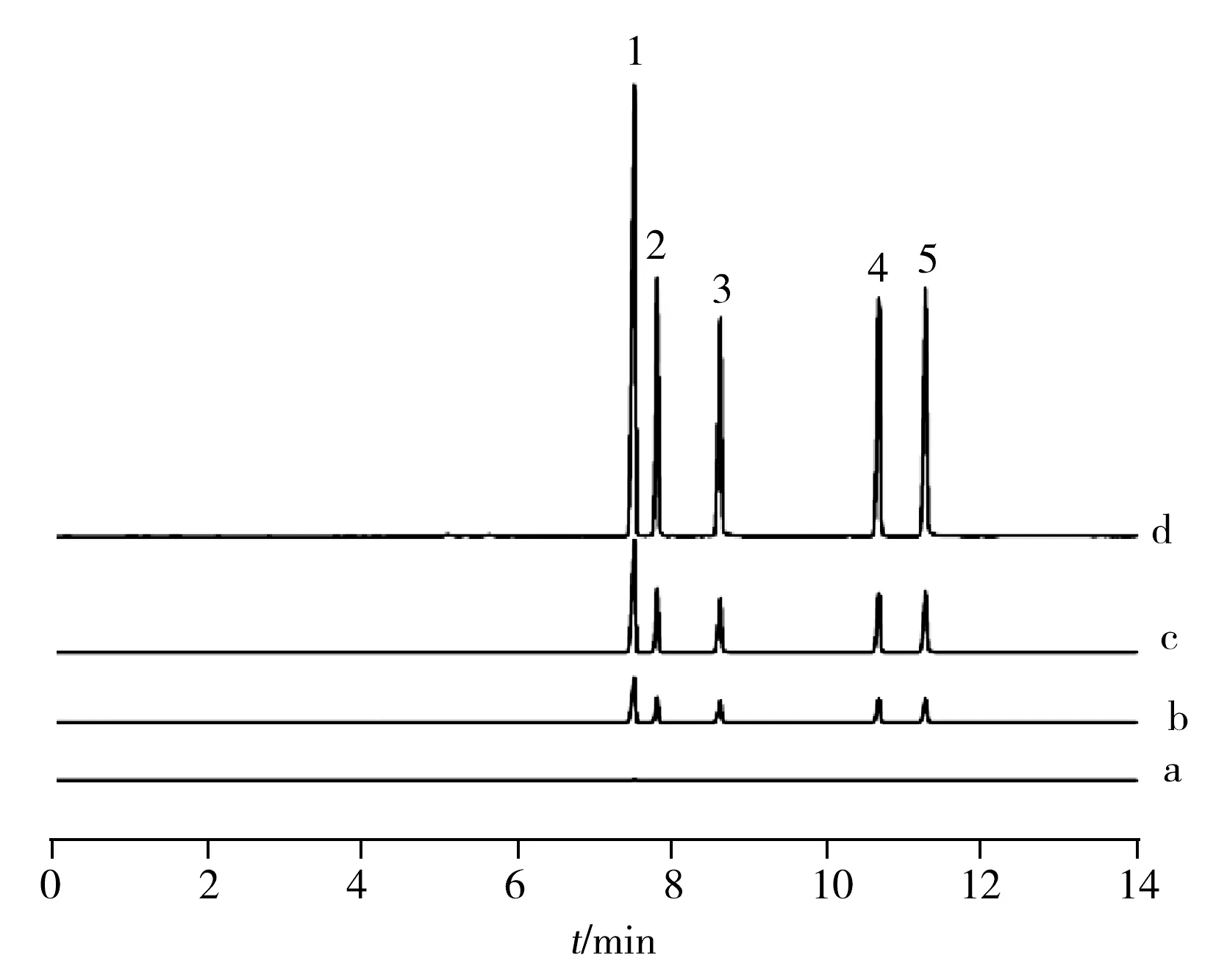
图4 地下水(a)、地下水加标后(b~d)的磁固相萃取/气相色谱图谱Fig.4 MMIP/GC chromatograms of agriculture irrigating water(a) and spiked agriculture irrigating water (b-d) spiked concentrration(b-d):1.0,10,20 μg·L-1;peaks:1.acetochlor;2.metolachlor;3.propisochlor;4.pretilachlor;5.butachlor
2.7 实际样品的应用
以MMIPs为吸附剂,采用优化后的磁固相萃取方法对农田灌溉水中的目标分析物进行选择富集,将60 mg MMIPs置于100 mL样品中吸附15 min,采用4 mL甲醇-醋酸(96∶4)进行洗脱。图4为原始样品以及在不同加标水平(1.0,10,20 μg·L-1)下经MMIPs萃取后的样品气相色谱图。分析结果显示,地下水(农田灌溉用水)经MMIPs萃取,酰胺除草剂不能被检出。而经MMIPs萃取后不同加标水平下的样品,目标分析物的色谱峰明显,可定性定量分析。综上所述,MMIPs可以用于环境水样中酰胺类除草剂的富集和分离测定。
3 结 论
本文以丁草胺为假模板分子,AM为功能单体,MBA为交联剂,采用表面聚合法成功制备了磁性分子印迹聚合物。通过红外光谱、透射电镜与磁饱和强度分析,发现该磁性印迹聚合物微球大小均匀,分散性较好,能够在外加磁场作用下实现快速分离。将该磁性分子印迹聚合物结合气相色谱用于水质中酰胺类除草剂的检测,效果理想。
[1] Chang Q Y,Zhou X,Gao S T,Zang X H,Wang C,Wang Z.Chin.J.Anal.Chem.(常青云,周欣,高书涛,臧晓欢,王春,王志.分析化学),2012,40(4):523-528.
[2] Konda L N,Pásztor Z.J.Agric.FoodChem.,2001,49(8):3859-3863.
[3] Hu X G,Dai G M,Huang J J,Ye T T,Fan H J,Youwen T,Yu Y,Liang Y.J.Chromatogr.A,2010,1217 (38):5875-5882.
[4] Li J Z,Chu X G,Cai H X,An J,Yang Q.Chin.J.Chromatogr.(李建中,储晓刚,蔡会霞,安娟,杨强.色谱),2006,24(6):585-588.
[5] Yang M,Ma Y A,Lin Z S,Yao Z W.J.Instrum.Anal.(杨梅,马永安,林忠胜,姚子伟.分析测试学报),2008,27(1):38-41.
[6] Lin Z,Chen J,Li J,Hui M X,Lan J C,Jang J B,Yang F.Chin.Agric.Sci.Bull.(林真,陈健,李捷,惠美星,蓝锦昌,江锦彬,杨方.中国农学通报),2015,31(11):162-165.
[7] Yokley R A,Mayer L C,Huang S B,Vargo J D.Anal.Chem.,2002,74 (15):3754-3759.
[8] Xie L Q,Lan F,Lin L,Zhao Q H,Jin B H,Wu W D,Cai Y N.J.Instrum.Anal.(谢丽琪,蓝芳,林黎,赵琼晖,靳保辉,吴卫东,蔡伊娜.分析测试学报),2007,26(3):365-367.
[9] Tan W,Hu X X,Yang M,Barrow C J,Yang W,Wang H B.Desalin.WaterTreat.,2014,52(4/6):1177-1182.
[10] Hegedus G,Krikunova V,Belai I,Eremin S,Székács A.Int.J.Environ.Anal.Chem.,2002,82(11/12):879-891.[11] Chen J,Lin Y X,Jia L.J.Chromatogr.A,2015,1388:43-51.
[12] Tan C J,Chua H G,Ker K H,Ker K H,Tong Y W.Anal.Chem.,2008,80(3):683-692.
[13] Ji Y S,Yin J J,Xu Z G,Zhao C M,Huang H Y,Zhang H X,Wang C M.Anal.Bioanal.Chem.,2009,395(4):1125-1133.
[14] Wang X X,Yang J,Xie S Y,Chen Y,Liu F L,Shen H Y,Xia Q H.J.Instrum.Anal.(王新鑫,杨军,谢晟瑜,陈扬,刘芳伶,沈昊宇,夏清华.分析测试学报),2015,34(11):1213-1219.
[15] Ma J,Huang J,Zeng Y B,Zhang Z L,Zhang J,Chen Z D,Li L.J.Instrum.Anal.(马洁,黄静,曾延波,张祖磊,张剑,陈智栋,李蕾.分析测试学报),2013,32(6):726-731.
[16] Huang C N,Duan X J,Ma H P,Yu Y H,Chen L G.J.Instrum.Anal.(黄超囡,段西健,麻海鹏,于嫣涵,陈立钢.分析测试学报),2013,32(3):275-280.
[17] Liu K F,Chen J,Chen N,Hu M,Gong W J,Zhang Y P.J.Instrum.Anal.(刘坤峰,陈军,陈娜,胡梅,龚文君,张裕平.分析测试学报),2014,33(8):859-865.
[18] Ye L.Anal.Bioanal.Chem.,2016,408(7):1727-1733.
[19] Chen L X,Wang X Y,Lu W H,Wu X Q,Li J H.Chem.Soc.Rev.,2016,45:2137-2211.
[20] Safdarian M,Ramezani Z,Ghadiri A A.J.Chromatogr.A,2016,1455:28-36.
[21] Yang R,Liu Y X,Yan X Y,Liu S M.Talanta,2016,161:114-121.
[22] Ji W H,Zhang M M,Liu W,Wang X M,Duan W J,Xie H K,Wang X.RSCAdv.,2016,6:50487-50496.
Analysis of Five Chloroacetamide Herbicides by HPLC with Magnetic Molecularly Imprinted Solid-phase Extraction
SUN Ri-han1,WANG Tao2,WANG Xiao1,2,JI Wen-hua2*
(1.College of Food Science and Engineering,Shandong Agricultural University,Taian 271000,China;2.Shandong Key Laboratory of Quality Control of Chinese Medicine,Shandong Analysis and Test Center,Shandong Academy of Science,Jinan 250014,China)
Magnetic molecularly imprinted polymers(MMIPs) with specific recognition ability were successfully synthesized by using butachlor as template molecule and acrylamide(AM) as functional monomer.MMIPs were characterized by transmission electron microscopy(TEM),infrared spectroscopy(FT-IR) and vibrating sample magnetometry(VSM).The results showed that molecularly imprinted layer was successfully wrapped on the surface of Fe3O4.MMIPs showed a specific recognition for five chloroacetamide herbicides.The developed magnetic molecular imprinted solid phase extraction coupled with gas chromatography(MMISPE/GC) method exhibited a good recovery(85.0%-99.5%),a good precision(RSD:2.8%-5.0%,n=5),a good linearity(0.1-500 μg·L-1) and a low limit of detection(0.02-0.05 μg·L-1) under the optimized conditions.The introduced MMISPE/GC method was successfully used to analyze five chloroacetamide herbicides in environmental water samples.
chloroacetamide herbicides;magnetic molecularly imprinted polymers;magnetic solid phase extraction;adsorption performance;gas chromatography
2017-01-22;
2017-02-26
国家自然科学基金(81603286);山东省重点研发计划(2016GSF202033);山东省科学院先导科技专项;山东省泰山学者岗位专家专项
10.3969/j.issn.1004-4957.2017.06.008
O657.71;S482.4
A
1004-4957(2017)06-0750-06
*通讯作者:纪文华,助理研究员,研究方向:复杂体系样品前处理,Tel:0531-82605315,E-mail:jwh519@163.com

