白杨素对蒜氨酸美拉德反应的影响
杜阳敏,周 华*,黎海梅,欧仕益,晏日安
(暨南大学理工学院,广东 广州 510632)
白杨素对蒜氨酸美拉德反应的影响
杜阳敏,周 华*,黎海梅,欧仕益,晏日安
(暨南大学理工学院,广东 广州 510632)
以化学合成的蒜氨酸为原料,研究白杨素对蒜氨酸美拉德反应的影响。结果表明,在一定反应条件下,白杨素可能轻微促进蒜氨酸与果糖美拉德反应体系中羟甲基糠醛物质的生成;在反应初期,白杨素可以部分抑制蒜氨酸的分解,其分解率仅有10.1%,而空白对照体系的分解率接近25.0%,分解产物主要为二烯丙基硫醚,但到反应后期,白杨素对蒜氨酸分解的影响较弱,蒜氨酸的最终分解率达到68.2%,分解产物为二烯丙基硫醚、二烯丙基二硫醚、二烯丙基三硫醚等混合物;羟甲基糠醛对蒜氨酸的分解具有显著的促进作用,反应5 h后,蒜氨酸的分解率接近100%,推测羟甲基糠醛在蒜氨酸的分解中可能扮演了催化剂的角色。
白杨素;蒜氨酸;羟甲基糠醛;美拉德反应
杜阳敏, 周华, 黎海梅, 等. 白杨素对蒜氨酸美拉德反应的影响[J]. 食品科学, 2017, 38(11): 64-68. DOI:10.7506/ spkx1002-6630-201711011. http://www.spkx.net.cn
DU Yangmin, ZHOU Hua, LI Haimei, et al. Effect of chrysin on Maillard reaction of alliin[J]. Food Science, 2017, 38(11): 64-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711011. http://www.spkx.net.cn
大蒜是一种极其重要的药食两用植物,具有杀菌、抗病毒、防治中风、降血脂[1-2]、降糖[3-4]、抗肿瘤[5]和调节机体免疫力[6]等多重功效。这些功效与大蒜中的小分子类物质密切相关,如挥发性含硫化合物和极性较大的黄酮类物质等[7-10]。所以,研究大蒜中此类小分子化合物之间的相互作用,对于提高大蒜中活性成分的综合利用率、促进新型大蒜制品的开发以及推动我国大蒜产业转型升级具有极其重要的意义。
大蒜中挥发性含硫化合物的生成与蒜氨酸的转化有关,有酶催化[11]和热分解[12]两种主要方式。酶催化是指以蒜氨酸为底物,在蒜氨酸酶催化作用下转化生成大蒜素,而后分解生成挥发性含硫化合物[13-17];而蒜氨酸的热分解则是在高温条件下,硫碳键断裂导致,自由基的产生会促进该过程的发生;葡萄糖和果糖等物质的存在,可以使蒜氨酸发生美拉德反应,并产生含有牛奶气味的物质[18]。
黄酮化合物是存在于大蒜中的另一类重要次生代谢产物,包括杨梅素、槲皮素、芹菜素等[19-21]。这些物质普遍具有较强的生物活性,如抗人类免疫缺陷病毒[22]、保护低密度脂蛋白胆固醇[23]、抗氧化[24-26]、抑制血管紧张素转化酶[27]、亲和p-糖蛋白等[28]。本课题组曾采用较大规模的现代分离技术,系统地从大蒜中分离、鉴定了12 个黄酮类化合物,其中白杨素在大蒜中具有相对较高的含量[29]。众所周知,黄酮化合物具有良好的抗自由基的作用,结合蒜氨酸的热分解机理,推测黄酮(白杨素)对挥发性含硫化合物的形成可能产生一定的抑制效果。蒜氨酸的美拉德反应本质也是一种热反应,白杨素对蒜氨酸美拉德反应的影响如何,目前鲜见相关文献报道。
1 材料与方法
1.1 试剂与仪器
烯丙基溴、双氧水、正戊烷等试剂 阿拉丁试剂(上海)有限公司;水为蒸馏水。
UV3600 紫外-可见分光光度计 日本Shimadzu公司;高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;Acculab ALC210电子天平 德国Sartorius公司。
1.2 方法
1.2.1 蒜氨酸合成
蒜氨酸按文献[30]的方法合成。L-半胱氨酸盐酸盐7.9 g溶于200 mL水中,在0 ℃条件下不断搅拌加入10 mL 30%的浓氨水,然后滴加10 mL烯丙基溴,搅拌24 h,冷却得到白色固体S-烯丙基-L-半胱氨酸。将上述物质溶于100 mL水中,在0 ℃条件下加入10 mL 30%的双氧水,反应24 h,浓缩溶液,重结晶后可制得蒜氨酸纯品。核磁共振测定产物结构,氢谱和碳谱数据如下:13C NMR(75 MHz,D2O)δ 174.2、138.2、125.8、127.2、57.0、53.1、52.0;1H NMR(400 MHz,D2O)δ 3.23~3.45(2H,m)、3.60~3.90(2H,m)、4.22(1H,m)、5.50~5.56(2H,m)、5.90(1H,m)。与文献[30]数据一致。
1.2.2 紫外吸收曲线测定
蒜氨酸(0.1 mmol)、果糖(1.0 mmol)、白杨素(0.1 mmol,空白不加)加入带有冷凝管的二口瓶中,瓶和冷凝管的出口用玻璃塞密封。将上述样品在油浴锅中于120 ℃条件下反应一定时间后,用容量瓶加水定容10.0 mL,测定其紫外吸收光谱曲线。
1.2.3 蒜氨酸的分解与含量分析
取蒜氨酸(0.1 mmol)、果糖(或羟甲基糠醛(hydroxymethyl furfural,HMF),1.0 mmol)以及白杨素(0.1 mmol,空白不加)混合,加入1.0 mL去离子水,搅拌,装入密闭的高压反应罐,在120 ℃条件下反应一定时间,参考文献[24],分析反应体系中的蒜氨酸含量。样品中的大蒜素采用HPLC分析(H2O与MeOH体积比1∶1,前1~15 min流速为0.3 mL/min,后16~50 min流速为1 mL/min,色谱柱C18(3.9 mm×150 mm,5 μm),波长254 nm)。
1.2.4 挥发性含硫化合物产物分析
反应物冷却5 h后,用正己烷萃取样品,浓缩溶液,用容量瓶定容为10.0 mL。采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用分析溶液的组成。GC-MS分析条件为:70 eV,质谱扫描范围30~350,扫描时间3.89 s,氦气流速0.8 mL/min;柱温箱升温程序为:初始温度45 ℃,保持5 min;以6 ℃/min升温到90 ℃,以10 ℃/min升温到220 ℃,保持20 min。
1.2.5 HMF含量分析
准确称取1.00 mg HMF标品,用乙醇配制成100 mL标准母液备用。用移液管从中分别吸取0.8、2.0、5.0、8.0、10.0 mL,再用乙醇定容至25 mL,得到一系列梯度标准溶液,然后用GC-MS测其含量。GC-MS分析条件为:70 eV,质谱扫描范围m/z 30~350,氦气流速1.2 mL/min,柱温箱升温程序为:初始温度65 ℃,保持5 min;以6 ℃/min升温到120 ℃,以10 ℃/min升温到250 ℃,保持10 min。
美拉德反应完成后,加甲醇溶解,过滤,滤液浓缩,而后用甲醇定容为10 mL,而后用GC-MS分析HMF的含量。GC-MS分析条件同上。
1.3 数据分析
用Excel软件对数据进行统计、分析,所有数据取3 次重复的平均值;用Origin 8.0软件对数据进行拟合以及图形化处理。
2 结果与分析
2.1 反应体系的紫外光谱变化
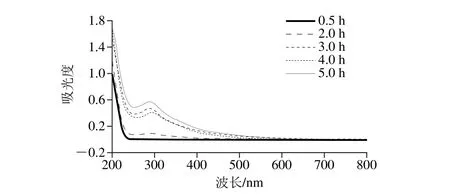
图1 反应体系的紫外光谱图Fig. 1 Ultraviolet (UV) absorption spectra of reaction products at different reaction times
白杨素、蒜氨酸、果糖反应后,紫外吸收光谱与反应时间的关系如图1所示。反应0.5 h,体系水溶液的紫外吸收曲线在波长220 nm以后接近零吸收,并没有呈现出白杨素的特征吸收峰,可能是因为白杨素在水中的溶解度太低所致。在反应2 h后,位于280 nm波长处产生了一个新的吸收峰,随着反应的进行,吸收强度不断增加,说明反应产生了新的产物,且具有共轭结构。而后,采用薄层层析(thin-layer chromatography,TLC)分析了体系中主要物质的组成,结果如图2所示,可以看到在TLC板上产生了具有紫外荧光的新点(Rf=0.4),通过制备薄层技术获得了该物质的纯品,并进行核磁共振表征,发现该物质的核磁共振碳谱上共有6 个碳信号,分别为178.0、161.8、152.5、129.4、123.4、56.2,说明该产物为HMF。

图2 反应体系的TLC色谱图Fig. 2 TLC of the reaction products
2.2 白杨素对反应体系中HMF含量和蒜氨酸分解率的影响

图3 反应体系中HMF含量的变化Fig. 3 Change in HMF contents in reaction system
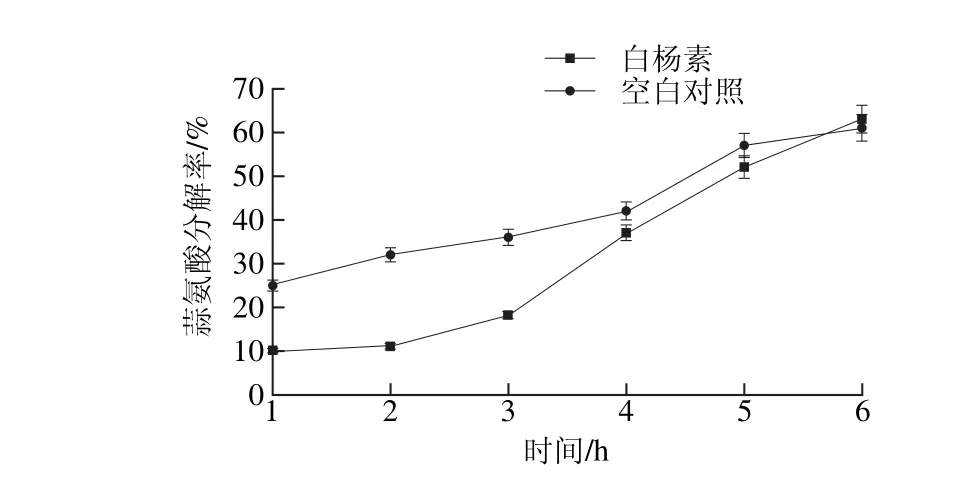
图4 反应体系中蒜氨酸分解率随反应时间的变化Fig. 4 Change in the percentage decomposition of alliin along with reaction time
从紫外光谱曲线和核磁共振谱,可以确定反应体系中生成了HMF。为了进一步研究白杨素对蒜氨酸、果糖美拉德反应的影响,结合GC-MS技术研究了体系中HMF随时间的变化规律。从图3可以看出,加入白杨素的反应体系相比于空白对照HMF含量有轻微的增加,推测可能与白杨素分子中含有的活泼氢有关,它们一般具有一定的酸性,可能会促进果糖的脱水,而生成HMF。反应体系中HMF的生成和体系的反应时间呈正相关,刚开始反应时,生成HMF的量较低,反应2 h后,体系中的HMF仅有0.03 mg/L,这可能与体系中的水分含量较高有关;随着反应的进行,体系中的水分不断蒸发,美拉德反应的速率提升,体系中生成的HMF随之增加,反应6 h后,体系中的HMF含量达到0.82 mg/L,与紫外光谱表征的结果基本一致。白杨素在一定程度上强化了果糖的脱水反应,为研究其对同存于体系中蒜氨酸的影响,本实验分析了体系中加入白杨素后蒜氨酸分解率与反应时间的关系,结果如图4所示。相比于空白对照,加入白杨素1 h后,蒜氨酸的分解率开始较低,大约10.1%,而空白对照体系接近25.0%。随着反应的进行,蒜氨酸的分解率迅速提升,反应4 h后,蒜氨酸分解率达到35.7%,接近空白对照体系的39.8%,反应6 h后,蒜氨酸分解率达到68.2%,与空白对照体系相差无几。有研究显示[12],在自由基含量较高的体系中,蒜氨酸容易发生C—S键断裂,使蒜氨酸的分解反应加速。结合文献[12]结论,推测反应开始阶段,蒜氨酸的分解率较低,可能与白杨素的抗自由基特性相关。反应时间延长后,体系中的蒜氨酸分解率提升,可能与中间产物HMF的生成有一定的关联。
2.3 白杨素对反应体系中含硫挥发性产物分布的影响

图5 白杨素对反应体系中蒜氨酸分解产物的影响Fig. 5 Effect of chrysin on alliin breakdown products
白杨素对反应体系中蒜氨酸分解产物的影响如图5所示。加入白杨素的反应体系在反应2 h后,生成含硫挥发性物质基本全为二烯丙基二硫醚,而空白对照体系中生成的产物包括二烯丙基硫醚、二烯丙基二硫醚、二烯丙基三硫醚、二烯丙基四硫醚,分布比例为10%、41%、35%、14%。挥发性含硫化合物的形成与中间体大蒜素密切相关,一般认为是大蒜素先形成二烯丙基二硫醚,再重组形成一硫醚、三硫醚、四硫醚等物质,这一过程的完成与自由基的参与有一定的关联。显然,自由基含量越高,C—S键的断裂和重组越强烈,生成一硫醚、三硫醚、四硫醚的可能性越高。白杨素对体系中自由基的抑制作用,使其最终产物停留在二硫醚阶段,这一结果对于反应体系挥发性含硫化合物的选择性控制具有一定的指导意义。
2.4 HMF对蒜氨酸分解率的影响
前面研究显示HMF是蒜氨酸美拉德反应体系的中间产物,初步推测,该产物的生成可能与蒜氨酸的热分解有重要关联。因此,把HMF与蒜氨酸直接混合加热,分析蒜氨酸的分解率,结果如图6所示。HMF与蒜氨酸在120 ℃条件下反应1 h后,蒜氨酸的分解率达到52%,反应5 h后,蒜氨酸的分解率将近100%。结合图3,不难得出结论,HMF确实显著促进了蒜氨酸的分解。蒜氨酸的分解产物从刚开始反应时以二烯丙基二硫醚为主,到反应5 h后,产物趋于平均化。

图6 HMF对蒜氨酸分解率的影响Fig. 6 Effect of HMF on the decomposition rate of alliin
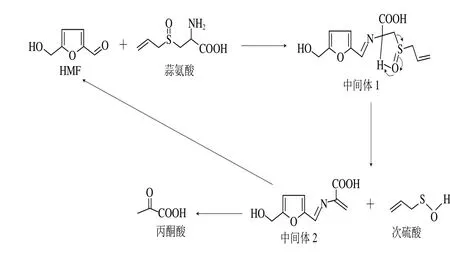
图7 HMF促进蒜氨酸分解的机理推测Fig. 7 Proposed mechanism for the decomposition of alliin promoted by HMF
蒜氨酸在HMF存在下,分解过程明显加快,对原因进行了简单的推理,如图7所示。HMF醛基的碳原子带有部分正电荷,容易与蒜氨酸的氨基发生亲电加成反应,生成中间体1,该分子因为连接有较大的吸电子共轭体系,使分子中连接羧基的碳原子的电子云密度降低,该原子上的氢原子酸性增强,更容易与蒜氨酸分子中的氧原子产生氢键作用,形成五元环而发生消除反应,生成中间体2和次硫酸,次硫酸脱水生成大蒜素,而中间体2加水分解生成丙酮酸,并释放出HMF。显然,HMF是蒜氨酸分解的重要催化剂,加速了蒜氨酸的分解。
3 结 论
白杨素对蒜氨酸美拉德反应体系中HMF的生成有轻微的促进作用,而对蒜氨酸的分解反应初期具有一定的抑制作用,反应产物以二烯丙基二硫醚为主,其原因可能与白杨素的抗自由基特性有关。生成的HMF可加速蒜氨酸的分解。HMF与蒜氨酸在120 ℃反应1 h后,蒜氨酸分解率达到52%;反应5 h后,蒜氨酸分解率将近100%。在反应过程中HMF可能扮演了催化剂的角色。
[1] 张百俊, 杨和连, 刘爱琴. 大蒜功能研究现状[J]. 河南科技学院学报(自然科学版), 2007, 35(4): 33-35. DOI:10.3969/j.issn.1673-6060-B.2007.04.013.
[2] 李瑜, 罗飞, 许时婴. 大蒜生物活性功能及蒜粉微胶囊化的研究进展[J]. 食品科学, 2007, 28(9): 610-613. DOI:10.3321/ j.issn:1002-6630.2007.09.149.
[3] SHER A, FAKHAR-UL-MAHMOOD M, SHAH S N, et al. Effect of garlic extract on blood glucose level and lipid profile in normal and alloxan diabetic rabbits[J]. Advances in Clinical and Experimental Medicine, 2013, 21(6): 705-711.
[4] PADIYA R, BANERJEE S K. Garlic as an anti-diabetic agent: recent progress and patent reviews[J]. Recent Patents on Food Nutrition and Agriculture, 2013, 5(2): 105. DOI:10.2174/18761429113059990002.
[5] MODEM S, DICARLO S E, REDDY T R. Fresh garlic extract induces growth arrest and morphological differentiation of MCF7 breast cancer cells[J]. Genes and Cancer, 2012, 3(2): 177-186. DOI:10.1177/1947601912458581.
[6] SCHAFER G, KASCHULA C H. The immunomodulation and antiinflammatory effects of garlic organosulfur compounds in cancer chemoprevention[J]. Anti-Cancer Agents in Medicinal Chemistry, 2014, 14(2): 233-240. DOI:10.1016/S0959-8049(14)50868-4.
[7] LANZOTTI V. The analysis of onion and garlic[J]. Journal of Chromatography A, 2006, 1112: 3-22. DOI:10.1016/j.chroma.2005.12.016.
[8] 闫淼淼, 许真, 徐蝉, 等. 大蒜功能成分研究进展[J]. 食品科学, 2010, 31(5): 312-318.
[9] 李瑜, 许时婴. 大蒜中硫代亚磺酸酯的提取工艺[J]. 食品与生物技术学报, 2004, 23(2): 76-81. DOI:10.3321/j.issn:1673-1689.2004.02.018.
[10] BLOCK E. ChemInform abstract: the organo-sulfur chemistry of the genus allium. implications for the organic chemistry of sulfur[J]. Angewandte Chemie International Edition, 1992, 23(51): 1135-1178. DOI:10.1002/chin.199251338.
[11] WANG J, CAO Y, WANG C, et al. Low-frequency and low-intensity ultrasound accelerates alliinase-catalyzed synthesis of allicin in freshly crushed garlic[J]. Journal of the Science of Food and Agriculture, 2011, 91: 1766-1772. DOI:10.1002/jsfa.4377.
[12] ZHANG M, LEI N, ZHU T, et al. Thermal processing effects on the chemical constituent and antioxidant activity of S-alk(en)ylcysteine S-oxides (alliin) extract[J]. LWT-Food Science and Technology, 2012, 51: 309-313. DOI:10.1016/j.lwt.2012.09.024.
[13] 于树芳, 毛月. 蒜氨酸酶纯化方法研究进展及影响因素[J].解放军药学学报, 2012, 26(5): 456-458. DOI:10.3969/ j.issn.1008-9926.2010.05.030.
[14] 曾哲灵, 徐仁华, 熊涛. 蒜氨酸酶的分离纯化及其酶学性质测定[J]. 食品科学, 2008, 29(12): 431-434. DOI:10.3321/ j.issn:1002-6630.2008.12.097.
[15] ANIFANTAKI E, TOULOUPAKIS E, GHANOTAKIS D F. Alliinase immobilization in calcium alginate beads and layered double hydroxides matrices[J]. Journal of Food Biochemistry, 2012, 36(1): 12-20. DOI:10.1111/j.1745-4514.2010.00510.x.
[16] ZHOU J. Immobilization of alliinase and its application: flow-injection enzymatic analysis for alliin[J]. African Journal of Biotechnology, 2009, 8(7): 1337-1342.
[17] 张敏, 胡秋辉, 辛志宏. 金属离子对蒜氨酸酶性质的影响[J]. 食品科技, 2012, 33(13): 160-166.
[18] YU T H, WU C M, HO C T. Meat-like flavor generated from thermal interactions of glucose and alliin or deoxyalliin[J]. Journal of Agricutral and Food Chemistry, 1994, 42(4): 1005-1009. DOI:10.1021/ jf00040a032.
[19] KIM J S, KANG O J, GWEON O C. Comparison of phenolic acids and flavonoids in black garlic at different thermal processing steps[J]. Journal of Functional Foods, 2012, 5(1): 80-86. DOI:10.1016/ j.jff.2012.08.006.
[20] ISABEL A M, ROMERO-GONZALEZ R, MARTINEZ V J L A. Determination of phenolic compounds in artichoke, garlic and spinach by ultra-high-performance liquid chromatography coupled to tandem mass spectrometry[J]. Food Analytical Methods, 2014, 7(10): 2095-2106. DOI:10.1007/s12161-014-9852-4.
[21] BEATO V M, ORGAZ F, MANSILLA F, et al. Changes in phenolic compounds in garlic (Allium sativum L.) owing to the cultivar and location of growth[J]. Plant Foods for Human Nutrition, 2011, 66(3): 218-223. DOI:10.1007/s11130-011-0236-2.
[22] MURATA R M, PASETTO S, PARDI V. The anti-HIV activity of flavonoids: quercetin and pinocembrin[J]. Plantaion Medica, 2014, 80: 811-811. DOI:10.1055/s-0034-1382573.
[23] GONG M, GARIGE M, VARATHARAJALU R, et al. Quercetin up-regulates paraoxonase 1 gene expression with concomitant protection against LDL oxidation[J]. Biochemical and Biophysical Research Communications, 2009, 379(4): 1001-1004. DOI:10.1016/ j.bbrc.2009.01.015.
[24] LU X, ROSS C F, POWERS J R, et al. Determination of total phenolic content and antioxidant activity of garlic (Allium sativum) and elephant garlic by attenuated total reflectance-fourier transformed infrared spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2012, 59: 5215-5221. DOI:10.1634/stemcells.2003-0049.
[25] CHEN S X, SHEN X Q, CHENG S Q, et al. Evaluation of garlic cultivars for polyphenolic content and antioxidant properties[J]. PLoS ONE, 2013, 8(11): 1-12. DOI:10.13712Fjournal.pone.0079730.
[26] BOZIN B, MIMICA-DUKIC N, SAMOJLIK I, et al. Phenolics as antioxidants in garlic (Allium sativum L., Alliaceae)[J]. Food Chemistry, 2008, 111(4): 925-929. DOI:10.1016/j.foodchem.2008.04.071.
[27] OBOH G, AKINYEMI A J, ADEMILUYI A O. Inhibitory effect of phenolic extract from garlic on angiotensin-1 converting enzyme and cisplatin induced lipid peroxidation-in vitro[J]. International Journal of Biomedical Science, 2013, 9(2): 98-106.
[28] COMTE G, DASKIEWICZ J B, BAYET C, et al. Isoprenylation of flavonoids enhances binding affinity toward p-glycoprotein and modulation of cancer cell chemoresistance[J]. Journal of Medicinal Chemistry, 2001, 44(5): 763-768. DOI:10.1021/jm991128y.
[29] LI W Q, ZHOU H, ZHOU M Y, et al. Characterization of phenolic constituents inhibiting the formation of sulfur-containing volatiles produced during garlic processing[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 787-794. DOI:10.1021/jf505982f.
[30] ABBEHAUSEN C, SUCENA S F, LANCELLOTTI M, et al. Synthesis, spectroscopic characterization, DFT studies, and antibacterial and antitumor activities of a novel water soluble Pd (II) complex with L-alliin[J]. Journal of Molecular Structure, 2013, 1035: 421-426. DOI:10.1016/j.molstruc.2012.11.065.
Effect of Chrysin on Maillard Reaction of Alliin
DU Yangmin, ZHOU Hua*, LI Haimei, OU Shiyi, YAN Ri’an
(College of Science and Engineering, Jinan University, Guangzhou 510632, China)
The effect of chrysin on the Maillard reaction between synthetic alliin and fructose was investigated. The results showed that chrysin could slightly increase the production of hydroxymethyl furfural (HMF). It was found that chrysin inhibited the decomposition of alliin with a decomposition percentage of only 10.1% compared with 25.0% for the control. In the earlier stage of the reaction, chrysin facilitated the production of diallyl sulfide, a major volatile sulfur-containing compound. In the later stage, the effect of chrysin on alliin decomposition was minimal leading to 68.2% decomposition of alliin with the production of a mixture of diallyl sulfide, diallyl disulfide, and diallyl trisulfide. HMF greatly promoted the decomposition of alliin, resulting in almost 100% decomposition of alliin after 5 hours of reaction. Therefore, HMF could be deemed as a catalyst for the process.
chrysin; alliin; hydroxymethyl furfural (HMF); Maillard reaction
10.7506/spkx1002-6630-201711011
O643.1
A
1002-6630(2017)11-0064-05引文格式:
2016-06-16
国家自然科学基金青年科学基金项目(31101323)
杜阳敏(1991—),女,硕士研究生,研究方向为食品化学。E-mail:1403877021@qq.com
*通信作者:周华(1976—),男,副教授,博士,研究方向为食品化学。E-mail:zhhua-1@163.com

