红外光谱研究超声促聚集作用对大豆蛋白-磷脂结构与功能的影响
毕 爽,张巧智,丁 俭,隋晓楠,王中江,齐宝坤,江连洲,李 杨*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
红外光谱研究超声促聚集作用对大豆蛋白-磷脂结构与功能的影响
毕 爽,张巧智,丁 俭,隋晓楠,王中江,齐宝坤,江连洲,李 杨*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆分离蛋白和大豆卵磷脂在中性条件下(pH 7.0)复合后,可自发组成蛋白质-磷脂复合体系,但仍有部分未自组装的蛋白质和磷脂存在于溶液中。为实现蛋白质-磷脂最大程度复合,解析复合体系功能性质与大豆蛋白二级结构间的构效关系,本研究采用“超声改性-结构变化-功能表达”的研究理念,采用傅里叶变换红外光谱法研究体系结构变化,测定持水性、持油性、凝胶质地剖面并分析其功能性质。结果表明:超声处理会显著改善大豆蛋白-磷脂复合体系的功能性质,超声时间较短时,持水性、持油性等功能性质随功率的增加先升高后降低;超声时间较长时,功能性质随功率的增加持续降低。傅里叶变换红外光谱分析发现低、中功率条件下,大豆蛋白二级结构中β-折叠相对含量较多而α-螺旋结构相对含量较少,说明大豆蛋白与磷脂间的交互作用更明显。超声波作用下复合体系凝胶质地剖面分析表明,功能性质与蛋白质的二级结构改变具有一定的关联性。以上结果说明,适当的超声处理有助于改变大豆蛋白-磷脂复合体系的结构并提升其功能性质。
大豆蛋白;卵磷脂;功能性质;结构性质;傅里叶变换红外光谱
引文格式:
毕爽, 张巧智, 丁俭, 等. 红外光谱研究超声促聚集作用对大豆蛋白-磷脂结构与功能的影响[J]. 食品科学, 2017, 38(11): 18-24. DOI:10.7506/spkx1002-6630-201711004. http://www.spkx.net.cn
BI Shuang, ZHANG Qiaozhi, DING Jian, et al. Infrared spectroscopic analysis of the effect of ultrasound-promoted aggregation behavior on structural and functional properties of soybean protein-lecithin system[J]. Food Science, 2017, 38(11): 18-24. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711004. http://www.spkx.net.cn
大豆蛋白是一种优质的全价植物蛋白,可替代动物蛋白[1]。但其难以同时满足加工时的特殊需要,所以应做出适当的改性[2]。在过去几年中,蛋白质的改性技术研究主要集中在物理改性和化学改性[3-4]。寻找一种简单、营养、高效的天然改性技术一直是研究热点,如引入生物小分子使其与蛋白质发生相互作用,复合体系的产生对大豆分离蛋白的功能性质具有重要影响。
大豆卵磷脂作为一种两性离子表面活性剂,可以通过结合的方式使蛋白质的表面活性发生改变,且蛋白质与磷脂之间的交互作用会影响大豆蛋白的功能性质。至今人们已对大豆蛋白-磷脂交互作用方式进行了部分研究,但未能清晰地解释超声处理等物理加工方式对蛋白质-磷脂复合体系的影响,更缺少对其结构及功能性质间构效关系的研究。磷脂与蛋白会通过静电作用和疏水作用结合形成复合物[5],环境因素能够影响复合体系的性质,如pH值可以修饰蛋白质和磷脂复合物的表面活性,同时改变液滴之间的流体动力学作用;NaCl浓度的增加导致乳清蛋白-磷脂乳液粒径增大,易造成油滴聚集降低乳液稳定性[6]。但是物理改性技术如超声波处理,对蛋白质-磷脂复合体系功能性质的影响研究目前仍鲜见报道。
因此,本实验重点研究超声功率和超声时间对大豆蛋白-磷脂复合体系结构和功能性质的影响。采用低、中、高3 种超声功率(150、300、450 W)和短时、长时2 种超声时间(12、24 min)作为实验条件,并对复合体系结构性质和功能特性进行了分析。实验结果为超声技术运用于加工专用型大豆蛋白-磷脂复合产品提供了一定参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 东北农业大学粮油加工实验室自制;大豆卵磷脂 德国Sigma公司;大豆油 山东鲁花集团商贸有限公司。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)配制试剂盒 北京索宝来试剂公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠 北京新光化工试剂厂。所有试剂均为国产分析纯。
1.2 仪器与设备
超声波细胞破碎仪 宁波新芝生物科技股份有限公司;5430小型高速离心机 德国Eppendorf公司;TA-XT2质构仪 英国Stable Micro System公司;MAGNA-IR560傅里叶变换红外光谱(Fourier transform infrared spectrum,FT-IR)仪 美国尼高丽公司;SDS-PAGE仪 东方电泳设备有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
新鲜大豆磨粉后与正己烷以1∶3(m/V)的比例混合,在 40 ℃条件下搅拌2 h 脱脂3 次。将脱脂豆粉按1∶10(m/V)的比例与水混合,采用2 mol/L的NaOH溶液调节pH值至8.5,搅拌后在4 ℃条件下10 000×g离心20 min,取上清液再用2 mol/L HCl调节pH值至4.5。静置后在4 ℃条件下6 000×g离心20 min,沉淀水洗2 次后分散于水中并用2 mol/L NaOH调节pH值至7.0。冷冻干燥后粉碎得大豆分离蛋白[7]。
1.3.2 超声制备大豆蛋白-磷脂复合体系
将大豆分离蛋白与大豆卵磷脂以质量比1∶10混合于50 mL锥形瓶中,室温条件下不断搅拌2 h。超声处理参考Hu Hao等[8]的方法。将超声波探头置于复合体系液面下,按表1条件依次超声。为保持温度一致,每5 min向冰水浴中加入冰块。超声处理后冷冻干燥得大豆蛋白-磷脂复合体系样品。

表1 超声处理制备大豆蛋白-磷脂复合体系条件Table 1 Ultrasonic treatments applied on soybean protein-lecithin complex
1.3.3 大豆蛋白-磷脂凝胶持油性测定
将超声处理的大豆蛋白-磷脂复合体系样品制备成10 g/100 mL的分散液。90 ℃条件下加热20 min后冷却至室温,形成蛋白质-磷脂凝胶,4 ℃的条件下冷藏24 h以完全形成凝胶。
参考Predroche等[9]的方法。取1 g大豆蛋白-磷脂凝胶样品加入12 mL大豆油混合。室温放置30 min使样品充分被大豆油浸润,4 500 r/min离心20 min,取沉淀称质量,持油性的计算方法见式(1)。

式中:m1为样品离心后沉淀的质量/g;m2为样品的质量/g。
1.3.4 大豆蛋白-磷脂凝胶持水性测定
将凝胶样品放在5 mL的离心管中,室温6 000×g离心20 min,将试管倒转,甩去多余的水分移出,分别将离心前与离心后的试管称质量[10],持水性的计算见式(2)。

式中:m1为样品离心前与离心管的总质量/g;m2为样品离心除水后与离心管的总质量/g。
1.3.5 大豆蛋白-磷脂凝胶质构测定
采用TA-XT2型质构仪进行测定。使用P/0.5探头,探头下行速率为1 mm/s,进入凝胶过程中的速率为1 mm/s,下行力为7 g,压缩变形为样品高度的30%,室温测定,每个样品重复3 次测定,取平均值作为最终结果[11]。
1.3.6 FT-IR测定
采用KBr压片法,称取凝胶样品1 mg,加入溴化钾100 mg,压片后进行测定。在室温条件下,设定扫描波数谱段范围为400~4 000 cm-1,分辨率设定为4 cm-1,波数精度为0.01 cm-1条件下扫描64 次,谱图利用Peakfit Version软件进行处理。平滑处理后估算出子峰的位置和个数,根据各子峰与二级结构对应关系,利用积分面积计算各二级结构组分的相对百分含量[12]。
1.3.7 SDS-PAGE测定
参考Laemmli[13]的测定方法,分离胶体积分数12%,浓缩胶体积分数5%,样品质量浓度为1 mg/mL,与上样缓冲液在95 ℃条件下加热5 min,上样量为10 μL。电泳过程先恒压为80 V,跑至分离胶时为120 V,结束后先染色再脱色,标准蛋白采用市售彩虹Marker。
2 结果与分析
2.1 大豆蛋白-磷脂凝胶持油性分析
由图1可知,未经超声处理的样品持油性为32.1%,在较短超声时间下,样品的持油性随着超声功率的升高先增加后降低。延长超声时间至24 min后,样品的持油性在超声功率为150 W时达到最大(52.7%),相比于未超声样品持油率增加64.2%,这是因为在超声波的机械剪切作用下,蛋白质空间结构打开,暴露的疏水基团与磷脂发生疏水相互作用,提升了复合体系凝胶的亲油特性[14]。然而,随着超声功率进一步增加,大豆蛋白-磷脂凝胶样品的持油率又有所下降。说明超声功率过大的情况下,大豆蛋白发生一定程度的聚集,形成的聚集体由可溶性转为不溶性,与磷脂间的疏水相互作用减弱。疏水基团包埋,降低了复合体系凝胶的亲油性[15]。
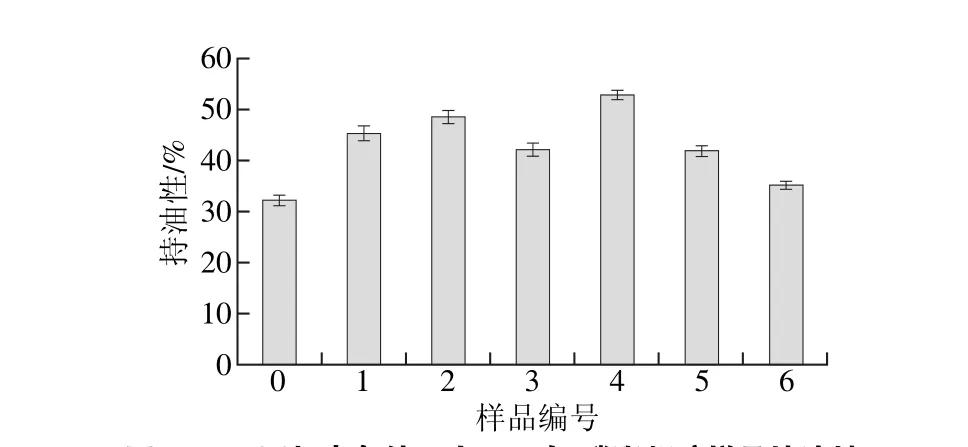
图1 不同超声条件下大豆蛋白-磷脂凝胶样品持油性Fig. 1 Oil-holding capacity of soybean protein isolate-lecithin gels irradiated under different ultrasonic conditions
2.2 大豆蛋白-磷脂凝胶持水性分析
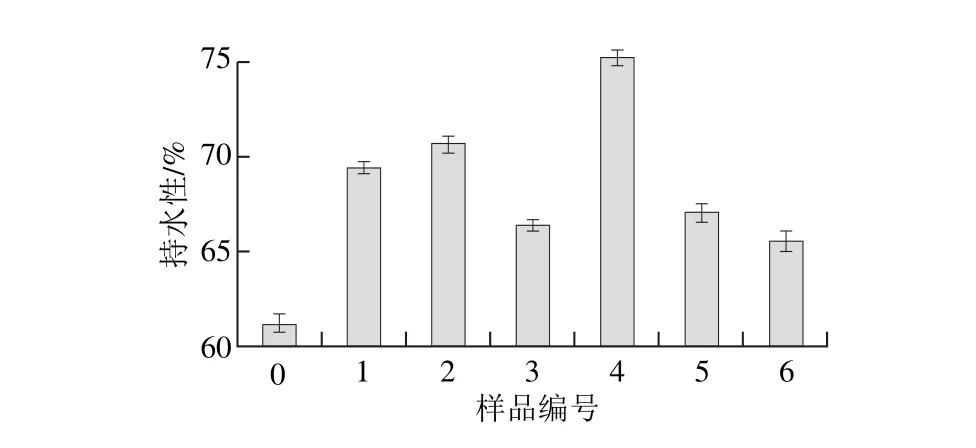
图2 不同超声条件下大豆蛋白-磷脂凝胶样品持水性Fig. 2 Water-holding capacity of soybean protein isolate-lecithin gels irradiated under different ultrasonic conditions
由图2可知,与未超声样品相比,经过不同程度的超声处理后,大豆蛋白-磷脂凝胶的持水性明显改善。持水性是重要的凝胶性质,提供凝胶网络结构吸收水分和保持水分的能力,同时也可表征样品凝胶内部结构的粗糙程度[16]。Wu Wei等[17]研究表明大豆蛋白凝胶持水性受蛋白质溶解性和粒径大小的影响。当超声时间较短时,凝胶样品持水性随超声功率的增加而先升高后降低,这可能是由于超声波的空化与剪切作用提高了蛋白质的溶解性并减小蛋白质粒子的颗粒直径,可溶性大豆蛋白与磷脂的交互作用更加明显。同时超声波处理导致大豆蛋白的疏水基团暴露,与磷脂分子的疏水尾部发生疏水相互作用[5],形成的密集凝胶网络结构有助于结合水分。但当超声时间较长时,高功率超声作用下粒径及不溶性聚集体含量增加,由于静电排斥作用,大豆蛋白与磷脂间的作用减弱,无法发生大范围的交联,造成一些大分子的不溶性聚集体出现在凝胶结构中,降低了大豆蛋白-磷脂凝胶的持水性[18]。
2.3 大豆蛋白-磷脂凝胶质构分析
凝胶质地剖面分析(texture profile analysis,TPA)实验模拟人体口腔的咀嚼运动,样品进过两次压缩,得到力-时间的关系曲线。图3是典型的蛋白质凝胶质构分析曲线,第一个峰值f2代表凝胶的硬度;t2与t1之比代表凝胶弹性;S3+S4与S1+S2之比代表凝胶的内聚性;S2与S1之比代表回弹性[19]。
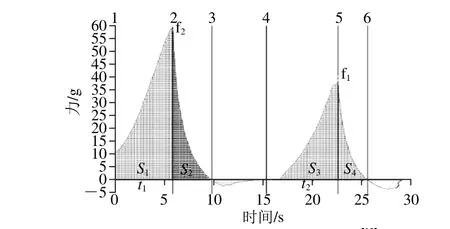
图3 典型的蛋白凝胶质构特性曲线[19]Fig. 3 Typical texture curves of protein gels[19]

图4 不同超声条件下大豆蛋白-磷脂凝胶质构特性Fig. 4 Texture properties of SPI-lecithin gels irradiated under different ultrasonic conditions
如图4所示,超声处理后凝胶样品的硬度、弹性、内聚性以及回弹性较未处理的样品均有所提高,且不同凝胶样品间变化较为显著。超声时间为12 min时,中强度超声功率(300 W)条件下大豆蛋白-磷脂凝胶样品的硬度较高,当超声时间为24 min时,低强度超声功率(150 W)条件下样品的硬度显著高于其他样品(P<0.05)。这可能是由于超声时间与超声功率的协同作用能量适宜,促进大豆蛋白与卵磷脂的溶解,此时体系内形成的聚集体是可溶性的,粒径较小。超声处理有助于蛋白质结构展开,促进与磷脂间的交互作用,形成致密的凝胶结构以增大凝胶的弹性[20]。但当超声能量输入进一步增加,蛋白质发生重聚集,形成不溶性的聚集体,破坏凝胶形成有序的网状结构。说明高功率条件下蛋白质分子柔性被破坏,降低其与小分子生物活性物质的相互作用,致使凝胶表现出硬度低、易破裂及弹性差等现象[21]。为了进一步探究样品功能性质与结构之间的构效关系,本实验采用光谱学方法及凝胶电泳分析蛋白质-磷脂凝胶样品的结构。
2.4 FT-IR分析
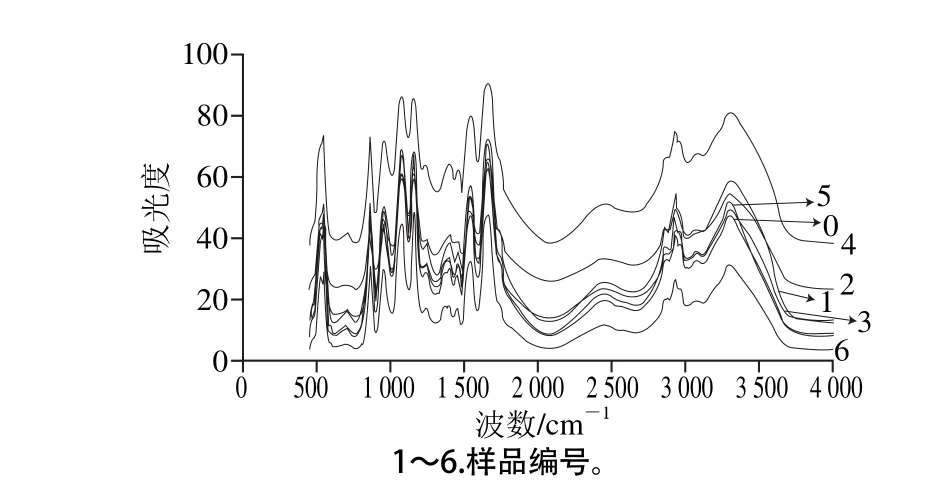
图5 不同超声条件下样品中大豆蛋白FT-IR分析Fig. 5 FT-IR spectra of SPI irradiated under different ultrasonic conditions
图5 所示为不同超声条件下样品中大豆蛋白的FT-IR图。FT-IR图可提供蛋白质酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带信息以及蛋白质结构中的C—C振动和碳氧糖苷键振动等信息[22]。FT-IR的研究可以定量给出样品中蛋白质的二级结构。根据已有研究,蛋白质二级结构与各子峰间的对应关系为:α-螺旋结构对应波数1 646~1 664 cm-1;β-折叠结构对应波数1 615~1 637 cm-1和1 682~1 700 cm-1;β-转角结构对应波数1 664~1 681 cm-1;无规卷曲结构对应波数1 637~1 645 cm-1[23]。
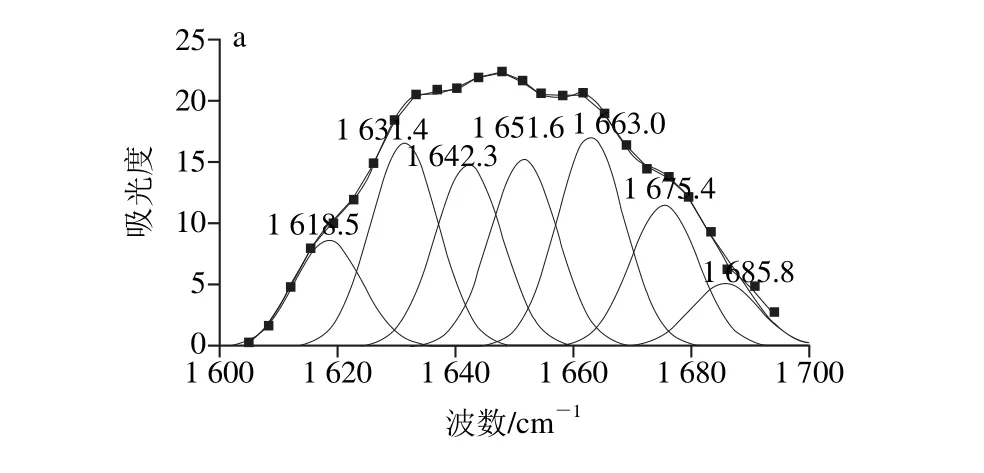

带的拟合图谱Fig. 6 Second-derivative FT-IR spectra in the amide Ⅰ region and Gaussian curve fitting for SPI irradiated under different ultrasonic conditions图6 不同超声条件下样品中大豆蛋白酰胺Ⅰ
将不同超声条件下样品中大豆蛋白的酰胺Ⅰ带红外谱图做二阶导数,采用Gauss面积法拟合,通过峰位归属确定二级结构种类和含量,计算结果见表2。
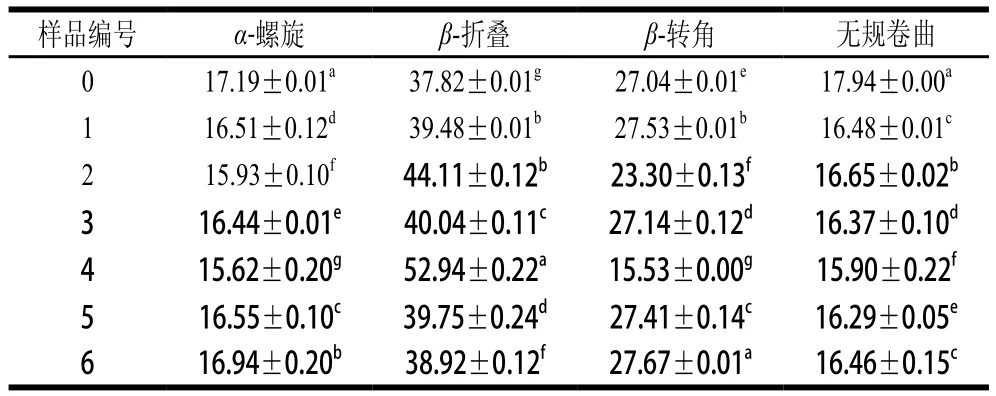
表2 不同超声条件下样品中大豆蛋白的二级结构相对含量Table 2 Contents of secondary structures in SPI irradiated under different ultrasonic conditions
低、中功率时蛋白质-磷脂凝胶样品中α-螺旋及无规卷曲结构相对含量较低,β-折叠结构相对含量较高,尤其是当150 W功率超声24 min时(4号样品)。这与Li Chen等[24]的研究一致,可能是大豆卵磷脂的疏水尾部结合到了α-螺旋结构中的疏水性氨基酸区域,从而使蛋白质分子展开改变了体系中二级结构的组成。高功率下蛋白质分子由于空穴效应运动加速,会发生一定程度的聚集,降低了磷脂与蛋白的疏水相互作用。当超声功率为450 W时,样品中的α-螺旋结构相对含量呈现出明显的增加趋势,这与Hu Hao等[8]研究结果一致,由于蛋白质的二级结构受蛋白质分子与其他分子交互作用的影响,上述结果说明超声波破坏了这些作用,导致二级结构变化。相似地,Chandrapala等[25]也指出较高的超声功率(20 kHz,450 W)导致蛋白质出现β-折叠结构向α-螺旋结构转移的现象。450 W超声条件下,当超声时间延长至24 min时,α-螺旋结构相对含量变化更加明显。因此,形成凝胶结构无序且分布不均匀,凝胶硬度及弹性较差。
2.5 SDS-PAGE结果
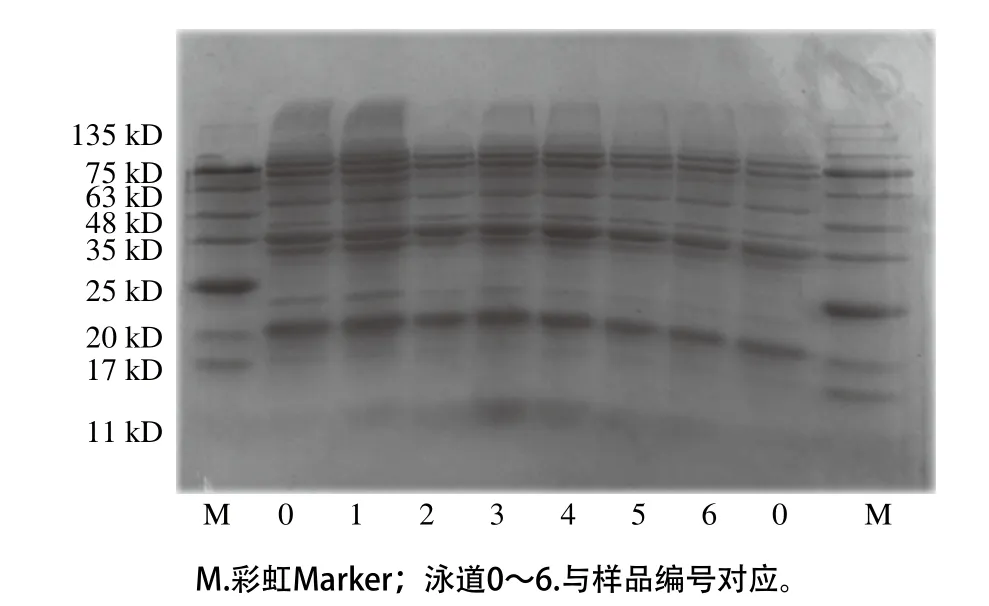
图7 不同超声条件下样品中大豆蛋白的SDS-PAGE图Fig. 7 SDS-PAGE profiles of SPI irradiated under different ultrasonic conditions
由图7可知,未处理样品SDS-PAGE图清晰地显示出大豆蛋白各亚基的条带。超声处理后大豆蛋白的条带并无显著变化,表明超声处理未改变蛋白质的四级结构,与Karki[26]、Zhang Qiuting[27]等研究结果相同。进一步说明非共价键是引起蛋白分子聚集的主要因素,如大豆蛋白与磷脂间的静电作用和疏水作用[28-30]。
本实验具体分析了大豆蛋白-磷脂复合体系功能性质随超声条件变化的规律,以及构象变化对复合体系功能性质的影响。持水、持油性质和凝胶TPA是复合体系重要的功能性质,与疏水基团的暴露、蛋白质二级结构组成及构象变化息息相关。因此,采用FT-IR法分析复合体系构象变化有利于解析超声波对复合体系构象、功能性质的影响规律。
3 结 论
本实验选用不同超声功率和时间处理蛋白-磷脂复合体系,分析其对体系功能性质的影响,并采用FT-IR分析体系功能与结构的构效关系。得到主要结论如下:1)经过超声处理后样品的持油、持水能力都有一定程度的提升。低(150 W)、中(300 W)功率超声条件下,样品凝胶的硬度、弹性以及内聚性等性质较好。高功率(450 W)处理致使样品功能性质下降,且随着时间的延长更加明显。2)当大豆蛋白-磷脂复合体系经过150 W,24 min超声处理时,复合体系的功能性质最佳。通过FT-IR分析发现,大豆蛋白-磷脂复合体系构象上的变化是影响其持水性、持油性、凝胶TPA性质的主要原因。3)FT-IR结果发现低(150 W)、中(300 W)功率超声处理样品中α-螺旋及无规卷曲结构相对含量降低,β-折叠相对含量上升,大豆卵磷脂的疏水尾部结合到了α-螺旋结构中的疏水性氨基酸区域,改变了二级结构组成。高功率条件下蛋白质分子由于空穴效应运动加速,会发生一定程度的聚集,降低了磷脂与蛋白的疏水相互作用,因此复合体系功能性质较差,形成的凝胶硬度及弹性低。样品的SDS-PAGE结果无明显改变,进一步说明复合体系功能性质的改变与蛋白质二级结构变化有关,而与四级结构变化无关。该结果为超声波技术运用于加工专用型大豆蛋白-磷脂复合产品提供了一定的理论依据。
[1] MA L, LI B, HAN F, et al. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk[J]. Food Chemistry, 2015, 173(5): 694-701. DOI:10.1016/ j.foodchem.2014.10.096.
[2] KATO A, OSAKA y, MATSUDOMI N, et al. Changes in the emulsifying and foaming properties of proteins during heat denaturation[J]. Agricultural and Biological Chemistry, 1983, 47(1): 33-37. DOI:10.1080/00021369.1983.10865579.
[3] WANG X S, TANG C H, LI B S, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567. DOI:10.1016/j.foodhyd.2007.01.027.
[4] ZHANG Jinbo, WU Nannan, yANG Xiaoquan, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28(2): 301-312. DOI:10.1016/ j.foodhyd.2012.01.006.
[5] SCURIATTI M, TOMAS M, WANGNER J. Influence of soybean protein isolates-phosphatidycholine interaction on the stability on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 80(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[6] SUNDER A, SCHERZE I, MUSCHIOLIK G. Physico-chemical characteristics of oil-in-water emulsions based on whey proteinphospholipid mixtures[J]. Colloids and Surfaces B: Biointerfaces, 2001, 21(1): 75-85. DOI:10.1016/S0927-7765(01)00186-2.
[7] WOLF W J. Soybean proteins. Their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[8] HU Hao, WU Jiahui, LI-CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids, 2013, 30(2): 647-655. DOI:10.1016/j.foodhyd.2012.08.001.
[9] PREDROCHE J, yUST M M, LQARI H, et al. Brassica carinata protein isolates: chemical composition, protein characterization and improvement of functional properties by protein hydrolysis[J]. Food Chemistry, 2004, 88(3): 337-346. DOI:10.1016/ j.foodchem.2004.01.045.
[10] TANG C H, WANG X y, yANG X Q, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/ j.ijbiomac.2006.06.013.
[11] ETTALIBI M, BARATTI J C. Purif i cation, properties and comparison of invertase, exoinulinases and endoinulinases of Aspergillus fi cuum[J]. Applied Microbiology and Biotechnology, 1987, 26(1): 13-20.
[12] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1988, 952: 115-130.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227(52): 680-685.
[14] 张海华, 朱科学, 周惠明. 超声波对小麦面筋蛋白结构的影响[J]. 中国农业科学, 2010, 43(22): 4687-4693.
[15] 陶蔚孙, 李惟, 姜涌明. 蛋白质分子基础[J]. 北京: 高等教育出版社, 1986: 33-36.
[16] LAKEMOND C M, de JONGH H H, PAQUES M, et al. Gelation of soy glycinin; inf l uence of pH and ionic strength on network structure in relation to protein conformation[J]. Food Hydrocolloids, 2003, 17(3): 365-377. DOI:10.1016/S0268-005X(02)00100-5.
[17] WU Wei, HUA yufei, LIN Qinlu, et al. Effects of oxidative modif i cation on thermal aggregation and gel properties of soy protein by peroxyl radicals[J]. International Journal of Food Science and Technology, 2011, 46(9): 1891-1897. DOI:10.1007/s13197-011-0533-7.
[18] 李云, 华欲飞. 大豆蛋白聚集及共混凝胶性质研究[D]. 无锡: 江南大学, 2007: 27-33.
[19] 王显生, 杨晓泉, 高文瑞, 等. 不同亚基变异类型的大豆分离蛋白凝胶质构特性的研究[J]. 中国粮油学报, 2006, 21(3): 116-121.
[20] ALTING A C, HAMER R J, de KRUIF C G, et al. Number of thiol groups rather than the size of the aggregates determines the hardness of cold set whey protein gels[J]. Food Hydrocolloids, 2003, 17(4): 469-479. DOI:10.1016/S0268-005X(03)00023-7.
[21] HOU D H J, CHANG S K C. Structural characteristics of purified glycinin from soybeans stored under various conditions[J]. Journal of Agricultural and Food Chemistry, 2004, 52(26): 3792-3800. DOI:10.1021/jf049430p.
[22] BARTH A. Infrared spectroscopy of proteins[J]. Biochimica et Biophysica Acta, 2007, 1767: 1073-1101. DOI:10.1016/ j.bbabio.2007.06.004.
[23] NGUYEN J, BALDWIN M A, COHEN F E, et al. Prion protein peptides induce alpha-helix to beta-sheet conformational transitions[J]. Biochemistry, 1995, 34(13): 4186-4192.
[24] LI Chen, HUANG Xingjain, PENG Qiang, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2014, 21(5): 1722-1727. DOI:10.1016/j.ultsonch.2014.03.018.
[25] CHANDRAPALA J, OLIVER C, KENTISH S, et al. Ultrasonics in food processing[J]. Ultrasonics Sonochemistry, 2012, 19(5): 975-983. DOI:10.1016/j.tifs.2010.04.003.
[26] KARKI B, LAMSAL B P, GREWELL D, et al. Functional properties of soy protein isolates produced from ultrasonicated defatted soy fl akes[J]. Journal of the American Oil Chemists’ Society, 2009, 86(10): 1021-1028.
[27] ZHANG Qiuting, TU Zongcai, XIAO Hui, et al. Inf l uence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37. DOI:10.1016/j.fbp.2013.07.006.
[28] yANJUN S, JIANHANG C, SHUWEN Z, et al. Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J]. Journal of Food Engineering, 2014, 124: 11-18. DOI:10.1016/j.jfoodeng.2013.09.013.
[29] THIVILLIERS F, LAURICHESSES E, SAADAOUI H, et al. Thermally induced gelling of oil-in water emulsions comprising partially crystallized droplets: the impact of interfacial crystals[J]. Langmuir, 2008, 24(23): 13364-13375. DOI:10.1021/la802521f.
[30] 毕爽, 齐宝坤, 隋晓楠, 等. 超声处理对黑豆蛋白结构和功能性质的影响[J]. 中国食品学报, 2016, 16(6): 153-160.
Infrared Spectroscopic Analysis of the Effect of Ultrasound-Promoted Aggregation Behavior on Structural and Functional Properties of Soybean Protein-Lecithin System
BI Shuang, ZHANG Qiaozhi, DING Jian, SUI Xiaonan, WANG Zhongjiang, QI Baokun, JIANG Lianzhou, LI Yang*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Soybean protein isolate (SPI) and lecithin can be self-assembled into a complex system at neutral condition (pH 7.0), while the unassembled compounds are still present in the solution. In an effort to achieve maximum complexation between SPI and lecithin and to elucidate the relationship between the functional properties of the complex system and the secondary structure of soybean proteins, we examined the structural variability of the system by Fourier transform infrared spectroscopy and measured its water-holding capacity, oil-holding capacity, gel texture characteristics and functional properties under ultrasound irradiation. The results showed that ultrasonic treatment significantly improved functional properties of the soybean protein-lecithin complex. Water-holding capacity and oil-holding capacity increased firstly then decreased with increasing ultrasonic power after a short irradiation time, but these functional properties continuously decreased with increasing ultrasonic power after a long irradiation time. Fourier transform infrared spectroscopic analysis revealed that the secondary structure of SPI contained a lower content of α-helix and a higher content of β-structure after ultrasonic irradiation at low and medium powers, indicating stronger protein-lecithin interactions. There was a certain relationship between the gel texture characteristics of the complex system and the secondary structure of SPI. The structure of soybean protein-lecithin system could be changed by proper ultrasonic treatment, thus improving its functional properties.
soybean protein; lecithin; functional properties; structural properties; Fourier transform infrared spectroscopy
10.7506/spkx1002-6630-201711004
TS214.9
A
1002-6630(2017)11-0018-07
2016-03-17
国家自然科学基金青年科学基金项目(31301501);国家自然科学基金面上项目(31571876);国家高技术研究发展计划(863计划)项目(2013AA102104);黑龙江省普通本科高等学校青年创新人才培养计划项目(UNPYSCT-2015011)
毕爽(1992-),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:13163436989@163.com
*通信作者:李杨(1979-),男,副教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:liyanghuangyu@163.com

