房水中血管内皮生长因子表达水平与黄斑水肿程度的相关性研究
朱妍 宋愈 黄黎黎
·临床研究·
房水中血管内皮生长因子表达水平与黄斑水肿程度的相关性研究
朱妍 宋愈 黄黎黎
目的 初步探讨房水中血管内皮生长因子(VEGF)水平与黄斑水肿程度是否正相关。方法 58例接受抗VEGF药物治疗的视网膜血管性疾病患者,包括增生期糖尿病视网膜病变(PDR)、视网膜中央静脉阻塞(CRVO)、视网膜分支静脉阻塞(BRVO)、视盘血管炎,相干光断层扫描(OCT)及眼底血管荧光素造影(FFA)检查证实合并黄斑水肿,记录黄斑中心厚度。玻璃体腔注射抗VEGF药物时获取房水。采用VEGFElisa试剂盒,通过酶联免疫吸附法(ELISA)测定房水中VEGF的浓度。统计学分析房水中VEGF水平与黄斑厚度是否存在正相关关系。结果 所有患者黄斑中心厚度在1102~197μm之间,均值(498.175±197.594)μm。患者房水中的VEGF浓度在112.7004~34.9411pg/ml之间,均值(78.971±15.743)pg/ml。统计学分析显示房水中VEGF水平与黄斑中心厚度相关性系数为~0.219,但无统计学意义(P=0.102>0.05)。结论 房水中的VEGF浓度与黄斑中心厚度无明显正相关关系。可能存在多种机制参与黄斑水肿及影响水肿程度,其相互关系有待进一步研究。
血管内皮生长因子;黄斑水肿;视网膜血管性疾病
[临床眼科杂志,2017,25:137]
[J Clin Ophthalmol,2017,25:137]
视网膜血管性疾病是一类常见的致盲性眼病,临床常见的包括糖尿病视网膜病变(DR)、视网膜静脉阻塞(retinal vein occlusion, RVO)、视网膜动脉阻塞(retinal artery occlusion, RAO)、视网膜血管炎等疾病。此类病变,常因视网膜长期缺血、缺氧导致血管内皮生长因子(VEGF)水平明显升高,血管渗漏致黄斑囊样水肿,并导致大量新生血管生成[1]。目前对视网膜血管性疾病导致黄斑水肿的进一步研究揭示, VEGF的大量表达在其中起到关键作用[2-5]。为此,本研究初步探讨房水中VEGF表达水平与黄斑水肿的程度是否存在相关性,现将相关情况报告如下。
资料与方法
一、一般资料
2016年1月至2016年7月在我院眼科接受抗VEGF药物治疗的患者58例(58只眼),其中增生期糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)患者15例(15只眼),女性6例,男性9例,年龄75~53岁;视网膜分支静脉阻塞(branch retinal vein occlusion , BRVO)患者31例(31只眼),女性13例,男性18例,年龄73~41岁;视网膜中央静脉阻塞(central retinal vein occlusion, CRVO)患者11例(11只眼),女性5例,男性6例,年龄68~52岁。视盘血管炎患者1例(1只眼),女性,年龄26岁。
入组患者均根据眼底荧光素血管造影(FFA)及相干光断层成像(OCT)检查,明确诊断为视网膜血管性疾病合并黄斑水肿,且无眼底激光光凝和其他眼部手术史,既往未曾接受任何抗VEGF药物治疗。本次研究经我院伦理委员会讨论批准,所有入选患者均签署知情同意告知书,并能坚持随访。
二、术前检查和相关准备
对所有患者进行常规的视力、眼压、裂隙灯、眼底、眼部B型超声、FFA检查,排除眼部活动性炎症疾病和高眼压者。注药当天进行OCT检查测量黄斑中心厚度。同时进行全身情况如血常规、血糖、心电图、血压等检查,评价是否能耐受玻璃体腔注药手术。注药前使用抗生素滴眼液滴眼5~7 d,每日3次。
三、获取房水方法
使用盐酸奥布卡因眼液表面麻醉患眼。严格按照内眼手术规范进行消毒铺巾。在注射抗VEGF药物前,使用1 ml注射器于颞侧角膜缘穿刺入前房,抽取房水约0.1~0.5 ml,撤针后角膜穿刺口自闭。随后于颞上方角膜缘后3.5~4.0 mm,进行玻璃体腔注药。注射结束后结膜囊内涂抗生素眼膏。使用不含热原和内毒素的离心管收集抽取的房水,以离心半径8.4 cm,15000 r/min离心10 min,保存于~70 ℃低温冰箱中[6]。
四、VEGF检测
1.检测方法和原理:使用人VEGF Elisa 试剂盒(上海博谷生物科技有限公司,产品编号:HEV002) ,通过酶联免疫吸附法测定房水中的VEGF片段。用VEGF 抗体包被微孔板,制成固相载体,实验时依次在微孔板中加入标本及标准品,并加入HRP标记的VEGF抗原,标本及标准品中的抗原和一定量的酶标抗原竞争与固相抗体结合。反复洗涤后加底物TMB显色。TMB在过氧化物酶的催化下转化为蓝色,再用硫酸终止反应,转变成黄色。标本中抗原量越多,结合在固相上的酶标抗原愈少,颜色越浅。颜色的深浅和样品中的VEGF含量呈负相关。采用酶标仪在450 nm波长测定吸光度(OD 值),根据标准曲线,计算测试样品中VEGF 浓度。
2.检测步骤:将房水标本在室温下充分解冻均匀后,以1000×g离心15 min,收集上清液。依照标准品的顺序分别加入100 μl的标准品溶液于空白微孔中,空白对照孔加入100 μl的蒸馏水,其余微孔中加入100 μl的待测样本。标准品组、待测样本组各孔中加入50 μl 的酶标溶液(空白对照孔除外)。酶标板用封板纸密封后,放入湿盒内于37℃恒温孵育1 h。用稀释后的洗涤液注满每孔,静置15~30 s,充分清洗酶标板5次,用吸水纸彻底拍干。各孔加入显色剂A液50 ul后,再加入显色剂B液50ul。25~37 ℃下避光反应10~15 min,加入50ul终止液。在450 nm波长读取各孔的OD值。
五、统计学处理
本研究统计学处理采用SPSS20.0软件进行分析,变量间的相关性采用Person相关。P<0.05有统计学意义。
结 果
一、黄斑中心厚度(μm)

表1 58例患者黄斑中心厚度情况
黄斑中心厚度1102~197μm,均值(498.175±197.594)μm
二、房水中VEGF的浓度(pg/ml)

表2 58例患者房水VEGF浓度情况
房水中的VEGF浓度112.7004~34.9411pg/ml,均值(78.971±15.743)pg/ml
三、统计学分析结果
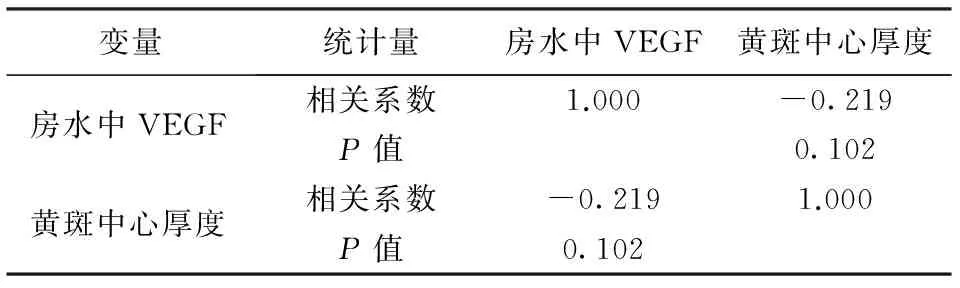
表3 房水中VEGF浓度与黄斑中心厚度
以上结果显示房水中VEGF水平与黄斑中心厚度相关性系数为-0.219,但无统计学意义(P=0.102>0.05)。
讨 论
VEGF是一种分泌型同型二聚体蛋白,它可以促进血管生成,增加血管壁的通透性,加重渗漏[7],是促进血管新生最重要的诱导因子[8]。抗VEGF药物通过抑制VEGF的表达,从而抑制眼部新生血管的形成,降低血管的通透性,减少血管渗漏,使视网膜血管性疾病引起的黄斑水肿减轻,为临床治疗黄斑水肿提供了一种新的方法[9,10]。近年来临床关于VEGF的研究仅限于注药前后黄斑区厚度、最佳矫正视力、眼压等变化的研究,本研究则通过检测房水内VEGF浓度,了解VEGF水平与黄斑水肿程度是否存在正相关关系。
以往的实验结果显示前房内细胞因子与玻璃体中的成正相关[11-14]。Miller等[15]研究猴RVO模型发现,房水中VEGF升高,而血清中未检测出VEGF, 因此认为房水中VEGF来源于缺血视网膜释放到玻璃体中的VEGF,而不可能来源于血液。理论上,玻璃体腔注药的同时,需先抽取少量玻璃体液,维持眼压平衡。但在实际操作中玻璃体液抽取困难,难以获得足量的研究标本。而且可能出现玻璃体积血、视网膜损伤等并发症。而前房穿刺获取房水更安全、有效,对患者的损伤更小,并可以稳定注药后的眼压。故本研究通过前房穿刺获取房水标本进行VEGF检测。
更多的临床试验表明,用抗VEGF药物治疗DR可有效提高视力和减轻黄斑水肿[9,16]。但至今并没有相关文献证实人眼房水中VEGF浓度与黄斑区厚度是否存在一定的相关性。本研究通过对房水中VEGF浓度与注射前黄斑区厚度相关性的分析,发现两者间并不存在明确相关性。分析可能存在以下几个原因。首先,多种细胞因子在视网膜血管性疾病的发病过程中起重要作用。其中包括血管内皮生长因子(VEGF) 、胰岛素样生长因子-1(IGF-1) 、碱性成纤维细胞生长因子(bFGF) 、转化生长因子-β(TGF-β) 、肿瘤坏死因子-α(TNF-α) 及色素上皮衍生因子(PEDF) 等。VEGF是目前已知最直接作用于眼内的新生血管形成因子,它能特异性的作用于视网膜血管内皮细胞。IGF-1可以促进细胞的增生和分化,同时可以激活VEGF,促进新生血管的形成[17]。bFGF可以强力促进血管生成。TGF-β促进内皮细胞黏附、增生及细胞外基质沉积[18],从而促进视网膜血管新生。TNF-α可提高目标细胞对TGF-β、VEGF及IGF-1等的反应性,促进血管新生及成纤维组织增生。PEDF是目前已知的最有效的血管增生抑制剂之一[19]。其次,原发疾病是否得到控制以及病程长短都对眼内VEGF浓度及黄斑水肿程度起到重要影响。伍春荣等[20]认为2型糖尿病并发PDR与糖尿病病程、尿白蛋白含量、空腹血糖、糖化血红蛋白和血压水平增高有关。其中病程、尿白蛋白含量和空腹血糖水平是影响PDR发病的危险因素。眼内本身存在一定程度的VEGF,它在色素上皮细胞(retinalpigmentepithelium,RPE)、神经元、神经胶质细胞、睫状上皮细胞、Müller细胞、内皮细胞均有表达[21]。然而只有增高的VEGF水平可以使视网膜血管产生病理性改变,引起玻璃体积血和视网膜新生血管等[10,21,22]。对于个体VEGF高表达而导致病理性改变的浓度阈值和时间阈值,还缺乏相关研究。
本研究初步显示房水中的VEGF浓度与黄斑中心厚度无明显正相关关系,但由于收集病例数有限,有待长期临床观察和进一步探讨。同时,参与黄斑水肿及影响水肿程度的多种机制仍待进一步研究。
[1]AldebasiYH,RahmaniAH,KhanAA,etal.Theeffectofvascularendothelialgrowthfactorintheprogressionofbladdercanceranddiabeticretinopath.IntJClinExpMed,2013,6:239-251.
[2]DyerKH,SlivaPs,SunJK.Vascularendothelialgrowthfactorgenepolymorphismsandvitreousproteomechangindiabeticretinopathy.SeminOphthalmol,2013,28:347-354.
[3]FunatsuH,YamashitaH,IkedaT,etal.Vitreouslevelsofinterleukin-6andvascularendothelialgrowthfactorarerelatedtodiabeticmacularedema.Ophthalmology,2003,110:1690-1696.
[4]NomaH,FunatsuH,YamasakiM,etal.Pathogenesisofmacularedemawithbranchretinalveinocclusionandintraocularlevelsofvascularendotheliagrowthfactorandinterleukin-6.AmJOphthalmology,2005,140:256-261.
[5] 许建华,刘哲丽,李岩溪,等. 曲安奈德对缺氧条件下恒河猴脉络膜视网膜内皮细胞VEGF表达的影响.国际眼科杂志,2006,6:1053-1055.
[6]CelikN,ScheuerleA,AuffarthGU,etal.Intraocularpharmacokineticsofafliberceptandvascularendothelialgrowthfactor-A.InvestOphthalmolVisSci. 2015,56:5574-5578.
[7]FerraraN,Davis-SmythT.Thebiologyofvascularendothelialgrowthfactor.EndocrRev, 1997,18:4-25.
[8]ZhaoS,HuangL,WuJ,eta1.VascularendothelialgrowthfactorupregulatesexpressionofannexinA2invitroandinamousemodelofischemicretinopathy.MolVis,2009,15:123-1242.
[9]MitchellP,BandelloF,Schmidt-ErfurthU,etal.TheRESTOREstudy:ranibizumabmonotherapyorcombinedwithlaserversuslasermonotherapyfordiabeticmacularedema.Ophthalmology2011,118:615-625.
[10]MillerJW,LeCouterJ,StraussEC,etal.Vascularendothelialgrowthfactorainintraocularvasculardisease.Ophthalmology,2013,120: 106-114.
[11]GaudreaultJ,FeiD,RusitJ,etal.PreclinicalpharmacokineticsofRanibizumab(rhuFabV2)afterasingleintravitrealadministration.InvestOphthalmolVisSci, 2005; 46:726-733.
[12]GaudreaultJ,FeiD,BeyerJC,etal.Pharmacokineticsandretinaldistributionofranibizumab,ahumanizedantibodyfragmentdirectedagainstVEGF-A,followingintravitrealadministrationinrabbits.Retina,2007,27:1260-1266.
[13]FunatsuH,YamashitaH,NomaH,etal.Aqueoushumorlevelsofcytokinesarerelatedtovitreouslevelsandprogressionofdiabeticretinopathyindiabeticpatients.GraefesArcbClinExpOphthalmol,2005,243:3-8.
[14]NomaH,FunatsuH,YamasakiM,etal.Aqueoushumourlevelsofcytokinesarecorrelatedtovitreouslevelsandseverityofmacularoedemainbranchretinalveinocclusion.Eye,2008,22:42-48.
[15]MillerJW,AdamisAP,ShimaDT,etal.Vascularendothelialgrowthfactor/vascularpermeabilityfactoristemporallyandspatiallycorrelatedwithocularangiogenesisinaprimatemodel.AmJPathol, 1994, 145:574-584.
[16]MassinP,BandelloF,GarwegJG,etal.Safetyandefficacyofranibizumabindiabeticmacularedema(RESOLVEstudy):a12-month,randomized,controlled,double-masked,multicenterphaseIIstudy.DiabetesCare, 2010, 33:2399-2405.
[17]KondoT,VicentD,SuzumaK,etal.KnockoutofinsulinandIGF-1receptorsonvascularendothelialcellsprotectsagainstretinalneovascularization.JClinInvest,2003,11: 1835-1842.
[18]TakamuraY,TomomatsuT,KnboE,etal.Roleofthepolyolpathwayinhighglucose-inducedapaptosisofretinalpericytesandproliferationofendothelialcells.InvestOphthalmolVisSei, 2008,49: 3216-3223.
[19]MuH,ZhangXM,LiuJJ,etal.EffectofhighglucoseconcentrationonVEGFandPEDFexpressioninculturedretinalMüllercells.MolBiolRep,2009,36: 2147-2151.
[20] 伍春荣,许樟荣,胡莲娜,等. 2 型糖尿病发生增生性糖尿病视网膜病变的危险因素. 中华眼底病杂志,2003,19:338-340.
[21]GuptaN,MansoorS,SharmaA,etal.DiabeticRetinopathyandVEGF.OpenOphthalmology,2013,7:4-10.
[22]AntonettiDA,BarberAJ,HollingerLA,etal.Vascularendothelialgrowthfactorinducesrapidphosphorylationoftightjunctionproteinsoccludinandzonulaoccluden1.Apotentialmechanismforvascularpermeabilityindiabeticretinopathyandtumors.JBiolChem,1999, 274:23463-23467.
(收稿:2016-09-10)
Relationship between aqueous humor vascular endothelial growth factor level and macular edema
ZhuYan,SongYu,HuangLili.
DepartmentofOphthalmology,NantongFirstPeople’sHospital,Nantong,Jiangsu226001,China
Objective To investigate whether the level of vascular endothelial growth factor (VEGF) in aqueous humor is positively correlated with the degree of macular edema.Methods 58 patients with retinal vascular diseases, including proliferative diabetic retinopathy (PDR), central retinal vein occlusion (CRVO), branch retinal vein occlusion (BRVO) and optic disc vasculitis
anti VEGF treatment. Optical coherence tomography (OCT) and fundus fluorescein angiography (FFA) were used to confirm macular edema. Aqueous humor was obtained during the vitreous cavity injection of anti VEGF drugs. Human vascular endothelial growth factor (VEGF) ELISA kit was used to determine the concentration of VEGF. Statistical analysis of the relationship between VEGF levels in the aqueous humor and macular thickness. Results All patients with macular center thickness between 197~1102 μm, with mean 498.175±197.594 μm. VEGF concentration in the aqueous humor was between 34.9~112.7 pg/ml, mean 79.0±15.7 pg/ml. Statistical analysis showed that the correlation coefficient between VEGF level and macular central thickness was -0.219, but there was no statistical significance (P=0.102>0.05). Conclusions There was no positive correlation between the concentration of VEGF in the aqueous humor and the thickness of the macular. There may be many mechanisms involved in macular edema and the degree of edema, and the relationship between them needs to be further studied.
Vascular endothelial growth factor(VEGF); Macular edema; Retinal vascular disease
10.3969/j.issn.1006-8422.2017.02.012
南通市青年科研基金项目(WQ2015014)
226001江苏省南通市第一人民医院眼科
宋愈(Email:195332410@qq.com)

