棘腹蛙I型干扰素基因的克隆与原核表达
向 勤,罗 洁,吴金芋 ,肖朝新,李 颜,樊汶樵,杨 帆
(重庆文理学院林学与生命科学学院重庆珍稀濒危水产资源保护与开发研究中心,重庆永川402168)
棘腹蛙I型干扰素基因的克隆与原核表达
向 勤,罗 洁,吴金芋 ,肖朝新,李 颜,樊汶樵,杨 帆
(重庆文理学院林学与生命科学学院重庆珍稀濒危水产资源保护与开发研究中心,重庆永川402168)
干扰素(IFN)具有抗病毒、抗肿瘤和免疫调节功能,具备较好的临床应用前景。为了解棘腹蛙干扰素的基因信息,本试验明确了棘腹蛙I型IFN基因ORF编码长度为561 bp,编码的蛋白质含有1个信号肽和103aa的保守功能结构域。遗传进化分析显示,棘腹蛙I型IFN进化相对保守;其蛋白质结构主要由α螺旋构成,细胞表面受体结合能力相对保守。将目的片段装入原核表达载体pET32a并转化BL21(DE3)进行蛋白表达与纯化,获得了预期蛋白。本研究证实了棘腹蛙I型IFN属于相对保守的典型I型干扰素;为后期深入挖掘棘腹蛙IFN的生物学功能、促进广谱抗病毒生物制剂研发提供了参考。
棘腹蛙 ; 干扰素 ; 克隆,序列分析,表达
干扰素(IFN)具有抗病毒、抗肿瘤和免疫调节功能,在机体免疫应答的过程中具有重要意义,也是首个成功应用于临床治疗的基因工程产品[1-2]。根据其抗原活性的差异,可分为Ⅰ、Ⅱ、Ⅲ型;其中,Ⅰ型干扰素为先天免疫细胞分泌的IFN-α、IFN-β和IFN-ω,能够识别位于同一类细胞膜的受体[3];Ⅱ型干扰素仅有IFN-γ,可辅助T细胞释放白细胞介素,若表达异常会导致自身免疫性疾病[4];Ⅲ型干扰素信号转导机制与Ⅰ型干扰素类似,但能够调节NK细胞发挥最佳活性[5-6]。
棘腹蛙(Paaboulengeri),隶属于两栖纲无尾目蛙科棘蛙属,是我国特有的分布于西南地区的土著大型蛙类。本课题组前期对棘腹蛙皮肤转录组进行序列测定,首次获得了其Ⅰ型干扰素的注释信息;通过对棘腹蛙Ⅰ型干扰素基因(IFN-Pb)进行验证、分析和原核表达,为进一步研究其生物学功能提供参考。
1 材料与方法
1.1 试验试剂和耗材 2岁龄健康棘腹蛙,饲养于本实验室两栖动物流水养殖系统。TRIZol、DEPC,购自上海生工生物工程技术服务有限公司;cDNA合成试剂盒、Taq酶、PCR纯化试剂盒,购自Promega公司;凝胶回收试剂盒,购自OMEGA公司;Trans2K DNA Marker、EcoRI和XhoI,购自TaKaRa公司。pET32a与BL21(DE3)为本实验室保存,Ni NTA Beads 为常州天地人和有限公司生产(货号:SA004010);其余培养基及蛋白表达与纯化相关试剂为国产分析纯。
1.2 特异引物的设计 IFN-Pb序列来自于本实验室自测的棘腹蛙皮肤转录组数据,利用Primer 5.0软件设计基因特异性引物(上游引物序列为:5′-GAGCCCACAGAGCAGAACATCCCTT -3′;下游引物序列为:5′-CAGGCTCCTTCATCGCGTCCAATCA -3′)。引物由苏州金唯智生物科技有限公司合成。
1.3 序列验证 小心摘取棘腹蛙皮肤组织,立即放入液氮中。随后按试剂盒说明书抽提总RNA,并利用cDNA合成试剂盒说明书完成cDNA的制备。利用DNATaq酶进行PCR扩增,产物经1%琼脂糖凝胶电泳检测后,利用凝胶回收试剂盒进行回收。阳性产物送苏州金唯智生物科技有限公司测序。
1.4 生物信息学分析 使用SMART,SignalP 3.0,BoxShade Server软件分别进行功能结构域、信号肽、同源比对。在GenBank数据库中检索IFN同源序列,利用ClustalX 1.83进行多重序列比对,随后利用MEGA 5.0软件对IFN家族基因进行邻接法(Neighbor-Joining)构建系统进化树,取1 000次重复检验以估算各分枝的置信值。
1.5 重组表达蛋白的分离及纯化 将1.3中验证后的重组质粒进行亚克隆,引物分别加上EcoRI和XhoI限制性内切酶位点后获得去除信号肽的ORF序列(上下游引物序列分别为:5′-CCGGAATTCCAAACTTGCAAATGGCTCCACCGAA-3′和5′-GGCGAGCTCTTAGTCATGTGACTTCTGTTTTCTC-3′),酶切后装入大肠杆菌表达载体pET32a。
阳性重组表达载体pET32a-IFN-Pb转入大肠杆菌表达感受态细胞BL21(DE3)。经抗性筛选出转化成功的菌株,在37 ℃下用终浓度为0.5mmol/L IPTG进行诱导表达,经SDS-PAGE 检测蛋白表达情况。收集表达后的菌体进行超声破碎,检测蛋白的表达形式,最后根据蛋白的表达形式选择相应的方法通过镍柱亲和层析纯化目的蛋白。
2 结果
2.1IFN-Pb基因的扩增 以棘腹蛙皮肤组织的cDNA为模板,利用RT-PCR方法扩增出了长约650 bp的目的片段(图1)。测序结果如图2显示,IFN-Pb全长序列包含一个ORF为561 bp,共编码186个氨基酸,其中,酸性氨基酸为48个,远远大于碱性氨基酸的数目(27个),暗示该蛋白可能受到选择压力影响。
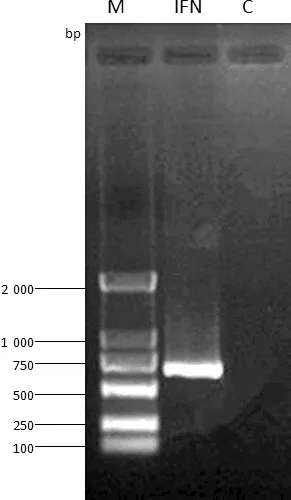
图1 IFN-Pb基因扩增结果
M:Marker; IFN:阳性样品; C:阴性对照

图2 IFN-Pb的基因编码序列及氨基酸序列
2.2IFN-Pb基因的序列相似性分析 对IFN-Pb同源序列构建遗传进化树,结果显示(图3)IFN-Pb与爪蟾单独聚为一枝,与硬骨鱼较为近缘,而与偶蹄类、食肉类、食虫类、啮齿类和灵长类动物亲缘关系较远。其中,与已发布的爪蟾的I型干扰素氨基酸序列同源性为65%,置信值为43%,亲缘关系最近,进一步说明棘腹蛙IFN-Pb的遗传进化相对稳定而保守。
将带有重组质粒pET32a-IFN-Pb的BL21(DE3)在37 ℃、IPTG浓度为0.5 mmol/L时以可溶蛋白和包涵体形式均可表达(图4A)。而后经过Ni NTA Beads亲合层析柱进行目的蛋白的纯化。结果显示(图4B),在浓度为20 mmol/L、60 mmol/L和300 mmol/L咪系统进化树构建所用的物种及GenBank登录号:鼩鼱,XP_012787224.1;东北虎,ALJ03295.1;猎豹,XP_014923397.1;地松鼠,XP_005335983.1;维德尔海豹,XP_006745530.1;太平洋海象,XP_004405712.1;雪貂,XP_004761833.1;刺猬,XP_007533180.1;小耳大婴猴,XP_003782904.1;克氏冕狐猴,XP_012520479.1;川金丝猴,XP_010371759.1;眼镜猴,XP_008069815.1;马,XP_005605088.1;驴,XP_014686764.1;家犬,AEI30864.1;南非爪蟾,AHN05532.1;热带爪蟾,CAO03087.1;虹鳟鱼,ACJ03565.1;大西洋鲑, XP_014059915.1;啮齿目动物包括:XP_001053250.1, XP_003750022.1, CAA25091.1, XP_578466.2, XP_008756430.1, XP 578467.1, XP_003750023.1. 分枝上的数字代表置信值唑均可将IFN-Pb重组蛋白洗脱出来,其中最佳咪唑洗脱浓度为300 mmol/L。

图3 棘腹蛙IFN同源序列的系统进化分析
3 结论
动物领域的新型干扰素研究起步相对较晚,开展两栖类动物干扰素研究对于动物传染病防控和临床医学研究都有一定的促进作用。前期对棘腹蛙的遗传特性研究发现,棘腹蛙种群属于一个单系分支[7-8],在进化过程中相对独立[9-10];其机体免疫系统针对传染性疾病的应答机制并无报道。本试验以棘腹蛙的cDNA为模板,获得了IFN-Pb的全基因序列,其氨基酸序列以酸性氨基酸占主导地位,可能严格遵循自然选择规则。与已知两栖类动物进行多重序列比对结果显示,与已知两栖模式动物相比,该基因在N端存在较多的氨基酸位点突变,C端则明显简缩,但该蛋白含有1个信号肽和103aa的保守功能结构域,暗示该基因的功能相对保守。遗传进化分析进一步说明,棘腹蛙IFN-Pb与爪蟾单独聚为一枝,与硬骨鱼相对近缘,进化地位相对保守。而蛋白质结构预测显示,IFN-Pb与人的干扰素α相似度为31%,主要由α螺旋构成,说明该蛋白尽管与人的同源蛋白存在较大分化;但是,其细胞表面受体结合能力相对保守。
原核表达结果显示,IFN-Pb在大肠杆菌中使用pET32a作为载体进行原核表达时,目的蛋白可以以包涵体沉淀和可溶上清两种形式,可溶上清使用Ni-NTA beads进行纯化,目的蛋白在300 mmol/L咪唑下洗脱得到了高纯度的蛋白,这为进一步对IFN的生物活性研究提供了扎实的基础。

图4 棘腹蛙IFN重组蛋白质表达及纯化的SDS-PAGE分析
注:箭头所示为IFN原核表达重组蛋白
综上所述,棘腹蛙IFN-Pb的结构和功能相对保守,仅N-和C-端序列存在一定分化,原核表达可获得预期蛋白。深入挖掘棘腹蛙的干扰素的生物学功能,将对我们了解该类细胞因子是如何介导的高等动物的免疫系统调节,以及生产广谱抗病毒生物制剂奠定前期基础。
[1] Isaacs A, Lindenmann J. Pillars Article: Virus Interference I The Interferon. Proc R Soc Lond B Biol Sci, 1957, 147: 258-267[J]. J Immunol, 2015, 195(5): 1911-1920.
[2] Isaacs A J.Lindenmann R C Valentine.Pillars Article: Virus Interference. II. Some Properties of Interferon. Proc R Soc Lond B Biol Sci. 1957, 147: 268-273[J]. J Immunol, 2015, 195(5): 1921-1926.
[3] Haus O. The genes of interferons and interferon-related factors: localization and relationships with chromosome aberrations in cancer[J]. Arch Immunol Ther Ex, 2000, 48(2): 95-100.
[4] 金伯泉. 新分子, 新细胞亚群, 新认识-追踪细胞和分子免疫学研究的最新进展[J]. 细胞与分子免疫学杂志, 2008, 24(1): 1-2.
[5] Dumoutier L, Tounsi A, Michiels T,etal. Role of the interleukin (IL)-28 receptor tyrosine residues for antiviral and antiproliferative activity of IL-29/Interferon-λ1 SIMILARITIES WITH TYPE I INTERFERON SIGNALING[J]. J Biol Chem, 2004, 279(31): 32269-32274.
[6] Souza-Fonseca-Guimaraes F, Young A, Mittal D,etal. NK cells require IL-28R for optimal in vivo activity[J]. P Natl Acad Sci, 2015, 112(18): E2376-E2384.
[7] Shan X, Xia Y, Zheng YC,etal. The complete mitochondrial genome ofQuasipaaboulengeri(Anura: Dicroglossidae)[J]. Mitochondr DNA, 2014, 25(2): 83-84.
[8] Xia Y, Hu L, Shan X,etal. Isolation and characterization of eleven polymorphic tetranucleotide microsatellite loci forQuasipaaboulengeri(Anura: Dicroglossidae)[J]. Conserv Genet Resour, 2013, 5(1): 5-7.
[9] Yuan S, Xia Y, Zheng Y,etal. Development of microsatellite markers for the spiny-bellied frog Quasipaa boulengeri (Anura: Dicroglossidae) through transcriptome sequencing[J]. Conserv Genet Resour, 2015, 7(1): 229-231.
[10] Qing L, Xia Y, Zheng Y,etal. A de novo case of floating chromosomal polymorphisms by translocation inQuasipaaboulengeri(Anura, Dicroglossidae)[J]. PloS one, 2012, 7(10): e46163.
Clone and expression of typeⅠinterferon fromPaaboulengeri
XIANG Qin, LUO Jie, WU Jin-yu,XIAO Chao-xin,LI Yan,FAN Wen-qiao,YANG Fan
(College of Forestry & Life Science Chongqing University of Art & Science Chongqing Chongqing Research Centers of Conservation and Development on Rare & Endangered Aquatic Resources, Chongqing 402168, China)
Interferons have the functions of anti-virus, anti-tumor and immune regulation. For better understanding of the interferon encoding genes, we have studied the full length sequence of typeⅠinterferon fromPaaboulengeriby RT-PCR. The results showed that,IFN-Pb, was 649bp long, encoding 186 aa protein and containing a signal peptide and a conserved interferon functional domain, especially consisting of an alpha helix composition and a cell surface receptor binding domain. Besides, phylogenic analysis illustrated that it had a closer relationship withXenopus, and was clustered into aquatic branches. TheIFN-Pbwas inserted into prokaryotic expression vector pET32a(+) by restriction enzyme digestion and then the plasmids was transformed inE.coliBL21(DE3). The protein was induced with IPTG and the fusion protein was purified successfully with Ni-sepahrose.
Paaboulengeri; Interferon ; Cloning ; Sequence analysis ; Expression
YANG Fan
2016-08-10
国家级大学生创新创业训练计划项目(201510642064);重庆市科技计划重点专项(cstc2015jcyjBX0013);重庆市科技计划项目 (cstc2014jcyjA80042);重庆文理学院人才引进项目(R2013LS13, R2014LX07)
向勤(1993-),女,本科生,就读于生物科学专业,E-mail: 846857730@qq.com
杨帆,E-mail: yfan4103@163.com
S947
A
0529-6005(2017)04-0023-04

