细毛羊皮肤毛囊不同发育时期miR-1298-5p靶基因预测及验证
徐 晶,姜怀志,张桂山,孙丽敏,白 曼,项露杰,娄玉杰
(1.长春科技学院动物科学技术学院 , 吉林长春130600 ; 2.吉林农业大学动物科学技术学院 , 吉林长春130118)
细毛羊皮肤毛囊不同发育时期miR-1298-5p靶基因预测及验证
徐 晶1,姜怀志2,张桂山2,孙丽敏2,白 曼2,项露杰2,娄玉杰2
(1.长春科技学院动物科学技术学院 , 吉林长春130600 ; 2.吉林农业大学动物科学技术学院 , 吉林长春130118)
为了探讨miR-1298-5p及其靶基因与细毛羊毛囊生长发育的关系,以细毛羊不同发育时期皮肤毛囊组织为材料,通过生物信息学方法预测miR-1298-5p的靶基因,采用RT-PCR对miR-1298-5p与其潜在靶基因FGF2进行核酸水平相对定量检测,利用Western Blot对潜在靶基因FGF2进行蛋白相对定量检测。生物信息学预测结果表明,FGF2的3′UTR存在miR-1298-5p种子区结合位点;miR-1298-5p在皮肤毛囊不同发育时期呈现差异性表达; miR-1298-5p与其潜在靶基因之间呈现一种负调控趋势,说明miR-1298-5p可能通过负调控FGF2从而调控皮肤毛囊生长发育。表明结合靶基因预测结果、miR-1298-5p在核酸水平表达规律及FGF2在核酸水平表达规律和蛋白表达水平表达规律初步确定FGF2为miR-1298-5p的靶基因。
细毛羊 ; 皮肤毛囊 ; miR-1298-5p ; FGF2
随着高通量测序技术的高速发展,大量新的microRNA被发现,其功能也相继被揭示,它可通过和特异的靶mRNA3′末端的非翻译区互补结合,经过互补程度引发靶mRNA翻译抑制或降解[1],从而干扰靶基因的表达,参与调控细胞发育、分化、凋亡、肿瘤的发生及恶变。本试验中mir-1298-5p通过高通量测序技术获得,其在毛囊发育的3个时期(生长期、退行期、休止期)呈现差异性表达,并在试验中得到了验证。毛囊具有自我更新和周期性生长的特点,其周期性变化决定被毛的生长与脱落,并受多种因子调控,有研究表明,成纤维细胞生长因子(Fibroblast growth factors,FGFs)是潜在的调控因子之一[2]。伴随着毛纤维的周期性生长,毛囊也经历着周期性的循环,即为生长期、退行期和静止期,生长期是毛囊生长发育的活跃阶段,在这个阶段毛纤维细胞开始分裂、生长旺盛、毛根变粗变长、生长快速。退行期是一个短暂的过渡期,发生在生长期结束之后。休止期是毛囊发育“休息”时期,在此期间,毛发脱落、毛囊萎缩、棒状毛被锚定、凋亡终止[3]。本试验以乾华细毛羊为研究对象,通过基因组学和蛋白组学方法验证miR-1298-5p与FGF2之间的关系以及其对毛囊发育时期的调控,从而为揭示毛囊生长发育的分子机制奠定理论基础。
1 材料与方法
1.1 试验动物及样品采集 随机选择不同时期乾华细毛羊3只,年龄为1.5周岁左右,饲养管理条件一致。采集时间分别为2014年9月羊毛生长旺盛期、2015年1月羊毛生长退行期和2015年5月羊毛生长休止期,采集肩部皮肤组织样,取样大小约为1 cm2,液氮保存。
1.2 主要试剂 FGF2兔多克隆抗体(1∶1 500TBST稀释),购自上海生工生物工程技术服务有限公司;辣根过氧化物酶标记羊抗兔IgG(二抗1∶2 000 TBST稀释),购自北京博奥森生物技术有限公司;彩色预染Marker,购自Promega,公司:ECL化学发光试剂盒;购自碧云天生物技术研究所;PVDF膜美国3 M。
1.3 引物设计 根据引物设计原则,利用Primer 5.0软件,分别设计miR-1298-5p和内参U6,FGF2和内参(β-Actin)的定量PCR引物,由上海生工生物工程技术服务有限公司合成。

表1 引物序列
1.4 生物信息学预测和分析 采用miRNA在线靶基因预测软件Targetscan v7.0、miRanda和RNA22等对miR-1298-5p靶基因进行预测,再结合调控皮肤毛囊发育相关通路的文献选出与毛囊发育相关的基因作为候选靶基因。
1.5 实时荧光定量PCR 采用染料法进行,20 μL体系:5×Realtime PCR SYB 10 μL,上游引物F(10 μmol/L) 1 μL,下游引物R(10 μmol/L) 1 μL,CDNA 1 μL,蒸馏水7 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,72 ℃(60 ℃)10 s,72 ℃,15 s(收集荧光),40个循环。1.6 Western Blot 将蛋白样品与5×上样缓冲液以4∶1进行混合,100 ℃水浴8 min,取40 μg总蛋白上样。浓缩胶电压80 V,分离胶电压100 V。半干转膜,140 mA转膜50 min。5%脱脂奶粉室温摇动封闭2 h。一抗(1∶1 500 TBST稀释),4度过夜,二抗(1∶2 000 TBST稀释)室温孵育1 h,ECL化学发光,曝光。用Image-Pro Plus 6.0分析目标条带的积分光密度值(IOD),利用SPSS 17.0对数据进行单因素方差分析。
2 结果与分析
2.1 生物信息学软件预测miR-1298-5p的靶基因 图1为Targetscan预测的miR-1298-5p的靶基因,在FGF23′UTR区有7个碱基互补配对结合的靶位点,说明FGF2基因的表达有可能受到miR-1298-5p的调控。因此,预测FGF2是miR-1298-5p的潜在靶点,可进行下一步验证。

图1 Targetscan预测的miR-1298-5p的靶基因
2.2 miR-1298-5p荧光定量表达 图2可见miR-1298-5p在绵羊毛囊发育生长期到退行期是不断上调的趋势,而退行期到休止期下调,且退行期与休止期之间、生长期与休止期之间的相对表达量差异显著(P<0.05),而退行期高表达,说明miR-1298-5p可能对毛囊从生长期进入退行期的转换起到驱动作用。且miR-1298-5p在细毛羊皮肤毛囊不同发育时期呈现差异性表达。
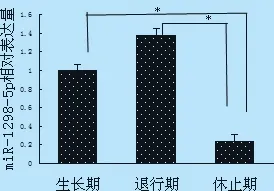
图2 miR-1298-5p相对表达量
2.3 靶基因FGF2荧光定量 图3可见FGF2mRNA从生长期到退行期略有下降,而从退行期到休止期不断上调。且FGF2mRNA的表达量在生长期和休止期、退行期和休止期之间均差异显著(P<0.05)。miR-1298-5p与FGF2荧光定量有负调控趋势,FGF2可能是miR-1298-5p的潜在靶基因。

图3 FGF2mRNA相对表达量
2.4 靶基因FGF2蛋白相对定量 图4可见,FGF2在绵羊毛囊中从生长期到退行期是下调的,而退行期到休止期是不断上调的趋势,且生长期与休止期、退行期与休止期之间的蛋白表达量有显著差异(P<0.05),生长期低表达而休止期高表达,说明FGF2是一个毛囊生长期拮抗剂。miR-1298-5p和 FGF2蛋白定量表达趋势相反,因此,可以初步确定FGF2是miR-1298-5p的潜在靶基因。
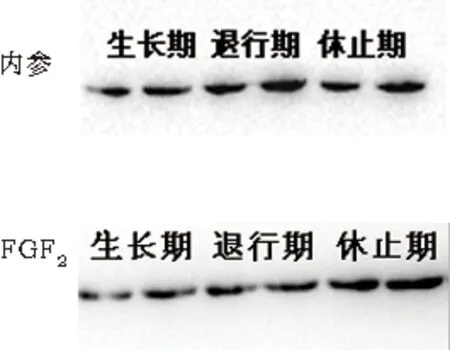

图4 FGF2蛋白相对表达量
3 讨论
miRNA是一类含有20到24个碱基的小分子RNA片段,具有高度的保守性、时序性和组织特异性,能精细地调节着某些特定细胞和组织类型的靶基因表达[4]。miRNA主要是通过与靶基因mRNA 的3′UTR区特异结合引起mRNA 的降解或抑制蛋白的翻译,因此,研究人员逐渐将研究重点转向miRNA与其靶基因的调控关系方面的研究。Wang等人[5]在研究miR-133a及其靶基因对非小细胞肺癌功能时利用过表达miR-133a来验证其与靶基因的互相调控作用。
为研究miR-1298-5p在细毛羊毛囊发育周期中的调控机制,本研究利用了生物信息软件Targetscan、miRanda和miRDB等对miR-1298-5p进行靶基因预测及归类,并通过阅读大量有关毛囊发育的文献,最终筛选出与毛囊发育周期相关的靶基因FGF2。Park等[6]研究发现,FGF2具有促进细胞生长、增殖及抑制细胞凋亡的重要作用,此外FGF2也通过激活相关的信号通路因子进而发挥作用。Kiso等[7]研究发现,FGF2与PDGF在促进体外培养的小鼠真皮乳头细胞增殖和诱导毛发再生方面具有协同作用。Hwang等[8]在研究腺苷对体外培养小鼠触须毛囊真皮乳头作用的过程中发现,腺苷通过提高FGF2与FGF7的表达,从而促进真皮乳头细胞的增殖。Santos[9]等研究发现,绵羊卵泡细胞中存在FGF2,并且10 ng/mL FGF2可抑制体外培养绵羊卵泡细胞凋亡,并促进卵泡细胞的生长。FGF2通过FGFR1间接作用于胎盘血管内皮细胞,诱导激活PI3K/AKT1和ERK1/2信号通路,进而抑制细胞的凋亡[10]。Yang等[11]研究发现,FGF2与FGF10通过激活MAPK信号通路为介质,引起绵羊胎盘滋养层细胞迁移。总之,miRNA及其靶基因对细胞的增殖、分化、凋亡等过程的重要作用正不断的被研究者得到验证。
本试验通过生物学试验方法检测靶基因的mRNA和蛋白质水平来验证FGF2是否为miR-1298-5p的靶基因,结果表明miR-1298-5p和 FGF2荧光定量及蛋白定量均呈相反趋势,因此,可以初步确定FGF2是miR-1298-5p的靶基因。Western Blot试验表明,FGF2在绵羊毛囊中从生长期到退行期是下调的,而退行期到休止期是不断上调的,生长期低表达而休止期高表达,说明FGF2是一个毛囊生长期的拮抗剂。这与Reiter M等的研究一致。Reiter等[12]研究发现,FGF2表达下降时,毛囊意味着进入生长期,FGF2的表达上调,使休止期毛囊的数量增加,意味着毛囊进入休止期。因此,FGF2可能是miR-1298-5p的靶基因,但是否具有调控作用,还需要做Luciferase报告基因试验进一步验证。
[1] MA J B,Huang Y.Post-transcriptional regulation of miRNA biogenesis and functional[J].Front Biol,2010,5(1):32-40.
[2] Takabayashi Y,Nambu M,Ishihara M,etal.Enhanced effect of fibroblast growth factor-2-containing dalteparin/protamine nanoparticles on hair growth[J].Clin Cosmet Investig Dermatol,2016,17(9):127-134.
[3] Stenn K S,Paus R.Controls of hair follicle cycling[J].Physiological Reviews,2001,81(1):449-494.
[4] Carthew,Sontheimer E J.Origins and mechanisms of miRNAs and siRNAs[J].Cell,2009,136(4):642-655.
[5] Wang L K,Hsiao T H,Hong T M,etal.MicroRNA-133a Suppresses Multiple Oncogenic Membrane Receptors and Cell Invasion in Non-Small Cell Lung Carcinoma[J].Plos One,2014,9(5):1-11.[6] Park J,Park O J,Yoon W J,etal.Functional characterization of a novel FGFR2 mutation,E731K,in craniosynostosis[J].Cell Biochem,2012,113:457-464.
[7] Kiso M,Hamazaki T S,Itoh M,etal.Synergistic effect of PDGF and FGF2for cell proliferation and hair inductive activity in murine vibrissal dermal papilla in vitro[J].Dermatol Sci,2015,79(2):110-118.
[8] Hwang K A,Hwang Y L,Lee M H,etal.Adenosine stimulates growth of dermal papilla and lengthens the anagen phase by increasing the cysteine level via fibroblast growth factors 2 and 7 in an organ culture of mouse vibrissae hair follicles[J].Int J Mol Med,2012,29(2):195-201.
[9] Santos J,Menezes V G,Barberino R S,etal. Immunohistochemical localization of fibroblast growth factor-2 in the sheep ovary and its effects on pre-antral follicle apoptosis and development in vitro[J].Reprod Domest Anim,2014,49(3):522-528.
[10] Feng L,Zhang H H,Wang W,etal.Compartmentalizing proximal FGFR1 signaling in ovine placental artery endothelial cell caveolae[J].Biol Reprod,2012,87(2):1-9.
[11] Yang Q E,Giassetti M I.Fibroblast growth factors activate mitogen-activated protein kinase pathways to promote migration in ovine trophoblast cells[J].Reprod,2011,141(5):707-714.
[12] Reiter M,Pfaffl M W,Schonfelder M,etal. Gene expression in hair follicle dermal papilla cells after treatment with stanozolol[J].Biomarker Insights,2009,4:1-8.
Target Gene Prediction and Identification of miR-1298-5p in different stage Skin and Hair Follicles of Fine Wool Sheep
XU Jing1,JIANG Huai-zhi2, ZHANG Gui-shan2,SUN Li-min2,BAI Man2,XIANG Lu-jie2, LOU Yu-jie2
(1.College of Animal Science and Technology,Changchun Sci-Tech University,Changchun 130060,China ; 2.College of Animal Science and Technology,Jilin Agricultural University,Changchun 130118 , China)
To investigate the relationship among hair follicle development,miR-1298-5p, and its target genes in fine wool sheep.Using different stage skin and hair follicles from fine wool sheep as materials,potential target genes of miR-1298-5p were predicted by bioinformatics analysis,and the relative expressions of miR-1298-5p and its potential target gene FGF2were analyzed by RT-PCR and Western blot.Results:Bioinformatics analysis showed that 3′UTR of FGF2had a binding site for mir-1298-5p.And the results showed that both miR-1298-5p and FGF2showed differential expression at different hair follicle development stages. We also showed that miR-1298-5p negatively regulated FGF2expression. All these indicated that miR-1298-5p may play an important role in skin and hair follicle cycling development by regulating FGF2. Based on the target gene prediction and the expression of miR-1298-5p and FGF2,FGF2was preliminarily considered as a target gene of miR-1298-5p.
Fine wool sheep; Skin and hair follicles; MiR-1298-5p; FGF2
LOU Yu-jie
2016-07-04
吉林省教育厅项目(2015566)
徐晶(1981-),女,副教授,博士,研究方向为反刍动物营养与遗传,E-mail:xujing19811007@126.com
娄玉杰,E-mail:904973880@qq.com
Q78
A
0529-6005(2017)04-0020-03

