分子影像学在认知障碍疾病诊断及鉴别诊断中的应用
陈祖芝 梅文丽 任志霞 张元杏 向 莉
郑州大学人民医院神经内科 郑州 450003
分子影像学在认知障碍疾病诊断及鉴别诊断中的应用
陈祖芝 梅文丽 任志霞 张元杏 向 莉△
郑州大学人民医院神经内科 郑州 450003
正电子发射体层成像;认知障碍疾病;葡糖糖代谢率;早期诊断
认知障碍疾病常见包括轻度认知障碍、阿尔茨海默病、额颞叶痴呆、路易体痴呆、血管性痴呆等。在2009年全球有3.56千万认知障碍疾病患者,预计在2030年将达到6.6千万[1],故痴呆的发病率随着年龄增长而成倍的增加[2]。目前国内外较多的应用18F标记的氟代脱氧葡萄糖(18F-FDG)为显像进行PET功能显像[3-4],FDG PET除了是一种肿瘤生物标志物[5-9],对神经变性的痴呆来说也是一种生物标志物[10]。PET对认知障碍疾病的临床评价包括定性分析和定量分析,定性主要是确定是否为认知障碍疾病,而定量主要是确定敏感的界限值,并对痴呆的严重程度进行分期,故体现PET分子成像的重要性。
1 正常脑葡萄糖代谢情况
多项研究表明,正常人脑葡萄糖代谢区域通常是对称正常分布的,特别是在尾状核、丘脑等部位[11]。随着年龄的增长,糖代谢率明显下降的部位是优势半球的颞极、岛叶、前额叶、顶叶及前扣带回等。糖代谢率相对较小的主要是内侧颞极(海马、杏仁核、海马旁回),而壳核、苍白球、丘脑外侧核以及非优势半球的后扣带回、楔前叶、双侧枕颞叶、小脑等很少受影响,相对保留在接近正常的水平[12]。
2 轻度认知障碍与FDG PET研究
轻度认知障碍(mild cognitive impairment,MCI)是发生在阿尔茨海默病(Alzheimer's disease AD)临床前期的一种综合征。MCI患者的脑FDG PET显示在双侧边缘系统(后扣带回、海马旁回)和颞下回的葡萄糖代谢下降[13],与那些已被证实的楔前叶、顶叶、后扣带回葡萄糖代谢下降的AD患者比较,MCI患者的后扣带回下降最明显[14-15]。在Kantarci[16]的研究中,包括25例年龄55~86岁的MCI患者和25例性别匹配、同龄的健康对照者全部进行脑FDG PET影像学检查,将所有人分为2组:正常或MCI(年龄≤73岁)的年轻组和正常或MCI(年龄>73岁)年老组,观察其葡萄糖代谢情况。结果显示,在MCI年轻组中后扣带回、楔前叶、顶叶和颞叶部位的葡萄糖代谢下降程度与AD患者基本一致,但MCI年老组葡萄糖代谢下降主要在额叶和左顶叶。因此,应注意MCI(年龄>73岁)的患者可能存在AD的典型特征——额叶区代谢下降。
从遗传学角度来看,APOE基因已被证实是一个晚发性AD的主要遗传危险因子[17],其中相关的APOEε4等位基因是神经变性病中最显著的危险因子,而APOEε2等位基因可降低AD的发生。一家系中20~39岁认知功能正常但APOEε4基因携带者进行脑FDG PET筛查的研究显示,其双侧后扣带回和其他皮质区域都有明显的葡萄糖代谢率下降[18]。Mosconi等[19]研究37例经脑FDG PET、脑电图和APOEε4基因筛查后诊断为MCI患者,随访1 a后,所有患者均被重新诊断和评估严重程度,结果显示,37例中8例(22%)MCI患者发展为AD,且发展为AD的患者比未发展的顶叶区域的葡萄糖代谢下降得明显。APOEε4阳性患者在前扣带回和额叶区域的代谢也下降。因此,预测APOEε4阳性患者从MCI发展为AD的敏感性100%,特异性90%,准确性94%(P<0.000 5),非常有利于从APOEε4基因阴性者中区分出来。
3 阿尔茨海默病与 FDG PET研究
阿尔茨海默病(AD)在>65岁的痴呆患者中是最常见的原因,占8%~10%[20]。AD患者常隐袭起病,起初常是记忆力障碍,逐渐发展为语言、视空间定向、计算力障碍及精神行为异常,晚期呈四肢强直或屈曲状态。由于AD的确切病因尚未完全明了,至今还未发现真正有效的治疗方法,临床上治疗的目的主要是改善症状,延迟疾病进一步发展,维持残存的脑功能,减少并发症。故目前新药的研发主要是针对AD的病理改变,治疗方面有望得到进一步的改善。
最近,Bloudek[21]研究的一项关于区分轻度AD与非AD的Meta分析,利用各种生物标志物和先进的影像学检查来诊断AD,发现FDG PET的灵敏性及特异性均最高,故其准确性最高。FDG PET、MRI、CT、SPECT和不同脑脊液生物标记物诊断的准确性见表1。
在FDG PET中AD比MCI葡萄糖代谢下降的区域要广泛得多,其中包括边缘系统(海马旁回、后扣带回)、顶叶和少见的枕叶[13]。有研究表明,86%的AD患者在后扣带回有不同程度的葡萄糖代谢下降的情况,颞叶、顶叶和额叶分别是71%、64%和35%[14]。在另外一项诊断AD的研究中,颞顶叶代谢率的敏感性较高(敏感性93.6%,特异性50%,P=0.003),但后扣带回的特异性较高(敏感性74.2%,特异性71.4%,P=0.01),AD比额颞叶痴呆在颞顶叶和后扣带回出现糖代谢率下降更多见(各自所占的比例分别是14.5%、7.2%)[22]。
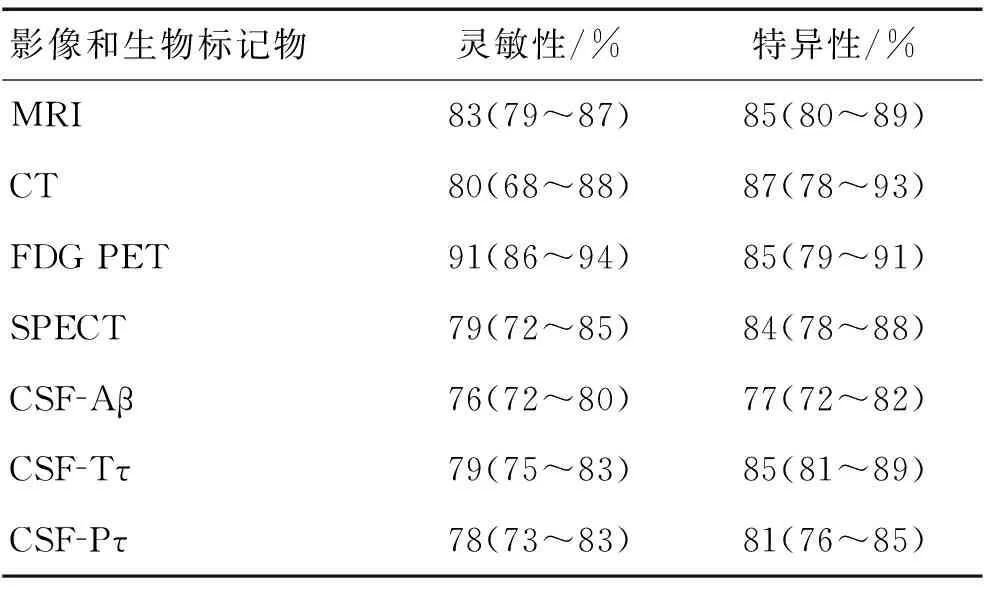
表1 不同影像学形态和脑脊液生物标记物诊断 AD的准确性
注:参考数据的百分比(95%CI),此表是总结以前公布的数据[22]
4 额颞叶痴呆与FDG PET研究
额颞叶痴呆(frontotemporal lobar dementia,FTD)是在<65岁痴呆患者中最常见的形式之一,而>75岁的FTD患者很少见。额颞叶痴呆以前额叶和颞叶前部萎缩为著,以弥漫性额颞叶皮层变性引起的行为和人格改变为贯穿疾病全程的突出特点,不同于AD患者的是记忆相对保留。对于FTD无一种药物治疗是明确有效的,且某些药物还会产生不良反应,应谨慎使用,如胆碱酯酶抑制剂可能加重精神行为异常,会使患者更加易怒和烦躁不安。
FTD患者的FDG PET成像易发现脑葡萄糖代谢下降区域在额叶和前颞叶,但随病情加重,将扩大至额叶、颞叶、皮层下基底节区(壳核和苍白球)及内侧丘脑等区域。虽在FTD患者中前额叶和皮层下结构代谢异常很重要,但也易与AD相混淆[23]。Womack等[22]研究表明,FTD患者的代谢下降量在前扣带回(特异性93.6%,P<0.001)和前颞叶(特异性80.7%,P<0.001)比AD的颞顶叶(特异性50.0%,P=0.003)有更高的特异性和概率比。
5 路易体痴呆与FDG PET研究
路易体痴呆(dementia with Lewy bodies,DLB)常以波动性认知障碍、视幻觉和帕金森病综合征为临床特征。DLB早期易发生记忆力下降,而其锥体外系的症状比帕金森病痴呆更明显。到目前为止仍没有治疗DLB非常有效的药物,只是对症治疗,包括抗胆碱酯酶抑制剂、美金刚和多巴胺。神经安定药因易引起意识障碍、帕金森病症状和自主神经功能紊乱,一般禁止使用。而非典型抗精神病药也需慎用,因可能会产生抗胆碱能的不良反应、锥体外系症状及加重认知功能的损伤。考虑其发病的特点及经典抗精神病药物的禁忌证,故DLB早期诊断是很有必要的。对DLB患者脑FDG PET影像显示葡萄糖代谢下降区域常包括枕叶、后扣带回、颞叶和顶叶[24]。绝大多数DLB患者在发病早期即存在视幻觉,这可能与大脑的初级视觉皮层的糖代谢率下降有关。
6 血管性痴呆与FDG PET研究
血管性痴呆(vascular dementia,VaD)在老年痴呆中是仅次于AD的常见病因,同样在治疗方面无特异性药物,但乙酰胆碱酯酶抑制剂和美金刚对VaD患者的认知方面有一定的改善作用,但其不良反应在上述已讨论[25]。虽CT和MRI能够检测到结构性病变,但不能确定潜在的功能性病理变化,而FDG PET成像可显示散发的病灶和皮层下代谢下降与AD鉴别[26]。虽某些引发痴呆的疾病在PET影像学上具有一定特征,但随着痴呆程度的加重,可出现较大范围的脑糖代谢率下降,甚至全脑糖代谢率下降,此时往往已不具有某种痴呆的典型影像而表现为相似的图像。不同类型痴呆的脑葡萄糖代谢下降典型部位见表2。
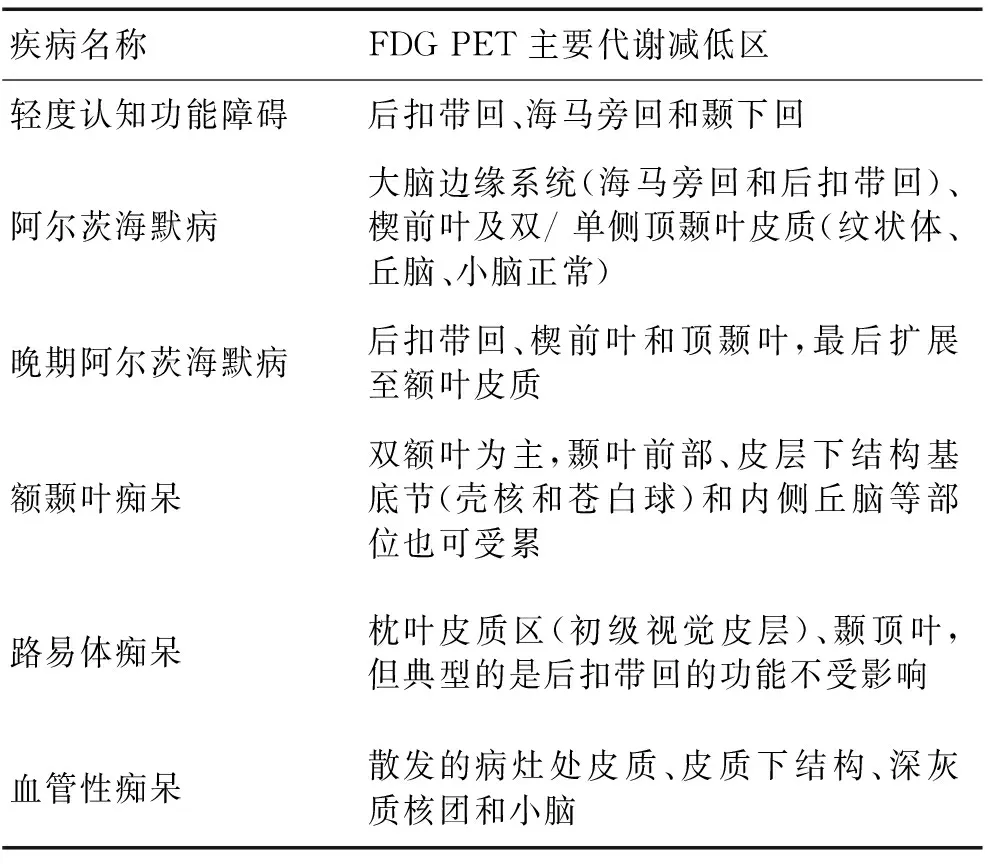
表2 不同痴呆类型的FDG PET特点比较
7 FDG PET应用于老年痴呆的局限性
当患者行PET扫描时头部运动产生运动伪影易影响成像质量,特别是在分析微小脑结构时,头部运动易导致定量分析数据时不准确[27]。
8 结论
目前,对于认知障碍疾病临床诊断无特异明确指标,但特异性强、敏感度高的FDG PET成像在其中显得相对有优势。FDG PET成像在认知障碍疾病中显示特有的代谢分布区域,即对临床医生作出诊断和鉴别诊断提供了有利证据。本文讨论的FDG PET成像可使临床医生明确诊断认知障碍疾病,减少误诊率,同时也可避免患者服用某些禁忌药产生不良反应而使患者病情加重。
[1] Wortmann M.Dementia:a global health priority -highlights from an ADI and World Health Organization report[J].Alzheimers Res Ther,2012,4(5):40.
[2] Breteler MM,Ott A,Hofman A.The new epidemic:frequency of dementia in the Rotterdam Study[J].Haemostasis,1998,28(3-4):117-123.
[3] Newberg A,Alavi A,Reivich M.Determination of regional cerebral function with FDG-PET imaging in neuropsychiatric disorders[J].Semin Nucl Med,2002,32(1):13-34.
[4] Van Heertum RL,Greenstein EA,Tikofsky RS.2-deoxy-fluorglucose-positron emission tomography imaging of the brain:current clinical applications with emphasis on the dementias[J].Semin Nucl Med,2004,34(4):300-312.
[5] Dibble EH,Karantanis D,Mercier G,et al.PET/CT of cancer patients:part 1,pancreatic neoplasms[J].AJR Am J Roentgenol,2012,199(5):952-67.
[6] Paidpally V,Chirindel A,Lam S,et al.FDG-PET/CT imaging biomarkers in head and neck squamous cell carcinoma[J].Imaging Med,2012,4(6):633-647.
[7] Subramaniam RM,Wilcox B,Aubry MC,et al.18F-fluoro-2-deoxy-D-glucose positron emission tomography and positron emission tomography/computed tomograp-hy imaging of malignant pleural mesothelioma[J].J Med Imaging Radiat Oncol,2009,53(2):160-169;quiz 170.
[8] Agarwal A,Chirindel A,Shah BA,et al.Evolving role of FDG PET/CT in multiple myeloma imaging and management[J].AJR Am J Roentgenol,2013,200(4):884-890.
[9] Subramaniam RM,Clayton AC,Karantanis D,et al Hibernoma:18F FDG PET/CT imaging[J].J Thorac Oncol,2007,2(6):569-570.
[10] McKhann GM,Knopman DS,Chertkow H,et al.The diagnosis of dementia due to Alzheimer's disease:recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease[J].Alzheimers Dement,2011,7(3):263-269.
[11] Kuhl DE,Metter EJ,Riege WH,et al.Effects of human aging on patterns of local cerebral glucose utilization determined by the[18F]fluorodeoxyglucose method[J].J Cereb Blood Flow Metab,1982,2(2):163-171.
[12] Kalpouzos G,Chételat G,Baron JC,et al.Voxel-based mapping of brain gray matter volume and glucose metabolism profiles in normal aging[J].Neurobiol Aging,2009,30(1):112-124.
[13] Sanabria-Diaz G,Martínez-Montes E,Melie-Garcia L.Glucose metabolism during resting state reveals abnormal brain networks organization in the Alzheimer's disease and mild cognitive impairment[J].PLoS One,2013,8(7):e68 860.
[14] Del SA,Clerici F,Chiti A,et al.Individual cerebral metabolic deficits in Alzheimer's disease and amnestic mild cognitive impairment:an FDG PET study[J].Eur J Nucl Med Mol Imaging,2008,35(7):1 357-1 366.
[15] Drzezga A,Lautenschlager N,Siebner H,et al.Cerebral metabolic changes accompanying conversion of mild cognitive impairment into Alzheimer's disease:a PET follow-up study[J].Eur J Nucl Med Mol Imaging,2003,30(8):1 104-1 113.
[16] Kantarci K,Senjem ML,Lowe VJ,et al.Effects of age on the glucose metabolic changes in mild cognitive impairment[J].AJNR Am J Neuroradiol,2010,31(7):1 247-1 253.
[17] Holtzman DM,Herz J,Bu G.Apolipoprotein E and apolipoprotein E receptors:normal biology and roles in Alzheimer disease[J].Cold Spring Harb Perspect Med,2012,2(3):a006312.
[18] Reiman EM,Chen K,Alexander GE,et al.Functional brain abnormalities in young adults at genetic risk for late-onset Alzheimer's dementia[J].Proc Natl Acad Sci U S A,2004,101(1):284-289.
[19] Mosconi L,Perani D,Sorbi S,et al.MCI conversion to dementia and the APOE genotype:a prediction study with FDG-PET[J].Neurology,2004,63(12):2 332-2 340.
[20] Gauthier S,Reisberg B,Zaudig M,et al.Mild cognitive impairment[J].Lancet,2006,367(9 518):1 262-1 270.
[21] Bloudek LM,Spackman DE,Blankenburg M,et al.Review and meta-analysis of biomarkers and diagnostic imaging in Alzheimer's disease[J].J Alzheimers Dis,2011,26(4):627-645.
[22] Womack KB,Diaz-Arrastia R,Aizenstein HJ,et al.Temporoparietal hypometabolism in frontotemporal lobar degeneration and associated imaging diagnostic errors[J].Arch Neurol,2011,68(3):329-337.
[23] Jeong Y,Cho SS,Park JM,et al.18F-FDG PET findings in frontotemporal dementia:an SPM analysis of 29 patients[J].J Nucl Med,2005,46(2):233-239.
[24] Haller S,Garibotto V,Kövari E,et al.Neuroimaging of dementia in 2013:what radiologists need to know[J].Eur Radiol,2013,23(12):3 393-3 404.
[25] Perneczky R,Drzezga A,Boecker H,et al.Right prefrontal hypometabolism predicts delusions in dementia with Lewy bodies[J].Neurobiol Aging,2009,30(9): 1 420-1 429.
[26] Gilman S,Koeppe RA,Little R,et al.Differentiation of Alzheimer's disease from dementia with Lewy bodies utilizing positron emission tomography with[18F]fluorodeoxyglucose and neuropsychological testing[J].Exp Neurol,2005,191(Suppl 1):S95-S103.
[27] Baskys A,Cheng JX.Pharmacological prevention and treatment of vascular dementia:approaches and perspectives[J].Exp Gerontol,2012,47(11):887-891.
(收稿2016-12-20)
河南省科技厅重点科技攻关计划项目(092102310084)
R742
A
1673-5110(2017)05-0136-04
△通讯作者:向莉,女,博士,研究生导师,主任医师,E-mail:yiyuan20161023@126.com

