血清25-羟维生素D缺乏与脑小血管病的相关性研究
李世容 刘 蕊 陈 岚 曾 雯 胡 晓
贵州省人民医院神经内科 贵阳 550002
血清25-羟维生素D缺乏与脑小血管病的相关性研究
李世容 刘 蕊 陈 岚 曾 雯 胡 晓△
贵州省人民医院神经内科 贵阳 550002
目的 探讨血清25-羟维生素D[25-(OH)-D]缺乏与脑小血管病(cerebral small vessel disease,CSVD)的关系。方法 选取2015-01—2016-04于我院神经内科住院治疗的脑小血管病患者150例为观察组,150例正常体检者为对照组,收集2组患者基线资料,测定血清25-(OH)-D水平、钙、磷及碱性磷酸酶水平。采用单因素Logistic回归和多因素Logistic回归进行数据分析。结果 单因素Logistic回归分析显示,高血压OR=0.442,95%CI0.278~0.703,P<0.001;糖尿病OR=0.342,95%CI0.209~0.520,P<0.001;25(OH)D缺乏OR=0.231,95%CI0.139~0.383,P=0.032。多因素Logistic回归分析显示,高血压OR=0.305,95%CI0.266~0.531,P<0.001;糖尿病OR=0.291,95%CI0.108~0.506,P<0.001;25(OH)D缺乏OR=0.225,95%CI0.139~0.383,P=0.032。结论 25-(OH)-D缺乏可能为CSVD事件发生的危险因素之一。
脑小血管病;25-(OH)-D;危险因素
脑小血管病(cerebral small vessel disease,CSVD)主要指脑部小血管病变引起的疾病,临床上多指脑小动脉及微动脉病变。血清25-(OH)-D不仅发挥经典的骨骼生物效应,调节机体钙磷水平,还与心脑血管疾病相关,其中25-(OH)-D水平与血管危险因素、血管疾病和认知功能障碍呈密切相关[1-2]。本研究旨在通过检测CSVD患者和正常体检者血清25-(OH)-D水平,探讨25-(OH)-D缺乏与CSVD之间的相关性。
1 资料与方法
1.1 一般资料 选取2015-01—2016-04在贵州省人民医院神经内科住院治疗的CSVD患者150例为观察组,选取同期我院150例健康体检者为对照组。收集2组患者性别、平均年龄、高血压、糖尿病、高胆固醇血症、吸烟等基线资料。本研究通过本院伦理委员会审查。
1.2 纳入标准 CSVD诊断标准符合第4届全国脑血管病学术会议制定的各类脑血管疾病诊断要点;CSVD患者发病7 d内入院;CSVD患者均经头颅CT或MRI确诊。
1.3 排除标准 神志不清,合并神经类疾病;患甲状腺及甲状旁腺疾病;合并重要器官病变,如肝肾功损害、心脏疾病等;近期服用过维生素制剂、钙剂;长期口服糖皮质激素等。
1.4 检测方法 所有研究对象均晨起空腹抽血,分离血清并检测25-(OH)-D、钙、磷、碱性磷酸酶水平。应用ELISA法使用人25-(OH)-D ELISA试剂盒(德国CST公司)测定血清25-(OH)-D含量,当检测值 ≤ 20 ng/mL 定为25-(OH)-D 缺乏。
1.5 统计学分析 采用统计软件SPSS 19.0进行数据分析。对性别、年龄、高血压、糖尿病、高胆固醇血症、吸烟及25-(OH)-D缺乏进行分析,先行单因素分析,先后行多因素Logistic回归分析,以减少各因变量之间交互效应对结果的影响。计算检验OR值、95%CI和P值。P<0.05表示差异有统计学意义。
2 结果
2.1 2组一般资料比较 观察组血清钙、磷水平低于对照组,碱性磷酸酶水平高于对照组。观察组高血压、糖尿病及25-(OH)-D缺乏事件发生均高于对照组(P<0.05)。见表1。
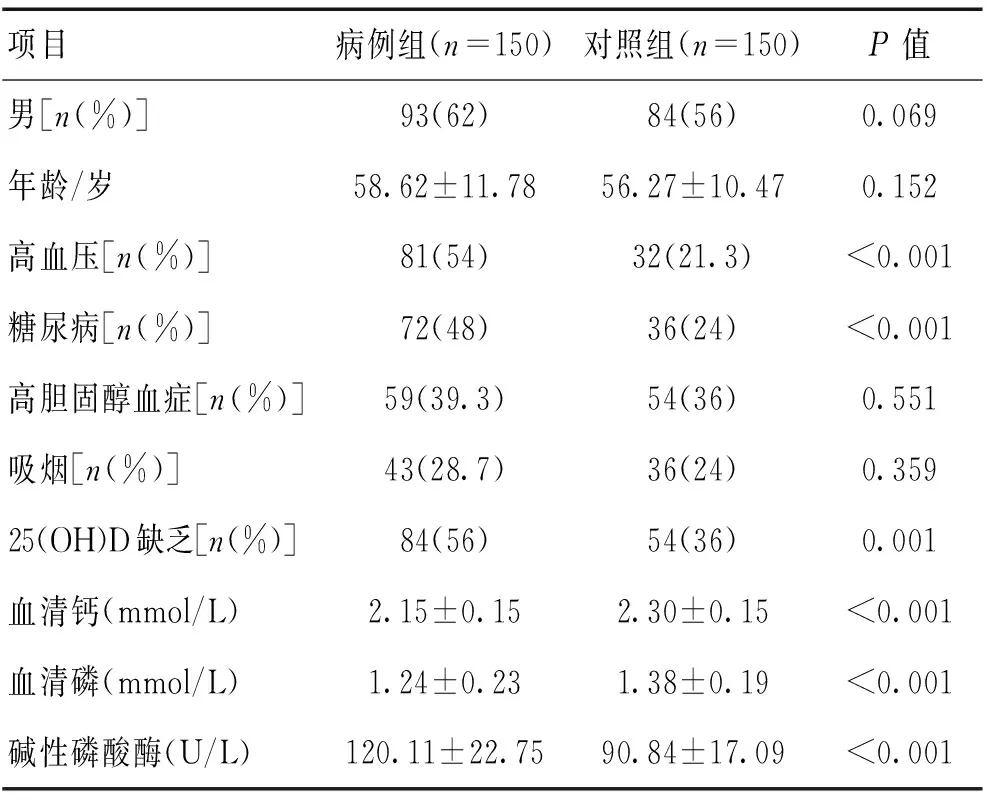
表1 2组临床资料及血清25(OH)D、钙、磷、碱性 磷酸酶水平比较
2.2 CSVD危险因素的单因素Logistic回归分析 单因素Logistic回归分析显示,高血压OR=0.442,95%CI0.278~0.703,P<0.001;糖尿病OR=0.342,95%CI0.209~0.520,P<0.001;25(OH)D缺乏OR=0.231,95%CI0.139~0.383,P=0.032。单因素Logistic回归分析提示,高血压、糖尿病、25-(OH)-D缺乏为CSVD危险因素。见表2。
2.3 CSVD危险因素的多因素Logistic回归分析 多因素Logistic回归分析显示,高血压OR=0.305,95%CI0.266~0.531,P<0.001;糖尿病OR=0.291,95%CI0.108~0.506,P<0.001;25(OH)D缺乏OR=0.225,95%CI0.139~0.383,P=0.032。多因素Logistic回归分析矫正排除各因素互相影响后,提示高血压、糖尿病、25-(OH)-D缺乏为CSVD危险因素。见表3。

表2 CSVD危险因素的单因素Logistic回归分析
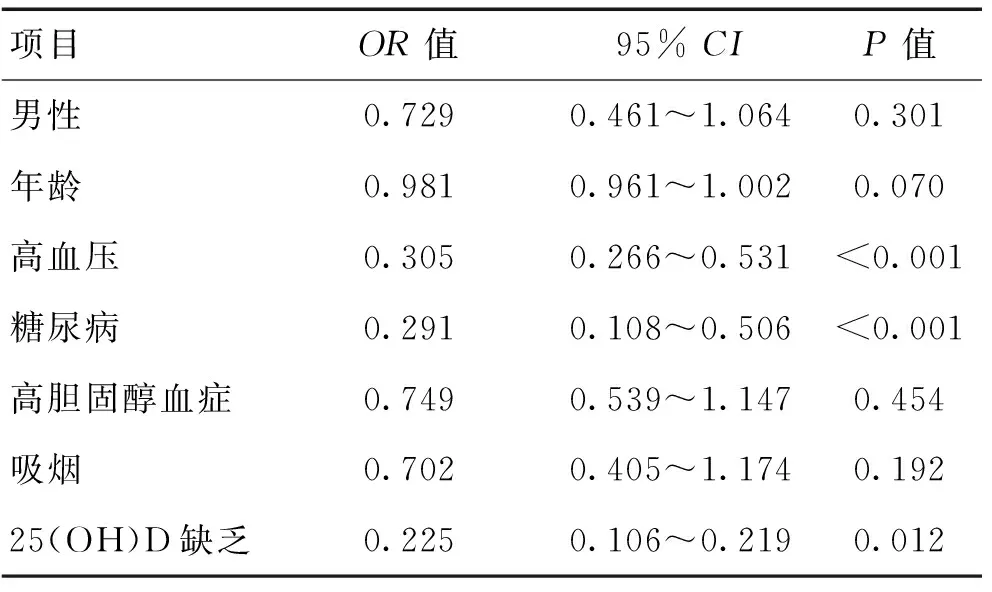
表3 CSVD危险因素的多因素Logistic回归分析
3 讨论
CSVD通常是指各种原因引起脑内小的穿支动脉和小动脉(直径40~200 μm)、毛细血管和小静脉发生病变[1],故CSVD又称为脑微小血管疾病[2]。我国CSVD发病率为17.2%[3]。认知障碍是CSVD最常见和最重要的临床表现,包括执行功能、注意力、记忆力、日常生活功能的损害,其中以执行功能损害最为常见。CSVD影像学主要以下几种表现:腔隙性梗死(lacunes)、脑白质病变(white matter hyperintensities,WMH)、脑微出血(cerebral microbleed,CMB)、血管周围间隙扩大及脑萎缩等[4]。这些影像学表现可单独或同时存在,并非CSVD唯一特有表现,但其存在高度提示CSVD发生[5]。CSVD是引起老年人认知、情感功能下降的重要原因[6],因可能导致血管性认知功能障碍或痴呆,这将严重降低老年人的生活质量并加重家庭及社会的经济负担[7]。
目前,国内关于CSVD的认识很局限,对CSVD危险因素的相关报道甚少。本研究主要初步探索25-(OH)-D 与CSVD事件发生的相关性。研究表明,影响CSVD的危险因素包括年龄、高血压、冠心病、高同型半胱氨酸血症、糖尿病、吸烟、饮酒等[8-9]。目前,高龄、高血压、糖尿病已被证实为CSVD事件的独立危险因素。本研究发现,高血压、糖尿病、25-(OH)-D缺乏是CSVD发生的独立危险因素,这也是国内首次关于25-(OH)-D缺乏与CSVD发生的相关报道,该结果与Chung等[10]研究一致,不同之处在于Chung仅以CSVD组患者为研究对象,而本研究同时观察了同期患者和健康体检者为研究对象,较前者更完善。目前,国外大量研究表明25-(OH)-D缺乏是脑卒中TOAST分型中脑大动脉粥样硬化性卒中及心源性脑栓塞发生的高危因素,但其与脑小管疾病事件关系的研究报道较少。Bajaj等[11]研究发现,25-(OH)-D缺乏的男性脑卒中发生率较高。Atif等[12]研究发现,对短暂性大脑中动脉阻塞的SD大鼠行黄体酮联合维生素D治疗,较采用单一黄体酮治疗更有效,其机制可能与BDNF/TrkB/Erk1/2信号通路的激活有关,有待进一步研究证实。研究中,除高血压、糖尿病、25-(OH)-D外,其余危险因素均无相关性,不能除外由于样本量较少或各因素相互作用的关系,为进一步研究其他相关因素与CSVD的相关性,尚需更大样本的临床研究。
大量研究表明,CSVD的发生与多种老年慢性病相关[13-14],在临床工作中,对发生CSVD的患者,可通过检查患者CSVD事件发生的危险因素,如高血压、糖尿病、25-(OH)-D等,便于更好地指导临床CSVD的治疗。进行常规体检时,除进行脑血管常见危险因素检查外,可增加血清25-(OH)-D水平检测,进一步评估患者发生CSVD的风险,对这些因素进行早期干预,从而延缓CSVD的发生、发展。
综上所述,CSVD是多种危险因素共同作用的结果,虽CSVD的诊断手段主要为神经影像学,无系统完善的诊疗方案,但脑血管疾病重在预防,故积极控制危险因素对该病的发生、发展具有重要意义。
[1] Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging[J].Lancet Neurol,2013,12(5):483-497.
[2] Schmidtke K,Hull M.Cerebral small vessel disease:how does it progress[J].J Neurol Sci,2005,229-230:13-20.
[3] Xu J,Liu L,Wang Y,et al.TOAST subtypes:Its inf-luence upon doctors' decisions of antihypertensive prescription at discharge for ischemic stroke patients[J].Patient Prefer Adherence,2012,6:911-914.
[4] Pantoni L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J].Lancet Neurol,2010,9(7):689-701.
[5] 付建辉,赵辉.脑小血管病研究进展[J].中华脑血管病杂志,2011,5(5):355-361.
[6] 张丽莉.脑小血管疾病[J].内科理论与实践,2013, 8(5):301-307.
[7] Debette S,Markus HS.The clinical importance of white matter hyperintensities on brain magnetic resonance imaging:systematic review and meta-analysis[J].BMJ,2010,341:C3 666.
[8] 陈娜,陆连生,宋巧,等.脑微血管病变致缺血性卒中的危险因素、临床表现的相关分析[J].河北医药,2014, 36(24):3 732-3 734.
[9] 刘寒,孙中武.代谢综合征在脑小血管病发病机制中的作用[J].中华全科医学,2013,11(11):1 772-1 774.
[10] Chung PW,Park KY,Kim JM,et al.25-Hydroxyvitamin D status is associated with chronic cerebral small vessel disease[J].Stroke,2015,46(1):248-251.
[11] Bajaj A,Stone KL,Peters K,et al.Circulating Vitamin D,Supplement Use,and Cardiovascular Disease Risk:The MrOS Sleep Study[J].J Clin Endocrinol Metab,2014,99(9):3 256-3 262.
[12] Atif F,Yousuf S,Sayeed I,et al.Combination treatment with progesterone and vitamin D hormone is more effective than monotherapy in ischemic stroke:the role of BDNF/TrkB/Erk1/2 signaling in neuroprotection[J].Neuropharmacology,2013,4(67):78-87.
[13] 付建辉,赵辉.脑小血管病研究进展[J].中华脑血管病杂志,2011,5(5):355-359.
[14] 孙芳,郭会映,严斌,等.高龄脑小血管病患者重度脑白质损害和认知功能下降风险的相关分析[J].医学研究生学报,2014,27(4):398-400.
(收稿2016-11-07)
The correlation research of the lack of 25-(OH)-D and cerebral small vessel disease
LiShirong,LiuRui,ChenLan,ZengWen,HuXiao
DepartmentofNeurology,thePeople’sHospitalofGuizhouProvince,Guiyang550002,China
Objective To explore the relationship between serum 25-(OH)-D deficiency and cerebral small vessel disease(CSVD).Methods A total of 150 CSVD cases from January 2015 to April 2016 were observed as observation group and 150 cases who
normal physical examination were selected as control group.After collecting the baseline data,we measured the levels of serum 25-(OH)-D,calcium,phosphorus and alkaline phosphatase.All figures were analyzed by univariate and multi-factor Logistic regression.Results Univariate Logistic regression analysis revealed that hypertension(OR=0.442,95%CI:0.278 to 0.703,P<0.001),diabetes(OR=0.342,95%CI:0.209 to 0.520,P<0.001)and 25-(OH)-D deficiency(OR=0.231,95%CI:0.139 to 0.383,P=0.032) were significant different.Multivariate Logistic regression analysis revealed that hypertension(OR=0.305,95%CI:0.266 to 0.531,P<0.001),diabetes(OR=0.291,95%CI:0.108 to 0.506,P<0.001)and 25-(OH)-D deficiency(OR=0.225,95%CI:0.139 to 0.383,P=0.032) were closely correlated with CSVD.Conclusion The lack of 25-(OH)-D may be a risk factor for CSVD.
Cerebral small vessel disease;25-(OH)-D;Risk factor
贵州省科学技术基金 黔科合[2012]2231号
R743
A
1673-5110(2017)05-0020-04
△通讯作者:胡晓,E-mail:natasan520@163.com

