稳定表达绿色荧光蛋白的HEK293T细胞的构建
阳小飞,余 意,刘孟雪,荣 伊,林显光
(中南民族大学 生物医学工程学院,脑认知国家民委重点实验室,医学信息分析及肿瘤诊疗湖北省重点实验室,膜离子通道与药物研发实验室,武汉430074 )
稳定表达绿色荧光蛋白的HEK293T细胞的构建
阳小飞,余 意,刘孟雪,荣 伊,林显光*
(中南民族大学 生物医学工程学院,脑认知国家民委重点实验室,医学信息分析及肿瘤诊疗湖北省重点实验室,膜离子通道与药物研发实验室,武汉430074 )
为探讨绿色荧光蛋白(GFP)在传代细胞中是否能随细胞的增殖稳定表达,构建稳定表达GFP的细胞系统,选取HEK293T细胞,使用第三代慢病毒包装系统,包装表达了GFP的慢病毒,然后用包装好的慢病毒去侵染HEK293T细胞. 通过细胞成像技术统计了不同代数细胞的荧光强弱并计算细胞形态大小,利用膜片钳记录了HEK293T细胞的电流-电压(I-V)曲线.实验结果显示,GFP能随细胞的增殖稳定表达,被慢病毒侵染后的细胞的形态及基本电生理活动与正常细胞相比,没有产生显著差异.
绿色荧光蛋白;HEK293T细胞;慢病毒
绿色荧光蛋白(GFP)是在水母体内发现的一种荧光蛋白. 经过改造后GFP其结构与光学性质更加稳定,在488 nm的激发光下会发出绿色荧光[1]. 由于其极强的稳定性,在细胞内蛋白的定位、基因表达的监测等实验中发挥了巨大的作用.
慢病毒载体是对HIV-1进行改造后得到的慢病毒载体[2,3],使用慢病毒载体可以有效地将外源shRNA或者基因在宿主细胞内表达[4]. 将慢病毒的几个核心元件(RRE、REV和VSVG)同时转染到体外培养的人胚肾细胞HEK293T中,元件表达后得到的蛋白会互相识别,组装成具有侵染能力的慢病毒[5-7]. HEK293T细胞生物学性质稳定,且表达5型腺病毒E1A蛋白和SV40大T抗原,转染效率高[8-10].
选取HEK293T细胞作为宿主细胞. 通过慢病毒侵染的方法将GFP导入HEK293T细胞,侵染后的HEK293T细胞(HEK293T- GFP)在488 nm的激发光下会发出绿色荧光[11]。为探究GFP是否能随传代细胞的增殖稳定表达,本实验拟通过将GFP导入HEK293T细胞,记录细胞不同代数细胞的荧光强度来判断GFP是否能随细胞的增殖稳定表达。
1 材料与方法
1.1 材料
DMEM培养基、NaHCO3、牛血清(FBS),Na2HPO4、NaCl、KCl、CaCl2·2H2O、MgCl2·6H2O、HEPES、Glucose、MgATP、Na2GTP、EGTA和胰蛋白酶购于Sigma公司.
1.2 仪器
二氧化碳细胞培养箱(Thermo Fisher),显微镜、倒置荧光显微镜(奥林巴斯),超净工作台(苏州净化),激光共聚焦显微镜(尼康),膜片钳放大器系统(HEKA),微量移液器(Thermo).
1.3 方法
1.3.1 溶液配制
细胞培养基:用DMEM、NaHCO3和FBS配制细胞培养基. 电生理记录外液:在烧杯中依次加入8.42 g NaCl,0.75 g KCl,0.294 g CaCl2, 0.2033 g MgCl2,2.383 g HEPES ,1.8016 g Glucose,然后定容至1 L,调整pH到7.4. 电生理记录内液:在烧杯中依次加入20 μL (5 mol母液)的NaCl,0.2162 g KCl,0.0425224 g MgATP ,100 μL (60 mmol 母液)的Na2GTP,0.04766 g HEPES,0.038035 g EGTA,定容至20 mL,调整pH到7.4.
1.3.2 HEK293T细胞的传代培养
当培养皿中的细胞覆盖率达到80%左右时对细胞进行传代. 将原有的培养基吸掉,加入PBS清洗一遍,然后用胰蛋白酶消化,加入含血清的培养基终止消化. 300 r/min离心2 min. 去上清液,加入新的培养基重悬细胞,将重悬的细胞加入培养皿中,放入培养箱中培养.
1.3.3 慢病毒包装
先在1.5 mL无菌EP管中加入100 mL Opti-MEM;再依次加入1.5 μg GFP质粒,1 μg RRE,1 μg REV,0.5 μg VSVG,12 μg PEI,震荡混匀;室温静置30 min,将EP管中的液体加入培养有HEK293T细胞的直径3.5 cm培养皿中;48 h后,收集培养基上清液,3000 r/min离心,所得上清液即为慢病毒原液.
1.3.4 慢病毒感染HEK293T细胞(感染复数为20)
将离心后的慢病毒原液加入事先准备好的HEK293T细胞中,48 h后观察荧光.
1.3.5 全细胞记录
电极拉制仪拉制玻璃电极,电极入液前给一个正压,避免电极尖端被污染. 电极加入内液后的入液电阻3~5 MΩ. 在显微镜下找到电极,然后将电极慢慢移到细胞上方,缓慢靠近细胞,当入液电阻上升0.2~0.3 MΩ时,不再下降电极,将嵌电压改为-10 V,打开气阀给一个负压,立刻关闭气阀. 该嵌电压为-70 V,电阻继续上升,当上升到100 Ω时打开气阀,电阻逐渐上升至G 欧,补偿电容,给一个负压吸破细胞膜,然后补偿细胞膜电容与串联电阻,稳定后记录信号[11].
1.4 数据处理
用激光共聚焦显微镜对细胞进行拍照, Image J对照片进行分析,获得图片中单个细胞面积大小以及过表达GFP后细胞的荧光强度. 用HEKA EPC10进行电生理记录,用Pclamp 10.2软件分析并用Igor Pro Folder作图;GraphPad Prism 5.01 软件对数据进行统计学分析. 统计结果进行t检验,独立重复4次.
2 结果
2.1 荧光强度随时间的变化
在慢病毒感染表达GFP的 HEK293T细胞中,随着GFP在HEK293T细胞中表达量的增加,荧光强度经历一个由弱变强的过程,最后达到一个较稳定的值,且随着时间的延长,观察到的荧光强度不会随着HEK293T细胞的增殖而减弱. 表明经慢病毒导入HEK293T细胞的GFP能随细胞的增殖稳定表达,在细胞增殖的过程中基本不会丢失(图1).
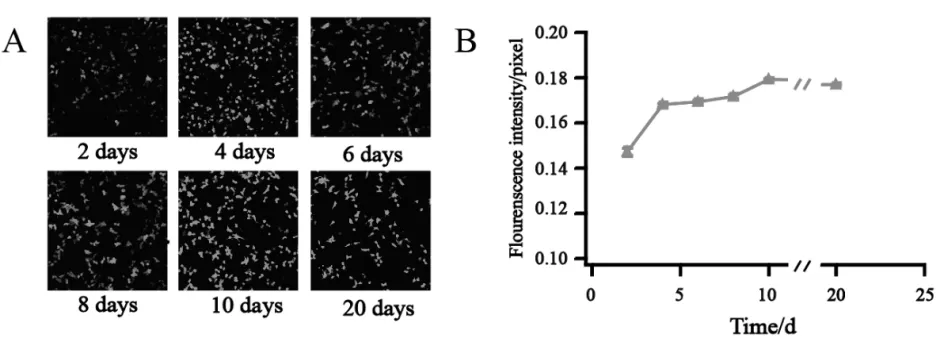
A) 在HEK293T细胞中GFP表达; B) A图荧光强度的统计结果(每个时间段统计150个细胞)图1 GFP荧光强度随时间的变化Fig.1 GFP fluorescence intensity after injection
2.2 细胞大小分析
慢病毒感染HEK293T细胞第8 d用激光共聚焦显微镜对细胞进行拍照,统计细胞面积大小并进行t检验.结果如图2和表1所示.t检验结果显示被慢病毒感染后的细胞面积与正常细胞相比,差异不明显. 因此,慢病毒的感染不会影响细胞大小.

A) 正常HEK293T细胞与表达GFP的HEK293T细胞图片;B) 正常HEK293T细胞与表达GFP的HEK293T细胞的面积统计结果(p>0.05)图2 慢病毒侵染不影响细胞大小Fig.2 Lentivirus infection did not affect the size of HEK293T cells

Conditionarea/μm2Controlgroup890.902±6.436Experimentalgroup896.076±6.587
2.3 电生理分析
为了检验慢病毒感染对HEK293T细胞的电生理是否有影响,利用膜片钳技术,在全细胞记录模式下,分别记录正常HEK293T细胞与经慢病毒感染后的HEK293T细胞的I-V曲线.结果表明电流表现出电压依赖性,随着电压的阶跃上升记录到的电流也随之上升(图3). 实验组细胞在不同刺激下测得的电流与对照组细胞相比,统计结果显示差异不明显.

图3 实验组与对照组细胞的I-V曲线(n=9)Fig.3 The I-V curves of the experimental group and the control group(n=9)
表2记录了不同阶跃刺激下实验组与对照组所测得的平均电流幅值,结果显示,随着刺激电压的增加,所测得的电流随之增加,将不同刺激电压下实验组与对照组所测得的平均电流幅值进行了t检验.

表2 不同刺激电压下记录的电流均值
注:-,p>0.05
3 讨论
GFP常用作示踪工具,在反转录病毒与腺病毒载体转移系统中可以很好地显示转移效率. 在体外成功包装的慢病毒具有一定感染能力. 慢病毒在感染宿主细胞后可以将基因有效地整合到宿主细胞的染色体中,随着宿主细胞染色体的复制而复制. 基于慢病毒的这一特性,可以用慢病毒感染传代细胞来构建细胞系[12]. 有报道显示,在慢病毒表达 GFP 感染兔脂肪干细胞(rADSCs)的实验中,当感染复数(MOI)值为50、100时,GFP慢病毒对 rADSCs 的生长无明显影响. 在慢病毒载体介导的增强型绿色荧光蛋白(LV-EGFP)侵染大鼠角膜的实验显示,用慢病毒离体感染角膜,对角膜进行7 d培养后,观察到角膜内皮细胞生长正常,未发现角膜出现皱缩、变形及缺失等病理改变[14,15].
本文利用慢病毒感染的方法将GFP导入HEK293T细胞,通过统计不同代数细胞的荧光强度来评判GFP是否能随细胞增殖稳定表达. 通过对实验数据分析发现,细胞荧光强度并未随细胞的增殖而减弱,且被慢病毒感染后的细胞大小和电生理情况与正常细胞相比无明显差异,被感染后的细胞能正常增殖,未出现明显的凋亡现象. 本研究验证了通过慢病毒导入细胞的GFP能随细胞的增殖稳定表达,并不会随着细胞的增殖而丢失,且慢病毒感染的过程并不会对细胞的形态与基本电生理特性产生显著性影响,该结果为构建外源基因(如GFP基因)的稳定表达细胞体系或相关实验提供了更多的参考.
[1] Ikawa M, Yamada S, Nakanishi T, et al. Green fluorescent protein (GFP) as a vital marker in mammals[J]. Current Topics in Developmental Biology,1999,44(4):1-20.
[2] Ter Brake O, Westerink J T, Berkhout B. Lentiviral vector engineering for anti-Hiv RNAi gene therapy [J]. Methods Mol Biol, 2010, 614201-614213.
[3] Oliveira L A, Kim C, Sousa L B, et al. Gene transfer to primary corneal epithelial cells with an integrating lentiviral vector [J]. Arquivos Brasileiros De Oftalmologia,2010,73(5): 447-453.
[4] Stewart S A, Dykxhoorn D M, Palliser D, et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells [J]. RNA,2003,9(4):493-501.
[5] Naldini L, Blomer U, Gallay P, et al.Invivogene delivery and stable transduction of nondividing cells by a lentiviral vector [J]. Science,1996,272(5259):263-267.
[6] Dull T, Zufferey R, Kelly M, et al. A third-generation lentivirus vector with a conditional packaging system [J]. Journal of Virology,1998,72(11):8463-8471.
[7] Hfig I, Barth S, Salomon M, et al. Systematic improvement of lentivirus transduction protocols by antibody fragments fused to VSV-G as envelope glycoprotein [J]. Biomaterials,2014,35(13):4204-4212.
[8] Thomas P, Smart T G. HEK293 cell line: a vehicle for the expression of recombinant proteins [J]. Journal of Pharmacological & Toxicological Methods,2005,51(3):187.
[9] Reiser J, Harmison G, Kluepfel-Stahl S, et al. Transduction of nondividing cells using pseudotyped defective high-titer HIV type 1 particles [J]. Proc Natl Acad Sci USA, 1996, 939(26): 15266-15271.
[10] Lee D, Kim N Y, Bae G E, et al. Transmissible infection of human 293T cells with porcine endogenous retroviruses subgroup a from NIH-miniature pig [J]. Transplant Proc, 2008, 40(10): 3742-3745.
[11] Gandini M A, Sandoval A, Felix R. Whole-cell patch-clamp recording of recombinant voltage-sensitive Ca2+channels heterologously expressed in HEK-293 cells [J]. Cold Spring Harbor Protocols,2014(4):396.
[12] Manicassamy B. Analysis ofinvivodynamics of influenza virus infection in mice using a GFP reporter virus [J]. Proc Natl Acad Sci USA,2010,107(25): 11531-11536.
[14] 李宏松, 徐 晨, 邹 俊. 慢病毒负载 GFP 转染兔脂肪干细胞的效率及毒性评价[J]. 上海交通大学学报(医学版),2013,33(4):439-444.
[15] 刘 立, 赵 敏. 慢病毒载体介导增强型绿色荧光蛋白转染大鼠角膜的效率及其毒性研究[J]. 解放军医学杂志,2014,39(4):307-310.
Construction of HEK293T Cells Stable Expressing Green Fluorescent Protein
YangXiaofei,YuYi,LiuMengxue,RongYi,LinXianguang
(Key Laboratory of Cognitive Science, Key Laboratory of Medical Information Analysis and Tumor Diagnosis and Treatment, Laboratory of Membrane Ion Channels and Medicine, College of Biomedical Engineering,South-Central University for Nationalities, Wuhan 430074, China)
In order to investigate whether green fluorescent protein (GFP) can stably express with the proliferation of cells in the passage cells, HEK293T cells were infected by the third generation lentivirus to build a cell line stable expressing GFP. The fluorescence intensity and the morphology of the cells were measured by the cell imaging, the current voltage (I-V) curve of HEK293T cells was recorded by whole cell patch. The results showed that GFP could stably express with the proliferation of cells, and the morphology and basic electrophysiological activity were not significantly changed between experimental cells and control cells.
green fluorescent protein; HEK293T cells; lentivirus
2017-02-24 *通讯作者 林显光,研究方向:神经生物学,E-mail:22527195@qq.com
阳小飞(1979-),男,教授,博士,研究方向:神经信号转导,E-mail:sunlittlefly@hotmail.com
国家自然科学基金资助项目(31670850);湖北省自然科学基金资助项目(2014CFA027,2014CFB455);中南民族大学科学基金引进人才科研启动基金自科项目(YZZ13002)
Q813.6
A
1672-4321(2017)02-0038-04

