黄河中下游农业景观中景观简化对传粉昆虫多样性的影响
——以巩义市为例
王 润,丁圣彦,*,卢训令,宋 博
王1 教育部黄河中下游数字地理技术重点实验室, 开封 475004 2 河南大学环境与规划学院, 开封 475004
黄河中下游农业景观中景观简化对传粉昆虫多样性的影响
——以巩义市为例
王 润1,2,丁圣彦1,2,*,卢训令1,2,宋 博1,2
王1 教育部黄河中下游数字地理技术重点实验室, 开封 475004 2 河南大学环境与规划学院, 开封 475004
在农业景观中,传粉昆虫的生存繁衍与半自然生境的面积大小有关。集约化生产方式使半自然生境比例逐渐减少,农田比例不断增加,随着景观简化梯度的变化(农田比例逐渐增大),传粉昆虫群落多样性将会发生怎样的变化?选择黄河中下游典型农区巩义市为研究区域,采用诱捕盘法(Pan traps)进行农田、林地的传粉昆虫取样,以21个样点作为景观简化梯度(农田比例范围5%—86%)的呈现,基于每个样点的传粉昆虫多度和丰富度变化来探究景观简化对传粉昆虫多样性的影响。结果显示:区内累计捕获传粉昆虫39660头,优势类群包括双翅目(Diptera)、膜翅目(Hymenoptera)、鞘翅目(Coleoptera)等。采用逐步回归分析及线性拟合后发现景观简化程度与传粉昆虫多度和丰富度呈显著负相关(P<0.05);景观简化对传粉昆虫类群间的影响也是有差异的,其中对鞘翅目多度的影响最为密切(R2=0.27),同时对膜翅目和双翅目也有较大影响(R2=0.14、R2=0.11),景观简化与鳞翅目多度呈正相关;随景观简化的程度加深,农田生境中膜翅目多度呈显著下降趋势(P<0.05),而林地中膜翅目多度变化不明显。在未来的景观规划中,应着重考虑传粉昆虫中鞘翅目类群的栖息地变化及食物资源状况。依据研究结果建议林地生境中应注重保护现有的自然植被群落,在人工林中可以种植一定面积的蜜粉源植物;农田生境内对杂草群落、半自然生境斑块进行合理规划的基础上,还可以种植线性景观植物作为传粉昆虫的食物源。
传粉昆虫;多样性;景观简化;蜜粉源植物;农业景观
在农业景观中,随着土地利用集约化程度的加强以及农业用地的扩张,半自然生境(林地、沟渠、树篱、农田边界等)逐渐消失,农业景观结构单一,呈现极大的均质化[1]。有研究表明,复杂的景观具有多样化的植物物种,通过提供栖息地、资源、庇护所等条件从而吸引更多的生物种类,可以在一定程度上保护生物多样性,维持农业生态系统的稳定[2- 4]。传粉昆虫是农业景观中不可缺少的非农生物之一,它所提供的传粉服务是保障全球粮食安全以及人类福祉的重要方面[3]。景观简化严重威胁着传粉昆虫所提供的传粉服务[4],甚至随着自然栖息地的破坏,传粉昆虫物种多样性表现出显著下降的趋势[5- 6]。
Tscharntke的研究表明,在集约化的农业景观中,维持传粉昆虫的生存繁衍取决于永久性半自然生境的比例[7],加之传粉者易迁移,对景观中不同镶嵌斑块(半自然生境与农田等)[8]时间空间分布很敏感[9],因此保护传粉者需要景观中农田、半自然斑块的规划和调整[10]。目前已有较多研究采用农田的面积比例来表征景观简化的程度[1,11- 12],在农田比例梯度的基础上探讨物种多样性变化可在一定程度上为保护生物多样性提供景观依据。
鉴于保护农业景观中传粉昆虫多样性及其所提供的生态系统服务,国外学者进行了大量的研究,主要集中在传粉昆虫与农作物产量的密切关系[13]、野生传粉者的生态价值[14]、不同的景观结构对传粉昆虫的影响[15]、研究传粉昆虫的尺度效应[16]等方面。而国内对传粉昆虫多样性及管理的景观途径方面研究还不够全面[17],例如如何管理农业景观中农田与半自然生境的比例来维持传粉服务[18]等问题仍然在探索之中。本文以黄河中下游典型农业区巩义市为研究区,区内地形复杂,农田面积比例跨度相对较大,因此在本地区探讨景观简化对传粉昆虫多样性的影响具有很好的代表性。基于以往的传粉昆虫研究我们对本文结果提出以下假设:(1)景观简化与传粉昆虫多度和丰富度呈负相关关系。(2)不同传粉昆虫类群对景观简化的响应存在差异,猜测膜翅目和鞘翅目类群与景观简化相关关系更为密切。研究景观简化对传粉昆虫多样性的影响,旨在保护本地区生物多样性,为本地区的农业景观规划和管理提供理论支持。
1 研究区域
研究区位于河南省巩义市,巩义市位于河南省中西部,南靠嵩山,北依黄河,地处34°31′—34°52′ N,112°49′—113°17′E之间,总面积约1041 km2,属暖温带大陆季风气候,年平均气温14.5°C,年平均降水量为583 mm。区内地势呈南高北低的趋势,地貌类型多样,河川平原地貌、丘陵地貌和山地地貌兼有,南部的嵩山、五指岭为海拔在1000 m以上的中山,中山向北依次绵延着一系列扇形的低山丘陵,海拔为400—1000 m,低山向北为广阔的河川平原。本区耕作历史悠久,农业景观是主要的景观类型,主要分布在河川平原地区,丘陵地区主要有自然林、灌木林、人工林等景观类型,山地地区主要有自然林、休耕地等景观类型。
巩义市不同生境的植物组成十分丰富,主要以暖温带华北植物区系为主。农田边分布的植物物种多为草本植物,如狗牙根(Cynodondactylon)、芦苇(Phragmitesaustralis)、牛筋草(Eleusineindica)、香附子(Cyperusrotundus)、牵牛(Pharbitisnil)、圆叶锦葵(Malvasinensis)、打碗花(Calystegiahederacea)等;林地中除了国槐(Sophorajaponica)、杨树(PopulusprzewalskiiMaxim.)、栓皮栎(Quercusvariabilis)、泡桐(Paulowniafortunei)等这些常见的乔木以外,还分布着灌丛和草本植物,如酸枣(Ziziphusjujubavar.spinosa)、白刺花(Sophoradavidii)、牡荆(Vitexnegundovar.cannabifolia)、旋复花(InulajaponicaThunb.)、紫花地丁(Violaphilippica)、狗哇花(Heteropappushispidus)等[19]。
2 研究方法
2.1 数据统计
2.1.1 景观数据来源及处理
以巩义市2015年1月Google Earth影像作为景观图像数据源,通过ArcMap 10.0软件对其矢量化获得研究区的景观数据。经过野外实际调查并结合实际状况后,把研究区分为农田、居民点、林地、建设用地、工矿用地、道路、裸地、沟渠等13种景观类型,基本上能够代表研究区的景观特征。
考虑到本地区地貌类型特点以及人为干扰程度,选取巩义市特色的丘陵山地地区,共设置21个采样点(图1)。每个采样点中选取农田、林地两种生境类型,共调查42个生境斑块。本文以农田比例来表征农业集约化程度,以半自然生境的比例来表征景观的复杂程度,两者共同代表景观简化的程度,最终将所有样点按照农田比例从高到低的梯度排序。
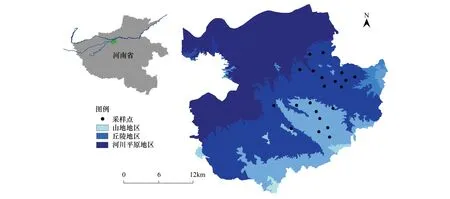
图1 研究区地理位置和采样点示意图Fig.1 Schematic diagram and sampling points of the study area′s location
2.1.2 传粉昆虫取样方法
使用诱捕盘法获取传粉昆虫,方法如下:将3 个内部分别使用荧光漆涂成黄色、白色、蓝色的塑料碗(内径11 cm,深6 cm)间隔5 m呈等边三角形布设,每个样地中3组重复,每个碗中放水200 mL和1滴洗涤剂,在野外放置48 h后收回[19]。在此方法中,荧光碗被当作花朵吸引传粉者,不同颜色的荧光碗作为补充将会更有效率地捕获传粉昆虫,虽然调查一次,但捕获传粉昆虫个体数较多(图2),所得昆虫样品保存在75%乙醇溶液的带盖离心管中。采用双目体视显微镜(LeicaM125)并参考中国昆虫分类等[20-22]进行昆虫物种的鉴定,鉴定到科水平,同时统计数量。在昆虫取样的同时,调查取样点周围10 m内植被特征,同时使用GPS记录样点坐标。

图2 昆虫取样方法和所得样品图Fig.2 Insect sampling method and the resulting sample map
2.2 数据分析
2.2.1 景观指标的选取与数据处理方法
在景观中研究传粉昆虫多样性需要一个合适的尺度[1],为了探究本地区合适的特征尺度,分别以样点为中心,截取以250、500、750、1000、2000、3000m为半径的6个缓冲区[6],计算各缓冲区的斑块密度(Patch Density,PD)、斑块丰富度指数(Patch Richness,PR)、Shannon′s多样性指数(Shannon′s Diversity Index, SHDI)和蔓延度指数(Contagion Index, CONTAG),将景观指数与传粉昆虫多样性指数通过赤池信息量准则(Akaike Information Criterion, AIC)的多模型推理(Multi-model Information, MMI)[23]计算Δi(=AICci- AICcmin) 和赤池权重(Akaike weight,wi),选取传粉昆虫的特征响应尺度。在最优尺度的基础上,计算各样点的农田比例与半自然生境的比例。
在R 3.1.0软件中使用赤池信息量准则的NLME程序包来选取传粉昆虫特征尺度,在Fragstats 4.1软件中计算各缓冲区内的景观指数,在PCORD 5.0中计算传粉昆虫的多样性指数,通过多元线性回归模型来分析农田比例和传粉昆虫多样性的关系,并用Origin 9.0软件完成线性拟合作图。
2.2.2 物种多样性指数
本文选取的3个物种多样性指数计算公式分别是:
(1)物种丰富度(S)
S=样地内出现的物种数
(2)Shannon-Wiener多样性指数(H)
H=-∑PilnPi
(3)Simpson多样性指数(D)
式中,Pi为第i类群的个体数占总个体数的百分比
3 结果与分析
3.1 传粉昆虫物种组成特征
本研究捕获传粉昆虫分属6个目、58个科,共计39660头。在传粉昆虫主要类群方面,双翅目个体数最多(26236头),其次是膜翅目(13893头)、鞘翅目(2033头)、鳞翅目(510头)。优势类群、常见类群、稀有类群分别有3科、7科、48科,其中优势类群为花蝇科(29.42%)、食蚜蝇科(12.33%)、蕈蚊科(10.09%),常见类群为胡蜂科(5.98%)、小蜂科(3.89%)、瘿蚋科(3.64%)、蜜蜂科(2.81%)、蜂虻科(2.24%)、丽蝇科(2.01%)、花蓟马科(1.93%)(表1)。稀有类群虽然类群数较多,如粉蝶科(Pieridae)、凤蝶科(Papilionidae)、花萤科(Cantharidae Imhoff)等,但总多度仅占捕获总数的9.15%。
在农田和林地两种生境中,农田生境中共捕获传粉昆虫24540头,林地中15120头,农田生境的物种多度远大于林地。不同的生境条件下,植物等组成分布差异使传粉昆虫群落组成也存在差异。比如花蝇科在两种生境中的分布均有很大优势,农田中的个体数仅比林地中多986头。除此之外农田生境中传粉昆虫较多的有胡蜂科、蜜蜂科、花蓟马科等。在优势类群和常见类群中,也有林地中多度占优势的类群,比如丽蝇科、瘿蚋科等。

表1 不同生境中传粉昆虫优势类群与常见类群
+++表示优势类群(10%),++表示常见类群(1%—10%)
3.2 景观简化对传粉昆虫多样性的影响
3.2.1 基质检验结果
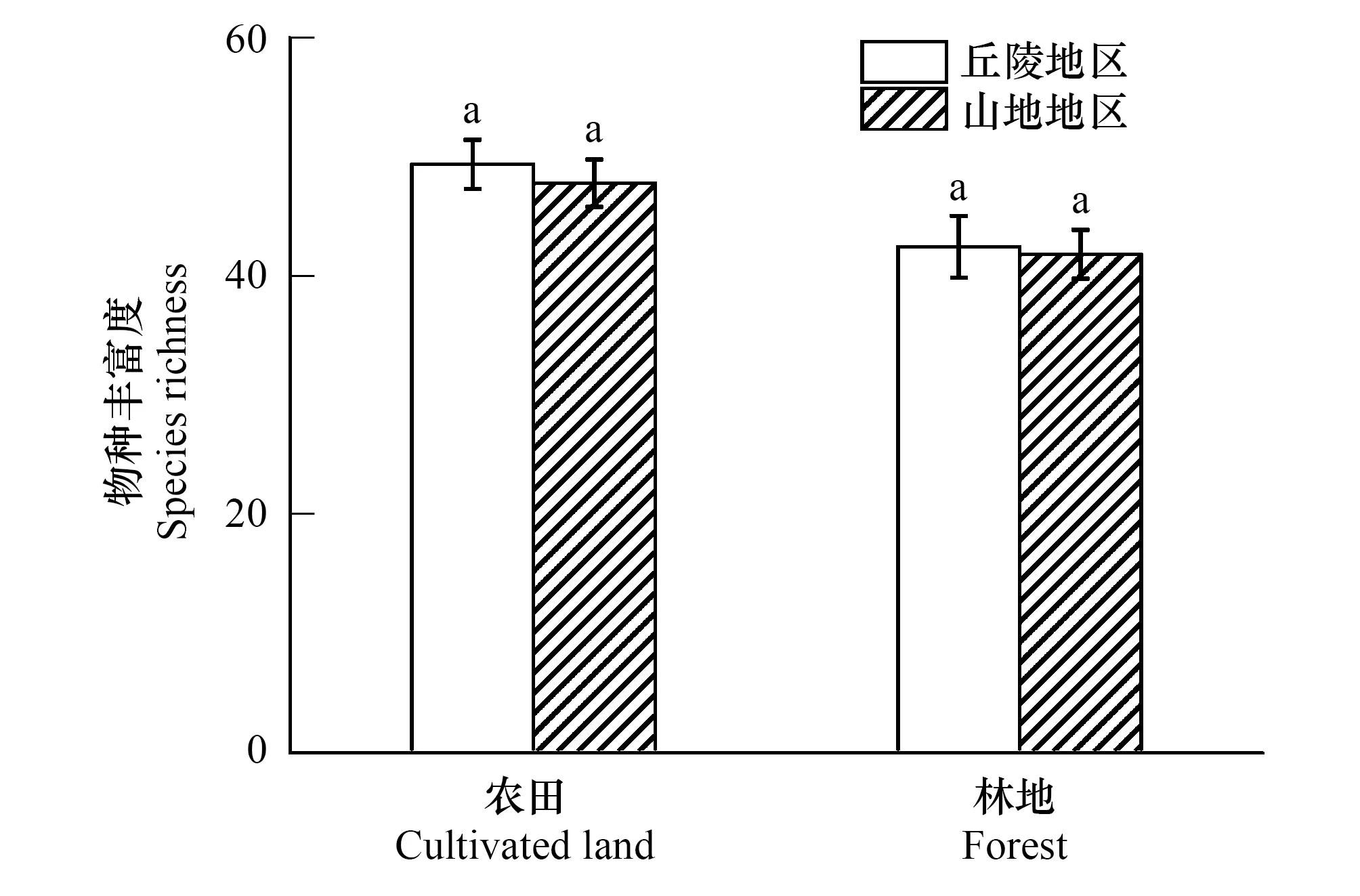
图3 不同地貌类型下的单因素方差分析 Fig.3 Single factor analysis of variance under different landform types
本研究样点分布在丘陵和山地地区,为了验证基质不同对研究结果是否产生影响,将两种地貌类型下的传粉昆虫丰富度进行单因素方差分析(图3)。结果显示:不同基质下农田和林地中传粉昆虫丰富度差异不显著(P0.05),因此在探究景观特征对传粉昆虫的影响时可以忽略基质对结果的影响。
3.2.2 最优特征尺度分析
由于传粉昆虫类群数较多,受生境条件和食物资源的影响较大,加之各类群的觅食距离不同,易在不同生境中迁移,因此受到不同景观结构(如农田面积比例)的影响尺度也是不同的[21]。为了选取本地区传粉昆虫的最优特征尺度,将传粉昆虫多样性指数(S、H、D)和不同尺度的景观指数(PD、PR、CONTAG、SHDI)拟合到NLME程序包的多推理模型中。从表2可以看出,500 m尺度上景观指数对传粉昆虫多样性的影响是最为显著的,其次是3000 m尺度。在500m尺度上AICc变化量为0,权重值最大(wi=0.68);其次在3000 m尺度上AICc变化量为3.06,权重值wi= 0.15。因此本研究中传粉昆虫特征尺度为500 m。
通过计算500 m缓冲区内各样点农田比例与半自然生境比例发现:在500 m尺度上,农田面积比例的范围是5%到86%,半自然生境的面积比例范围为2%到93%。两种生境的面积比例变化如图4所示,可见农田面积比例与半自然生境面积比例呈负相关关系,总体看来,农田面积越大,半自然生境面积相对越小,因此选取农田面积比例作为景观简化的依据,以21个样点作为景观简化梯度(农田面积比例范围5%—86%)的呈现。

表2 不同尺度下传粉昆虫解释模型选择结果
*为500m尺度上的最优模型
3.2.3 景观简化对传粉昆虫丰富度和多度的影响
在之前的研究中,已证明结构复杂的景观比单一景观支持更多物种的存在,和同尺寸、同质量、较不复杂景观中的生境斑块相比,复杂景观中的生境斑块能够接收到更高的、来自总种库的潜在外来物种多样性[22]。为了探究传粉昆虫多样性是如何随着景观简化梯度而发生变化,本研究以农田比例为自变量,传粉昆虫多度(D)和丰富度指数(S)为响应变量,采用线性回归模型对两者进行分析后,将传粉昆虫多样性指数线性拟合,从而探究景观简化对传粉昆虫多度和丰富度的影响。根据图5可知,随着农田面积比例增大,物种丰富度呈下降趋势,农田面积比例与物种丰富度呈显著负相关关系,随着景观简化的程度加深,传粉昆虫丰富度随之降低。
蝴蝶等传粉昆虫对植物组成和生境结构的变化十分敏感,不同生境中的传粉昆虫多样性存在很大差异[24- 26]。因此选取农田与林地两种生境类型来探讨景观简化对传粉昆虫多度的影响。从图6可以看出,农田生境中物种多度随景观简化虽呈减少趋势,但仍高于林地生境中的物种多度;林地生境中的物种多度随景观简化呈显著下降趋势。在农田、林地两种生境中,物种多度在景观简化梯度上表现出了不同的下降趋势,与农田生境相比(R2=0.18),景观简化对林地生境中物种多度的影响更为密切(R2=0.24)。

图4 500 m特征尺度下各样点的农田和半自然生境面积比例 Fig.4 Proportion of farmland and semi natural habitats in the 500m characteristic scale
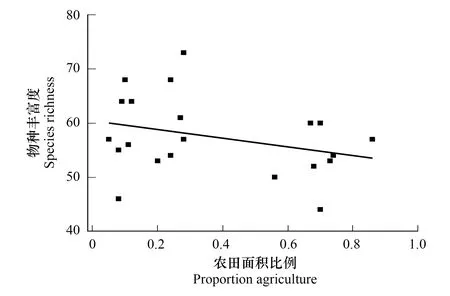
图5 农田面积比例与物种丰富度的拟合曲线(P<0.05)Fig.5 Fitting curve of farmland area proportion and species richness(P<0.05)
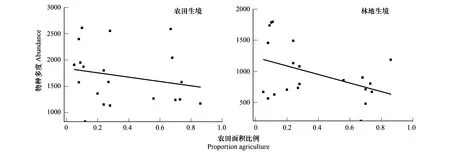
图6 不同生境下农田面积比例与物种多度的拟合曲线(P<0.05)Fig.6 Fitting curve of farmland area proportion and species abundance in different habitats(P<0.05)
3.2.4 景观简化对传粉昆虫不同类群的影响
Katja Poveda的研究表明,景观简化有利于蛾类等鳞翅目个体数的增加[23],结合本研究结果,我们猜测随农田比例的增加伴随着鳞翅目等类群也呈增加趋势,在总数不变的情况下,膜翅目、鞘翅目等类群多度则会减少,因此推测景观简化对膜翅目、鳞翅目等类群多度影响可能更为显著,故选取鞘翅目和双翅目、膜翅目和鳞翅目多度作为响应变量,农田面积比例为自变量,探究景观简化对传粉昆虫中不同类群多样性的差异。将农田面积比例与双翅目、膜翅目、鞘翅目、鳞翅目多度拟合后,由图7可知,对于景观简化,传粉昆虫不同类群多度存在差异,景观简化对鞘翅目多度(R2=0.27)的影响比双翅目(R2=0.11)、膜翅目(R2=0.14)、鳞翅目(R2=0.09)更为密切,双翅目、膜翅目和鞘翅目多度随着景观简化呈减少趋势,而鳞翅目多度随着景观简化缓慢增加,结果与之前假设吻合。
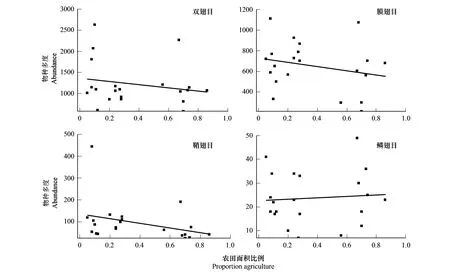
图7 农田面积比例与不同类群物种多度的拟合曲线(P<0.05)Fig.7 Fitting curve of farmland area proportion and abundance of different groups(P<0.05)
4 讨论
农业景观中的自然栖息地、蜜粉源植物资源等是联系景观与传粉昆虫的媒介。近年来,土地利用方式的改变以及人类活动的影响使这些景观媒介的比例逐渐减少[24- 25],进而影响传粉昆虫多度和丰富度[26]。在景观简化的大环境影响下,传粉昆虫不同类群间产生不同的响应。研究表明,不同的植被组成[27]、景观配置(半自然生境比例)[28]、生境特性(面积、覆盖度)[29]会对传粉昆虫种间关系、群落组成造成影响[30]。通过分析景观简化对传粉昆虫主要四大类群的影响可以更好理解传粉昆虫内种间关系以及影响不同类群的生态学过程,对于保护传粉昆虫具有重要的生态意义。
(1)在本文的研究中景观简化对传粉昆虫中鞘翅目类群的影响更为显著。不同类群产生不同的响应,而鞘翅目类群多度发生了显著改变,在农田比例为70%的样点水平上,鞘翅目个体数低至28头,按照拟合的曲线对农田比例再高时物种多度进行预测,那么在农田比例超过90%以上的农业景观中,鞘翅目多度将急剧下降。鞘翅目类群是昆虫纲中种类最多的第一大目,占昆虫总数的25%[31],在农业生产中发挥着重要的生态系统功能[32],而在本文中鞘翅目多度的显著下降可能与本地区样点景观构型异质性有关,虽然农田面积增加的同时半自然生境面积减少,但这种梯度变化并不能代表景观异质性。有研究表明,在景观异质性组成和构型方面,鞘翅目类群受景观构型的影响更大[33],增加景观的构型异质性可以显著提高鞘翅目多度,因此在未来的农业生产中,为了保证鞘翅目多度可以适当考虑景观构型(农田、半自然生境形状)的配置。在集约化农田的景观规划方面,需要着重考虑鞘翅目的生活食性及栖息地分布。
(2)在景观简化的影响下,鳞翅目多度呈缓慢增加趋势。本研究中的鳞翅目主要有尺蛾科(Geometridae)、螟蛾科(Pyralidae)、凤蝶科等6科物种,其中尺蛾科、夜蛾科、螟蛾科多度占鳞翅目总数的76%,尺蛾科、螟蛾科多以果树、林木、枣树等为食,夜蛾科以玉米、核桃等作物为食,粉蝶科以蔬菜、果树为食,是农业生产的害虫,也有喜花粉花蜜的凤蝶科,但在本研究中凤蝶科个体数很少。Root的“资源集中假说”(resource concentration hypothesis)认为简单化的景观(高比例农田面积)中将存在更多的植食性动物[33]。天敌假说[34]认为复杂化的农业生态系统有利于多样化的物种存在,同时也会增加害虫和害虫天敌的数量,具有较强的控害能力[35]。而景观单一化使害虫天敌失去了栖境与食物资源,因此景观简化对害虫的生长产生了积极的影响,这也就解释了本文的结果。
(3)蜜蜂(Apisspp.)等膜翅目是传粉昆虫的重要组成部分,探究膜翅目在不同生境中的分布状况对于传粉昆虫的保护至关重要[36]。虽然是同一种类群,但是在林地和农田生境中的分布不一致。由图8可知,膜翅目多度随着农田比例增加而显著减少(P<0.05),而林地生境中农田比例变化对膜翅目多度没有显著影响(P0.05)。原因可从林地中植被分布、农田集约化程度、半自然生境形状3个方面解释。首先,采样点位于丘陵和山地地区,此地区中的林地多为人为干扰较小的自然林,通过对采样点的植物物种调查发现,林地中植物群落结构较为复杂,草本层和灌木层植物数量多且覆盖度较高,菊科(Asteraceae)、蔷薇科(Rosaceae)等蜜粉源植物[22]吸引传粉昆虫,随着农田比例的增加,林地可以作为有利的自然生境维持较多的膜翅目等传粉昆虫;同时农田生境内大多种植小麦、花生等粮食作物,半自然生境面积随着景观简化不断减少。另有研究发现,灌木丛和线性景观特征直接影响野生蜜蜂的传粉服务[37],在本地区农田生境内很少出现灌木丛等植被类型,仅一些如秃疮花(Dicranostigmaleptopodum)、中华小苦荬(Ixeridiumchinense)等植物物种零星分布在农田中,因此林地和农田生境中膜翅目多度随着景观简化会展现不同的结果。在野外调查的过程中发现,农田生境中分布有一定比例的杂草群落。如今集约化生产使农田中杂草群落发生很大改变,物种丰富的杂草群落作为农业生态系统的一部分,也是传粉昆虫的花粉和花蜜资源[38]。在未来的农业景观规划中,在保护好杂草群落等原有自然生境的基础上,农田边界可以规划种植一些合适面积的人工线性景观,对于保护膜翅目等资源昆虫具有重要的生态意义。

图8 不同生境下农田面积比例与膜翅目类群多度的拟合曲线Fig.8 The fitting curve of the proportion agriculture and abundance of Hymenoptera in different habitats
(4)景观简化对林地生境中物种多度的影响更为显著(图6),在未来的农业发展中,景观简化的程度如果继续加深,农田生境内传粉昆虫面临景观简化可能有避难所等应对措施,而林地生境内传粉昆虫将大幅度减少。原因可从两个方面进行分析,一是农田生境中的非农植物、半自然生境斑块所发挥的生态作用十分重要,在维持非农动植物群落、害虫控制、避难所、食物源等方面为物种多度提供很大的保障。二是林地生境并没有完全发挥“自然生境”所带来的生态功能,在取样的林地生境中,有植物群落丰富的自然林,也有人工种植的杨树林,杨树林中草本植物群落结构单一,蜜粉源植物较少,或为裸露的土地,虽然也有林下植被丰富的自然林,但在景观简化的大环境影响下,自然林难以发挥其自然生境所维持的物种多度。物种多度受到各种生态过程、资源的时空分布、种间关系等多个因素的影响[39],在本文中,农田生境中的传粉昆虫个体数高于林地。现已有研究表明,在农业景观中,半自然生境边界的存在更容易维持较高的多度水平[40],另外农田的“边缘效应”认为农田和周围半自然生境边界存在物种的交流与迁移,包括鸟类、甲虫、传粉昆虫等[41]。调查取样的4月底是农作物生长期,农田生境中干扰较少,加之种植的一些荞麦、白菜等为传粉昆虫群落提供了食物来源,在农田的破碎化小生境中繁殖生长,使得农田生境中的传粉昆虫多度高于林地生境成为可能。
5 结论与建议
总体来说,本文结果与文章开始的假设基本一致,景观简化对传粉昆虫类群的影响十分显著,随着景观简化的加剧,传粉昆虫多度和丰富度呈显著下降趋势。在传粉昆虫的双翅目、膜翅目、鞘翅目、鳞翅目四大类群中,景观简化对鞘翅目影响更为密切,在以后的农业景观规划中需着重考虑鞘翅目类群的食物资源保护和栖境分布。随着景观简化,膜翅目多度呈下降趋势,在农田生境中,这种趋势表现得更加明显。因此保护野生蜂等膜翅目类群不仅需要在林地、沟渠等半自然生境中保护现有自然植被,在农田生境中规划合适比例的半自然线性景观要素、种植蜜粉源植物也同样重要。在景观简化的梯度变化中,物种多度丰富度发生了很大改变,那么农田与半自然生境比例为多少的农业景观中可以维持较高的传粉昆虫多样性?本文结果表明农田比例将直接影响传粉昆虫的多度和丰富度,在具体的面积范围上,合适的农田与半自然生境比例还需要考虑到农业用地与生态用地[5]、决策者与利益者[42]等关系的权衡。
[1] Meehan T D, Werling B P, Landis D A, Gratton C. Agricultural landscape simplification and insecticide use in the Midwestern United States. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(28): 11500- 11505.
[2] 段美春, 张鑫, 李想, 陶渊渊, 朱春阳, 刘云慧, 宇振荣. 农田景观虫害控制植被缓冲带布局、模式和功能. 中国农学通报, 2014, 30(1): 264- 270.
[3] 戴漂漂, 张旭珠, 刘云慧. 传粉动物多样性的保护与农业景观传粉服务的提升. 生物多样性, 2015, 23(3): 408- 418.
[4] Connelly H, Poveda K, Loeb G. Landscape simplification decreases wild bee pollination services to strawberry. Agriculture, Ecosystems & Environment, 2015, 211: 51- 56.
[5] Steffan-dewenter I, Münzenberg U, Bürger C. Scale-dependent effects of landscape context on three pollinator guilds. Ecology, 2002, 83(5): 1421- 1432.
[6] Kennedy C M, Lonsdorf E, Neel M C, Williams N M, Ricketts T H, Winfree R, Bommarco R, Brittain C, Burley A L, Cariveau D, Carvalheiro L G, Chacoff N P, Cunningham S A, Danforth B N, Dudenhöffer J H, Elle E, Gaines H R, Garibaldi L A, Gratton C, Holzschuh A, Isaacs R, Javorek S K, Jha S, Klein A M, Krewenka K, Mandelik Y, Mayfield M M, Morandin L, Neame L A, Otieno M, Park M, Potts S G, Rundlöf M, Saez A, Steffan-Dewenter I, Taki H, Viana B F, Westphal C, Wilson J K, Greenleaf S S, Kremen C. A global quantitative synthesis of local and landscape effects on wild bee pollinators in agroecosystems. Ecology Letters, 2013, 16(5): 584- 599.
[7] Tscharntke T, Klein A M, Kruess A, Steffan-Dewenter I, Thies C. Landscape perspectives on agricultural intensification and biodiversity-ecosystem service management. Ecology Letters, 2005, 8(8): 857- 874.
[8] Westrich P. Habitat requirements of central European bees and the problems of partial habitats // Matheson A, Buchmann S L, O′Toole C, Westrich P, Williams I H, eds. The Conservation of Bees. New York: Academic Press, 1996: 1- 16.
[9] Kremen C, Williams N M, Aizen M A, Gemmil-Herren B, Lebuhn G, Minckley R, Packer L, Potts S G, Roulston T, Steffan-Dewenter I, Vázquez D P, Winfree R, Adams L, Crone E E, Greenleaf S S, Keitt T H, Klein A M, Regetz J, Ricketts T H. Pollination and other ecosystem services produced by mobile organisms: a conceptual framework for the effects of land-use change. Ecology Letters, 2007, 10(4): 299- 314.
[10] Dainese M, Luna D I, Sitzia T, Marini L. Testing scale-dependent effects of seminatural habitats on farmland biodiversity. Ecological Applications, 2015, 25(6): 1681-1690.
[11] Jonason D, Smith H G, Bengtsson J, Birkhofer K. Landscape simplification promotes weed seed predation by carabid beetles (Coleoptera: Carabidae). Landscape Ecology, 2013, 28(3): 487- 494.
[12] Purtauf T, Dauber J, Wolters V. The response of carabids to landscape simplification differs between trophic groups. Oecologia, 2005, 142(3): 458- 464.
[13] Garibaldi L A, Steffan-Dewenter I, Winfree R, Aizen M A, Bommarco R, Cunningham S A, Kremen C, Carvalheiro L G, Harder L D, Afik O, Bartomeus I, Benjamin F, Boreux V, Cariveau D, Chacoff1 N P, Dudenhöffer J H, Freitas B M, Ghazoul J, Greenleaf S, Hipólito1 J, Holzschuh A, Howlett B, Isaacs R, Javorek S K, Kennedy C M, Krewenka K M, Krishnan S, Mandelik Y, Mayfield M M, Motzke I, Munyuli T, Nault B A, Otieno M, Petersen J, Pisanty G, Potts S G, Rader R, Ricketts T H, Rundlöf M, Seymour C L, Schüepp C, Szentgyörgyi H, Taki H, Tscharntke T, Vergara C H, Viana B F, Wanger T C, Westphal C, Williams N, Klein A M. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science, 2013, 339(6127): 1608- 1611.
[14] Holzschuh A, Dudenhöffer J H, Tscharntke T. Landscapes with wild bee habitats enhance pollination, fruit set and yield of sweet cherry. Biological Conservation, 2012, 153: 101- 107.
[15] Concepción E D, Díaz M, Kleijn D, Báldi A, Batáry P, Clough Y, Gabriel D, Herzog F, Holzschuh A, Knop E, Marshall E J P, Tscharntke T, Verhulst J. Interactive effects of landscape context constrain the effectiveness of local agri-environmental management. Journal of Applied Ecology, 2012, 49(3): 695- 705.
[16] Razgour O, Hanmer J, Jones G. Using multi-scale modelling to predict habitat suitability for species of conservation concern: the grey long-eared bat as a case study. Biological Conservation, 2011, 144(12): 2922- 2930.
[17] Scherr S J, Mcneely J A. Biodiversity conservation and agricultural sustainability: towards a new paradigm of ‘ecoagriculture’ landscapes. Philosophical Transactions of the Royal Society B: Biological Sciences, 2008, 363(1491): 477- 494.
[18] Benjamin F E, Reilly J R, Winfree R. Pollinator body size mediates the scale at which land use drives crop pollination services. Journal of Applied Ecology, 2014, 51(2): 440- 449.
[19] Westphal C, Bommarco R, Carré G, Lamborn E, Morison N, Petanidou T, Potts S G, Roberts S P M, Szentgyörgyi H, Tscheulin T, Vaissière B E, Woyciechowski M, Biesmeijer J C, Kunin W E, Settele J, Steffan-Dewenter I. Measuring bee diversity in different European habitats and biogeographical regions. Ecological Monographs, 2008, 78(4): 653- 671.
[20] Toivonen M, Herzon I, Kuussaari M. Differing effects of fallow type and landscape structure on the occurrence of plants, pollinators and birds on environmental fallows in Finland. Biological Conservation, 2015, 181: 36- 43.
[21] Tscharntke T, Tylianakis J M, Rand T A, Didham R K, Fahrig L, Batáry P, Bengtsson J, Clough Y, Crist T O, Dormann C F, Ewers R M, Fründ J, Holt R D, Holzschuh A, Klein A M, Kleijn D, Kremen C, Landis D A, Laurance W, Lindenmayer D, Scherber C, Sodhi N, Steffan-Dewenter I, Thies C, van der Putten W H, Westphal C. Landscape moderation of biodiversity patterns and processes-eight hypotheses. Biological Reviews, 2012, 87(3): 661- 685.
[22] Poveda K, Martínez E, Kersch-Becker M F, Bonilla M A, Tscharntke T. Landscape simplification and altitude affect biodiversity, herbivory and Andean potato yield. Journal of Applied Ecology, 2012, 49(2): 513- 522.
[23] Burnham K P, Anderson D R. Model Selection and Multimodel Inference: A Practical Information-Theoretic Approach. 2nd ed. New York: Springer, 2002,67(3): 606.
[24] Petersen J D, Nault B A. Landscape diversity moderates the effects of bee visitation frequency to flowers on crop production. Journal of Applied Ecology, 2014, 51(5): 1347- 1356.
[25] Bartomeus I, Potts S G, Steffan-Dewenter I, Vaissière B E, Woyciechowski M, Krewenka K M, Tscheulin T, Roberts S P M, Szentgyörgyi H, Westphal C, Bommarco R. Contribution of insect pollinators to crop yield and quality varies with agricultural intensification. PeerJ, 2014, 2(2): e328.
[26] Klein A M, Steffan-Dewenter I, Tscharntke T. Fruit set of highland coffee increases with the diversity of pollinating bees. Proceedings of the Royal Society B: Biological Sciences, 2003, 270(1518): 955- 961.
[27] Morandin L A, Kremen C. Hedgerow restoration promotes pollinator populations and exports native bees to adjacent fields. Ecological Applications, 2013, 23(4): 829- 839.
[28] Bommarco R, Lindborg R, Marini L, Öckinger E. Extinction debt for plants and flower-visiting insects in landscapes with contrasting land use history. Diversity and Distributions, 2014, 20(5): 591- 599.
[29] Fründ J, Linsenmair K E, Blüthgen N. Pollinator diversity and specialization in relation to flower diversity. Oikos, 2010, 119(10): 1581- 1590.
[30] Flohre A, Fischer C, Aavik T, Bengtsson J, Berendse F, Bommarco R, Ceryngier P, Clement L W, Dennis C, Eggers S, Emmerson M, Geiger F, Guerrero I, Hawro V, Inchausti P, Liira J, Morales M B, Oate J J, Pärt T, Weisser W W, Winqvist C, Thies C, Tscharntke T. Agricultural Intensification and biodiversity partitioning in European landscapes comparing plants, carabids, and birds. Ecological Applications, 2011, 21(5): 1772- 1781.
[31] Aviron S, Burel F, Baudry J, Schermann N. Carabid assemblages in agricultural landscapes: impacts of habitat features, landscape context at different spatial scales and farming intensity. Agriculture, Ecosystems & Environment, 2005, 108(3): 205- 217.
[32] 侯笑云, 宋博, 赵爽, 丁圣彦. 黄河下游封丘县不同尺度农业景观异质性对鞘翅目昆虫多样性的影响. 生态与农村环境学报, 2015, 31(1): 77- 81.
[33] Root R B. Organization of a plant-arthropod association in simple and diverse habitats: the fauna of collards (Brassicaoleracea). Ecological Monographs, 1973, 43(1): 95- 124.
[34] Risch S J. Intercropping as cultural pest control: prospects and limitations. Environmental Management, 1983, 7(1): 9- 14.
[35] 侯茂林, 盛承发. 农田生态系统植物多样性对害虫种群数量的影响. 应用生态学报, 1999, 10(2): 245- 250.
[36] 谢正华, 徐环李, 杨璞. 传粉昆虫物种多样性监测、评估和保护概述. 应用昆虫学报, 2011, 48(3): 746- 752.
[37] Cranmer L, McCollin D, Ollerton J. Landscape structure influences pollinator movements and directly affects plant reproductive success. Oikos, 2012, 121(4): 562- 568.
[38] Gabriel D, Thies C, Tscharntke T. Local diversity of arable weeds increases with landscape complexity. Perspectives in Plant Ecology, Evolution and Systematics, 2005, 7(2): 85- 93.
[39] Jorgensen C F, Powell L A, Lusk J J, Bishop A A, Fontaine J J. Assessing landscape constraints on species abundance: does the neighborhood limit species response to local habitat conservation programs?. Plos One, 2014, 9(6): e99339.
[40] Fahrig L, Girard J, Duro D, Pasher J, Smith A, Javorek S, King D, Lindsay K F, Mitchell S, Tischendorf L. Farmlands with smaller crop fields have higher within-field biodiversity. Agriculture, Ecosystems & Environment, 2015, 200: 219- 234.
[41] Rand T A, Tylianakis J M, Tscharntke T. Spillover edge effects: the dispersal of agriculturally subsidized insect natural enemies into adjacent natural habitats. Ecology Letters, 2006, 9(5): 603- 614.
[42] Garibaldi L A, Aizen M A, Klein A M, Cunningham S A, Harder L D. Global growth and stability of agricultural yield decrease with pollinator dependence. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(14): 5909- 5914.
Effects of landscape simplification on pollinator diversity in agricultural areas near the lower reaches of the Yellow River: a case study
WANG Run1,2,DING Shengyan1,2,*,LU Xunling1,2,SONG Bo1,2
1KeyLaboratoryofGeospatialTechnologyFortheMiddleandLowerYellowRiverRegions,MinistryofEducation,Kaifeng475004,China2CollegeofEnvironmentandPlanning,HenanUniversity,Kaifeng475004,China
In agricultural landscapes, the survival and reproduction of pollinators depends on the size of semi-natural habitats. The intensive agricultural production model has caused a decrease in semi-natural habitats and an increase in the proportion of land dedicated to agriculture. This study aimed to quantify any changes in the diversity of pollinators following this increase in the proportion of land dedicated to agriculture. Our study area was in Gongyi City, which is a typical agricultural region located near the lower reaches of the Yellow River. Twenty-one study sites were collected from the northeast to the central area. Pan traps were used to capture pollinators from farmland and woodland habitats. Using the Akaike Information Criterion (AIC), we calculated the optional characteristics scales of the pollinators and landscape features by 500m, where landscape simplifying was determined in terms of farmland proportion. Finally, the proportion of farmland was chosen as the basis of landscape simplification, which provided us with 21 sample points as the simplified gradient of the landscape (the ratio of farmland should be between 5% and 86%). We then explored the impact of landscape simplification on pollinator diversity, which was based on the species abundance and richness of pollinators at each sample point. We caught a total of 39660 individual pollinators. The most common orders caught included Diptera (26236 individuals), Hymenoptera (13893 individuals), and Coleoptera (2033 individuals). Stepwise analysis and linear fitting showed that landscape simplification directly influenced the richness and abundance of pollinators, with greater proportions of farmland significantly negatively correlating with the richness and abundance of species caught (P<0.05). The effect of landscape simplification on different pollinator groups was variable. The effect of landscape simplification was most significant on Coleoptera (R2= 0.27), followed by Hymenoptera (R2= 0.14), and Diptera (R2=0.11). Landscape simplification was correlated with an increase in the number of Lepidoptera individuals caught (R2=0.09). Hymenoptera abundance was significantly decreased in farmland habitats, while there was no observable change in Hymenopteran abundance in woodlands. Overall, as the proportion of farmland increased, we observed significant changes in the abundance and richness of species caught. Our results showed that the proportion of farmland directly affected the abundance and richness of pollinators caught. In certain areas the balance between farmlands and semi-natural habitats is inappropriate and needs to be carefully reconsidered by decision makers and stakeholders. During land use planning, there should be an emphasis on the habitat and food resources needed by the Coleoptera taxa of pollinating insects in particular. Our results also suggested that more attention needed to be paid to the protection of existing natural vegetation communities in woodland habitats, while nectar-producing plants could be planted in artificial forests. Moreover, linear landscape plants could be planted as a food source for pollinators alongside farmlands. To protect natural habitats, such as weed communities, linear artificial landscapes of a suitable size could be planted on the boundary of farmlands, which would have a significant ecological impact and help to protect resource insects, such as Hymenopterans.
pollinators; diversity; landscape simplification; nectar plants; agricultural landscape
10.5846/stxb201511292392
国家自然科学基金资助项目(41371195, 41071118)
2015- 11- 29; 网络出版日期:2016- 08- 30
王润,丁圣彦,卢训令,宋博.黄河中下游农业景观中景观简化对传粉昆虫多样性的影响——以巩义市为例.生态学报,2017,37(7):2225- 2236.
Wang R,Ding S Y,Lu X L,Song B.Effects of landscape simplification on pollinator diversity in agricultural areas near the lower reaches of the Yellow River: a case study.Acta Ecologica Sinica,2017,37(7):2225- 2236.
*通讯作者Corresponding author.E-mail: syding@henu.edu.cn

