芒果基质土壤中苯醚甲环唑的残留分析
赵方方, 郑雪红, 吕岱竹, 谢德芳
(中国热带农业科学院分析测试中心,海南省热带果蔬产品质量安全重点实验室,农业部热作产品质量安全风险评估实验室(海口),农业部热带产品质量监督检验测试中心,海南 海口 571101)
芒果基质土壤中苯醚甲环唑的残留分析
赵方方, 郑雪红, 吕岱竹, 谢德芳
(中国热带农业科学院分析测试中心,海南省热带果蔬产品质量安全重点实验室,农业部热作产品质量安全风险评估实验室(海口),农业部热带产品质量监督检验测试中心,海南 海口 571101)
采用乙腈提取,弗罗里硅土固相萃取柱净化,气相色谱测定,外标法定量的方法,建立了苯醚甲环唑在芒果基质土壤中的残留分析方法,并对其在芒果基质土壤中的消解动态和最终残留进行了研究。在0.02~0.20 mg·kg-1内,苯醚甲环唑在芒果土壤中的平均回收率为103%~106%,变异系数为0.9%~6.5%;方法检出限为0.02 mg·kg-1,准确度高,灵敏度高,线性良好。苯醚甲环唑在云南和海南两地芒果土壤中的消解半衰期分别为15.3 d和12.8 d。施药后21、28、35 d收获的芒果土壤中苯醚甲环唑残留量为0.069~0.520 mg·kg-1。
苯醚甲环唑;芒果;土壤;气相色谱;消解;残留
苯醚甲环唑(Difenoconazole)是一种内吸广谱类杀菌剂[1],它是通过抑制麦角甾醇的生物合成而干扰病原菌的正常生长,现已广泛应用于蔬菜、豆类、水果等作物上的真菌防治上,且具有较好的防治效果[2-3]。土壤是陆地生态系统物质循环和能量交换的中心,既是农药在环境中的“贮藏库”,又是“集散地”。苯醚甲环唑在农作物中的广泛使用,对土壤环境造成了严重危害。据报道,农药施用过程中,只有10%~20%附着在农作物上,其余大部分最终散落在农作物周边的土壤中,破坏了土壤中微生物种群结构,危害环境昆虫,污染环境[4]。据报道,不同基质作物的土壤中苯醚甲环唑半衰期差异很大。目前,对苯醚甲环唑的研究主要集中于药效与毒理等方面,对其在土壤中的降解动态研究也只集中于大白菜、葡萄、芹菜、芦笋等蔬菜及苹果、香蕉等水果的土壤中[5-9],尚未见芒果土壤中的研究报道。目前,苯醚甲环唑的测定主要采用液相色谱法(LC)[10-11]、气相色谱法(GC)[12-13]、气相色谱-质谱联用法(GC-MS)[14]和液相色谱-串联质谱法(LC-MS/MS)[15-16]。其中,GC-MS或LC-MS/MS法因价格昂贵,设备投资大等特点使其应用受到一定限制。
本研究建立了适合于芒果基质土壤中苯醚甲环唑的气相色谱残留分析方法,并对苯醚甲环唑在云南、海南两地芒果基质土壤中的残留动态及最终残留进行了研究。为苯醚甲环唑在芒果基质土壤中的消解残留研究提供了数据支持,同时,为指导苯醚甲环唑在芒果上的科学合理使用和评价其在土壤生态环境中的持效性及安全性提供一定的理论参考。
1 材料与方法
1.1 材料
Agilent气相色谱仪7890A(ECD检测器);T18高速均质机(德国IKA集团);苯醚甲环唑标准品(德国Dr.Eh-renstorfer GmbH 公司);R-210旋转蒸发仪(瑞士Buchi公司);万分之一天平(SHIMAZU);微型旋涡混合仪(上海沪西分析仪器厂有限公司);弗罗里硅土固相萃取柱;甲醇、乙腈、丙酮均为色谱纯;氯化钠(140 ℃烘烤4 h)。试验药剂:30%苯醚甲环唑悬浮剂。田间试验芒果品种:海南为台农芒,云南为象牙芒。海南试验地点:海口市;云南试验点:昆明市。标准储备液: 准确称取标准品 0. 01 g于10 mL容量瓶中,用甲醇溶解定容,0~4 ℃保存,按需稀释。
1.2 方法
1.2.1 田间试验设计
1.2.1.1 消解动态试验 采取1次施药多次取样的方式进行试验。以1.5倍推荐剂量(375 mg·kg-1)对土壤均匀喷雾1次,土壤每小区20 m2,3次重复,对照区施以清水,施药后0、1、3、7、14、21、28、42、60 d取样品待测。
1.2.1.2 最终残留试验 以推荐剂量(250 mg·kg-1)、1.5倍推荐剂量(375 mg·kg-1)施药3、4次,施药间隔10 d。3次重复,对照区施以清水,末次施药后间隔21、28、35 d分别采集土壤样品待测。
1.2.1.3 样品的制备 土壤样品采用棋盘式选择6~12个点,每点以往复旋转的方式将土钻压入15 cm深度采集土壤,每个重复采集样本1~2 kg,将土壤样品碾碎后过筛,充分混匀后,四分法分取200 g样品,-20 ℃冰箱冷冻保存。
1.2.2 样品分析 称取10.00 g样品,置于150 mL塑料瓶中,加入20.0 mL乙腈,在往复式振荡器上振荡提取1 h后,加入5~7g氯化钠,继续在往复式振荡器上振荡提取5 min,在室温下静置30 min以上,使乙腈相和水相分层,准确吸取上清液10.0 mL于100 mL圆底烧瓶中,减压浓缩(40 ℃)至干,用5.0 mL正己烷溶解,待净化。
分别用5.0 mL正己烷-丙酮(V正己烷∶V丙酮=90∶10)和5.0 mL正己烷预淋弗罗里硅土固相萃取柱,当溶剂液面到达柱吸附层表面时,立即倒入待净化溶液,用100 mL圆底烧瓶收集,用5.0 mL正己烷-丙酮(V正己烷∶V丙酮=90∶10)冲洗圆底烧瓶残留物后淋洗固相萃取柱,重复3次。收集液减压浓缩(40 ℃)至干,5.0 mL正己烷-丙酮(V正己烷∶V丙酮=90∶10)定容后,待测。
1.2.3 色谱检测条件 气相色谱柱:DB-1 123-1033 (30 m×0.32 mm×1 μm);升温程序:200 ℃ 保持1 min,以15 ℃·min-1升至260 ℃,保持10 min,以20 ℃·min-1升至280 ℃ ,保持4 min;进样口温度:250 ℃;检测器类型:电子捕获检测器(ECD),检测器温度300 ℃;载气:氮气,纯度≥99.99%,流速:6.5 mL·min-1;进样量:1 μL;进样方式:不分流进样。
2 结果与分析
2.1 标准曲线及线性范围
由于苯醚甲环唑易溶于有机溶剂,提取时常选用丙酮、二氯甲烷、乙腈作为提取溶剂。其中丙酮毒性较低,但共萃物较多;二氯甲烷毒性与乙腈相当,但二氯甲烷沸点低,对试验人员和环境危害较大;因此,选择乙腈作为提取溶剂,而且它在饱和 NaCl 溶液的存在下可增强其离子化效应,使其与水更好更快分层,同时也使农药目标物能更完全地溶于乙腈中,除去溶于水的一部分干扰杂质。苯醚甲环唑标准样品(0.2 mg·L-1)的气相色谱图见图1。可以看到,保留时间为16.02 min。用正己烷做溶剂,以 0.01、0.02、0.05、0.1、0.2 mg·L-1标准溶液绘制标准曲线(图2)。由图2看出,苯醚甲环唑在0.01~0.2 mg·L-1的范围内线性良好,相关系数为0.996 9。
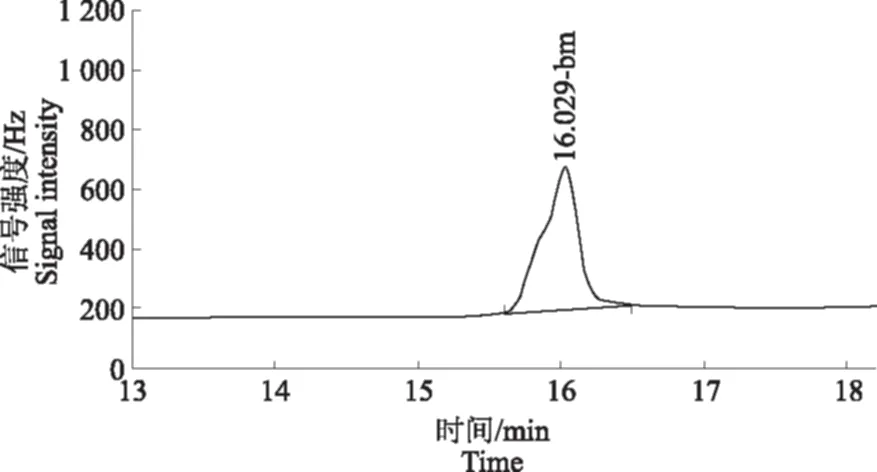
图1 苯醚甲环唑标准溶液色谱图Fig.1 The GC spectrum of difenoconazole
2.2 方法准确度、精密度及灵敏度
2.2.1 准确度及精密度 在土壤空白样品中添加苯醚甲环唑标准溶液测定回收率,结果如表1 所示。3个添加水平在土壤中平均回收率为103%~106%,相对标准偏差为0.9%~6.5%。回收率以及相对标准偏差均在农药残留试验准则允许范围内[17],方法的重复性好,可满足残留分析的要求。
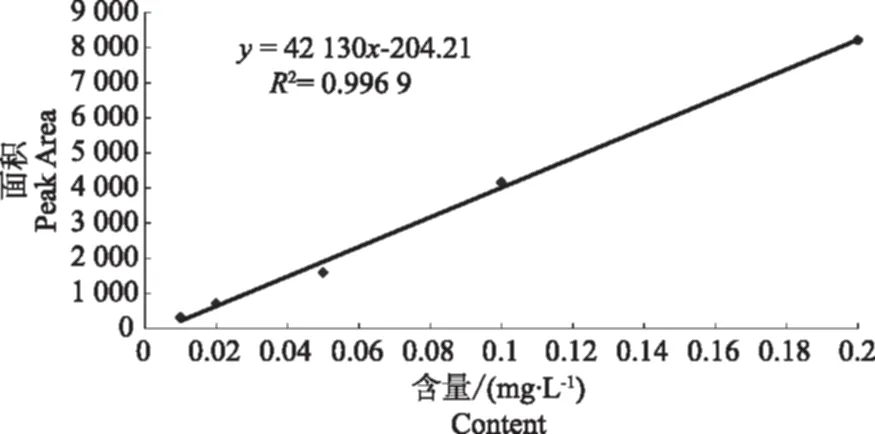
图2 苯醚甲环唑标准曲线Fig.2 The standard curve of difenoconazole

添加质量分数/(mg·kg-1)Spikedconcentrationscore回收率/%RecoveryrateⅠⅡⅢⅣⅤ平均Average相对标准偏差/%RSD0.02108106106931111056.50.071041021051031031030.90.201041081081051031062.2
2.2.2 方法灵敏度 方法的灵敏度采用最小检出量和最低检出质量分数来表示。最小检出量:1×10-11g,香蕉土壤中最低检出质量分数均为:0.02 mg·kg-1,方法灵敏度符合吡唑醚菌酯农药残留量分析要求。
2.3 苯醚甲环唑在芒果土壤中的消解动态
按照1.2.1.1方法进行施药,同步采集样品进行测定,云南和海南两地的苯醚甲环唑降解曲线见图3,从图3可以看出,消解规律符合一级动力学模型,在芒果土壤中的消解动态方程分别为:云南:

图3 苯醚甲环唑在芒果土壤中的消解曲线Fig.3 The degradation curve of difenoconazole in soil for mango
y=3.7227e-0.0454x,(R2=0.9566),T1/2=15.3 d;海南:y=5.7498e-0.054x,(R2=0.984 8),T1/2=12.8 d;云南和海南两地的苯醚甲环唑消解动态数据结果见表2,从表2中看出,施药后60 d,苯醚甲环唑在云南、海南两地芒果土壤上的降解率分别为93%和96%。
2.4 苯醚甲环唑在芒果土壤中的最终残留
按照试验设计,芒果土壤中苯醚甲环唑的最终残留量见表3。由表3可知,苯醚甲环唑在云南土壤中的残留量分别为:最后一次施药21 d为0.130~0.520 mg·kg-1;28 d时为0.087~0.234 mg·kg-1;35 d时为0.069~0.163 mg·kg-1。苯醚甲环唑在海南土壤中的残留量分别为:最后一次施药21 d为0.165~0.321 mg·kg-1;28 d时为0.098~0.312 mg·kg-1;35 d后为0.103~0.361 mg·kg-1。
3 结论与讨论
本研究采用Agilent气相色谱仪7890A(ECD检测器),建立了芒果基质土壤中苯醚甲环唑的提取、检测方法,并对苯醚甲环唑在云南、海南两地芒果基质土壤中的残留动态及最终残留进行了比较研究。在设定的检测条件下,样品的方法检出限为0.02 mg·kg-1,样品平均添加回收率为103%~106%,变异系数为0.9%~6.5%;方法的灵敏度、精密度和回收率均符合农药残留分析的要求。本方法完全适用于芒果基质土壤中苯醚甲环唑残留分析。
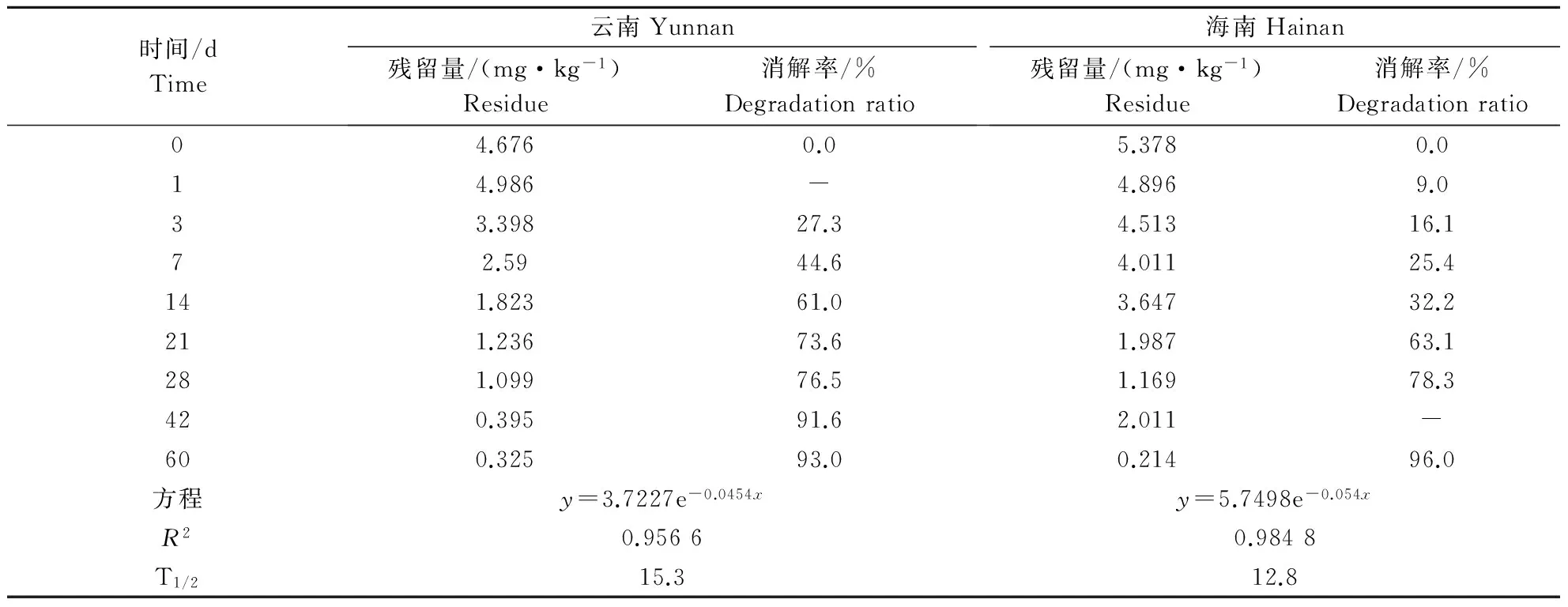
表2 苯醚甲环唑在芒果土壤中的消解动态表Table 2 The degradation dynamics of difenoconazole in soil for mango
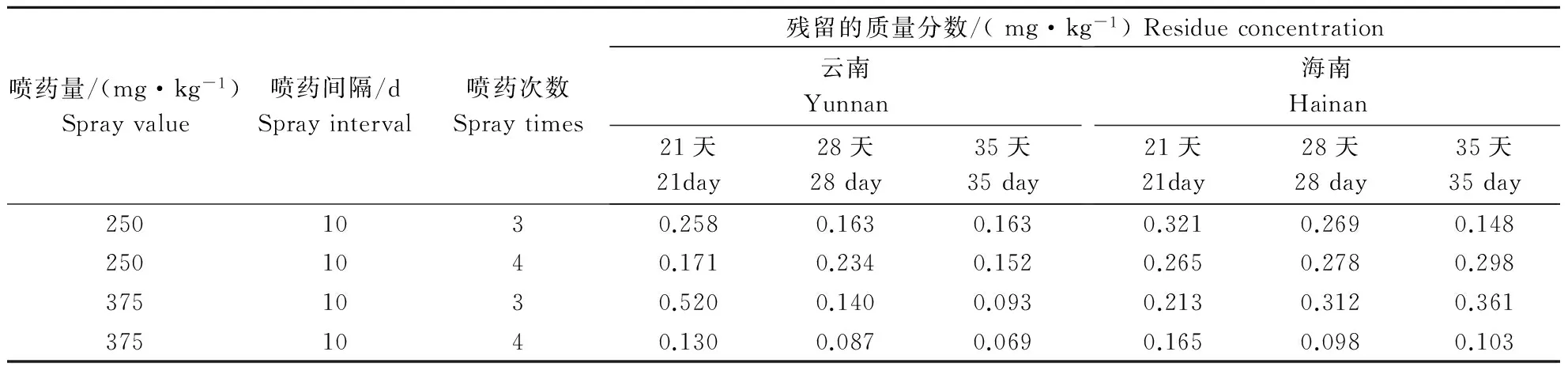
表3 苯醚甲环唑在芒果土壤中的最终残留量Table 3 The residue of difenoconazole in soil for mango
在云南和海南两地的消解动态结果显示:苯醚甲环唑在云南和海南两地芒果中的半衰期分别为15.3 d和12.8 d。文献[5,7-9]的苯醚甲环唑在大白菜、葡萄、芦笋、苹果、香蕉基质土壤中的半衰期分别为54.2~55.0 d、121.6~135.9 d、6.57 d、37.27~40.07 d、27.29~35.36 d。王军等[4]报道的10%苯醚甲环唑水分散粒剂在北京、萧县、杭州、长沙4个地区土壤中的降解半衰期为11.63 ~21.77 d。可见,苯醚甲环唑在不同作物的田间土壤中的消解动态变化差异很明显,这可能是由于其在土壤中的消解与不同作物适宜生长的土壤特点有很大关系,农药在土壤中的消解除了与气候因素(温度、降水、光照)有关外,主要与土壤的类型、pH值及土壤中的有机质含量、含水量等有关,同时,所使用的农药剂型的差异也会造成半衰期的不同[18]。
在云南和海南两地的最终残留结果表明,按推荐剂量和1.5倍推荐剂量,对芒果进行3次和4次喷药,末次施药后21、28、35 d采样,在芒果土壤中苯醚甲环唑的残留量为云南0.069~0.520 mg·kg-1,海南为0.098~0.361 mg·kg-1。本研究为指导苯醚甲环唑在芒果上的科学合理使用和评价该药在土壤生态环境中的持效性及安全性提供了重要理论参考。
[1] 王远,邢丽杰,郝家勇,等.高效液相色谱-串联质谱法测定蔬菜中苯醚甲环唑的残留量[J]. 食品科学,2011,32(18):296-299.
[2] 刘纲华.苯醚甲环唑在几种果蔬中的残留降解行为研究[D].长沙:湖南农业大学,2012.
[3] 王华栋,陈锦辉. SPE-GC/ECD测定西瓜中的苯醚甲环唑残留[J]. 安徽农业科学,2009,37(28):13448-13449.
[4] 王军,温家钧,边侠玲,等. 苯醚甲环唑在土壤中的降解动力学及其影响因子[J]. 西北农业学报,2009,18(6):342-346.
[5] 杨桐.苯醚甲环唑在大白菜、菜豆、葡萄及土壤中的残留测定和消解动态研究[D].北京:北京化工大学,2008.
[6] 初春,王志华,秦冬梅,等.苯醚甲环唑在芹菜及其土壤中的残留测定和消解动态研究[J]. 中国科学(化学),2011,41(1): 129 ~ 135.
[7] 吴曼,陈九星,付启明,等.气相色谱法测定芦笋及其土壤中的苯醚甲环唑残留量[J].精细化工中间体,2009,39(6):71-76.
[8] 仇微.苯醚甲环唑在苹果果实及土壤中的残留分析[D].保定:河北农业大学,2013.
[9] 周楷博. 苯醚甲环唑在香蕉和土壤中的残留动态及水化学、光化学降解研究[D].海口:海南大学,2010.
[10]王二琼. 30%苯醚甲环唑·丙环唑乳油的反相高效液相色谱测定[J].安徽化工,2014,40(6):81-83.
[11]周凌云,王素芬. 高效液相色谱法测定废水中苯醚甲环唑的含量[J].光谱实验室,2010,27(6):2211-2214.
[12]殷德荣,冯德富,钟国海,等.GC-μECD 测定鲜食毛豆中苯醚甲环唑残留的研究[J].中国卫生检验杂志,2014,24(4):481-482.
[13]潘晓威,谢艳丽,张宇,等.气相色谱法测定芒果中的苯醚甲环唑残留[J].广东农业科学,2014(3):112-114.
[14]薄海波.水果和蔬菜中苯醚甲环唑残留量的气相色谱-串联质谱测定方法研究[J].青海师范大学学报(自然科学版),2014 (1):56-59;66.
[15]安晶晶,刘新刚,董丰收,等.超高效液相色谱-串联质谱法测定土壤、蔬菜及水果中苯醚甲环唑和丙环唑残留[J].农药,2009,48(7):506-508.
[16]张新忠,罗逢健,陈宗懋,等.超高效液相色谱串联质谱法测定茶叶、茶汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J].分析化学,2013,41(2):215-222.
[17]农业部农药检定所. NY/T 788—2004 农药残留试验准则[S].北京:中国农业出版社,2004:5.
[18]薛晓航,戴守辉,张璐珊,等. QuEChERS/GC-MS快速分析土壤中的苯醚甲环唑残留[J]. 农药学学报,2010,12(3):309-312.
(责任编辑:朱秀英)
Residue analysis of difenoconazole in soil for mango
ZHAO Fangfang, ZHENG Xuehong, LV Daizhu, XIE Defang
(Analysis & Testing Center, Chinese Academy of Tropical Agricultural Sciences, Hainan Provincial Key Laboratory of Quality and Safety for Tropical Fruits and Vegetables, Laboratory of Quality Safety Risk Assessment for Tropical Products (Haikou), Ministry of Agriculture, Quality Supervision and Inspestion center of Tropical Agro-products, Haikou 571101, China)
The soil samples were extracted with acetonitrile and clean-up using the florisil solid phase extraction column. Then the samples were injected to the GC for analysis by external standard method. The determination method of difenoconazole residues in soil for mango was established. And the residue and dynamics of difenoconazole in soil for mango were studied. The method with the average recoveries of difenoconazole in soil was found in the range of 103%~106% at the three spiking levels from 0.02~0.20 mg·kg-1with relative standard deviations of 0.9%~6.5%. The lowest detection limit of instrument for difenoconazole was 0.02 mg·kg-1. The method shows high accuracy, high sensitivity and good linearity. The residue and degradation dynamics analysis of difenoconazole in soil was determined in Yunnan and Hainan. The experiments results demonstrated that the half-lives for soil were 15.3 d in Yunnan, and 12.8 d in Hainan, respectively. The residue of difenoconazole was between 0.069~0.520 mg·kg-1, after 21 d, 28 d and 35 d of spray.
difenoconazole; mango; soil; GC; degradation; residue
2016-01-28
农业部农药残留试验项目(2014F417);蔬菜产品未知危害因子识别与已知危害因子安全性评估(GJFP2015001)
赵方方(1987-),女,山东济宁人,助理研究员,主要从事农药残留方面的研究。
1000-2340(2017)01-0115-05
TQ481.8
A

