心脉隆注射液对酒精性心肌病大鼠心肌纤维化的影响
刘国红,黄 洁,刘玉双
心脉隆注射液对酒精性心肌病大鼠心肌纤维化的影响
刘国红,黄 洁,刘玉双
目的 探讨心脉隆注射液对酒精性心肌病大鼠心肌纤维化的影响。观察在心脉隆治疗的不同阶段,结缔组织生长因子(CTGF)在心肌的表达情况。方法 雄性健康SD大鼠50只,随机分为模型组和对照组,模型组酒精浓度从5%、10%、20%、30%各自由饮1周,然后浓度递增到36%后以该浓度维持饲养,对照组每日饮用与酒精同等热量的葡萄糖水,6个月后判断心力衰竭模型是否成功。将模型大鼠随机分为3组:心脉隆治疗1 d组、心脉隆治疗5 d组、心脉隆治疗10 d组。予以心脉隆注射液5 mg/kg腹腔注射,用免疫组化的方法对结缔组织生长因子在3组大鼠的左室心肌的分布及表达进行半定量分析。用Masson染色法观察3组大鼠左室心肌的胶原沉积情况。结果 随着治疗时间的延长,大鼠的心肌结缔组织生长因子表达明显减少(P<0.05);大鼠心肌的胶原沉积明显减少。结论 心脉隆注射液可以延缓酒精性心肌病心肌纤维化的过程。
酒精性心肌病;心脉隆注射液;心肌纤维化;结缔组织生长因子
酒精性心肌病(alcoholic Cardiomyopathy,ACM)是指长期饮酒导致心肌变性、心脏扩大和心力衰竭的一种继发性心肌病[1]在西方,ACM是继发性心肌病的主要类型。我国近年来发展有增加的趋势。一般来说,每天饮酒80 g以上,连续10年以上,有20%~36%的人可发生酒精性心肌病。酒精性心肌病病理学特征类似于原发性扩张型心肌病,常见的心肌组织改变为心肌细胞肥大,空泡变性和间质水肿。变性心肌细胞内胶原纤维减少,胞浆变稀疏,胞浆内含大小不等的空泡,严重者空泡逐渐融合增大,细胞中的有形成分被溶解而留下肌膜空腔,最终形成弥漫性纤维化。
1 材料与方法
1.1 实验分组 健康雄性SD大鼠50只,随机分为正常对照组(5只)、模型组(45只)。
1.2 酒精性心肌病动物模型的建立[2]模型组依次给予质量浓度为5%、10%、20%、30%食用酒精自由饮各1周之后,第5周开始36%浓度酒精(灭菌水52 mL∶95%食用酒精48 mL)持续饲喂至6个月末(含酒精的饮水为唯一水源)。对照组每天给予与酒精同等热量的葡萄糖水饮用,颗粒饲料量依据实验组每日食用量给予对照组相同剂量。
1.3 模型判定 在模型制作期间,每天观察大鼠精神状况,活动情况,饮酒量,进食量,大小便情况,毛色改变情况,每周称重一次,观察体重变化。
1.3.1 心脏超声心动图检查 超声心动图检测各组大鼠心脏形态学指标及功能学指标,计量资料连续测量3个心动周期取其平均值,用以分析。形态学指标包括:左心室收缩末期内径(LVDS)、左心室舒张末期内径(LVDD)、室间隔厚度(IVS)、左心室后壁收缩期厚度(LVPWTs)左心室后壁舒张期厚度(LVPWTd)。功能学指标包括:左室射血分数(LVEF)、左室短轴缩短率(FS)。将LVEF≤45%确定为心力衰竭模型成功。
1.3.2 HE染色组织学评价慢性心力衰竭模型是否成功 4%多聚甲醛固定48 h后,脱水,透明,浸蜡,包埋,制成4 μm的石蜡切片,行HE染色,光镜下观察病理学变化,判定慢性心力衰竭模型是否成功。
1.3.3 免疫组织化学检测(采用ABC法) 4 μm石蜡切片脱蜡至水,滴加3%过氧化氢,以灭活内源性过氧化物酶。滴加打孔液,以充分暴露抗原。以微波修复抗原。滴加5%BSA封闭液,37 ℃孵育40 min。滴加一抗,4 ℃冰箱过夜。37 ℃复温40 min,滴加二抗,37 ℃复温40 min。滴加链酶亲和素-生物素-过氧化物复合物,37 ℃孵育50 min。DAB显色,显微镜下控制显色时间,最后以苏木素复染,盐酸酒精分化,脱水,透明,封片。实验同时以PBS替代一抗作阴性对照,用计算机图像分析系统软件进行分析,镜下随机选取5个视野,计数阳性细胞数,取其平均数,进行半定量分析。
2 结 果
2.1 HE染色光镜下观察 正常对照组心肌细胞排列整齐,形态正常,胞浆纹理清晰。模型组心肌细胞排列紊乱,可见心肌纤维排列紊乱,炎细胞增多,有明显出血坏死,心肌纤维排列呈波浪状,甚至断裂,炎性细胞明显增多,出血坏死明显。
2.2 心肌组织超微结构改变 透射电镜下观察可见,对照组大鼠心肌纤维走行规则,Z线清晰可见,线粒体结构清晰,血管内皮细胞结构正常。模型组大鼠心肌细胞核膜明显不规则,核仁裂解;染色质边集;线粒体数量增多、大小不等、肿胀、有空泡变性、可见巨线粒体、线粒体嵴融合消失,并向细胞核附近聚集;M线消失;肌原纤维溶解、断裂;间质胶原纤维增生明显。
2.3 多普勒超声评估(见表1) 与对照组相比,心衰组LVDD、LVDS显著增加, FS、LVEF显著减小,差异有统计学意义(P<0.05)。
表1 两组左室结构和功能的多普勒超声检查结果(±s)
2.4 组织学检查 对照组心肌细胞排列齐,形态正常,胞浆纹理清晰。随着治疗时间的延长,心肌纤维排列较前整齐,出血坏死较前减少。详见图1~图4。
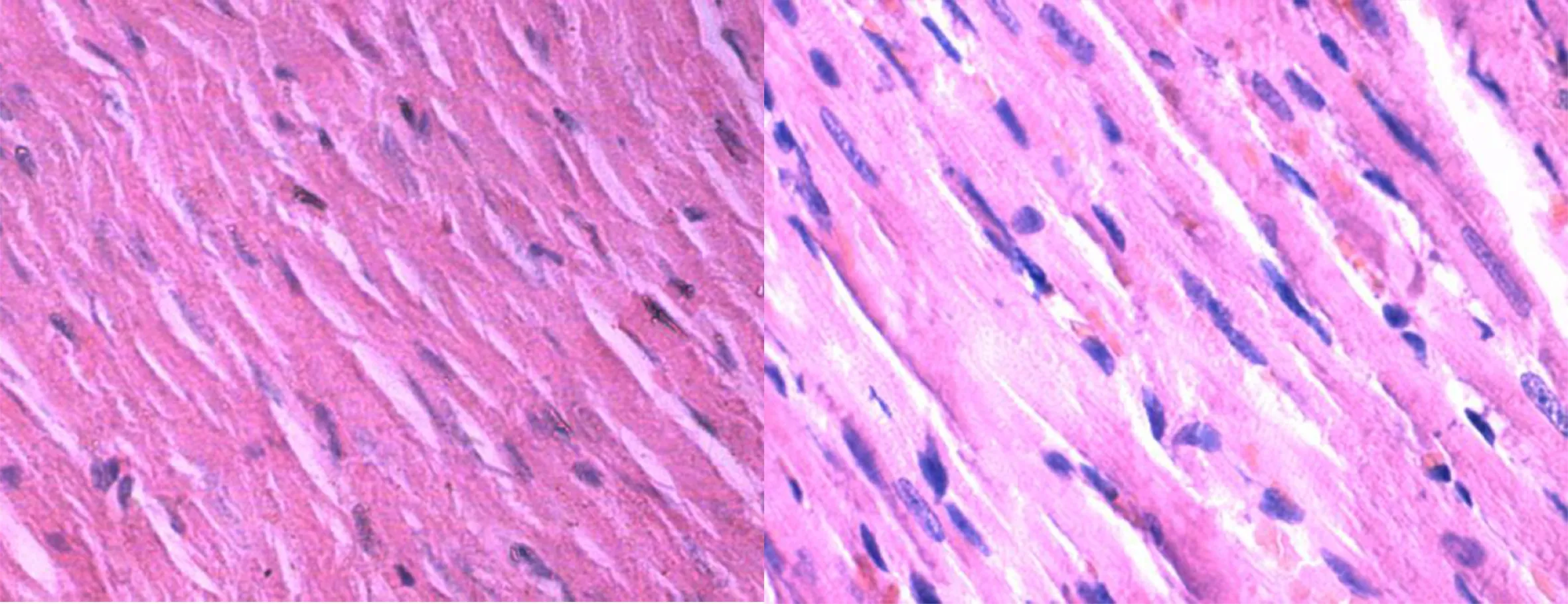
图1 正常心肌HE染色(×400) 图2 治疗10 d HE染色(×400)
图3 治疗5 d HE染色(×400) 图4 治疗1 d HE染色(×400)
2.5 MASSON染色结果 对照组心肌无明显胶原沉积。随着治疗时间的延长,心肌胶原沉积逐渐减少。详见图5~图8。
图5 正常心肌 Masson染色(×200) 图6 治疗 10 d Masson染色(×200)
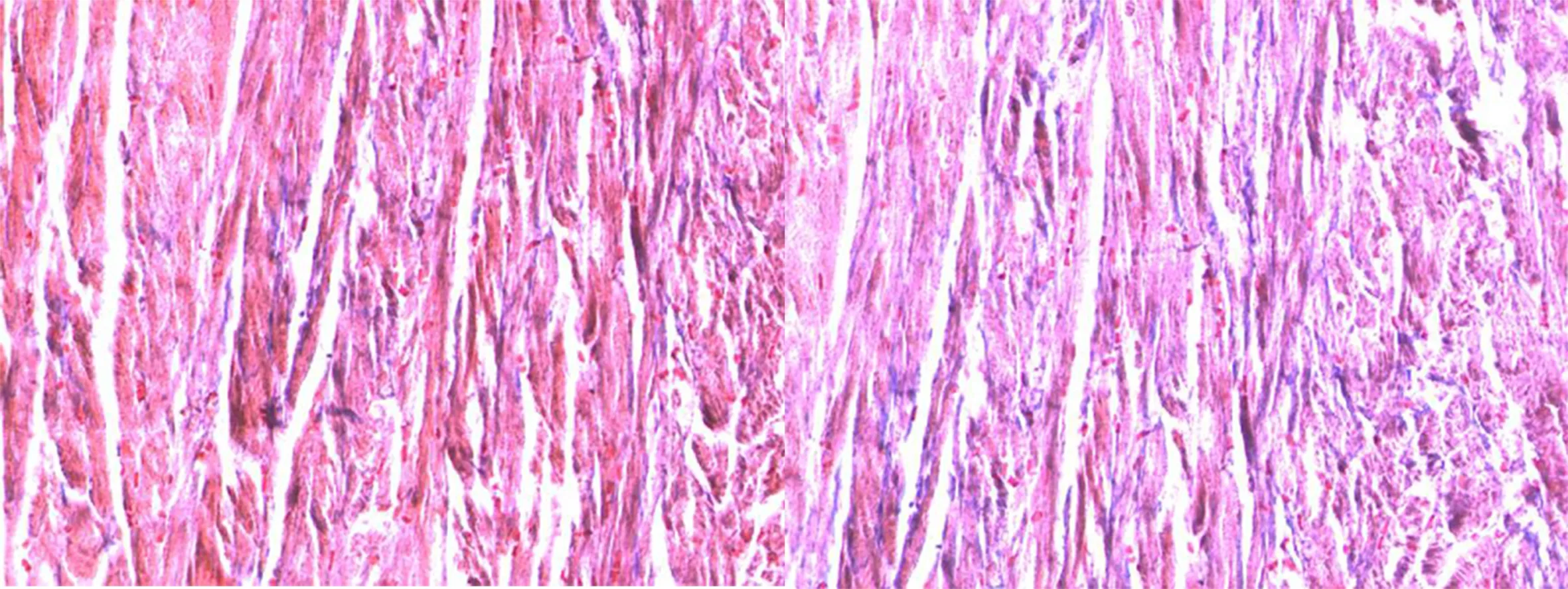
图7 治疗5 d Masson染色(×200) 图8 治疗1 d Masson染色(×200)
2.6 免疫组化指标测定 结缔组织生长因子(CTGF)在假手术组几乎不表达,在心衰组,随着治疗时间的延长,CTGF表达逐渐减少。详见表2。
表2 CTGF的半定量分析(±s) 个/HP
3 讨 论
CTGF是新近发现的细胞因子[3],它能够促进细胞外基质及细胞外基质成分的产生。可作为促纤维化的共同下游介导因子,在器官纤维化的发生中起着重要的作用。并通过蛋白激酶C(Protein kinase C)途径诱导心肌纤维化,心力衰竭时,CTGF表达增加,CTGF扮演了一个独立的因素,或和其他细胞因子一起诱导心肌纤维化和功能障碍。转化生长因子β1(TGF-β1)是启动纤维化的必须因子,而不依赖于TGF-β1的CTGF持续升高是纤维化进展的特征性表现[4]。血管紧张素Ⅱ(angiotensin Ⅱ)促进胶原合成和降解,并通过血压和神经依赖性钙调蛋白的途径调节心肌纤维化[5]。并且CTGF能够介导转化生长因子β1诱导的胶原合成[6]。
本实验采用饲喂酒精的方法,制备了发病情况与病理表现与人类相似的酒精性心肌病早期心肌损伤的动物模型,主要根据是由于乙醇及其代谢产物乙醛对心肌细胞和生物膜的毒性效应,导致心脏扩大,负荷增加,最终导致全心衰竭,来模拟酒精性心肌病的病理改变。在心力衰竭的发病机制中,心室重构是最重要的病理基础,而心肌纤维化是心肌损伤及心室重构的终末病理过程[7]。本实验发现,随着治疗时间的延长,心肌纤维化得到了明显的改善。CTGF的发现,为控制心肌纤维化提供了一个新的治疗靶点。拮抗CTGF可以更专一的拮抗细胞增殖肥大和细胞外基质的进行性积聚[8]。同时,实验发现,CTGF的表达比对照组明显升高,说明CTGF可能参与了心肌纤维化的发生。
心脉隆注射液是由美洲大蠊干品经过浸渍、减压、浓缩、分离后得到的,有效成分为多肽、核苷及复合氨基酸,复合氨基酸起着主要的作用。核苷通过水解途径起着辅助作用,二者缺一不可,具有利尿、增强心肌收缩力、减轻心脏负荷、改善心功能的作用。研究表明[9],心脉隆注射液能有效降低老年人心衰患者的BNP水平从而改善心功能。
综上所述,心脉隆注射液能有效地抑制心力衰竭大鼠的心肌纤维化,从而改善心室重构,改善心功能,并且不良反应少,是治疗慢性心力衰竭的良好药物。
[1] 李为民,井玲,刘怡希. 酒精性心肌病[J].中国实用内科杂志,2012,3(7):508-510.
[2] 程燕,孙尧,张浩良,等.慢性大鼠酒精性心肌病氧化应激的影响[J].华西医学,2010,25(4):664-666.
[3] 闫慧明,丁利芳,刘媛,等.转化生长因子-β1与结缔组织生长因子在类风湿性关节炎合并肺间质病变患者血清中的表达水平及临床意义[J].中国全科医学,2012,10(15):3268-3270.
[4] 周飞,李裕舒,杨俊,等.TGFβ1/CTGF动态变化与心房颤动患者进展的相关研究[J].临床血管病杂志,2011,27(1):49-51.
[5] 张为泽,宋振华,陈永清,等.阿托伐他汀抑制心房肌细胞CTGF及CX43的表达[J].第三军医大学学报,2011, 3(7):735-737.
[6] 符丽娟,王洪新,包翠芬,等.贝那普利对糖尿病大鼠心肌细胞外基质重塑中基质金属蛋白酶及转化生长因子的表达[J].中国药理学与毒理学杂志,2011,25(3):229-234.
[7] 孔宏亮,宋丽洁,李占全,等.人参皂甙Rb1对阿霉素心力衰竭大鼠心脏纤维化因子表达的影响[J].南京医科大学学报,2012,32(1):26-29.
[8] 王玮,李鲁杨,孟晓慧.甘草酸二胺联合前列地尔对大鼠肾间质纤维化的影响[J].山东大学学报,2012,50(9):29-32.
[9] 杨静,陈光辉,蒋博,等.心脉隆注射液治疗110例老年慢性心力衰竭患者的疗效观察[J].药物与临床,2012,9(14):93-94.
(本文编辑郭怀印)
河北唐山丰润区人民医院(河北唐山064000),E-mail:luckguohong@163.com.cn
信息:刘国红,黄洁,刘玉双.心脉隆注射液对酒精性心肌病大鼠心肌纤维化的影响[J].中西医结合心脑血管病杂志,2017,15(10):1177-1180.
R542.2 R285.5
A
10.3969/j.issn.1672-1349.2017.10.008
1672-1349(2017)10-1177-04
2016-12-05)
——以心脉医疗为例

