种痘样水疱病的临床病理特点及性质分析
周小鸽,张燕林,谢建兰,黄雨华,陈 浩,刘永霞,郑媛媛,韦 萍
·讲 座·
种痘样水疱病的临床病理特点及性质分析
周小鸽1,张燕林1,谢建兰1,黄雨华2,陈 浩3,刘永霞4,郑媛媛1,韦 萍1
种痘样水疱病(hydroa vacciniforme, HV)是发生在儿童皮肤的类似于接种牛痘疫苗后皮肤变化的一种复现性疾病。有关HV的性质众说纷纭,包括增生性、增殖性和肿瘤性;WHO(2008)淋巴造血组织肿瘤分类将其称为HV样淋巴瘤,2016年修订版又将其改为HV样淋巴组织增殖性疾病。该文通过文献复习并结合实际病例,对HV整体特征作基本的总结,并分析和探讨HV的性质,支持HV属于淋巴组织增殖性疾病(lymphoproliferative disease, LPD)的观点,建议将其命名为HV-LPD,并根据临床和病理特征将其分为3个级别:1级为良性增生性、2级为交界性、3级为肿瘤性。同时强调:(1)细胞克隆性绝不是判断HV-LPD良、恶性和分级的唯一指标,它只是多项指标之一,不可过度依赖,也绝非缺此不可。多数情况下,临床信息和形态学特征更为重要。(2)虽然HV-LPD的第3级已经达到肿瘤的阶段,但是否必须采用化疗以及采用何种化疗仍需斟酌。(3)尽管HV-LPD的分级有助于临床选择治疗方法,但对于如何识别和预防严重并发症的发生更为重要。
种痘样水疱病;爱博斯坦-巴尔病毒;淋巴组织增殖性疾病
1 前言
种痘样水疱病(hydroa vacciniforme, HV)是发生在儿童皮肤的类似于接种牛痘疫苗后皮肤变化的一种复现性疾病。有关HV的性质至今仍然众说纷纭,较早时有学者认为HV是良性增生性病变,因为很多病例可以自愈。也有学者认为HV是淋巴组织增殖性疾病(lymphoproliferative disease, LPD)[1-2],具有慢性活动性EBV感染的特征。后来,由于发现有的HV病变中存在单克隆细胞浸润,据此将HV认定为肿瘤性疾病[3]。WHO(2008)淋巴造血组织肿瘤分类也将具有单克隆的HV定为淋巴瘤,称为HV样淋巴瘤[4],2016年修订版又将其改为HV样淋巴组织增殖性疾病[5]。本文将结合实际工作中的病例并复习相关文献,对HV的整体特征作一总结,以此分析和探讨HV的性质,并提出我们的观点。
2 HV的概述
自1862年Bazin首次报道HV以来,学者们曾采用多种名称,也包括多种水疱状疾病。目前较为公认的称谓有两种:经典HV和重症HV,也有叫做典型HV和不典型HV。本文着重探讨与EBV有关的HV,而不包括遗传性、药物性、代谢性等日光相关的水疱状皮肤疾病。
2.1 HV典型的临床表现 暴露于日光照射的皮肤(面部、手脚)在照射后数小时出现红斑、丘疹、水泡、坏死、结痂、愈合后留下凹陷性瘢痕(图1),不伴(或轻微)发烧。病变按此顺序反复出现,春夏季加重,秋冬季减轻或缓解,有的患者年复一年,有的患者可持续多年,部分患者到青春期后完全恢复健康,该HV称为经典HV[6-7]。也有患者病情较重或经典HV逐渐变重,可累及身体各处皮肤,病变更深(图2),可伴发烧,失去发病的季节性,持续时间更长,可进展成慢性活动性系统性疾病,出现肝、脾、淋巴结肿大,甚至死亡;该HV被称为重症HV[7-8]。
部分HV患者经紫外线光敏试验(UVA)呈阳性,出现类似于日光照射的皮肤反应[1,9];也有少数患者被蚊(虫)叮后出现严重水疱病,称为蚊叮超敏反应(hypersensitivity to mosquito bites, HMB)[9]。典型HV病例的血液检验多数无异常发现,重症HV病例可检测到血细胞减少、肝功能异常、抗EBV抗体增高等。HMB患者血液中IgE常常增高。
2.2 HV的病理特点 经典HV和重症HV的病理形态基本相似,均表现为表皮和真皮之间形成水疱,表皮基底层破坏,累及真皮浅层。真皮层内散在和灶状淋巴样细胞浸润,主要围绕在血管和皮肤附属器周围,淋巴细胞中小,核轻度不规则,核仁不明显,可见核分裂。病变中混杂多少不等组织细胞及其它少数炎性细胞,可见散在核碎片和小灶坏死。病变亦可累及浅层皮下脂肪组织(图3、4)。值得注意的是,重症HV比经典HV累及深部皮肤更常见,出现异型淋巴样细胞浸润也更常见[3,9-10]。
2.3 免疫表型 经典HV和重症HV的免疫表型无明显差异。病变中浸润的淋巴细胞多数是CD3+的T细胞[9],或CD56+的NK细胞,CD20+的B细胞较少[10]。对T细胞和NK细胞进一步分析发现,少数病例主要是CD4+T细胞[11],多数是CD8+T细胞[12],有的是γδT细胞[13],有的是NK细胞[9,14 ]。无论T细胞还是NK细胞为主的病例,病变细胞均表达细胞毒性分子,包括Granzyme B、TIA-1[11]。
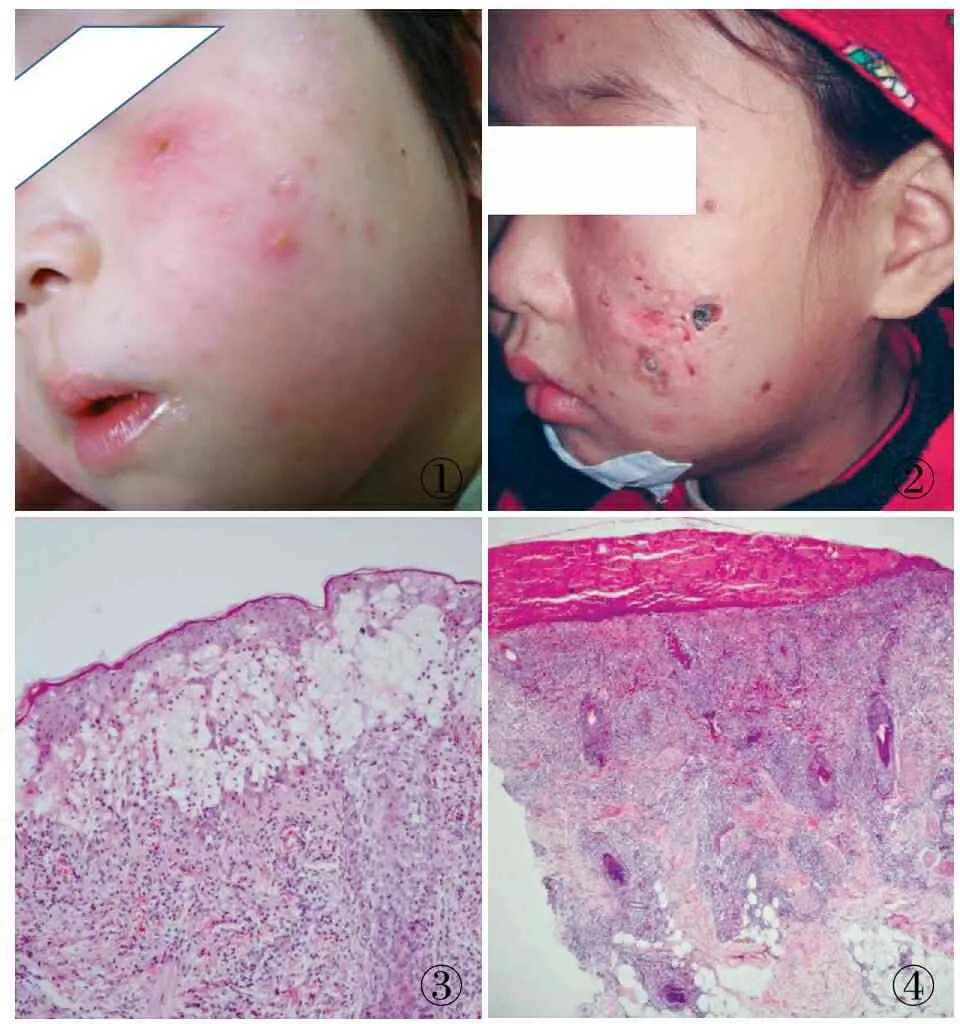
①②③④
图1 经典HV皮肤病变特点:患者女童,3岁,面颊、鼻背皮肤同时存在散在的小红疹、水疱(部分结痂)及陈旧性浅瘢痕 图2 重症HV皮肤病变特点:患者女童,8岁,反复出现面部水疱5年,间断发烧,双侧颈部淋巴结肿大,血中EBV拷贝数1.19×107,面部出现红疹、痂皮及大片瘢痕 图3 HV镜下形态:表皮和真皮之间出现水疱,呈网状变性坏死,真皮层内散在和灶状淋巴样细胞浸润,围绕毛囊和血管 图4 HV镜下形态(结痂病变):皮肤表面见多量红染的角化物,真皮全层淋巴样细胞围绕皮肤附属器周围呈灶状或散在浸润,并累及皮下脂肪组织浅层
2.4 EBV感染 病变中的T细胞或NK细胞存在EBV感染。EBER原位杂交检测,阳性细胞一般为3%~30%[9](我们的病例EBER阳性细胞一般大于50/ 40 HPF);在重症HV中EBER阳性率比经典HV高;偶有少数细胞LMP-1阳性、EBNA-2阴性[2,9-10]。有的病例(主要是重症HV)在外周血中也可检测到EBV-DNA拷贝数增高(>102.5copies/μg DNA)[9,15]。
2.5 细胞克隆性检测 超过一半的病例在皮肤病变中可检测到TCR基因克隆性重排[2,10-11,15]。在我们遇见的重症HV病例中也存在TCR基因克隆。也有重症HV病例在外周血中检测到EBV+克隆性T细胞[15]。
3 HV的性质
从上述资料可以看出,经典HV中部分患者到青春期后可以自愈。因此,有的病例中具有像是良性病变的变化过程,难以用淋巴瘤来解释该现象。另一方面,大多数重症HV患者未自愈,而是长期带病生存,有的病例经长期的临床过程进展成系统性疾病(发烧、肝脾淋巴结肿大、噬血细胞综合征、侵袭性NK细胞白血病、NK/T细胞淋巴瘤等)甚至死亡。这些病例具有侵袭性的临床过程且有细胞克隆性增殖。因此,其具备肿瘤的特征,应该属于肿瘤。WHO(2008)淋巴造血组织肿瘤分类中HV样淋巴瘤指的是具有克隆性的重症HV。另外,还有相当多的患者长期带病生存(一般为10~15年,甚至50多年,2012年我们遇到1例已持续48年,至今仍然每年出现水泡和发烧的患者[16]);也有病例从经典HV逐渐进展到重症HV[9];还有的HV样淋巴瘤患者只经过干扰素-α治疗就可以缓解[14];也有的经临床化疗,可一度缓解但复发后很快死亡,而经过免疫调节治疗的患者则可以长期生存[10]。这些现象均与典型的肿瘤特征不吻合,很难用肿瘤解释。因此,有学者提出质疑,仅仅靠单克隆性来定义HV为淋巴瘤是否恰当,早期的或经典的HV也是肿瘤吗[10]?
从HV疾病发生、发展中看,经典HV多数不是肿瘤;在重症HV病例中有一部分进展成淋巴瘤/白血病;还有一部分病例虽然是单克隆却能长期带病生存(如果未受到第二次打击仍可缓解[17]),有的病例仅用激素治疗就可以缓解且长期随访无复发[18]。因此,应该视为交界性疾病/病变。由此得出HV的性质应该属于LPD,即它具有一个疾病演进的谱系,包含良性病变、交界性病变、肿瘤性病变,而不仅仅是单纯的良性或恶性疾病。因此,在诊断和治疗时应根据HV当时的演进阶段做出判断和处理。
4 HV-LPD的分级
由于HV具有LPD的特性,我们建议将HV称为HV-LPD,并分为3个级别:1级(良性)、2级(交界性)、3级(肿瘤性);从而取代经典HV和重症HV。具体分级标准:1级仅有皮肤病变,无发烧或可有低烧,细胞无明显或轻度异型性,累及真皮中浅层,细胞呈多克隆或寡克隆,EBER阳性。2级以皮肤病变为主,可有低烧、脾脏可轻度肿大,细胞有轻度异型性,累及至真皮深层,细胞呈单克隆,EBER阳性,外周血EBV-DNA拷贝数轻度增高。3级除皮病变外有高烧和明显肝脾淋巴结肿大、肝功能异常等系统性表现,细胞单一,异型性明显,累及真皮全层及皮下脂肪,细胞呈单克隆,EBER阳性,外周血EBV-DNA拷贝数显著增高。据此,HV-LPD的第3级类似于WHO(2008)淋巴造血组织肿瘤分类的HV样淋巴瘤。虽然HV-LPD的第2级也呈单克隆,但其它指标不同于WHO(2008)淋巴造血组织肿瘤分类的HV样淋巴瘤。
5 HV-LPD的注意事项
值得强调的是:(1)细胞克隆性绝不是判断HV-LPD良恶性和分级的唯一指标,它只是多项指标之一,不可过度依赖,也绝非缺此不可。多数情况下,临床信息和形态特征更为重要。(2)虽然HV-LPD的第3级已经达到肿瘤的阶段,但是否必须采用化疗和采用何种化疗仍需斟酌。(3)尽管HV-LPD的分级有助于临床选择治疗方法,但对于如何识别和预防严重并发症(如嗜血细胞综合征、血管内弥漫性凝血、脓毒血症等)的发生更为重要。
6 问题
对于HV和HMB是2种不同疾病还是HV中包括HMB的问题,目前尚无统一认识。它们有相似之处,也有各自的一些特征。如HMB的病变更大更深、血液中IgE增高、病变和血液中NK细胞明显增多、更容易进展为NK细胞肿瘤等。
总之,由于HMB病例临床罕见,目前对它的研究资料仍有限。因此,这两种疾病的关系尚有待进一步分析。
7 结论
HV的性质属于LPD,它具有一个疾病演进的谱系,包含良性病变、交界性病变和肿瘤性病变。
[1] Cho K H, Lee S H, Kim C W,etal. Epstein-Barr virus-associated lymphoproliferative lesions presenting as a hydroa vacciniforme-like eruption: an analysis of six cases[J]. Br J Dermatol, 2004,151(2):372-380.
[2] Cohen J I, Kimura H, Nakamura S,etal. Epstein-Barr virus-associated lymphoproliferative disease in non-immunocompromised hosts: a status report and summary of an international meeting, 8-9 September 2008[J]. Ann Oncol, 2009,20(9):1472-1482.
[3] Plaza J A, Sangueza M. Hydroa vacciniforme-like lymphoma with primarily periorbital swelling: 7 cases of an atypical clinical manifestation of this rare cutaneous T-cell lymphoma[J]. Am J Dermatopathol, 2015,37(1):20-25.
[4] Quintanilla-Martinez L, Kimura H, Jaffe E S. EBV positive T-cell lymphoproliferative disorders of childhood[M]//Swerdlow S H, Campo E, Harris N L,etal. WHO classification of tumours of haematopoietic and lymphoid tissues. 4th ed. Lyon: IARC Press, 2008:260-278.
[5] Swerdlow S H, Campo E, Pileri S A,etal. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood, 2016,127(20):2375-2390.
[6] Gupta G, Man I, Kemmett D. Hydroa vacciniforme: a clinical and follow-up study of 17 cases[J]. J Am Acad Dermatol, 2000,42(2 Pt 1):208-213.
[7] Park S, KO Y H. Epstein-Barr virus-associated T/natural killer-cell lymphoproliferative disorders[J]. J Dermatol, 2014,41:29-39.
[8] Tabata N, Aiba S, Ichinohazama R,etal. Hydroa vacciniforme-like lymphomatoid papulosis in a Japanese child: a new subset[J]. J Am Acad Dermatol, 1995,32(2 Pt 2):378-381.
[9] Iwatsuki K, Satoh M, Yamamoto T,etal. Pathogenic link between hydroa vacciniforme and Epstein-Barr virus-associated hematologic disorders[J]. Arch Dermato, 2006,142(5):587-595.
[10] Quintanilla-Martinez L, Ridaura C, Nagl F,etal. Hydroa vacciniforme-like lymphoma: a chronic EBV+ lymphoproliferative disorder with risk to develop a systemic lymphoma[J]. Blood, 2013,122(18):3101-3110.
[11] Wu Y H, Chen H C, Hsiao P F,etal. Hydroa vacciniforme-like Epstein-Barr virusassociated monoclonal T-lymphoproliferative disorder in a child[J]. Int J Dermatol, 2007,46(10):1081-1086.
[12] Chen H H, Hsiao C H, Chiu H C. Hydroa vacciniforme-like primary cutaneous CD8-positive T-cell lymphoma[J]. Br J Dermatol, 2002,147(3):587-591.
[13] Hirai Y, Yamamoto T, Kimura H,etal. Hydroa vacciniforme is associated with increased numbers of Epstein-Barr virus-infected gdT cells[J]. J Invest Dermatol, 2012,132(5):1401-1408.
[14] Xu Z, Lian S. Epstein-Barr virus-associated hydroa vacciniforme-like cutaneous lymphoma in seven Chinese children[J]. Pediatr Dermatol, 2010,27(5):463-469.
[15] Kimura H, Ito Y, Kawabe S,etal. EBV-associated T/NK-cell lymphoproliferative diseases in nonimmunocompromised hosts: prospective analysis of 108 cases[J]. Blood, 2012,119(3):673-686.
[16] Xie J L, Chen G Y, Jin Y,etal. Hydroa vacciniforme present for 48 years with cytotoxic CD4+ T-cell infiltration and Epstein-Barr virus infection[J]. Br J Dermatol, 2012,166(2):449-451.
[17] Piris M A, Cornejo C B. Cutaneous EBV-associated lymphoma?[J]. Blood, 2013,31,122(18):3095.
[18] Li Y, Chen X H, Tian X Y,etal. Primary cutaneous hydroa vacciniforme-like lymphoma with indolent clinical course: report of two cases and review of literature[J]. Int J Surg Pathol, 2013,21(2):161-168.
1首都医科大学附属北京友谊医院病理科,北京 1000502中山大学肿瘤防治中心病理科,广州 5100603中国医学科学院皮肤病医院病理科,南京 2100424山东省皮肤病性病防治研究所病理科,济南 250022
周小鸽,男,主任医师。E-mail: zhouxiaoge59@hotmail.com
时间:2017-5-17 23:53 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.016.html
R 752.2
A
1001-7399(2017)05-0544-03
10.13315/j.cnki.cjcep.2017.05.016
接受日期:2017-03-07

