骨肉瘤中Axl抑制凋亡及与凋亡蛋白的相关性
蒋 念,王雪迪,田 锐,谢显彪,赖英荣,彭挺生
骨肉瘤中Axl抑制凋亡及与凋亡蛋白的相关性
蒋 念1,王雪迪1,田 锐1,谢显彪2,赖英荣1,彭挺生1
目的 探讨受体酪氨酸激酶Axl在骨肉瘤中的抗凋亡作用,分析磷酸化Axl(P-Axl)与抗凋亡蛋白之间的相关性。方法 常规培养骨肉瘤细胞株MG63、143B和U2OS,分别设立人重组蛋白Gas6刺激组、Axl siRNA转染组、Gas6刺激+Axl siRNA转染组及各阴性对照组,应用顺铂(DDP)或氨甲喋呤(MTX)致使细胞凋亡后,通过Hoechst 33258染色、MTT实验、Annexin V-FIFC等检测法统计分析不同处理组间细胞凋亡率的差异及不同浓度Gas6刺激后骨肉瘤细胞的细胞周期变化;采用免疫组化EnVision两步法检测41例骨肉瘤及18例骨纤维结构不良组织中P-Axl、BCL-2及Bax的表达,分析患者预后与三者的相关性;应用TUNEL染色分析骨肉瘤组织中P-Axl表达水平与细胞凋亡率的相关性。结果 Hoechst 33258、MTT、Annexin V-FIFC等的实验结果一致,均表明骨肉瘤细胞株MG63、143B和U2OS中Gas6通过活化Axl降低DDP或MTX导致的细胞凋亡率(P<0.05),Axl siRNA则引起细胞凋亡率增加(P<0.05),在Axl siRNA干扰前Gas6预刺激有降低凋亡率的趋势。41例骨肉瘤组织中P-Axl、BCL-2、Bax的阳性率分别为85.4%、70.7%及36.6%;18例骨纤维结构不良组织中三者阳性率分别为11.1%、22.2%及11.1%,两组相比骨肉瘤组织中P-Axl、BCL-2、Bax的表达明显增高(P<0.05)。Pearson相关性分析显示BCL-2表达与P-Axl呈显著正相关(r=0.842,P<0.000 1);Cox单因素风险回归分析发现BCL-2和Bax表达是影响患者预后的预测因素;TUNEL结果显示P-Axl高表达的骨肉瘤组织中细胞凋亡率明显降低(P<0.05)。结论 骨肉瘤中Gas6/Axl活化后通过调节凋亡蛋白BCL-2,抑制由DDP或MTX诱发的细胞凋亡,从而促进肿瘤的进展。
骨肉瘤;Axl;BCL-2;细胞凋亡;预后
骨肉瘤是原发于骨的恶性肿瘤,好发于儿童和青少年,其恶性度高,易发生早期肺转移。目前采用新辅助化疗和外科手术相结合的标准治疗方式,但由于缺乏早期诊断指标和肿瘤化疗耐受等因素,患者的预后情况较差[1]。Axl是TAM酪氨酸激酶受体家族中的一员,其家族成员中还包括Tyro3等[2-3]。TAM酪氨酸激酶受体家族有2个共同的配体Gas6和protein S,其中Gas6/Axl蛋白复合物参与调控体内肿瘤多种生物学行为,如细胞增殖、凋亡、迁移、黏附等[4]。细胞凋亡即细胞程序性死亡,与体内多种疾病的发生发展相关[5]。BCL-2家族属于凋亡相关蛋白,包括促凋亡因子(Bax、Bak、Bad等)和抗凋亡因子(BCL-2、BCL-xL、BCL-w等)。细胞接收凋亡信号后,线粒体膜渗透性增高,释放细胞色素C,抗凋亡蛋白可通过抑制细胞色素C的释放抑制凋亡,其促凋亡蛋白作用与之相反[6]。BCL-2在多种肿瘤如乳腺癌、前列腺癌中表达增高[7-8],在非小细胞肺癌中BCL-2高表达者预后差[9];Bax在结肠癌、鼻咽癌中的表达降低[10-11],在口腔鳞癌中Bax高表达者预后较好[12]。因此,凋亡相关蛋白在不同肿瘤中的表达水平不尽相同,可能与肿瘤的预后有关。本文着重探讨骨肉瘤中凋亡相关蛋白BCL-2和Bax的表达,分析磷酸化Axl(P-Axl)与BCL-2、Bax表达的相关性。
1 材料与方法
1.1 临床资料 收集2010~2013年中山大学附属第一医院首诊无转移的41例骨肉瘤石蜡标本,其中男性23例,女性18例;患者年龄8~58岁,平均16.32岁;术后随访30~70个月,16例患者死于骨肉瘤。另收集18例骨纤维结构不良石蜡标本作为良性对照组。
1.2 试剂 收集骨肉瘤细胞株MG63、143B、U2OS(中科院上海细胞研究所),DMEM培养基、胎牛血清、100 U/mL青链霉素双抗(GIBCO),P-Axl单克隆抗体和人重组蛋白Gas6(R&D,美国),BCL-2、Bax单抗(DAKO,丹麦),顺铂(DDP)、氨甲喋呤(MTX)(大连美仑公司),Axl siRNA及阴性对照siRNA、RNA提取试剂盒(广州锐博公司),X-treme(Roche,美国),qRT-PCR逆转录试剂盒、扩增试剂盒SYBR Premix Ex Taq Ⅱ试剂盒及引物(Japan Takara),Hoechst 33258、MTT、DNA检测试剂盒、免疫组化二抗试剂盒(凯基,中国),Annexin-V-FITC、TUNEL试剂盒(Roche,德国),荧光显微镜(Leica,德国),流式细胞仪(Beckman Coulter,美国)。
1.3 Axl siRNA瞬时转染骨肉瘤细胞系 收集对数生长期的细胞株MG63、143B,提前1天接种于6孔板,密度为30%,当细胞生长密度增至60%,换无血清培养液,每孔1.5 mL,4 h后实验组每孔加入Axl siRNA 5 μL、opti-mem 500 μL和x-treme 5 μL混合物,对照组加入对照siRNA 5 μL、opti-mem 500 μL和x-treme 5 μL混合物(室温下已静置30 min),轻摇后置于37 ℃培养箱中6 h,换完全培养液,48 h内提取RNA并逆转录成cDNA,采用荧光定量PCR进行扩增。Axl引物正向: 5′-TCAAGGTGGCTGTGAAGACGA-3′,反向:5′-CGTTCAGAACCCTGGAAACAGAC-3′;GAPDH引物正向:5′-GCACCGTCAAGGCTGAGAA C-3′,反向:5′-TGGTGAAGACGCCAGTGGA-3′。
1.4 Hoechst 33258染色检测凋亡细胞 骨肉瘤细胞株MG63和U2OS分别用浓度为0、400 ng/mL的Gas6预处理24 h,然后用20 μL/mL DDP或600 μL/mL MTX处理24 h。1 μL/mL Hoechst 33258避光室温染色10 min,荧光显微镜下拍照;实验重复3次。用1-OD(处理组)/OD(对照组)计算抑制率,细胞抑制率高者凋亡细胞百分率(凋亡率)低,细胞抑制率低者细胞凋亡率高。
1.5 MTT法检测细胞凋亡率 取对数生长期的细胞株MG63和143B,以每孔3×103个接种于96孔板。分别设阴性对照组、Gas6刺激组、Axl siRNA转染组和Axl siRNA转染+Gas6刺激组,以此为基础再分别设置DDP或MTX处理组。细胞接种后孵育过夜,无血清培养4 h转染Axl siRNA。转染6 h后继续无血清培养,然后分别在Gas6刺激组和Axl siRNA转染+Gas6刺激组加入浓度为200 ng/mL Gas6培养24 h;化疗组中DDP的终浓度为20 μg/mL,MTX的终浓度为300 μg/mL,孵育24 h。最终用MTT法检测不同实验组细胞的凋亡率。
1.6 Annexin V-FIFC双染检测细胞凋亡率 取对数生长期细胞株MG63,以每孔2×105个接种于6孔板中。实验分组设置与MTT实验相同。分别用Axl siRNA、Gas6或DDP、MTX处理后,按Annexin V-FITC试剂盒说明书,加入100 μL混合液进行染色,室温放置15 min后转入流式硬管中,每管再加入200 μL Buffer,用流式细胞仪以488 nm为激发波长检测分析各实验组细胞的凋亡率;各实验重复3次。1.7 细胞周期检测 取对数生长期细胞株MG63、U2OS,应用浓度分别为0、100、200、400 ng/mL的Gas6处理48 h。PI染色后,应用流式细胞仪以488 nm为激发波长分析各实验组的细胞周期;各实验重复3次。1.8 免疫组化及判断标准 采用免疫组化EnVision两步法检测P-Axl、BCL-2、Bax蛋白表达,选取三位病理医师采用盲法阅片。按细胞阳性百分比判断:无阳性细胞为0分,<25%为1分,25%~50%为2分,51%~75%为3分,>75%为4分。按细胞阳性强度判断:0分为阴性,1分为弱阳性,2分为阳性,3分为强阳性。两者相乘以P-Axl评分≥2分为高表达,<2分为低表达;BCL-2和Bax评分≥2分为阳性,<2分为阴性。
1.9 TUNEL染色检测骨肉瘤组织中凋亡细胞 随机选取10例Axl高表达组与10例Axl低表达组,石蜡切片脱蜡、水化,置入含0.1% TritonX-100的10 mmol/L枸橼酸盐(pH 6.0)水浴30 min以透膜,1 μg/mL的蛋白酶K 37 ℃消化10 min。每张切片滴加50 μL TUNEL反应混合液,置于37 ℃湿盒避光反应1 h,PBS漂洗3次,荧光显微镜下计数凋亡细胞[激发波长为450~500 nm,检测波长为515~565 nm(绿色)];计算每张切片的平均阳性率。
1.10 统计学分析 应用两独立样本t检验和χ2检验进行统计学分析;采用Pearson相关性分析P-Axl、BCL-2和Bax蛋白表达的相关性;应用Cox单因素风险回归分析骨肉瘤患者预后的危险因素。所有数据采用SPSS 16.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 Gas6/Axl增强骨肉瘤细胞对DDP和MTX的抗凋亡作用 Hoechst 33258染色发现,MG63在DDP或MTX处理后,化疗药所致的细胞凋亡率分别为42.6%和21.9%;Gas6预刺激后,相同浓度的DDP或MTX处理的细胞凋亡率分别降为29.8%和6.4%(P<0.01)。同样,Gas6预刺激后DDP和MTX对U2OS的细胞凋亡率分别由40.0%和28.6%降为22.8%和16.4%(P<0.05)(图1A)。MTT实验发现在MG63和143B中,无论是对照组还是DDP或MTX处理组,均显示转染Axl siRNA导致细胞增殖率降低;而Gas6刺激后细胞增殖率明显增高(P<0.05);Gas6预刺激后再转染Axl siRNA,其细胞增殖率与单独转染Axl siRNA者相比亦有增高的趋势(图1B、C)。Annexin V-FITC检测发现骨肉瘤细胞株MG63在DDP或MTX分别处理后,其凋亡率由11.16%分别增至16.90%或17.67%;反之,以未处理组细胞为例,Gas6刺激使细胞凋亡率由11.16%降为3.46%;转染Axl siRNA使细胞凋亡率增至30.09%;而Gas6预刺激后再转染Axl siRNA,可使细胞凋亡率又降至27.79%。在DDP或MTX处理组也可观察到类似结果,即Gas6预刺激降低细胞凋亡率,而Axl siRNA协同升高细胞凋亡率(图2)。与细胞凋亡实验结果不同的是,不同浓度Gas6(0、100、200、400 ng/mL)的预刺激并不能使MG63、143B细胞周期出现显著性变化。
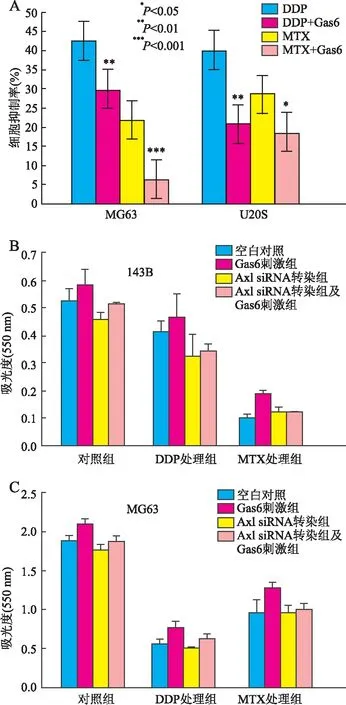
图1 A.骨肉瘤细胞株MG63和U2OS经Gas6预刺激化疗药物DDP和MTX处理后细胞凋亡情况;B.MTT实验中143B的细胞凋亡率;C.MTT实验中MG63的细胞凋亡率
2.2 BCL-2、Bax和P-Axl蛋白在骨肉瘤组织中的表达及其与凋亡率的相关性 免疫组化结果显示BCL-2及Bax蛋白在骨肉瘤细胞质中表达,P-Axl在瘤细胞核质内表达(图3);骨肉瘤组织中BCL-2、Bax及P-Axl蛋白表达量明显高于骨纤维结构不良组织。在41例骨肉瘤组织中,BCL-2阳性者29例(70.7%),Bax阳性者15例(36.6%),P-Axl高表达者35例(85.4%);在18例骨纤维结构不良组织中,BCL-2、Bax阳性者和P-Axl高表达者分别为4例(22.2%)、2例(11.1%)和2例(11.1%)。因此,骨肉瘤组织中BCL-2、Bax和P-Axl的表达显著高于骨纤维结构不良组织(P<0.05,表1)。Pearson相关性分析显示:BCL-2与P-Axl蛋白表达呈显著正相关(r=0.842,P<0.000 1),Bax与P-Axl、BCL-2的表达呈负相关,但差异无统计学意义。TUNEL实验证明骨肉瘤组织中P-Axl高表达者细胞凋亡率仅为1%;P-Axl低表达者细胞凋亡率为7%,差异有统计学意义(P<0.05,图4)。
2.3 BCL-2和Bax蛋白表达与骨肉瘤临床病理特征的关系 BCL-2和Bax蛋白表达与患者的预后明显相关(P<0.05,表2);Cox单因素风险回归分析发现BCL-2和Bax表达是影响患者预后的因素(P<0.05,表3)。
3 讨论
本课题组前期实验表明,Axl及其配体Gas6的活化可以促进骨肉瘤的发展,提示其预后差。由于P-Axl可抑制骨肉瘤细胞的凋亡[13],因此Gas6/Axl信号与凋亡相关蛋白的相关性值得深入分析。本组应用骨肉瘤细胞系为基础,建立Axl siRNA抑制及Gas6刺激活化细胞模型,应用MTT、Annexin V-FIFC等方法,证明骨肉瘤细胞中Gas6与Axl结合并促其磷酸化后抑制化疗药物对骨肉瘤细胞的致凋亡作用。TUNEL实验亦表明骨肉瘤组织中P-Axl高表达者细胞的凋亡率降低,证明Gas6/Axl在骨肉瘤组织中也发挥抗凋亡作用。此外,免疫组化结果表明P-Axl、BCL-2和Bax蛋白在骨肉瘤组织中表达均高于骨纤维不良组织,Pearson相关性分析显示BCL-2与P-Axl蛋白表达呈显著正相关,而Cox单因素风险回归表明BCL-2或Bax蛋白表达是患者预后的独立因素,提示P-Axl可能通过调节细胞凋亡蛋白BCL-2抑制骨肉瘤细胞的凋亡,从而促进肿瘤进展。由于本组例数较少,Bax与P-Axl和BCL-2的表达不具有统计学意义,但其负相关趋势提示三者之间可能存在调节或平衡关系。

表1 BCL-2、Bax和P-Axl蛋白在骨肉瘤和骨纤维结构不良组织中的表达差异

图2 流式细胞术检测MG63细胞不同处理组的凋亡细胞数量
随着新辅助化疗在临床上的广泛使用,骨肉瘤患者的5年生存率有所提高。近年化疗耐药性已严重影响化疗药物的敏感性和有效性。有文献报道[14]Axl高表达可降低乳腺癌细胞对伊马替尼的敏感性,使用Axl抑制剂能使乳腺癌细胞恢复对伊马替尼的敏感。另外,阻断Axl受体可促进非小细胞肺癌细胞凋亡并增强化疗药物作用[15]。Sinha等[16]报道阻断Axl受体能促进慢性B淋巴细胞性白血病细胞的凋亡,并具有与酪氨酸激酶抑制剂的协同作用,与本实验结果一致。AKT通路下游有2条凋亡通路,外通路靶向结合凋亡受体,内通路由细胞线粒体异常引起。在外通路中,细胞的凋亡取决于BCL-2家族因子的平衡[17]; AKT/GSK3β/Cyclin D1/Cdk4通路是另一种以抑制细胞周期而致细胞凋亡的信号通路[18]。本实验发现Gas6可以不通过影响细胞周期而使骨肉瘤细胞系抗凋亡,表明Gas6可能通过AKT-BCL-2信号通路抑制细胞凋亡,而并非通过AKT-Cyclin D1通路实现作用。Hong等[19]报道耐药的急性髓系白血病细胞中Axl表达上调,Gas6/Axl活化可能通过促进BCL-2表达进一步产生耐药性,与本实验结果一致。
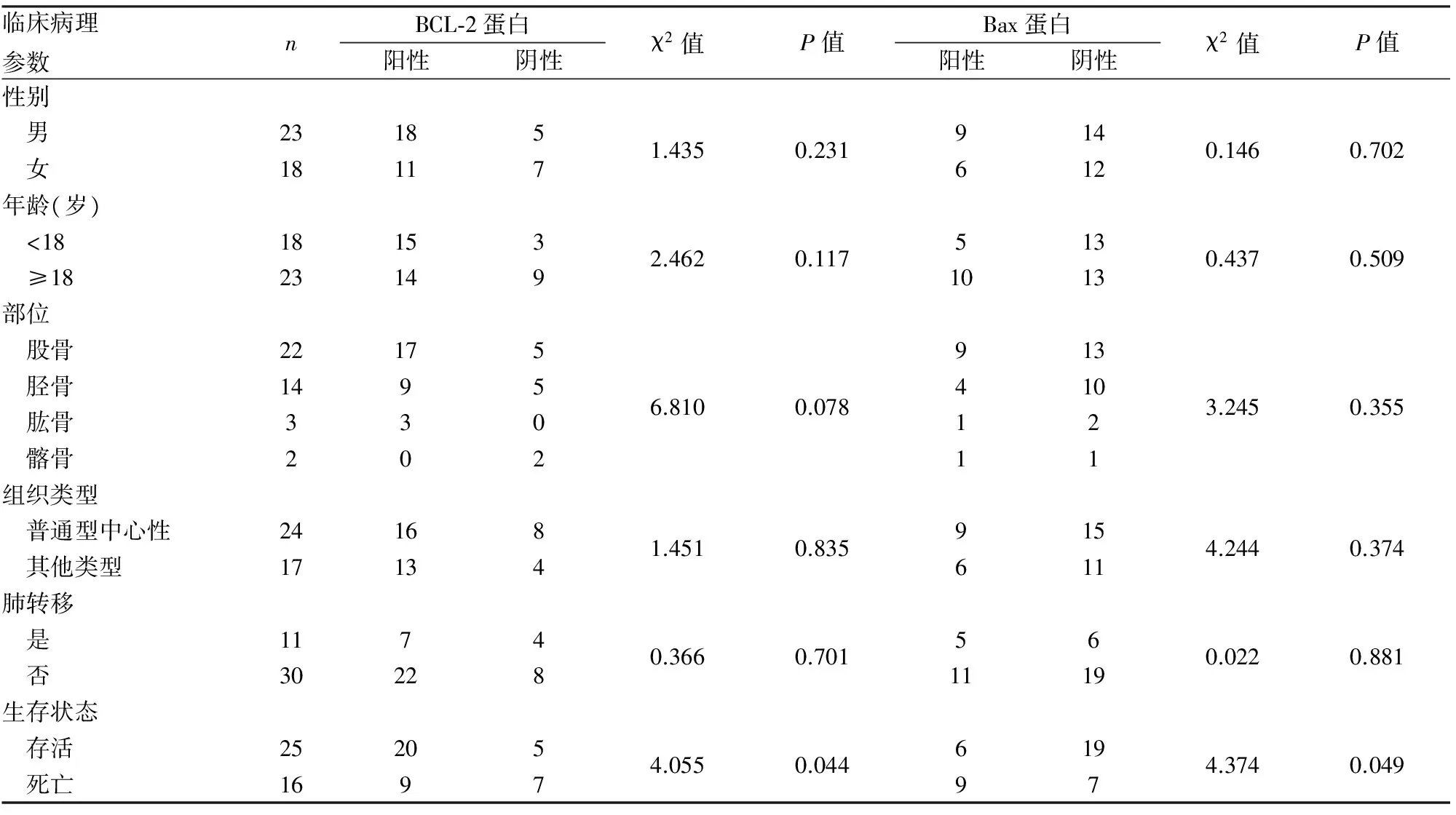
表2 BCL-2 、Bax蛋白表达与骨肉瘤临床病理特征的关系
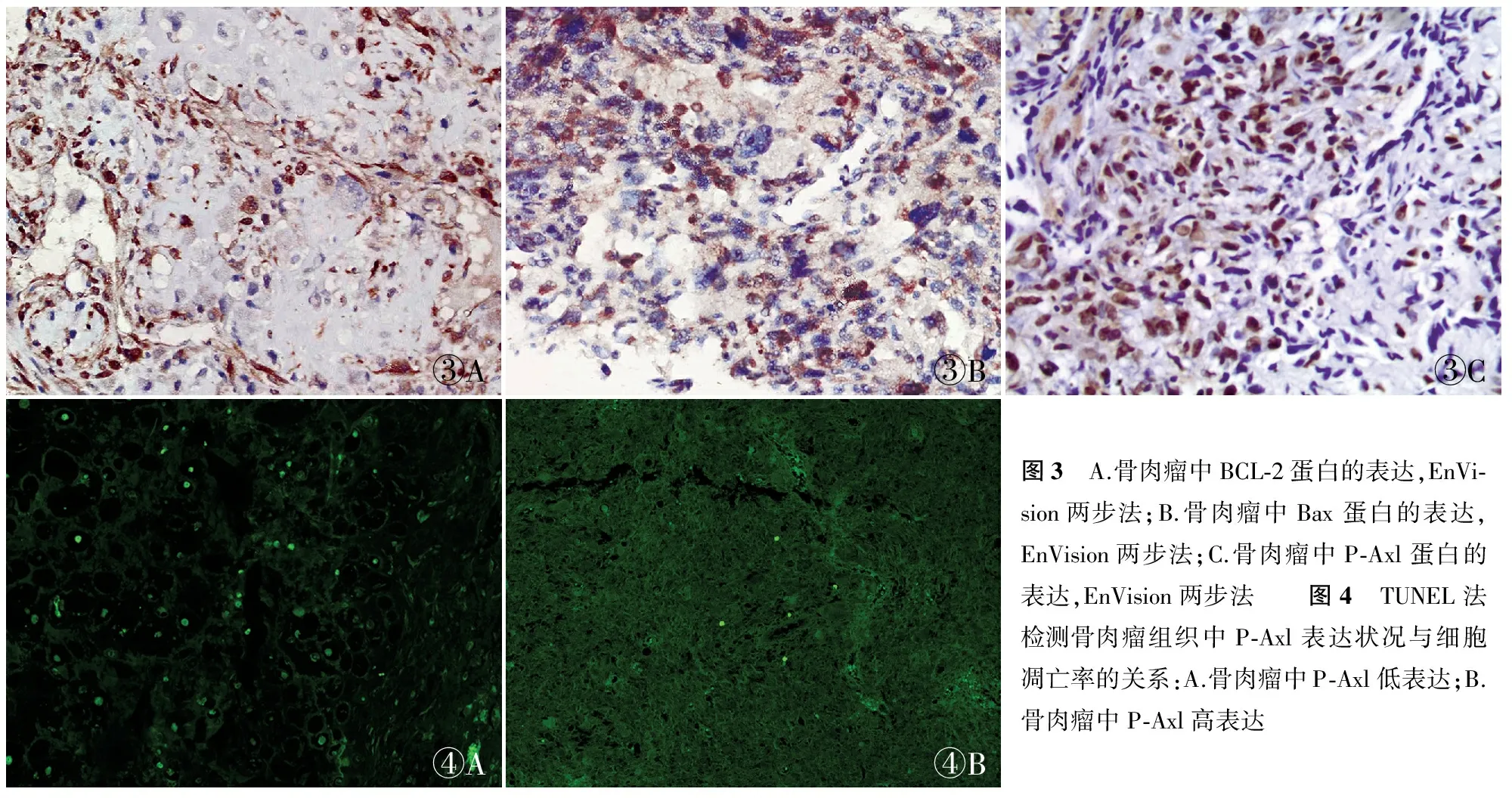
③A③B③C④A④B图3 A.骨肉瘤中BCL⁃2蛋白的表达,EnVi⁃sion两步法;B.骨肉瘤中Bax蛋白的表达,EnVision两步法;C.骨肉瘤中P⁃Axl蛋白的表达,EnVision两步法 图4 TUNEL法检测骨肉瘤组织中P⁃Axl表达状况与细胞凋亡率的关系:A.骨肉瘤中P⁃Axl低表达;B.骨肉瘤中P⁃Axl高表达

表3 Cox单因素回归分析预后相关因素
综上所述,本实验结果提示骨肉瘤中Gas6/Axl活化后通过调节凋亡蛋白BCL-2,促进骨肉瘤细胞抵抗由DDP或者MTX诱发的细胞凋亡,从而促进肿瘤的进展。因此,未来抑制Axl表达或活化可能成为增加化疗药疗效、抑制肿瘤进展的治疗手段之一。
[1] Jaffe N. Osteosarcoma: review of the past, impact on the future. The American experience[J]. Cancer Treat Res, 2009,152:239-262.
[2] Liu E, Hjelle B, Bishop J M. Transforming genes in chronic myelogenous leukemia[J]. Proc Natl Acad Sci U S A, 1988,85(6):1952-1956.
[3] O′Bryan J P, Frye R A, Cogswell P C,etal. Axl, a transforming gene isolated from primary human myeloid leukemia cells, encodes a novel receptor tyrosine kinase[J]. Mol Cell Biol, 1991,11(10):5016-5031.
[4] Hafizi S, Dahlback B. Gas6 and protein S. Vitamin K-dependent ligands for the Axl receptor tyrosine kinase subfamily[J]. FEBS J, 2006,273(23):5231-5244.
[5] Hassan M, Watari H, AbuAlmaaty A,etal. Apoptosis and molecular targeting therapy in cancer[J]. Biomed Res Int, 2014,2014:150845.
[6] Moldoveanu T, Follis A V, Kriwacki R W,etal. Many players in BCL-2 family affairs[J]. Trends Biochem Sci, 2014,39(3):101-111.
[7] Choi J E, Kang S H, Lee S J,etal. Prognostic significance of BCL-2 expression in non-basal triple-negative breast cancer patients treated with anthracycline-based chemotherapy[J]. Tumour Biol, 2014,35(12):12255-12263.
[8] Asmarinah A, Paradowska-Dogan A, Kodariah R,etal. Expression of the Bcl-2 family genes and complexes involved in the mitochondrial transport in prostate cancer cells[J]. Int J Oncol, 2014,45(4):1489-1496.
[9] Schmidt L H, Görlich D, Spieker T,etal. Prognostic impact of BCL-2 depends on tumor histology and expression of MALAT-1 lncRNA in non-small-cell lung cancer[J]. J Thorac Oncol, 2014,9(9):1294-1304.
[10] Pryczynicz A, Gryko M, Niewiarowska K,etal. Bax protein may influence the invasion of colorectal cancer[J]. World J Gastroenterol, 2014,20(5):1305-1310.
[11] Kontos C K, Fendri A, Khabir A,etal. Quantitative expression analysis and prognostic significance of the BCL2-associated X gene in nasopharyngeal carcinoma: a retrospective cohort study[J]. BMC Cancer, 2013,13:293.
[12] Bose P, Klimowicz A C, Kornaga E,etal. Bax expression measured by AQU Analysis is an independent prognostic marker in oral squamous cell carcinoma[J]. BMC Cancer, 2012,12:332.
[13] Han J, Tian R, Yong B,etal. Gas6/Axl mediates tumor cell apoptosis, migration and invasion and predicts the clinical outcome of osteosarcoma patients[J]. Biochem Biophys Res Commun, 2013,435(3):493-500.
[14] Liu L, Greger J, Shi H,etal. Novel mechanism of lapatinib resistance in HER2-positive breast tumor cells: activation of AXL[J]. Cancer Res, 2009,69(17):6871-6878.
[15] Linger R M, Cohen R A, Cummings C T,etal. Mer or Axl receptor tyrosine kinase inhibition promotes apoptosis, blocks growth and enhances chemosensitivity of human non-small cell lung cancer[J]. Oncogene, 2013,32(29):3420-3431.
[16] Sinha S, Boysen J, Nelson M,etal. Targeted Axl inhibition primes chronic lymphocytic leukemia B cells to apoptosis and shows synergistic/additive effects in combination with BTK inhibitors[J]. Clin Cancer Res, 2015,21(9):2115-2126.
[17] Papadakis E S, Cichoń M A, Vyas J J,etal. Axl promotes cutaneous squamous cell carcinoma survival through negative regulation of pro-apoptotic Bcl-2 family members[J]. J Invest Dermatol, 2011,131(2):509-517.
[18] Shimura T. Acquired radioresistance of cancer and the AKT/GSK3β/cyclin D1 overexpression cycle[J]. J Radiat Res, 2011,52(5):539-544.
[19] Hong C C, Lay J D, Huang J S,etal. Receptor tyrosine kinase AXL is induced by chemotherapy drugs and overexpression of AXL confers drug resistance in acute myeloid leukemia[J]. Cancer Lett, 2008,268(2):314-324.
Relationship between receptor tyrosine kinase Axl andapoptosis relative proteins in osteosarcoma
JIANG Nian1, WANG Xue-di1, TIAN Rui1, XIE Xian-biao2, LAI Ying-rong1, PENG Ting-sheng1
(1DepartmentofPathology,2DepartmentofMusculoskeletalOncology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,China)
Purpose To identify the role of tyrosine kinase receptor Axl for anti-apoptosis which was induced by cisplatin (DDP) and methotrexate (MTX) chemotherapy and to analyze the relationship between P-Axl and apoptosis-related proteins in osteosarcoma. Methods Osteosarcoma cell lines MG63, 143B and U2OS were used in apoptosis assays, Axl siRNA transfection, cytotoxicity assays, cell cycle analysis, etc. A total of 41 cases of osteosarcom patients were included for immunohistochemistry of EnVision two-step staining and clinico-pathological relative analysis. TUNEL assay was performed in ten cases for apoptosis detection. Results Among the osteosarcoma cell lines, Gas6/Axl could obviously protect tumor cells from apoptosis induced by DDP and MTX (P<0.05). Axl siRNA transfection enhanced cell apoptosis, whereas Gas6 prone to function upon previous knockdown by Axl siRNA. Among the 41 cases, the positive rate of P-Axl, BCL-2, and Bax was 85.4%, 70.7%, and 36.6%, respectively. In contrast, the positive rate of them was 22.2%, 11.1%, and 11.1% in osteofibrous dysplasia, respectively. The expression levels of these apoptosis-related factors were significantly higher in osteosarcoma than in osteofibrous dysplasia (P<0.05). Through clinico-pathological analysis, there were significant relationships between the survival status and BCL-2 or Bax expression (P<0.05). Pearson correlation analysis demonstrated that BCL-2 was positively correlated to P-Axl with statistical significance (r=0.842,P<0.000 1). By Cox univariate analysis, BCL-2 or Bax was correlated with the patients’ prognosis. TUNEL assay also demonstrated that P-Axl high expression inhibited apoptosis in osteosarcoma tissues. Conclusion Gas6/Axl protects osteosarcoma cells from the apoptosis induced by DDP and MTX chemotherapy and inhibits apoptosis in osteosarcoma tissue, possibly through the regulation of apoptosis-related protein BCL-2.
osteosarcoma; Axl; BCL-2; apoptosis; prognosis
国家自然科学基金(81302348)
中山大学附属第一医院1病理科、2骨肿瘤科,广州 510080
蒋 念,女,硕士研究生。E-mail: candicejang@163.com 彭挺生,女,博士,主任医师,副教授,通讯作者。E-mail:pengtsh@mail.sysu.edu.cn
时间:2017-5-17 23:52 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.005.html
R 738.3
A
1001-7399(2017)05-0490-07
10.13315/j.cnki.cjcep.2017.05.005
接受日期:2017-04-18

