咪康唑对大鼠缺氧缺血性早产儿脑白质损伤的保护作用
汤文燕苏学文杨印祥栾 佐
1.南方医科大学第三临床医学院(广东广州 510515);2.中国人民解放军海军总医院 (北京 100048)
咪康唑对大鼠缺氧缺血性早产儿脑白质损伤的保护作用
汤文燕1,2苏学文2杨印祥2栾 佐1,2
1.南方医科大学第三临床医学院(广东广州 510515);2.中国人民解放军海军总医院 (北京 100048)
目的探讨咪康唑对早产儿脑白质损伤(WMD)大鼠髓鞘的保护作用。方法新生3日龄SD大鼠随机分为假手术组、WMD模型组、10 mg/(kg·d))和40 mg/(kg·d)咪康唑组,每组15只;采用结扎右侧颈总动脉,缺氧80 min的方法制作早产儿WMD模型。咪康唑组于建模后第1~5天腹腔注射10 mg/(kg·d)和40 mg/(kg·d)咪康唑,WMD模型组注射等浓度二甲基亚砜(DMSO)。采用髓鞘碱性蛋白(MBP)免疫荧光染色及Western blot检测脑白质特异性MBP表达量,超微结构电镜观察髓鞘超微结构变化,并比较各组幼鼠体质量变化。结果WMD大鼠经咪康唑治疗后,胼胝体MBP表达量较WMD模型组高,差异有统计学意义(P<0.05)。咪康唑治疗组MBP的表达量较模型对照组增高。模型对照组胼胝体髓鞘疏松,髓鞘内小空泡形成,呈筛网状改变,髓鞘厚度明显降低,结构紊乱。经咪康唑治疗后可明显改善缺氧缺血所致的脱髓鞘改变。WMD模型组幼鼠体质量增长速度较假手术组明显减慢,咪康唑治疗后大鼠的体质量生长速度增快。结论咪康唑可通过促进髓鞘形成保护新生大鼠脑缺氧缺血诱导的白质损伤,并改善大鼠的生长发育情况。
脑白质损伤; 咪康唑; 髓鞘碱性蛋白; 早产儿
脑白质损伤(white matter damage,WMD)是早产儿脑损伤最主要的类型,也是导致早产儿认知缺陷和脑性瘫痪等神经发育障碍的主要原因[1]。WMD患儿的发病机制主要是由于脑血流的改变和脑组织代谢的改变,造成内源性少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)大量丢失而出现少突胶质细胞(oligodendrocytes,OLs)成熟、髓鞘形成障碍,从而引起脑白质损伤[2]。缺氧缺血和感染是引起新生儿脑白质损伤最主要的原因[3],最终病理结果均为白质的损伤与丢失。对新生儿缺氧缺血性脑损伤的治疗,目前国内外尚无统一、有效的治疗方案,探寻更有效的治疗方法己成为目前研究的重点之一。相关研究发现咪康唑可促进OPCs分化和髓鞘形成,从而改善多发性硬化(multiple sclerosis, MS)的临床症状[4]。本研究初步探讨新型促髓鞘再生药物咪康唑对早产儿WMD模型大鼠髓鞘形成的保护作用,为咪康唑用于早产儿WMD的治疗提供理论依据。
1 材料与方法
1.1 动物模型建立及分组
新生3日龄Sprague-Dawley(SD)大鼠60只,雌雄不限,体质量7~8 g,由北京维通利华实验动物技术有限公司提供。饲养环境清洁级,维持12 h明暗交替,自由进食、水。实验动物随机分为假手术组、WMD模型组、10 mg/(kg·d)和40 mg/(kg·d)咪康唑组,每组15只。新生3日龄SD大鼠无菌环境下戊巴比妥钠麻醉后,四肢仰卧位固定于手术台,医用碘伏消毒颈部皮肤,行颈部正中切口,逐层分离右侧皮下组织,找到与颈内静脉及迷走神经相伴行的颈总动脉并游离,用电凝笔切断血管永久性结扎右侧颈总动脉,分层缝合皮肤切口。假手术组仅游离出右侧颈总动脉,不做结扎及缺氧处理;术后将幼鼠置37 ℃恒温垫上,待幼鼠麻醉复苏后,置于6%氧气、94%氮气的33 ℃恒温缺氧箱中缺氧80min后返回母鼠笼中继续喂养[5]。咪康唑处理组腹腔注射不同剂量,10 mg/(kg·d)和40 mg/(kg·d)的咪康唑,注射药物时间为造模后第1、2、3、4、5天,1次/d,连续注射5天。模型对照组腹腔注射与咪康唑处理组等浓度的DMSO溶液,假手术组不做任何处理。
1.2 方法
1.2.1 脑组织切片制备 生后12天,行戊巴比妥钠(50 mg/kg)腹腔注射麻醉,开胸暴露心脏,经左心室灌注生理盐水(总量约为100 mL)的同时剪开右心耳,再用4%多聚甲醛(约100 mL)灌注固定;断头取脑后,脑组织立即置于4%多聚甲醛固定24 h,次日换为30%蔗糖溶液内脱水直至组织块沉底。脱水脑组织于-20 ℃冰冻切片机连续切片,切片厚约10 μm。
1.2.2 免疫荧光染色 磷酸盐缓冲液(PBS)洗涤脑组织切片3次,0.03% TritonX-100破膜45 min后,用5%羊血清封闭60 min。吸除封闭液,不清洗,加入MBP一抗,4 ℃过夜。次日,吸除一抗,PBS洗涤3次,加入抗小鼠二抗,室温避光孵育两小时,孵育后,PBS洗涤3次,于荧光显微镜下观察并进行拍照。应用Image-Pro Plus 6.0软件将荧光照片转换为黑白图片然后选取相同的黑色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(IOD),检测脑白质特异性MBP表达(n=5)。
1.2.3 Western blot检测 按照术前实验分组设计,各分组每次分别取3只幼鼠,行戊巴比妥钠(50 mg/ kg)腹腔注射麻醉后,幼鼠迅速断头取脑。利用蛋白提取试剂盒提取大鼠胼胝体脑组织蛋白,然后进行蛋白定量,样品加热变性后每孔加等质量蛋白样品,采用10% SDS-PAGE电泳,10 V转膜过夜。5%脱脂牛奶室温封闭0.5 h后,加入MBP一抗(1:1 000),4 ℃孵育12 h后,辣根过氧化物酶(HRP)标记的对应二抗(1:3 000)室温孵育0.5 h,然后放入化学发光仪中显影。运用AlphaEase FC软件分析目的条带灰度值(GAPDH标准内参对照),计算MBP相对值表达量。
1.2.4 超微结构电镜 生后12天,戊巴比妥钠腹腔注射麻醉,用2%戊二醛心脏灌注,断头取脑,选取右侧胼胝体脑组织1 mm×1 mm×1 mm,立即置于2%戊二醛4 ℃固定保存。1%锇酸4 ℃下固定2 h 后,用30%~100%浓度丙酮梯度脱水。将脱水后组织置环氧树脂包埋剂中浸泡、包埋,再行加温聚合。修整组织包埋块,用超薄切片机制备髓鞘横断面切片,片厚约50 nm,载网收集切片,并对切片用蜡酸铀染色。在透射电镜下观察髓鞘形成情况,拍照分析电镜结果(n=2)。
1.2.5 大鼠体质量变化 各组实验大鼠分别于术前、术后1、3、5、7、9天及生后11天同一时间段电子天平称量体质量,记录并观察四组实验大鼠体质量的变化(n=5)。
1.3 统计学分析
采用SPSS 21.0统计软件进行数据分析。数据以均数±标准差(±s)表示,各组间均数比较采用单因素方差分析,组内比较采用t检验。P<0.05为具有统计学差异。
2 结果
2.1 免疫荧光染色MBP表达情况
通过MBP免疫荧光染色观察到:WMD模型组白质区胼胝体可见明显的髓鞘丢失(图1A)。WMD模型组、10 mg/(kg·d)咪康唑组、40 mg/(kg·d)咪康唑组的胼胝体MBP表达量差异有统计学意义(F=37.37,P<0.001);10 mg/(kg·d)咪康唑组和40 mg/(kg·d)咪康唑组的胼胝体MBP表达量均高于WMD模型组,40 mg/(kg·d)咪康唑组高于10 mg/(kg·d)咪康唑组,差异均有统计学意义(P<0.05)。见表1、图1。

图1 髓鞘碱性蛋白(MBP)免疫荧光染色
表1 各组大鼠IOD比较(±s)
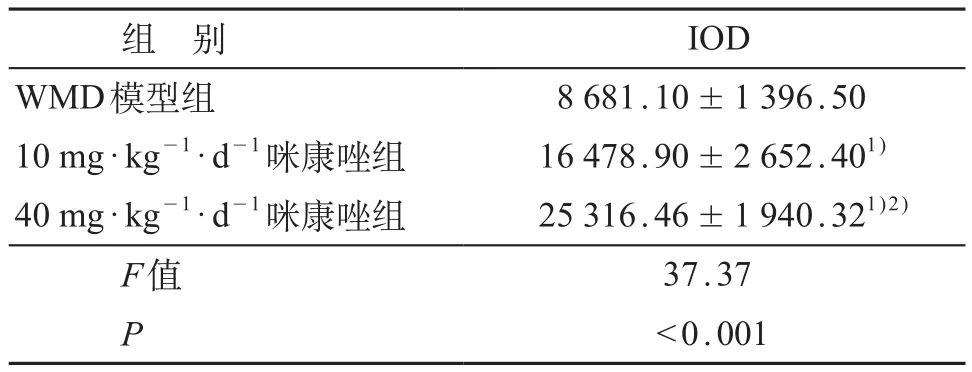
表1 各组大鼠IOD比较(±s)
注:1)与WMD模型组比较,P<0.05;2)与10 mg·kg-1·d-1咪康唑组比较,P<0.05
组 别 IOD WMD模型组 8 681.10±1 396.50 10 mg·kg-1·d-1咪康唑组 16 478.90±2 652.401)40 mg·kg-1·d-1咪康唑组 25 316.46±1 940.321)2)F值 37.37 P <0.001
2.2 Western blot检测胼胝体MBP表达
Western blot结果显示,与WMD模型组(0.17)比较,咪康唑处理组MBP蛋白的表达量(目的条带灰度值和内参条带灰度值比值)有所提高。且10 mg/(kg·d)咪康唑组(0.52)较10 mg/(kg·d)咪康唑组(0.31)高。由此可见,咪康唑增加胼胝体MBP髓鞘蛋白的表达,提示其对缺氧缺血导致的脑白质损伤具有一定的保护作用。见图2。
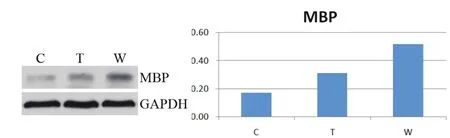
图2 Western blot检测髓鞘碱性蛋白(MBP)的表达量
2.3 超微结构电镜结果
透射电镜观察各组大鼠脑室周围白质髓鞘的超微结构,WMD模型组罕见髓鞘形成,神经纤维形态不规则,排列松散,髓鞘厚度明显降低。经10 mg/(kg·d)和40 mg/(kg·d)咪康唑治疗后髓鞘数量较WMD模型组明显增多,并可明显改善缺血所致的脱髓鞘和髓鞘厚度降低。提示咪康唑明显有助于改善早产儿WMD大鼠脑白质髓鞘形成不良的状况。见图3。
2.4 体质量增长速度
各组大鼠术前平均体质量分别为(7.7±0.3)g、(7.6±0.4)g、(7.6±0.3)g、(7.5±0.3)g,各组间体质量差异无统计学意义(P>0.05)。术后第1天,假手术组的体质量最高,高于其他三组,差异有统计学意义(P<0.05),而其他三组之间的差异无统计学意义(P>0.05)。术后第3、5、7、9、11天,假手术组的体质量仍然最高,高于其他三组。并且,10 mg/(kg·d)和40 mg/(kg·d)咪康唑组的体质量均高于WMD模型组,差异有统计学意义(P<0.05),值得注意的是,10 mg/ (kg·d)和40 mg/(kg·d)咪康唑组之间的体质量差异无统计学意义(P>0.05)。见表2。

图3 超微结构电镜
3 讨论
早产儿WMD可引起长期的运动和认知功能障碍,是儿童脑瘫和智力障碍的主要病因之一。极低出生体质量儿(<1 500 g)是早产儿WMD的高危人群,10%~15%可出现运动功能障碍,25%~50%呈现认知、行为缺陷或社会化功能障碍[6],是早产儿神经系统和智能发育障碍的最主要原因,已成为影响早产儿生存质量的严重问题,引起了广泛关注。遗憾的是,目前早产儿WMD没有任何有效的治疗方法。WMD发病的主要原因是脑内OPCs损伤,脑白质髓鞘化延迟或被破坏。近年来,不断有研究学者将外源性OPCs移植入动物脑内,验证其是否存活并分化为成熟OLs,发挥髓鞘化的作用。2009年,研究者将OPCs移植到脂多糖诱导的脑室周围白质软化(PVL)模型大鼠,7周后观察发现绝大多数移植细胞存活,但仍表达NG2、O4、Olig2等OPCs特异性标记物,这说明移植的OPCs没有分化为成熟的OLs[7]。又有研究者将人神经干细胞诱导而来的OPCs移植到脱髓鞘模型小鼠,尽管移植8周后仍可见大量植入细胞,仅有不到2%细胞表达成熟OLs特异性标记物MBP[8]。这些研究结果表明,尽管移植的OPCs能够迁移至损伤区域并长期存活,但绝大多数细胞并不能分化为成熟OLs,而是保持在前体细胞阶段。神经系统的自我修复一直以来都是世界难题,研究发现中枢神经生长微环境是影响神经元、轴突再生的一个关键因素[9];近年来,从改善神经再生微环境入手,寻找促进轴突再生的有效靶点成为了神经修复研究的新方向[10]。
既然外源性OPCs在脑内难以分化为OLs,发挥成髓鞘作用。因此,我们尝试寻找一种促进内源性OPCs存活、分化及髓鞘形成的方法来治疗各种脱髓鞘病变将会是脱髓鞘性疾病新的曙光。目前,大多数的药物都是依靠强大的抗炎和免疫抑制作用来减少免疫系统对髓鞘的攻击来缓解脱髓鞘病变的临床症状,但这类药物对疾病的进展却影响甚微。因此,寻找非免疫性介导的药物来促进体内OPCs的分化和髓鞘再生至关重要。研究发现,像苯托品[11]等毒蕈碱受体拮抗剂类小分子药物,可促进髓鞘再生,进而改善MS的疾病进展。值得一提的是,该类拮抗剂中的另一成员,已获FDA批准且目前广泛用于抗真菌感染治疗的咪康唑,可高效地促进体外培养的OPCs的分化,并可促进MS脱髓鞘鼠内源性OPCs的分化,这表明咪康唑在OPCs分化早期起重要的调控作用。鉴于此,我们发现咪康唑同样可以促进早产儿WMD模型大鼠内源性OPCs的分化,发挥成髓鞘作用,对早产儿WMD导致的缺氧缺血性损伤具有保护性作用。
研究证实,大鼠脑白质的易损期是生后2~3天,而生后2天的大鼠手术后极易造成幼鼠死亡[12]。因此,本研究选取新生3日龄SD大鼠,采用结扎右侧颈总动脉,缺氧80 min的方法制作早产儿WMD模型。造模后,缺氧缺血所致的脱髓鞘损伤开始逐渐加剧,并且,咪康唑可通过血脑屏障到达脑组织,因此,我们选择在造模后第1天腹腔注射不同浓度的咪康唑,力图在损伤的高峰期保护髓鞘的继续脱失,并促进内源性OPCs的分化,从而达到治疗的目的。
本研究主要还通过MBP免疫荧光染色、Western blot以及超微结构电镜等手段,观察咪康唑对OLs成髓鞘的保护作用。整个实验结果将为咪康唑应用于临床治疗WMD提供了实验依据,并为治疗WMD药物的研发提供了新的思路。本研究发现,通过MBP免疫荧光染色观察到WMD大鼠经10 mg/(kg·d)和 40 mg/ (kg·d)咪康唑治疗后,胼胝体MBP表达量较WMD模型组高,且40 mg/(kg·d)咪康唑组MBP表达水平较10 mg/(kg·d)咪康唑组高;Western blot结果也显示咪康唑处理组MBP表达水平较模型对照组高;并且,电镜结果进一步证实了经咪康唑治疗后,可明显改善缺氧缺血所致的脱髓鞘改变。因此,咪康唑有助于改善早产儿WMD大鼠脑白质髓鞘形成不良的状况。同时,本研究通过观察各组大鼠的体质量来评估其生长发育情况,发现咪康唑可有效改善缺氧缺血后幼鼠的生长发育情况,但40 mg/(kg·d)咪康唑组的体质量增长速度与10 mg/(kg·d)咪康唑组相比,差异没有统计学意义(P>0.05),我们分析这可能是由于高浓度的咪康唑会对新生大鼠的消化系统有一定的不良反应,例如恶心、呕吐、腹泻和食欲减退等,从而导致早产儿WMD大鼠的生长发育产生一定的影响。
表2 各组大鼠不同日龄体质量的比较 (±s, g)

表2 各组大鼠不同日龄体质量的比较 (±s, g)
注:1)与WMD模型组比较,P<0.05;2)与10 mg·kg-1·d-1咪康唑组比较,P<0.05;3)与40 mg·kg-1·d-1咪康唑组比较,P<0.05
组 别 术前 术后1天 术后3天 术后5天 术后7天 术后9天 术后11天WMD模型组 7.7±0.3 7.8±0.3 9.5±0.5 12.5±0.6 14.8±1.1 17.5±1.2 21.5±1.4 10 mg·kg-1·d-1咪康唑组7.6±0.4 8.0±0.7 10.8±0.41) 14.3±1.01) 17.7±0.81) 21.4±1.11) 25.0±1.51)40 mg·kg-1·d-1咪康唑组7.6±0.3 7.9±0.2 11.0±1.21) 14.1±0.71) 18.6±1.11) 21.9±1.01) 24.7±1.41)假手术组 7.5±0.3 9.0±0.41)2)3)13.0±0.71)2)3)16.6±1.11)2)3)21.2±1.51)2)3)27.2±1.01)2)3)32.3±1.71)2)3)F值 0.217 9.419 17.205 19.533 26.666 69.956 45.442 P 0.883 0.001 <0.001 <0.001 <0.001 <0.001 <0.001
综上所述,咪康唑可以通过促进髓鞘的形成保护缺氧缺血诱导的早产儿WMD,并改善其生长发育情况。然而,本研究仅仅是咪康唑对大鼠缺氧缺血性早产儿WMD保护作用的初步探讨,还需要进一步的研究明确:①咪康唑促进内源性OPCs发育分化的最佳剂量,加大单次剂量或追加给药次数是否对脑损伤有更好的保护作用;②咪康唑的最佳用药方式,腹腔注射是否为最佳的用药方式呢?其是否适用于肌肉注射,皮下注射或是静脉注射呢等方式呢?这都需要进一步的研究探讨;③咪康唑的最佳给药时间窗及其给药次数;④此外,咪康唑促进内外源性OPCs发育分化以及髓鞘形成的作用机制也需要进一步的研究探讨,我们会在后续的实验中探讨这部分的研究。
[1]Volpe JJ. Cerebral white matter injury of the premature infant-more common than you think [J]. Pediatrics, 2003,112(1):176-80.
[2]程童菲, 富建华, 薛辛东. 新生大鼠缺氧缺血性脑白质损伤脑组织形态学的动态演变[J]. 中国医科大学学报, 2015, 44(11): 987-991.
[3]Welin AK, Sedin P, Lapatto R, et al. Melatonin reduces inflammation and cell death in white matter in the mid gestation fetal sheep following umbilical cord occlusion [J]. Pediatr Res, 2007, 61(2):153-158.
[4]Najm FJ, Madhavan M, Zaremba A, et al. Drug-based modulation of endogenous stem cells promotes functional remyelination in vivo [J]. Nature, 2015, 522(7555):216-220.
[5]杨印祥, 索磊, 杜庆安,等. 缺氧时间对脑白质损伤程度影响的实验研究[J]. 临床儿科杂志, 2015, 33(10): 883-886.
[6]van Wezel-Meijler G, Steggerda SJ, Leijser LM. Cranial ultrasonography in neonates: role and limitations [J]. Semin Perinatol, 2010, 34(1):28-38.
[7]Webber DJ, van Blitterswijk M, Chandran S. Neuroprotective effect of oligodendrocyte precursor cell transplantation in a long-term model of periventricular leukomalacia [J]. Am J Pathol, 2009, 175(6):2332-42.
[8]Jiang S, Seng S, Avraham HK, et al. Process elongation of oligodendrocytes is promoted by the Kelch-related protein MRP2/KLHL1 [J]. J Biol Chem, 2007, 282(16):12319-29.
[9]Dooley D, Vidal P, Hendrix S. Immunopharmacological intervention for successful neural stem cell therapy: New perspectives in CNS neurogenesis and repair [J]. Pharmacol Ther, 2014, 141(1):21-31.
[10]Zhao XH, Jin WL, Ju G. An in vitro study on the involvement of LINGO-1 and Rho GTPases in Nogo-A regulated differentiation of oligodendrocyte precursor cells [J]. Mol Cell Neurosci, 2007, 36(2):260-9.
[11]Deshmukh VA, Tardif V, Lyssiotis CA, et al. A regenerative approach to the treatment of multiplesclerosis [J]. Nature, 2013, 502(7471):327-332.
[12]Haynes RL, Folkerth RD, Keefe RJ, et al. Nitrosative and oxidative injury to premyelinating oligodendrocytes in periventricular leukomalacia [J]. J Neuropathol Exp Neurol, 2003, 62(5):441-450.
Protective effect of miconazole on white matter damage induced by anoxia and ischemia in rats
TANG Wenyan1,2, SU Xuewen2, YANG Yinxiang2, LUAN Zuo1,2
(1. The Third Clinical College of Southern Medical University, Guangzhou 510515, Guangdong, China;2. Navy General Hospital of Chinese People’s Liberation Army, Beijing 100048, China)
ObjectiveTo explore the protective effect of miconazole on white matter damage (WMD) in neonatal rats.MethodsThree-day-old neonatal SD rats were randomly divided into sham group, WMD model group, 10 mg/(kg·d) miconazole group and 40 mg/(kg·d) miconazole group with 15 rats each. Rats in WMD model group were subjected to the ligation of right carotid artery, and then kept in a chamber with 6% oxygen and 94% nitrogen for 80 min to establish the white matter damage model. The rats in miconazole group were intraperitoneally injected with different doses (10 and 40mg/kg) of miconazole, dissolved in dimethyl sulfoxide (DMSO), for fi ve consecutive days, and rats in WMD model group were injected with the same volume of DMSO. Myelin basic protein (MBP) of white matter was detected by immuno fl uorescence staining and western blot. Myelin sheaths of corpus callosum were observed by transmission electron microscopy. Weight changes of rats were compared among groups.ResultsImmuno fl uorescence staining and western blot showed that, after treatment with miconazole, the MBP expression level of corpus callosum was higher than in WMD model group (P<0.05). In WMD model group, the myelin sheath of corpus callosum had loose structure and a large number of small vacuoles with decreased thickness of myelin sheath. After treatment with miconazole, myelinolysis induced by anoxia and ischemia could be improved signi fi cantly. The increase in weight of rats in WMD model group was signi fi cantly less than that in sham group. And after miconazole treatment, the rate of weight gain of rats was increased. Conclusion Miconazole can signi fi cantly reduce the brain white matter damage induced by anoxia and ischemia through promoting myelination, and then improves the growth and development in rats.
white matter damage; miconazole; myelin basic protein; premature infant
10.3969/j.issn.1000-3606.2017.06.016
2016-10-16)
(本文编辑:邹 强)
国家自然科学基金面上项目(No.81471486);国家国际科学合作专项(No.2012DFA30880)
栾佐 电子信箱:luanzuo@aliyun.com

