脐带血维生素D水平与新生儿生长指标的关系
叶秀霞宋沅谨姜艳蕊林建华张 宇贝 斐江 帆
1.上海交通大学医学院附属上海儿童医学中心 (上海 200127);2.上海交通大学医学院附属仁济医院产科(上海 200127)
脐带血维生素D水平与新生儿生长指标的关系
叶秀霞1宋沅谨1姜艳蕊2林建华2张 宇1贝 斐1江 帆1
1.上海交通大学医学院附属上海儿童医学中心 (上海 200127);2.上海交通大学医学院附属仁济医院产科(上海 200127)
目的了解新生儿脐带血维生素D水平现况,探讨脐带血维生素D水平与新生儿生长指标的相关性。方法共纳入223对足月单胎母子。问卷法收集母亲孕期信息;测量新生儿出生体质量、头围和身长指标;采用酶联免疫法测定新生儿脐带血和母亲孕晚期血25(OH)D浓度。结果脐带血25(OH)D平均浓度为20.7 nmol/L,维生素D缺乏率达82.1%,其中严重缺乏率为12.1%(<10 nmol/L)。子代与母亲孕晚期25(OH)D浓度基本一致。脐带血不同25(OH)D 浓度新生儿的出生季节分布差异有统计学意义(P<0.05),<10 nmol/L组冬春季节所占比例较高。脐带血25(OH)D 浓度与低出生体质量(LBW)和小于胎龄(SGA)新生儿的发生率均无显著相关(P>0.05)。控制性别、胎龄、出生季节等变量后,脐带血不同25(OH)D 浓度组间的出生体质量和头围差异有统计学意义(P<0.05)。结论足月新生儿脐带血25(OH)D浓度普遍低,维生素D缺乏状态与其母亲孕晚期维生素D状况基本一致。脐带血25(OH)D浓度与新生儿出生体质量和头围存在一定相关性,其具体规律尚有待进一步扩大样本验证。
脐带血; 25(OH)D; 生长指标; 新生儿
近年来,越来越多的研究发现,除传统的钙磷代谢和骨代谢作用外,维生素D还与骨外系统如免疫系统、心血管系统以及预防肿瘤发生等有关。随着对维生素D的深入认识,维生素D缺乏现象也受到越来越多的重视,尤其孕妇维生素D缺乏或不足的现象已经成为全世界关注的问题,不同维度和不同发展水平国家都先后报道过[1-3]。在英国、阿拉伯联合酋长国、伊朗、北印度、新西兰和荷兰非西方孕妇中,维生素D的缺乏率分别达18%、25%、80%、42%、61%和60%~84%[4]。国内报道显示,半数以上孕妇维生素D处于缺乏状态[5-7]。
孕期维生素D缺乏不仅对孕妇本身有影响,增加其自身细菌性阴道炎、妊娠糖尿病、先兆子痫和剖宫产的风险[1];同时生命早期维生素D的缺乏或不足也可能对子代造成不良的影响,这种影响也可能会延续到成人,如代谢性骨病和过敏性疾病[8-11],还有免疫功能异常[12]等。为数不多的出生队列研究显示,子代出生时的身长和体质量与孕母维生素D状态有关,但不同国家地区和种族的结果不完全一致。丹麦Dalgard等[13]发现,较之于脐带血25(OH)D浓度大于50 nmol/L的新生儿,脐带血25(OH)D浓度小于12 nmol/L新生儿的身长会短0.49 cm(95%CI:0.05~0.93 cm)。母孕期维生素D不足或缺乏也可增加低出生体质量儿(low birth weight infant,LBWI)和小于胎龄儿(small for gestational age,SGA)的风险[5,14-16]。
可见,生命早期维生素D的不足或缺乏可能会对其生后生长产生负面影响,但报道不尽一致。国内有关孕晚期维生素D水平及其对子代生长影响的研究报道甚少。本研究旨在了解上海市母孕晚期和其新生儿脐带血维生素D的状态,探讨脐带血维生素D水平和婴儿出生体质量、身长和头围的相关性,为维生素D对生命早期婴儿生长的影响提供新的依据。
1 对象与方法
1.1 研究对象
2012年8月—2013年7月在上海交通大学医学院附属仁济医院招募研究对象。根据研究的纳入和排除标准共招募到277名孕35周及以上的健康孕妇,其中14名产前退出研究;新生儿出生后,根据排除标准,最后获得223对合格母子样本。研究对象的纳入标准:①孕晚期母亲长期居住于上海且2年无搬迁计划;②孕晚期母亲愿意参加本课题,并且能够在规定时间前来随访;③单胎活产正常新生儿。研究对象的排除标准:①孕晚期母亲在妊娠期间出现过早产征象;②孕晚期母亲曾被确诊过任何严重的需要医疗手段治疗的妊娠期疾病,如妊娠高血压、糖尿病等;③孕晚期母亲曾被确诊过任何严重的需要医疗手段治疗的慢性、器质性疾病,如严重心脏病、肝肾疾病等;④新生儿出生时有窒息史,1分钟或5分钟Apgar评分7分及以下;⑤新生儿出生后曾被送入新生儿重症监护室。
本研究获医院医学伦理委员会审批(SCMCIRB-2012033)及患者知情同意。
1.2 方法
1.2.1 临床资料收集 采用自拟问卷,在孕晚期对进入队列孕妇进行基本资料调查,包括个人资料、家庭环境以及孕期特殊用药和运动情况等。采用飞利浦Actiwatch 2记录母孕晚期夜间睡眠时间。
1.2.2 新生儿生长指标测量 出生体质量采用产院测量结果,精确到1 g。头围和身长(测量方法详见《诸福棠实用儿科学》第8版)在生后第3天由经过培训的固定工作人员测量,采用固定的测量工具,均精确到0.1 cm。
1.2.3 血液标本留取和检测方法 产前母血标本和新生儿脐带血各2 mL,-80℃冰箱冻存待用。采用罗氏e601设备,罗氏25(OH)D检测试剂盒检测25(OH) D 浓度。脐带血25(OH)D 浓度≥50nmol/L表示充足,30~ nmol/L表示不足,<30 nmol/L表示缺乏,<10 nmol/L表示严重缺乏[8]。
1.3 统计学分析
采用SPSS 13.0统计软件进行数据分析。正态分布计量资料以均数±标准差表示,多组间比较采用单因素方差分析或协方差分析;两组间比较采用配对t检验。计数资料以百分比表示,组间比较采用χ2检验。母子血25(OH)D 浓度一致性采用Kappa一致性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般情况
根据脐带血25(OH)D 浓度检测结果,研究对象分为≥50 nmol/L组,30~ nmol/L组,<30 nmol/L组以及<10 nmol/L组。因大于50nmol/L的样本只有1例,所以将≥50nmol/L和30~的分组进行合并,表示为≥30nmol/L组。
不同脐带血25(OH)D 浓度新生儿母亲在怀孕时年龄、身高、孕前BMI、孕期是否服用维生素D、孕晚期夜间睡眠时间、非节假日坐着时间和家人吸烟等方面,差异均无统计学意义(P>0.05)。见表1。
脐带血不同25(OH)D 浓度新生儿的出生季节分布差异有统计学意义(P<0.05),<10 nmol/L组冬春季节所占比例较高。脐带血不同25(OH)D 浓度新生儿在性别和胎龄方面差异均无统计学意义(P>0.05)。见表2。
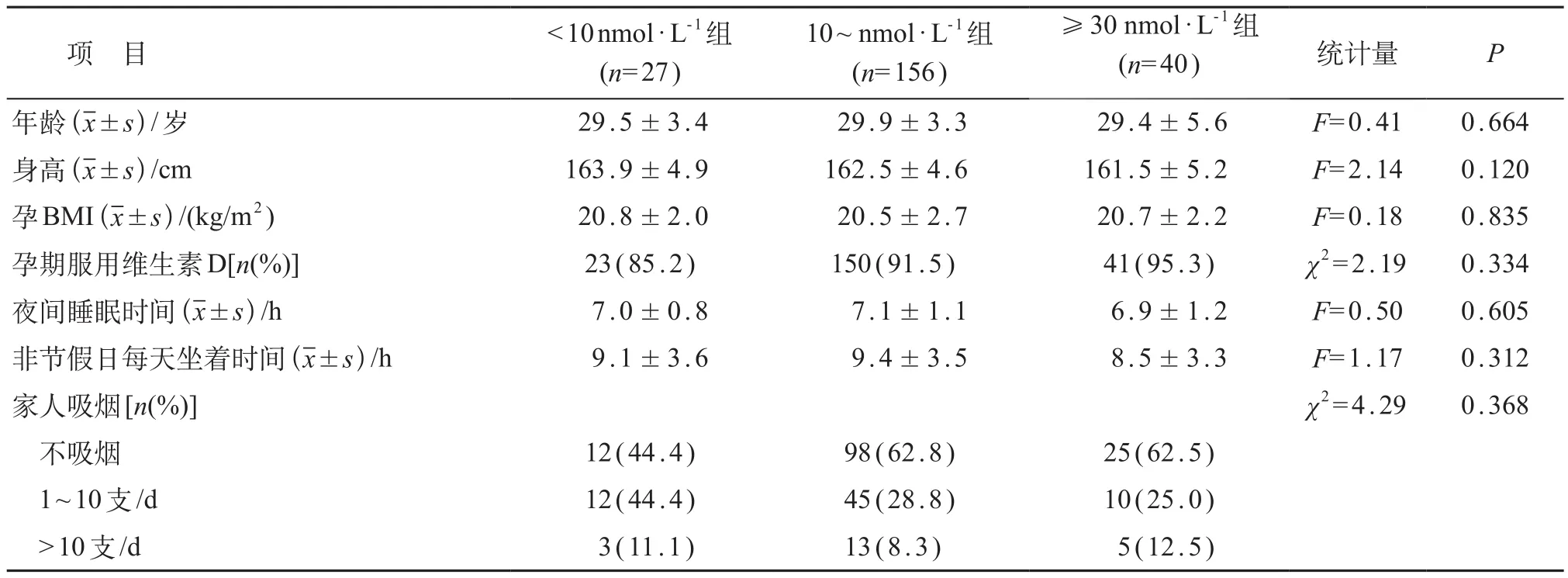
表1 不同脐带血25(OH)D 浓度新生儿母亲基本信息比较
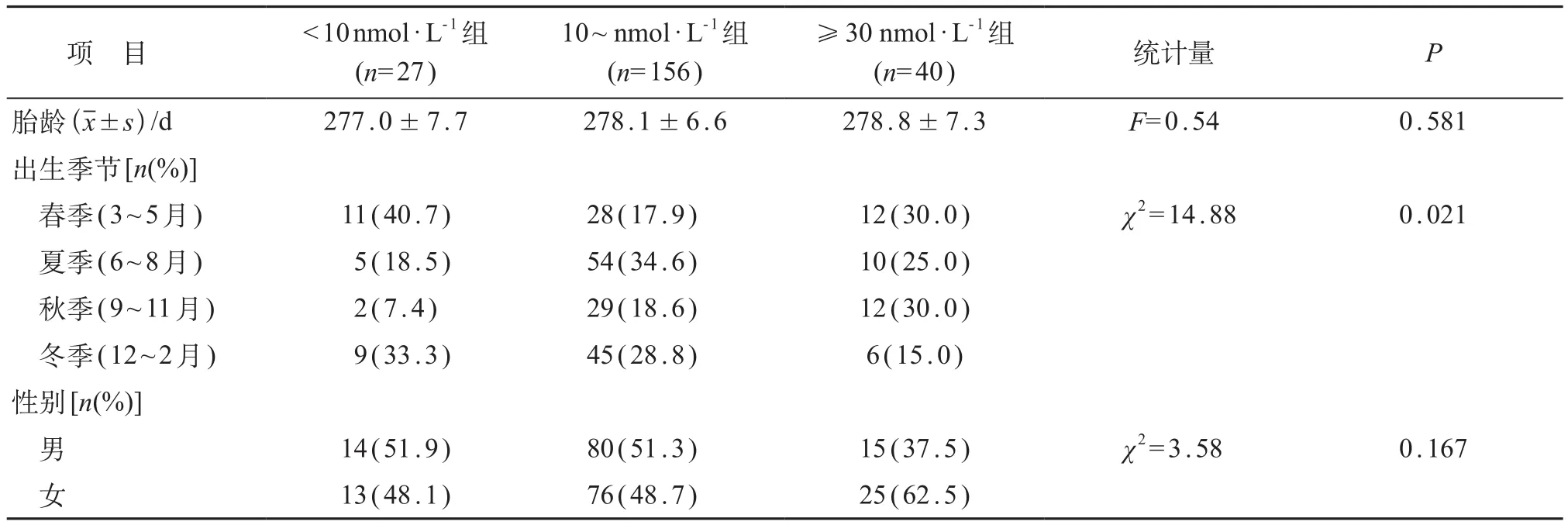
表2 脐带血不同25(OH)D 浓度新生儿的基本信息比较
表3 孕母和子代血不同25(OH)D 浓度比较(±s,nmol·L-1)
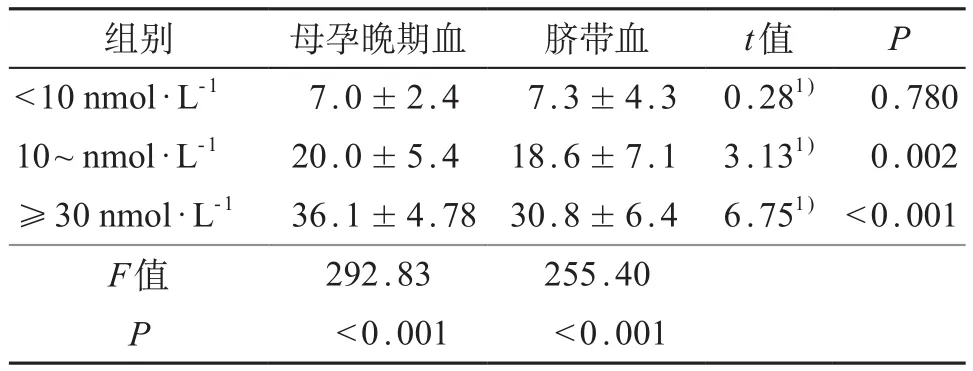
表3 孕母和子代血不同25(OH)D 浓度比较(±s,nmol·L-1)
注:1)配对t检验
组别 母孕晚期血 脐带血 t值 P <10 nmol·L-1 7.0±2.4 7.3±4.3 0.281) 0.780 10~ nmol·L-1 20.0±5.4 18.6±7.1 3.131) 0.002≥30 nmol·L-1 36.1±4.78 30.8±6.4 6.751)<0.001 F值 292.83 255.40 P <0.001 <0.001
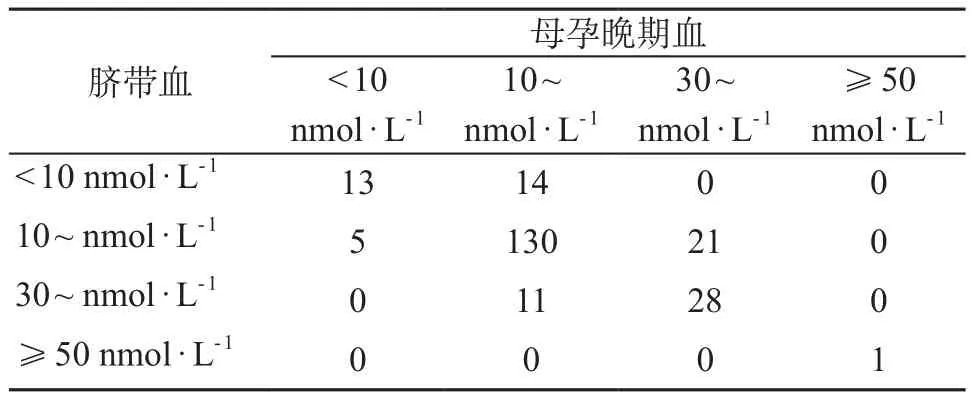
表4 母子不同血25(OH)D 浓度Kappa一致性分析
2.2 新生儿脐带血和母孕晚期血25(OH)D 浓度比较
母亲和其子代脐带血≥50 nmol/L的样本只有1对,99.5%脐带血和母亲孕晚期血25(OH)D 浓度处于不足和缺乏状态,其中母子共同存在严重维生素D缺乏的发生率为5.8%。见表3。
新生儿脐带血和母孕晚期不同血25(OH)D 浓度Kappa一致性分析显示,母子血25(OH)D 浓度一致性较好(Kappa=0.50,P<0.001)。见表4。
2.3 脐带血25(OH)D 浓度与新生儿生长
223名新生儿中,LBWI和SGA的发生率分别为0.9%和4.9%,脐带血不同25(OH)D 浓度组间LBWI和SGA发生率差异均无统计学意义(P>0.05)。见表5。
进一步控制性别、胎龄、出生季节、母孕前BMI、母孕晚期夜间睡眠时间、非节假期坐着时间和有无维生素D摄入等变量,运用协方差分析,对脐带血不同25(OH)D 浓度与新生儿生长指标的关系进行分析,结果显示,脐带血不同25(OH)D 浓度组间出生体质量和头围的差异有统计学意义(P均<0.05)。见表6。

表5 脐带血不同25(OH)D 浓度与LBWI和SGA发生率关系
表6 脐带血不同25(OH)D 浓度与新生儿生长指标关系(±s)

表6 脐带血不同25(OH)D 浓度与新生儿生长指标关系(±s)
组 别 例数 出生体质量/g 身长/cm 头围/cm≥30 nmol·L-1 40 3326.9±359.5 49.9±1.4 34.4±1.6 10~ nmol·L-1 156 3362.5±395.1 49.7±2.5 34.5±1.7 <10 nmol·L-1 27 3481.2±413.4 49.9±1.1 34.6±1.0 F值 2.98 1.03 2.45 P 0.003 0.420 0.012
3 讨论
孕妇孕期维生素D缺乏的现象仍较普遍[4,16],预防孕妇孕期维生素D缺乏仍是一个很重要的公共卫生问题,但可幸的是孕期维生素D缺乏对孕妇和子代的潜在影响是可以预防的。本研究发现,母亲和其子代脐带血大于50nmol/L的样本只有1对,99.5%新生儿脐带血和母亲孕晚期血25(OH)D 浓度处于不足和缺乏状态(<50 nmol/L),其中5.8%母子存在持续严重缺乏(<10 nmol/L)。上海处于北纬31度,孕母和新生儿维生素D不足和缺乏比较普遍,本研究结果略高于上海以往的报道和国外的研究,这可能与样本量和取样差异有关,也可能与种族差异有关。2012年上海市第六人民医院对就诊的1 695名孕妇研究发现,孕早期90.5%维生素D 水平低于50 nmol/L,不足和缺乏率分别为21.9%和68.6%[17]。2014年上海市环境与儿童健康重点实验室对2个医院共1 030名新生儿脐带血的维生素D水平研究发现,36.3%脐带血维生素D水平低于50 nmol/L[18]。印度位于北纬8.4至37.6度之间,与上海比较接近,至少95.7 % 新生儿维生素D 水平低于 50 nmol/L[19]。澳大利亚昆士兰大学的研究发现,孕中期26%孕妇和46%新生儿脐带血维生素D水平低于25nmol/L,其中21%母子存在持续的维生素D缺乏[1]。
本研究同时发现,新生儿出生时维生素D水平与其出生季节有关,这与相关研究一致[1,18],参考相关文献,我们进一步控制了性别、胎龄、出生季节、母亲孕前BMI、母孕晚期夜间睡眠时间、非节假期坐着时间和有无维生素D摄入等因素后,不同脐带血25(OH) D浓度新生儿之间出生体质量和头围的差异存在统计学意义,而与LBWI和SGA发生率无显著相关。为数不多的出生队列研究显示,子代出生时的体质量、身长和头围与母孕期和脐带血维生素D的状态有关。美国的一项出生队列研究显示,母孕26周之前血25(OH)D水平>37.5 nmol/L的子代比<37.5 nmol/L的子代出生体质量重46 g、头围大0.13cm[20]。澳大利亚的大样本研究显示母亲孕早期血25(OH)D水平<25 nmol/L可能会增加SGA的风险[21]。我国安徽省的队列研究结果显示,母孕期(孕早期样本占35.1%、孕中期占62.0%和孕晚期占2.9%)血25(OH)D水平<75 nmol/L,尤其<50 nmol/L增加了LBWI和SGA发生的危险[5]。丹麦Dalgard等[13]发现,与脐带血25(OH)D浓度>50 nmol/L的新生儿相比,脐带血25(OH)D浓度<12 nmol/L新生儿的身长短了0.49cm(95%CI:0.05~0.93cm)。母孕早中期25(OH)D浓度影响胎儿骨容量和新生儿的骨长[22]。
我们的研究结论与类似研究不完全一致,可能与以下因素有关。首先,目前对脐带血维生素D水平研究较少,大多研究采用的是孕早期、中期和晚期维生素D水平,但孕早中期、孕晚期和脐带血25(OH)D浓度会随着胎儿的发育发生不同的改变。目前的研究对于脐带血和母孕晚期的血25(OH)D水平孰高孰低尚无定论,认为两者都有可能[13,23],本研究结果提示母孕晚期维生素D水平稍高于脐带血。其次,多个研究对于维生素D缺乏的诊断标准不完全一致,这也给研究的一致性评价带来了困难。再次,可能需要考虑更多的研究因素,本研究控制了诸如性别、胎龄、出生季节、母亲孕前BMI、母孕晚期夜间睡眠时间、非节假期坐着时间和有无维生素D(药物)摄入等因素,但也有研究认为多食用海鲜的孕母会摄入更多的多不饱和脂肪酸,会增加新生儿的出生体质量[24],我们的研究与大多数的研究一致没有控制孕妇孕期海鲜等摄入分析,这有待进一步完善;关于其他混杂因素[25],比如母亲孕期运动水平,我们通过问询非假日坐着时间来控制这个因素,这是目前其他研究尚未提及的。最后,本研究样本量少也是影响研究结论的重要因素,这有待以后进一步完善。
综上,本研究队列人群发现,足月新生儿脐带血25(OH)D浓度普遍较低,维生素D缺乏状态与其母亲孕晚期的维生素D营养状况基本一致。脐带血25(OH)D浓度与新生儿出生体质量和头围存在一定相关性,其具体规律尚有待在更大样本中验证。
参考文献:
[1]Vinkhuyzen AA, Eyles DW, Burne TH, et al. Prevalence and predictors of vitamin D deficiency based on maternal midgestation and neonatal cord bloods. The Generation R Study [J]. J Steroid Biochem Mol Biol, 2016, 164: 161-167.
[2]Ates S, Sevket O, Ozcan P, et al. Vitamin D status in the first-trimester: effects of Vitamin D de fi ciency on pregnancy outcomes [J]. Afr Health Sci, 2016, 16(1): 36-43.
[3]Hossein-nezhad A, Holick MF. Optimize dietary intake of vitamin D: an epigenetic perspective [J]. Curr Opin Clin Nutr Metab Care, 2012, 15(6): 567-579.
[4]Dawodu A, Wagner CL. Mother-child vitamin D de fi ciency: an international perspective [J]. Arch Dis Child, 2007, 92(9): 737-740.
[5]Chen YH, Fu L, Hao JH, et al. Maternal vitamin D de fi ciency during pregnancy elevates the risks of small for gestational age and low birth weight infants in Chinese population [J]. J Clin Endocrinol Metab, 2015, 100(5): 1912-1919.
[6]Yun C, Chen J, He Y, et al. Vitamin D de fi ciency prevalence and risk factors among pregnant Chinese women [J]. Public Health Nutr, 2015, 20: 1-9.
[7]Xiao JP, Zang J, Pei JJ, et al. Low maternal vitamin D status during the second trimester of pregnancy: a cross-sectional study in Wuxi, China [J]. PLoS One, 2015, 6(10): e0117748.
[8]Munns CF, Shaw N, Kiely M, et al. Global consensus recommendations on prevention and management of nutritional rickets [J]. J Clin Endocrinol Metab, 2016, 101(2): 394-415.
[9]Dawodu A, Akinbi H. Vitamin D nutrition in pregnancy: current opinion [J]. Int J Womens Health, 2013, 5: 333-343.
[10]Shin JS, Choi MY, Longtine MS, et al. Vitamin D effects on pregnancy and the placenta [J]. Placenta, 2010, 31(12): 1027-1034.
[11]Miyake Y, Sasaki S, Tanaka K, et al. Dairy food, calcium and vitamin D intake in pregnancy, and wheeze and eczema in infants [J]. Eur Respir J, 2010, 35(6): 1228-1234.
[12]Tamblyn JA, Hewison M, Wagner CL, et al. Immunological role of vitamin D at the maternal-fetal interface [J]. J Endocrinol, 2015, 224(3): R107-121.
[13]Dalgard C, Petersen MS, Steuerwald U, et al. Umbilical cord serum 25-hydroxyvitamin D concentrations and relation to birthweight, head circumference and infant length at age 14 Days [J]. Paediatr Perinat Epidemiol, 2016, 30(3): 238-245.
[14]Tian Y, Holzman C, Siega-Riz AM, et al. Maternal serum 25-Hydroxyvitamin D concentrations during pregnancy and infant birthweight for gestational age: a three-cohort study [J]. Paediatr Perinat Epidemiol, 2016, 30(2): 124-133.
[15]Nobles CJ, Markenson G, Chasan-Taber L. Early pregnancy vitamin D status and risk for adverse maternal and infant outcomes in a bi-ethnic cohort: the Behaviors Affecting Baby and You (B.A.B.Y.) Study [J]. Br J Nutr, 2015, 114(12): 2116-2128.
[16]Wei SQ, Qi HP, Luo ZC, et al. Maternal vitamin D status and adverse pregnancy outcomes: a systematic review and meta-analysis [J]. J Matern Fetal Neonatal Med, 2013, 26(9): 889-899.
[17]Tao M, Shao H, Gu J, et al. Vitamin D status of pregnant women in Shanghai, China [J]. J Matern Fetal Neonatal Med, 2012, 25(3): 237-239.
[18]Yu X, Wang W, Wei Z, et al. Vitamin D status and related factors in newborns in Shanghai, China [J]. Nutrients, 2014, 6(12): 5600-5610.
[19]Trilok Kumar G, Chugh R, Eggersdorfer M. Poor vitamin D status in healthy populations in india: a review of current evidence [J]. Int J Vitam Nutr Res, 2015, 85(3-4): 185-201.
[20]Gernand AD, Simhan HN, Klebanoff MA, et al. Maternal serum 25-hydroxyvitamin D and measures of newborn and placental weight in a U.S. multicenter cohort study [J]. J Clin Endocrinol Metab, 2013, 98(1): 398-404.
[21]Schneuer FJ, Roberts CL, Guilbert C, et al. Effects of maternal serum 25-hydroxyvitamin D concentrations in the first trimester on subsequent pregnancy outcomes in an Australian population [J]. Am J Clin Nutr, 2014, 99(2): 287-295.
[22]Viljakainen HT, Saarnio E, Hytinantti T, et al. Maternal vitamin D status determines bone variables in the newborn [J]. J Clin Endocrinol Metab, 2010, 95(4): 1749-1757.
[23]Vieth Streym S, Kristine Moller U, Rejnmark L, et al. Maternal and infant vitamin D status during the fi rst 9 months of infant life-a cohort study [J]. Eur J Clin Nutr, 2013, 67(10): 1022-1028.
[24]Olsen SF, Grandjean P, Weihe P, et al. Frequency of seafood intake in pregnancy as a determinant of birth weight: evidence for a dose dependent relationship [J]. J Epidemiol Community Health, 1993, 47(6): 436-440.
[25]Bodnar LM, Klebanoff MA, Gernand AD, et al. Maternal vitamin D status and spontaneous preterm birth by placental histology in the US Collaborative Perinatal Project [J]. Am J Epidemiol, 2014, 179(2): 168-176.
Vitamin D level in cord blood and neonatal outcomes in a birth cohort study in Shanghai
YE Xiuxia1, SONG Yuanjin1, JIANG Yanrui2, LIN Jianhua2, ZHANG Yu1, BEI Fei1, JIANG Fan1
(1. Shanghai Children's Medical Center Af fi liated to Shanghai Jiaotong University School of Medicine, Shanghai 200127, China. 2. Obstetrical Department, Renji Hospital Affiliated to Shanghai Jiaotong University School of Medicine, Shanghai 200127, China)
Objectives To detect the cord blood vitamin D level in neonates and to determine the association between the cord blood vitamin D level and neonatal outcomes.MethodsA total of 223 eligible mother-and-singleton-offspring pairs were recruited. The information of mothers’ pregnancy was collected by questionnaires. The weight, length, and head circumference of neonates were measured. The levels of 25(OH)D in cord blood of neonates and in blood of late pregnancy mothers were determined by chemiluminescence immunoassay.ResultsThe median concentration of 25(OH)D in cord blood was 20.7 nmol/L, and 82.1% of neonate had vitamin D de fi ciency, and 12.1% had severe vitamin D de fi ciency (<10 nmol/L). The concentration of 25(OH)D in cord blood was consistent with that in blood of late pregnancy mother. The distribution of concentration of 25(OH)D in cord blood was signi fi cantly different in neonates in different seasons of birth (P<0.05). There were more cases <10 nmol/L in winter and spring. The concentration of 25(OH)D in cord blood had no signi fi cant associations with the incidences of low birth weight (LBW) and small for gestational age (SGA) (P>0.05). After the variables of sex, gestational age and birth season are controlled, the birth weight and head circumference were signi fi cantly different in neonates with different concentrations of 25(OH)D in cord blood (P<0.05).ConclusionsThe concentration of 25(OH)D in cord blood in term neonates was generally lower. The vitamin D status in neonates was consistet with that in their late pregnancy mothers. Cord blood 25(OH) D levels were associated with neonates’ birth weight and head circumference, but it should be con fi rmed by larger sample size in the future.
cord blood; 25(OH)D; neonate outcomes; neonate
10.3969/j.issn.1000-3606.2017.06.009
2016-10-31)
(本文编辑:邹 强)
国家自然科学基金资助项目(No.81422040,81172685);教育部新世纪优秀人才项目(No.NCET-13-0362);科技部973培育项目(No.2010CB535000);卫生部行业科研专项基金(No.201002006);上海市科委项目及启明星追踪项目(No.12411950405,No.13QH1401800);上海市教委曙光计划(No.11SG19)
江帆 电子信箱:fanjiang@shsmu.edu.cn

