黄秋葵水提物对2型糖尿病大鼠血尿酸及肾功能的影响
宋春蕾,何 伟,张灵敏,李海霞,窦伟峰,王 玲,*
(1.郑州大学公共卫生学院营养与食品卫生教研室,河南郑州 450001; 2.中牟县卫生防疫站,河南中牟 451450)
黄秋葵水提物对2型糖尿病大鼠血尿酸及肾功能的影响
宋春蕾1,何 伟1,张灵敏2,李海霞1,窦伟峰1,王 玲1,*
(1.郑州大学公共卫生学院营养与食品卫生教研室,河南郑州 450001; 2.中牟县卫生防疫站,河南中牟 451450)
目的:探讨黄秋葵水提物对2型糖尿病大鼠血尿酸水平及肾脏功能的影响。方法:将72只SD雄鼠随机分为正常对照组(8只)和2型糖尿病造模组(64只),除正常对照组为普通饲料,其余均以高糖高脂饲料喂养。4周后,造模组大鼠腹腔注射链脲佐菌素(STZ)建立2型糖尿病动物模型。成模大鼠随机分为5组:糖尿病模型组、阳性对照组(0.64 g/kg·d-1降糖宁灌胃)、黄秋葵低、中、高剂量组(分别按每公斤体重给予0.78、1.56、2.60 g黄秋葵水提物添加到高糖高脂饲料中),4周后,采集大鼠尿样,处死大鼠,称量肾脏重量以计算肾脏系数,同时测血尿酸、血肌酐和血尿素氮。结果:与糖尿病模型组比较,黄秋葵水提物高剂量组血尿酸水平降低(p<0.05),低、中、高剂量组大鼠的血肌酐和血尿素氮均有不同程度的下降,但差异无统计学意义(p>0.05)。结论:适宜剂量的黄秋葵水提物可降低2型糖尿病大鼠血尿酸水平,其对肾脏的保护作用有待进一步研究。
黄秋葵水提物,2型糖尿病,SD大鼠,血尿酸,肾脏
近年来随着生活水平的提高,2型糖尿病(type 2 diabetes mellitus,T2DM)及高尿酸血症(Hyperuric acid,HUA)的患病率都呈增加趋势,二者常常同时存在。T2DM可诱发高尿酸血症,而高尿酸血症也是T2DM的危险因素[1-2]。高尿酸血症可以与糖尿病协同,加重肾损伤程度[3]。糖尿病肾病是糖尿病常见并发症之一,也是其主要死亡原因之一。因此,早期发现肾损伤并进行干预治疗,如降血糖、降血尿酸等措施可有效减轻肾脏损害,延缓糖尿病肾病的进程。
黄秋葵又名补肾草、咖啡葵、羊角豆等,是锦葵科秋葵属一年生草本植物[4]。黄秋葵的新鲜嫩果可供食用,富含蛋白质、不饱和脂肪酸、维生素、多糖、黄酮类化合物等。黄秋葵既是营养丰富的鲜美蔬菜,又有药用保健效果,具有抗氧化[5]、抗疲劳[6]特性,本课题组前期研究中发现黄秋葵水提物能降低T2DM大鼠的血糖,改善其糖脂代谢[7],孙元琳等[8]证明黄秋葵中的果胶类多糖具有降低血糖、血脂的功效,Sabitha等[9]的研究也有类似的发现。本研究在之前的基础上,进一步观察黄秋葵水提物对T2DM大鼠血尿酸水平及肾脏功能的影响,为黄秋葵在改善尿酸代谢异常、减轻肾脏损害,进而防治糖尿病并发症提供科学依据。
1 材料与方法
1.1 材料与仪器
黄秋葵 由郑州大学药学院提供,经郑州大学药学院中药系潘成学副教授鉴定为锦葵科秋葵属植物黄秋葵;标准普通饲料(颗粒状)、基础饲料(粉状,成分同标准普通饲料) 河南省实验动物中心;高糖高脂饲料(粉状)配方:59.5%基础饲料、20%蔗糖、10%猪油、10%蛋黄粉、0.5%胆酸钠;链脲佐菌素(Streptozocin,STZ) 美国Sigma公司;乌拉坦 上海乙基化工有限公司;葡萄糖测定试剂盒 南京建成生物工程研究所;尿酸(UA)、肌酐(SCr)、尿素氮(BUN)试剂盒 中生北控生物科技有限公司。
卓越360全自动生化分析仪 上海科华生物工程股份有限公司;旋转蒸发仪 河南智诚科技发展有限公司;LGJ—18B冷冻干燥机 北京四环科学仪器厂有限公司;5424R台式高速冷冻离心机 艾本德中国有限公司。
1.2 实验方法
1.2.1 黄秋葵水提物冻干粉的制备 8月份新鲜采摘的黄秋葵嫩果13 kg,清水洗净,继以蒸馏水冲洗,自然晾干后切成约1 cm的长段,按2.5 L/kg添加蒸馏水放入不锈钢桶内,煮沸1 h自然冷却到室温用200目筛网将提取液过滤,再次加蒸馏水,重复提取三次。所得滤液用旋转蒸发仪于55 ℃蒸馏浓缩,直至1 min内无水滴滴下,低温真空冷冻干燥后得到758 g冻干粉。本实验中,黄秋葵水提物得率(%)=黄秋葵水提物冻干粉量/鲜黄秋葵量×100,即0.758/13×100=5.83%。
1.2.2 T2DM动物模型的建立与实验分组 SPF级4周龄SD雄鼠72只,体重(76.34±15.77) g,饲养于郑州大学公共卫生学院SPF级屏障系统动物实验室,12 h光照/黑暗交替,室温18~23 ℃,相对湿度45%~55%,动物自由摄食和饮水。适应性喂养7 d后,按体重将动物随机分为正常对照组(8只)和造模组(64只),分别饲以标准普通饲料和高糖高脂饲料(59.5%基础饲料、20%蔗糖、10%猪油、10%蛋黄粉、0.5%胆酸钠)。第4周末,禁食不禁水12 h,造模组大鼠腹腔注射STZ 35 mg/kg(临用前溶于0.1 mmol/L柠檬酸钠-柠檬酸缓冲液,pH=4.3),正常对照组注射等体积的柠檬酸钠-柠檬酸缓冲液,在注射后第9 d测空腹血糖,筛选血糖值大于7.0 mmol/L的大鼠为T2DM成功模型[10]。
将成模的54只糖尿病大鼠按照血糖值随机分为5组,即糖尿病模型组(11只),阳性对照组(10只),黄秋葵水提物低、中、高剂量组(各11只)。阳性对照组以0.64 g/kg·d-1降糖宁混悬液灌胃,低、中、高剂量组分别以每公斤体重0.78、1.56、2.60 g黄秋葵水提物冻干粉按1∶10的比例添加到高糖高脂饲料中喂养大鼠,连续4周,每周称量大鼠体重。实验结束,大鼠禁食12 h,按每公斤体重1 g的剂量腹腔注射乌拉坦麻醉,腹主动脉采血,分离血清,用于血尿酸、肌酐、尿素氮等生化指标测定。摘取肾脏,称重后计算肾脏系数。
1.2.3 指标检测 应用全自动生化分析仪检测血糖、血尿酸、血肌酐、尿素氮,严格按照试剂盒说明操作。脏器系数(%)=脏器质量(g)/体重(g)×100。

2 结果与分析
2.1 糖尿病大鼠一般状态及体重的变化
实验期间,正常对照组大鼠精神状态良好,皮毛光泽度佳,体重持续稳定上升。造模前(第1周末)各组大鼠体重无显著性差异(p>0.05);注射STZ前(第5周末),各组大鼠体重均有所增加,但差异无统计学意义(p>0.05);注射STZ后,糖尿病大鼠逐渐出现多饮、多尿、多食、消瘦等现象,并出现毛色晦暗,精神萎靡,反应迟钝,动作迟缓的状况,与正常对照组比较有明显差异。实验第10周末,各干预组大鼠症状均有一定程度改善,糖尿病模型组大鼠体重仍低于正常对照组(p<0.05),阳性对照组、黄秋葵中剂量组、黄秋葵高剂量组体重明显增加,与模型组比较有显著性差异(p<0.05,p<0.05,p<0.01),结果详见表1。
2.2 黄秋葵水提物对大鼠血尿酸水平的影响
由表2可知,糖尿病模型组大鼠血尿酸水平显著高于正常对照组(p<0.01)。黄秋葵水提物干预4周后,与模型组相比,阳性对照组和黄秋葵低、中、高剂量组血尿酸水平均有不同程度的下降,但只有阳性对照组和高剂量组的下降有统计学意义(p<0.05),这些结果提示黄秋葵水提物能改善糖尿病大鼠血尿酸水平,且呈剂量效应关系。
2.3 黄秋葵水提物对大鼠肾脏重量和肾脏系数的影响
与正常对照组相比,糖尿病模型组肾脏重量、肾脏系数均显著增高(p<0.01),间接反映了肾脏肥大的程度。

表1 各组大鼠体重的变化与比较Table 1 The changes and comparison of body weight in rats(±s)
注:与正常对照组比,#p<0.05,##p<0.01,表2~表4同;与模型对照组比,*p<0.05,**p<0.01,表2同。
说明此时可能已发生糖尿病肾脏损伤的典型改变—肾脏肥大。尽管各黄秋葵干预组的大鼠肾脏重量均高于模型组(p>0.05),但肾脏系数却低于模型组,可能与体重增加脏器重量也随之增加有关;而各干预组肾脏系数却有下降趋势,表明肥大的肾脏有所改善,但无统计学差异(p>0.05),可能与干预时间较短有关,详细结果见表3。
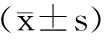
表2 黄秋葵水提物对2型糖尿病大鼠血尿酸的影响Table 2 Effects of okra extract on the serum uric acid in T2DM rats(±s)

表3 干预4周后各组大鼠肾脏重量及肾脏系数Table 3 Kidney weight and renal index in rats after four weeks of intervention(±s)
2.4 黄秋葵水提物对大鼠肾脏功能相关生化指标的影响

表4 黄秋葵水提物对2型糖尿病大鼠肾脏功能相关指标的影响Table 4 Effects of okra extract on renal index of renal function in T2DM rats(±s)
由表4可知,糖尿病模型组大鼠的尿比重明显高于正常对照组(p<0.01),提示糖尿病大鼠肾脏功能发生异常改变。与模型组相比,阳性对照组和黄秋葵各干预组大鼠的尿比重无明显差异,可能与干预时间过短有关。各组大鼠血肌酐水平虽无统计学意义(p>0.05),但与模型对照组相比,各干预组大鼠血肌酐水平均降低,且以高剂量组为最低。与正常对照组比较,模型组血清尿素氮明显升高,差异有统计学意义(p<0.01);与模型组比较,黄秋葵低、中、高剂量组的血尿素氮水平均降低,但差异无统计学意义(p>0.05),可能与干预时间过短有关。
3 讨论
目前的研究成果表明,糖尿病和高尿酸血症关系密切。糖尿病所引起的代谢紊乱会导致高尿酸血症,可能由于糖尿病存在微血管病变,肾脏微血管病变导致肾缺血、肾血流下降,而尿酸排泄与肾血流成正比,故血尿酸增高[11]。另外,高尿酸血症的发病与胰岛素抵抗所致的高胰岛素血症也有关,胰岛素能促进肾脏对尿酸的重吸收,使尿酸排泄减少,从而使血尿酸水平升高[12]。高尿酸血症也会引起糖尿病的发生、发展,高尿酸血症后尿酸结晶会直接损伤胰岛β细胞,且其沉积在胰岛局部血管后引起的炎性反应也会造成胰岛β细胞缺血而凋亡[13]。高尿酸血症常合并肥胖、高脂血症,这些均与胰岛素抵抗有密切的关系,而胰岛素抵抗是糖尿病的主要病因[14]。因此,糖尿病的临床治疗除了关注降低血糖外,还应考虑改善血尿酸水平。在本实验中,黄秋葵水提物各干预组大鼠血尿酸水平较糖尿病模型组有不同程度降低,由此可推测黄秋葵水提物能改善T2DM大鼠血尿酸水平,可能与其抗氧化功能有关。
BUN可以反映肾小球滤过功能,临床上多采用该指标评估肾功能。同BUN相似,尿比重可用于评价肾脏浓缩功能,间接反映肾功能状态。本实验发现,糖尿病模型组BUN、尿比重均高于正常对照组,推测糖尿病大鼠肾脏功能受损。有研究证实,糖尿病患者体内存在氧化应激,抗氧化作用减弱,减缓自由基的清除,致使其直接攻击足细胞,促进系膜细胞的凋亡[15]。糖尿病时,葡萄糖可与蛋白质等多种物质通过不依赖酶类的途径形成晚期糖基化终末产物(AGEs),堆积在肾组织内,干扰肾小球、肾小管细胞的分化和生成,导致肾脏功能受损[16]。本实验中,与正常对照组相比,模型组大鼠BUN升高的同时,SUA水平也显著增高。高水平SUA可能引起新的肾脏疾病,也可能恶化原有的肾脏疾病[17]。有研究证实,血尿酸具有促进炎症发生的作用,通过参与血管内皮炎症反应导致血管内皮损伤和功能障碍,致使肾脏损害[18]。高水平UA可激活肾素-血管紧张素系统,抑制一氧化氮合酶,引发动脉平滑肌细胞增殖,肾血流量减少,肾小球缺氧加重肾损害[19]。同时,肾损伤降低机体对尿酸的排泄能力导致血尿酸含量进一步升高,这样HUA与肾脏损害之间形成恶性循环回路。因此,对T2DM合并高尿酸血症患者应考虑给予积极的降血尿酸治疗,以减少肾脏损害。一项国外长期随访研究表明,在糖尿病患者中应用别嘌醇进行降尿酸治疗,糖尿病患者肾功能的下降速度较未进行治疗的患者慢,肾功能损伤程度也相对较轻[20],证实可以通过降低尿酸的治疗预防糖尿病患者肾脏病变的发生及进展。本研究中,糖尿病大鼠经过黄秋葵水提物干预后尿酸水平有不同程度的降低,尽管SCr、BUN水平也有所下降,但无统计学意义,原因可能为黄秋葵水提物干预时间不够长,未能看到明显的改善肾脏功能的作用。
4 结论
黄秋葵营养与功能成分的利用前景极为广阔,然而目前国内对黄秋葵的研究大多停留在营养成分、农艺形状等指标,对其进食后与人体生理、病理影响等方面的基础性研究甚少。本研究证实适宜剂量的黄秋葵水提物能够降低2型糖尿病大鼠血尿酸水平,为将黄秋葵开发为新的具有降低尿酸作用的保健食品提供了实验依据。
[1]杨帆,练凤江. 2型糖尿病并发高尿酸血症相关因素分析[J]. 广东医学,2012,33(9):1270-1271.
[2]胡怡淳,倪海祥. 无症状高尿酸血症对早期2型糖尿病肾病肾功能的影响及中医相关证型研究[J]. 云南中医学院学报,2015,38(6):75-78.
[3]郭义娟,马玉霞,董立新,等. 2项指标联合检测对高尿酸血症合并糖尿病患者肾损伤的影响[J]. 检验医学与临床,2015,12(8):1051-1052,1055.
[4]任丹丹,陈谷. 黄秋葵多糖的提取、分离及其体外结合胆酸盐能力的分析[J]. 食品科学,2010,31(13):110-113.
[5]赵焕焕,贾陆,裴迎新. 黄秋葵粗多糖体外抗氧化活性测定[J]. 郑州大学学报(医学版),2012,47(1):40-43.
[6]杨毅,金祖汉,毛培江,等. 黄秋葵提取物抗疲劳的实验研究[J]. 中国现代应用药学,2012,39(12):1091-1094.
[7]张灵敏,王玲,贾奥,等. 黄秋葵水提物对2型糖尿病大鼠糖脂代谢的影响[J]. 食品工业科技,2016,37(3):355-358,363.
[8]孙元琳,汤坚. 果胶类多糖的研究进展[J]. 食品与机械,2004,20(6):60-63.
[9]Sabitha V,Ramachandran S,Naveen KR,et al. Antidiabetic and antihyperlipidemic potential of Abelmoschus esculentus(L.)Moench. in streptozotocin-induced diabetic rats[J]. Journal of Pharmacy & Bioallied Sciences,2011,3(3):397-402.
[10]Matteucci E,Giampietro O. Proposal open for discussion:defining agreed diagnostic procedures in experimental diabetes research[J]. Journal of Ethnopharmacology,2008,115(2):163-172.
[11]Weir CJ,Muir SW,Walters MR,et al. Serum urate as an independent predictor of poor outcome and future vascular events after acute stroke[J]. Stroke,2003,34(8):1951-1956.
[12]马通军,冯凭. 2型糖尿病伴高尿酸血症的对策与评价[J]. 中国实用内科杂志,2004,24(3):142-144.
[13]杨帆,练凤江. 2型糖尿病并发高尿酸血症相关因素分析[J]. 广东医学,2012,33(9):1270-1271.
[14]石万元,杨帅,李芙琴. 糖化血红蛋白、血清胱抑素C和尿微量白蛋白排泄率联合检测对早期糖尿病肾损伤诊断的临床价值[J]. 河北北方学院学报(自然科学版),2013,29(3):104-106.
[15]Kim KM,Kim YS,Jung DH,et al. Increased glyoxalase I levels inhibit accumulation of oxidative stress and an advanced glycation end product in mouse mesangial cells cultured in high glucose[J]. Experimental Cell Research,2012,318(2):152-159.
[16]Raj DS,Choudhury D,Welbourne TC,et al. Advanced glycation end products:a Nephrologist’s perspective[J]. American Journal of Kidney Diseases:the Official Journal of the National Kidney Foundation,2000,35(3):365-380.
[17]Feig DI,Kang DH,Johnson RJ. Uric acid and cardiovascular risk[J]. The New England Journal of Medicine,2008,359(17):1811-1821.
[18]Targher G,Day CP,Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease[J]. The New England Journal of Medicine,2010,363(14):1341-1350.
[19]韩宝玲,王伟. 2型糖尿病合并高尿酸血症患者肾脏功能的变化[J]. 山东医药,2015,55(37):45-46.
[20]Momeni A,Shahidi S,Seirafian S,et al. Effect of allopurinol in decreasing proteinuria in type 2 diabetic patients[J]. Iranian Journal of Kidney Diseases,2010,4(2):128-132.
《食品工业科技》愿为企业铺路、搭桥!
Effects of okra extract on serum uric acid and renal function in type 2 diabetes mellitus rats
SONG Chun-lei1,HE Wei1,ZHANG Ling-min2,LI Hai-xia1,DOU Wei-feng1,WANG Ling1,*
(1.Department of Nutrition and Food Hygiene,College of Public Health,Zhengzhou University,Zhengzhou 450001,China; 2.Zhongmu Center for Disease Control and Prevention,Zhongmou 451450,China)
Objective:To investigate the effects of okra extract on serum uric acid and renal function in type 2 diabetes mellitus(T2DM)rats. Methods:72 male Sprague-Dawley(SD)rats were randomly divided into normal control group(8 rats)and T2DM model group(64 rats),fed with lab chow diet and high-sugar and high-fat diet respectively for four weeks. Then the rats in T2DM model group were injected with streptozocin(STZ)intraperitoneally to establish T2DM animal model. The successful model rats were further assigned into T2DM model,positive control(Jiang-tangning gavage,0.64 g/kg·d-1),low,medium and high dose of okra extract groups(okra extract at the dosages of 0.78,1.56 g and 2.60 g per kilograms of body weight was added into the high-sugar and high-fat diet taken by the rats). Administered four weeks,the urine samples were collected and the kidneys of the rats were dissected for evaluating the kidney index. Serum uric acid(SUA),serum creatinine(SCr)and blood urea nitrogen(BUN)were measured. Results:Compared with diabetic model group,the level of SUA in high dosage of okra extract group was significantly decreased(p<0.05),but the significant difference was not found in serum SCr and BUN between okra extract intervention groups(p>0.05). Conclusion:Okra extract may mitigate the level of SUA at a appropriate dosage in T2DM rats,the protective effect on renal function needs to be explored in the further researches.
okra extract;T2DM;SD rats;serum ucic acid;kidney
2016-12-02
宋春蕾(1990-),女,硕士研究生,研究方向:营养与疾病,E-mail:13676932983@163.com。
*通讯作者:王玲(1962-),女,博士,副教授,研究方向:营养与疾病,E-mail:896048831@qq.com。
TS201.4
A
1002-0306(2017)11-0344-04
10.13386/j.issn1002-0306.2017.11.058

