响应面法优化超声波辅助提取猕猴桃果皮多酚工艺研究
郭彩霞,任晓婷,张生万,李美萍,尉立刚
(山西大学生命科学学院,山西太原 030006)
响应面法优化超声波辅助提取猕猴桃果皮多酚工艺研究
郭彩霞,任晓婷,张生万,李美萍,尉立刚
(山西大学生命科学学院,山西太原 030006)
采用超声波辅助提取猕猴桃果皮多酚,并利用响应面法对多酚提取工艺进行优化。在单因素实验的基础上,采用四因素三水平的响应面实验优化设计,研究超声波功率、提取时间、提取温度、液料比对多酚提取量的影响。结果显示最佳提取工艺条件为:超声波功率384.00 W,提取时间30 min,提取温度65.00 ℃,液料比23.00 mL/g,多酚提取量的实验值为(28.10±0.38) mg GAE/g,与理论预测值(28.14 mg GAE/g)相差不大。通过体外1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除力测定多酚的抗氧化性,并且得到猕猴桃果皮多酚的EC50值为0.13 mg/mL,说明提取的多酚具有很好的抗氧化性。
猕猴桃果皮,多酚,超声波提取,响应面法,抗氧化活性
猕猴桃(Kiwifruit)属于猕猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl)多年生藤本植物[1]。猕猴桃富含碳水化合物,纤维素,维生素C,多酚类化合物和类胡萝卜素[2],具有很高的营养价值。研究发现多酚具有抗氧化[3]、抗病毒[4]、抗癌、抗过敏[5]、抑菌[6]和预防心血管疾病等功能[7-8]。猕猴桃果皮是加工生产猕猴桃过程中产生的废弃物[9],且果皮的浪费占整个猕猴桃的30%[10-11]。若可以将猕猴桃果皮中大量潜在的多酚资源加以综合利用,不仅会使猕猴桃的经济价值最大化,而且还可以保护环境。
多酚的提取方法多种多样[12],一般来说,从不同植物中提取多酚的方法有浸提法、加热回流法和索氏提取法等[13-14],然而,这些方法不仅耗时、而且效率低[15]。现在各种新型萃取技术已被开发并用于多酚的提取,如超声波辅助提取法、微波辅助提取法、超临界流体萃取法和加压液体萃取法等[16-19]。研究表明超声波辅助提取多酚的方法效率会更高,且相对于其它方法溶剂和原材料的消耗使用较少,最终提取的多酚杂质少、产量也高[14,18]。超声波辅助提取的原理是一种超声波增强使气泡引起气蚀的声学效应,从而破坏植物细胞壁,促使溶剂充分渗透到细胞中达到提取的目的[20-22]。响应面法是一种优化复杂过程的统计技术,它的优点是可以根据实验需要减少评估多个参数及其相互作用的个数,因此相比于其它方法更省时、省力[23]。目前,王凤舞等[24]做了超声波辅助法提取猕猴桃多酚的相关研究,但是对猕猴桃果皮多酚提取测定及其抗氧化性研究鲜有报道。
本实验利用响应面法优化超声波辅助提取猕猴桃果皮多酚的工艺,并对提取得到的猕猴桃果皮多酚进行了抗氧化活性研究。主要考察了影响多酚提取的几个单因素如超声波功率、提取时间、提取温度和液料比,并利用响应面法优化得到最佳提取条件。此外,采用测定DPPH自由基清除率的方法来评价所提取的多酚抗氧化性。
1 材料与方法
1.1 材料与仪器
猕猴桃果皮 陕西周至的猕猴桃加工厂。将其通过真空冷冻干燥机在-54 ℃下冻干26 h,再经过粉碎细度为40~200目的粉碎机后将其密封于塑料袋中备用。
没食子酸,抗坏血酸(分析纯) 天津市光复精细研化工究所;福林酚 北京索莱宝科技有限公司;DPPH(1,1-diphenyl-2-picrylhydrazyl) 美国Sigma公司,纯度>98.0%;无水乙醇 (分析纯)天津市进丰化工有限公司;无水碳酸钠 (分析纯)天津博迪化工有限公司。
FW-80高速万能粉碎机 上海科恒实业发展有限公司;FD-1A-50真空冷冻干燥机 西安太康生物科技有限公司;SB25-12DTDN超声波清洗机 宁波新芝生物科技股份有限公司;SHZ-D(Ⅲ)循环水式真空泵 郑州予华仪器制造有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;UV-Probe2550双光束紫外光谱仪 日本岛津公司。
1.2 实验方法
1.2.1 猕猴桃果皮多酚超声波辅助提取 称取猕猴桃果皮干粉1.00 g放在100 mL的圆底烧瓶中,按一定浓度和液料比加上一定浓度的无水乙醇,在恒温水浴中按设定的超声波条件提取一定时间。抽滤,收集上清液,重复提取3次,合并上清液,即得多酚粗提液。将多酚提取液旋转蒸发去除溶剂后用10 mL无水乙醇溶解-4 ℃避光保存备用。
1.2.2 猕猴桃果皮总酚的测定 总酚测定参照Singleton等[25]报道的Folin-Ciocalteu法略作改动。将稀释后的50 μL提取物加到试管中再加入3.95 mL的超纯水,0.25 mL用超纯水稀释的Folin-Ciocalteu试剂(1∶1,v/v),在室温25~30 ℃下反应2 min后,加入20%的0.75 mL的无水碳酸钠溶液。将所加液体进行混合并且在室温下反应2 h后用紫外分光光度计测定765 nm处的吸光度。以没食子酸为标准,多酚提取量以没食子酸当量干重表示(mg GAE/g)。
式(1)
式(1)中:C:没食子酸质量浓度,mg/L;V:提取液体积,mL;N:稀释倍数;M:取样量,g。
1.2.3 乙醇浓度的选择 设定液料比为20∶1 mL/g,提取时间为20 min,提取温度为50 ℃,超声波功率为360 W,按以上超声波提取方法考察乙醇浓度为40%、50%、60%、70%、80%对猕猴桃皮多酚提取量的影响。
1.2.4 单因素实验
1.2.4.1 超声功率对猕猴桃皮多酚的影响 设定乙醇浓度为60%,液料比为20∶1 mL/g,提取时间为20 min,提取温度为50 ℃,考察超声波功率为240、300、360、420、480、540 W时对猕猴桃皮多酚提取量的影响。
1.2.4.2 提取时间对猕猴桃皮多酚的影响 设定乙醇浓度为60%,液料比为20∶1 mL/g,提取温度为50 ℃,超声功率为360 W,考察提取时间为5、10、15、20、25、30、35 min时对猕猴桃皮多酚提取量的影响。
1.2.4.3 提取温度对猕猴桃皮多酚的影响 设定乙醇浓度为60%,液料比为20∶1 mL/g,超声功率为360 W,提取时间为20 min,考察提取温度为30、40、50、60、70、80 ℃时对猕猴桃皮多酚的影响。
1.2.4.4 液料比对猕猴桃皮多酚的影响 设定乙醇浓度为60%,提取温度为50 ℃,超声功率为360 W,提取时间为20 min,考察液料比为10∶1、15∶1、20∶1、25∶1、30∶1 mL/g时对猕猴桃皮多酚提取量的影响。
1.2.5 响应面优化实验设计 在单因素实验基础下利用响应面法设计超声波辅助提取的实验方法,选取超声波功率、提取时间、提取温度、液料比为影响多酚的提取优化的因素,以多酚提取量(Y)作为实验设计的响应值,根据Box-Benhnken 实验设计,利用四因素三水平的实验设计优化超声波辅助提取多酚工艺参数。响应面设计实验因素及水平见表1。

表1 响应面设计实验因素及水平Table 1 Variables and levels in response surface design
1.2.6 抗氧化活性研究 抗氧化活性测定参照Sulaiman等[26]报道的方法略做改动。用无水乙醇制备0.65 mmoL的DPPH·溶解液,准确吸取1 mL所配DPPH·溶液和1 mL无水乙醇置于试管中,混合均匀后,室温下静置30 min后用紫外分光光度计在517 nm处测定吸光度,所有的实验进行3次测定,用抗坏血酸来做比较。清除率的计算用下面的方程:
式(2)
式(2)中:Ac:未加样品的DPPH·溶液的吸光度;Ai:含有样品的DPPH·溶液的吸光度;Aj:样品未加DPPH·溶液的吸光度。
1.3 统计分析
所有实验都进行3次重复,所得数据以均值±标准差(SD)表示。响应面设计利用Design Expert 7.1.3软件进行设计,采用SPSS 15.0对数据进行单因素方差分析和邓肯多重比较,显著性水平为p<0.05,极显著水平为p<0.01。
2 结果与分析
2.1 乙醇浓度的选择
酚类化合物的提取是根据成分和溶剂的相似相溶性原理。当成分的极性与溶剂的极性一样时,成分才可以被提出来。一些研究表明乙醇和甲醇对于多酚的提取都是有效的[27-28]。在本次实验中,用乙醇来提取多酚,因为乙醇是一种廉价的、低毒的并且可以重复利用的溶剂。不同浓度的溶剂有不同的极性影响,因此找到一个合适的浓度可以获得更高的多酚提取量[29]。本实验选用浓度为40%~80%的乙醇考察不同浓度的乙醇对多酚提取量的影响,结果如图1所示。多酚提取量一开始随着乙醇浓度的增加而增加,当乙醇浓度达到60%时,多酚提取量达到最大值为27.04 mg GAE/g,随后随着乙醇浓度的增加多酚提取量减少。本研究中多酚提取量随乙醇浓度变化趋势与一些报道是相符的[30-31],因此,选择60%乙醇作为猕猴桃果皮中多酚提取的浓度进行进一步实验。
2.2 单因素实验

图2 超声波功率对猕猴桃果皮多酚提取量的影响Fig.2 Effect of ultrasonic power on extraction of kiwifruit peel polyphenols
2.2.1 超声波功率对多酚提取量的影响 超声波功率对多酚类化合物的提取起着很重要的影响[32]。在超声的时候,由于气蚀现象导致细胞或细胞壁肿胀破裂,使细胞壁和细胞里的物质以高速扩散或简单渗透出来,从而达到有效提取[20]。超声波功率对多酚提取量的影响如图2所示,一开始多酚提取量随超声波功率增加而增加,当功率增加到360 W时,多酚提取量达到最大值为26.96 mg GAE/g,随着超声波功率的继续增加,多酚提取量开始下降,这可能由于较高的超声功率会使多酚降解从而导致多酚提取量降低。这种现象与其它报道类似[31]。本研究选择超声功率为360 W作为响应面实验设计的中心点。
2.2.2 提取时间对多酚提取量的影响 一般来说,提取时间越长提取的多酚就越多,然而提取时间的增加也会增加酚类物质的氧化,使得多酚提取量降低[29]。提取时间对多酚提取量影响如图3所示,一开始多酚提取量随提取时间的增加而增加,提取时间为25 min 时达到最大值,当提取时间超过25 min以后,多酚提取含量急剧下降。这种现象是因为在较长的提取时间下会发生更多的化学反应从而引起多酚的氧化。在一些报道中有些原材料提取多酚也观察到类似现象[33-34]。本研究选择提取时间为25 min作为响应面实验设计的中心点。
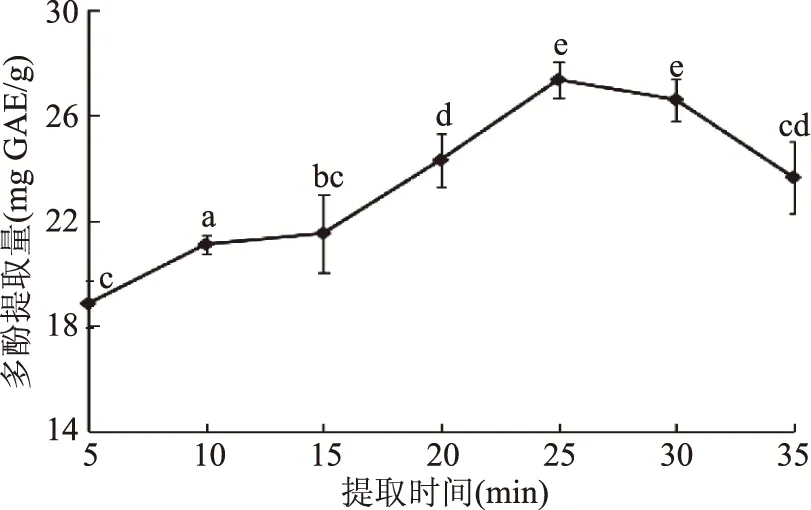
图3 提取时间对猕猴桃果皮多酚提取量的影响Fig.3 Effect of extraction time on extraction of kiwifruit peel polyphenols
2.2.3 提取温度对多酚提取量的影响 提取温度是多酚提取的重要影响因素[24]。本研究中提取温度对多酚提取量影响如图4所示,当提取温度从30 ℃增加到60 ℃时多酚提取量从18.85 mg GAE/g增加到27.24 mg GAE/g,然而当温度进一步升高时多酚提取量明显降低。这种现象可以解释为温度上升时可以降低溶剂粘度,加快分子运动从而导致扩散系数和溶解度增加,使多酚溶解出来[35],但是较高的温度会促使多酚水解氧化、聚合和氧化还原反应[15]。本研究选择温度为60 ℃作为响应面实验设计的中心点。

图4 提取温度对猕猴桃果皮多酚提取量的影响Fig.4 Effect of extraction temperature on the extraction of kiwifruit peel polyphenols
2.2.4 液料比对多酚提取量的影响 不同溶剂与原料的比例对多酚提取量有显著的影响,如果液料比太小,原材料中的多酚就不能完全提取出来。较高的液料比会使原材料中多酚很快的扩散到溶剂中去,有利于多酚的提取。但是,如果液料比过大,一些其它的成分将会溶出,如多糖的溶出会阻碍多酚的溶出[31]。因此,有必要选择一种合适的液料比进行多酚的提取。在本实验中,多酚提取将使用液料比为10∶1~30∶1(mL/g)进行提取,结果如图5所示,一开始多酚提取量随着液料比的增加而增加,在液料比为25∶1 mL/g时多酚提取量达到最大值为26.99 mg GAE/g,当液料比大于25∶1 mL/g时多酚提取量开始下降。本研究选择液料比为25∶1 mL/g作为响应面实验设计的中心点。

图5 液料比对猕猴桃果皮多酚提取量的影响Fig.5 Effect of liquid-solid ratio on the extraction of kiwifruit peel polyphenols
2.3 响应面法优化提取工艺
2.3.1 响应模型建立与分析 利用Design Expert 7.1.3软件进行Box-Behnken实验设计,结果如表2所示。

表2 Box-Behnken实验设计和响应值Table 2 Box-Behnken design and observed responses
根据BBD(43阶乘)对四个参数超声波功率、提取时间、提取温度、液料比进行优化实验。利用Design Expert 7.1.3软件对表2实验数据进行二次多项式回归模型方程拟合,得到多酚提取量(Y)、超声波功率(X1)、提取时间(X2)、提取温度(X3)、液料比(X4)的回归模型方程:
Y=-24.65333+0.12467X1+0.33367X2+0.57487X3+0.41567X4-0.000291667X1X2-0.000583333X1X3+0.000933333X1X4+0.0016X2X3-0.0056X2X4-0.00045X3X4-0.000129792X2-10.00279X22-0.0029975X32-0.012490X42

p值是用来检查每个系数的显著性,四个独立变量(X1,X2,X3和 X4)和三个二次项(X12,X32和X42)的p值表明四个独立变量对多酚提取量的影响是显著的(p<0.05)。并且分析得出超声功率与提取温度(X1X3)、超声功率和液料比(X1X4)、提取时间和液料比(X2X4)之间的交互作用对多酚提取率有显著影响,因此,超声波功率相比起提取温度、提取时间和液料比是影响多酚提取量最重要的参数。

表3 回归模型方差分析表(ANOVA)Table 3 Analysis of varlance of the regression model(ANOVA)
注:**差异极显著,p<0.01。
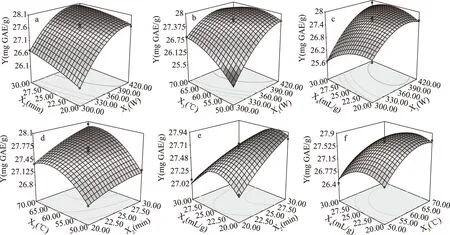
图6 响应面(3D)显示不同参数对多酚提取量的影响Fig.6 Response surface(3D)showing the effect of different extraction parameters on the total polyphenols yield注:(a)超声功率和提取时间;(b)超声功率和提取温度;(c)超声功率和液料比;(d)提取时间和提取温度;(e)提取时间和液料比;(f)提取温度和液料比。
2.3.2 响应面优化 响应曲面图如图6所示,分析超声波功率、提取时间、提取温度、液料比的响应曲面的形状对多酚提取量的影响。图6a~图6c为超声功率与其他三个因素交互作用对多酚提取量的影响,可以看出超声功率比其他三个因素对多酚提取量的影响更为显著。在这三种情况下,随着超声功率的增加多酚提取量增加,当超声功率为380 W时响应值达到最大。由于超声功率的增强导致声波的机械和化学作用使得生物细胞破坏,而促进了提取介质中细胞内含物的释放[20],因此,在超声波功率范围内对多酚提取量有显著影响。
图6a,图6d,图6e为提取时间与其他三个因素交互作用对多酚提取量的影响。在提取时间为20~30 min内,多酚提取量迅速增加,说明提取时间对多酚提取量的影响显著。
图6b,图6d,图6f为提取温度与其他三个因素交互作用对多酚提取量的影响。由于温度的升高加快了介质的传递从而导致多酚提取量增加,多酚提取量随温度的升高明显增大。
图6c,图6e,图6f为液料比与其他三因素交互作用对多酚提取量的影响。而液料比比起其他三因素来说并不显著,当液料比为20∶1 mL/g时会导致较低的多酚提取量,在液料比为20∶1~25∶1 mL/g的范围内,多酚提取量随着液料比的增加而增加从而达到最大值,当液料比大于25∶1 mL/g时,多酚提取量开始下降。这可能是由于大量的多酚在合适的溶剂中已经溶解出来。

表4 实验验证结果Table 4 The results of experimental verification
2.3.3 最优条件的优化与验证 根据Design-Expert软件中的模型获得四个独立变量的最优值,超声波功率,提取时间,提取温度和液料比分别为383.94 W,30 min,64.81 ℃和23.10 mL/g,该模型预测在最优条件下多酚提取量为28.14 mg GAE/g。为了进一步检验实验方法的可靠性,调整模型的最优条件进行提取实验,调整后的提取条件如表4。结果表明实验值为(28.10±0.38) mg GAE/g与理论预测值相似。因此,响应面法得到的预期优化提取条件不仅准确可靠,而且具有实际价值。
2.4 抗氧化活性分析
提取得到的猕猴桃果皮多酚对DPPH自由基清除率的影响如图7所示。结果表明,猕猴桃果皮多酚对DPPH自由基清除能力随着浓度增加而增加,当多酚浓度从0.001增加到 0.3 mg/mL时,DPPH自由基清除率从0增加到86.33%,表明猕猴桃果皮多酚对DPPH自由基具有较强的清除能力。半数有效浓度(EC50)定义为能引起样品50%最大效应的浓度。较低的EC50值对应于测试样品的较强的抗氧化性是[36],本实验提取得到猕猴桃果皮多酚的DPPH自由基清除力的EC50为0.13 mg/mL,表明猕猴桃果皮多酚的DPPH自由基清除效果很显著。

图7 多酚提取物在不同浓度下DPPH自由基清除力Fig.7 DPPH radical scavenging activities of polyphenols extract at different concentrations
3 结论
猕猴桃果皮在本实验中利用Box-Behnken设计(BBD)优化提取条件,结果表明,多酚的最佳提取条件为:超声波功率为383.94 W,提取时间为30 min,提取温度为64.81 ℃和液料比为23.10 mL/g,在该条件下多酚提取量为(28.10±0.38) mg GAE/g,这个结果与响应面模型预测的结果28.14 mg GAE/g很接近,同时,通过体外DPPH自由基清除率测定来评价多酚的抗氧化性,提取猕猴桃果皮多酚的EC50值为0.13 mg/mL,说明猕猴桃果皮多酚具有很显著的抗氧化能力。因此,超声波辅助提取多酚是一种有效的途径,并且利用超声波辅助提取猕猴桃果皮多酚对于猕猴桃果汁副产品的综合利用具有一定的指导意义,为植物多酚的开发利用提供理论依据和技术支持。
[1]徐小彪,张秋明.中国猕猴桃种质资源的研究与利用[J]. 植物学通报,2003,20(6):648-655.
[2]黄诚,周长春,李伟.猕猴桃的营养保健功能与开发利用研究[J]. 食品科技,2007,32(4):51-55.

[4]Motohashi N,Shirataki Y,Kawase M,et al. Biological activity of kiwifruit peel extracts[J]. Phytotherapy Research,2011,15(4):337-343.
[5]Deng J,Yang H,Fan D,et al. Antibacterial Activities of polyphenolic extract from Kiwi fruit(ActinidiachinensisPlanch.)Seeds[J]. Journal of Pure and Applied Microbiology,2013,7(1):491-496.
[6]Yoruk R,& Marshall M. R. Physicochemical properties and function of plant polyphenol oxidase:a review[J]. Journal of Food Biochemistry,2003,27(5):361-422.
[7]Motohashi N,Shirataki Y,Kawase M,et al. Cancer prevention and therapy with kiwifruit in Chinese folklore medicine:a study of kiwifruit extracts[J]. Journal of Ethnopharmacology,2002,81(3):357-364.
[8]Shivashankara K,& Acharya S. Bioavailability of dietary polyphenols and the cardiovascular diseases[J]. The Open Nutraceuticals Journal,2010,3:227-241.
[9]Amos R L. Sensory properties of fruit skins[J]. Postharvest biology and technology,2007,44(3):307-311.
[10]Schieber A,Stintzing F,& Carle R. By-products of plant food processing as a source of functional compounds—recent developments[J]. Trends in Food Science & Technology,2001,12(11):401-413.
[11]Wijngaard H. H,Röβle C,Brunton N. A survey of Irish fruit and vegetable waste and by-products as a source of polyphenolic antioxidants[J]. Food Chemistry,2009,116(1):202-207.
[12]Scherer R,Godoy H. Effects of extraction methods of phenolic compounds from Xanthium strumarium L. and their antioxidant activity[J]. Revista Brasileira de Plantas Medicinais,2014,16(1):41-46.
[13]Khan M. K,Abert-Vian M.,Fabiano-Tixier A. S,et al. Ultrasound-assisted extraction of polyphenols(flavanone glycosides)from orange(CitrussinensisL.)peel[J]. Food Chemistry,2010,119(2):851-858.
[14]Wang X,Wu Y,Chen G,et al. Optimisation of ultrasound assisted extraction of phenolic compounds from Sparganii rhizoma with response surface methodology[J]. Ultrasonics sonochemistry,2013,20(3):846-854.
[16]Both S,Chemat F,Strube J. Extraction of polyphenols from black tea-conventional and ultrasound assisted extraction[J]. Ultrasonics sonochemistry,2014,21(3):1030-1034.
[17]Dahmoune F,Nayak B,Moussi K,et al. Optimization of Microwave-assisted extraction of polyphenols fromMyrtuscommunisL[J]. Leaves. Food Chemistry,2015,166:585-595.
[18]Franquin-Trinquier S,Maury C,Baron A,et al. Optimization of the extraction of apple monomeric phenolics based on response surface methodology:Comparison of pressurized liquid-solid extraction and manual-liquid extraction[J]. Journal of Food Composition and Analysis,2014,34(1):56-67.
[19]Veggi P. C,Prado J. M,Bataglion G. A,et al. Obtaining phenolic compounds from jatoba(HymenaeacourbarilL.)bark by supercritical fluid extraction[J]. The Journal of Supercritical Fluids,2014,89:68-77.
[20]Toma M,Vinatoru M,Paniwnyk L,et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J]. Ultrasonics sonochemistry,2001,8(2),137-142.
[21]Vinatoru M,Toma M,Radu O,et al. The use of ultrasound for the extraction of bioactive principles from plant materials[J]. Ultrasonics sonochemistry,1997,4(2):135-139.
[22]Gan C Y,Latiff A A. Optimisation of the solvent extraction of bioactive compounds from Parkia speciosa pod using response surface methodology[J]. Food Chemistry,2011,124(3):1277-1283.
[23]Zhong K,Wang Q. Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J]. Carbohydrate Polymers,2010,80(1):19-25.
[24]王凤舞,郭丽萍,张晶,等. 超声辅助法提取猕猴桃多酚的工艺研究[J]. 食品科技,2013,38(1):73-77.
[25]Singleton V L,Orthofer R,Lamuela-Raventos R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J]. Methods in enzymology,1999,299:152-178.
[26]Sulaiman S F,Sajak A A,Ooi K L,et al. Effect of solvents in extracting polyphenols and antioxidants of selected raw vegetables[J]. Journal of Food Composition and Analysis,2011,24(4):506-515.
[27]Pérez-Jiménez J,Arranz S,Tabernero M,et al. Updated methodology to determine antioxidant capacity in plant foods,oils and beverages:Extraction,measurement and expression of results[J]. Food Research International,2008,41(3):274-285.
[28]Turkmen N,Sari F,Velioglu Y S. Effects of extraction solvents on concentration and antioxidant activity of black and black mate tea polyphenols determined by ferrous tartrate and Folin-Ciocalteu methods[J]. Food Chemistry,2006,99(4):835-841.
[29]Chew K,Khoo M,Ng S,et al. Effect of ethanol concentration,extraction time and extraction temperature on the recovery of phenolic compounds and antioxidant capacity of Orthosiphon stamineus extracts[J]. International Food Research Journal,2011,18(4):571-578.
[30]Silva E,Rogez H,Larondelle Y. Optimization of extraction of phenolics from Inga edulis leaves using response surface methodology[J]. Separation and Purification Technology,2007,55(3):381-387.
[31]Yue T,Shao D,Yuan Y,et al. Ultrasound-assisted extraction,HPLC analysis,and antioxidant activity of polyphenols from unripe apple[J]. Journal of separation science,2012,35(16):2138-2145.
[32]Hossain M. B,Brunton N. P,Patras A,et al. Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram(OriganummajoranaL.)using response surface methodology[J]. Ultrasonics sonochemistry,2012,19(3):582-590.
[33]Yang L,Jiang J,Li W,et al. Optimum extraction process of polyphenols from the bark of Phyllanthus emblica L. based on the response surface methodology[J]. Journal of separation science,2009,32(9):1437-1444.
[34]Sun Y,Xu W,Zhang W,et al. Optimizing the extraction of phenolic antioxidants from kudingcha made frrom Ilex kudingcha CJ Tseng by using response surface methodology[J]. Separation and Purification Technology,2011,78(3):311-320.
[35]Cacace J,Mazza G. Mass transfer process during extraction of phenolic compounds from milled berries[J]. Journal of Food Engineering,2003,59(4):379-389.
[36]Kozarski M,Klaus A,Niksic M,et al. Antioxidative and immunomodulating activities of polysaccharide extracts of the medicinal mushrooms Agaricus bisporus,Agaricus brasiliensis,Ganoderma lucidum and Phellinus linteus[J]. Food Chemistry,2011,129(4):1667-1675.
Optimization of ultrasound-assisted extraction of polyphenols from kiwifruit peel using response surface methodology
GUO Cai-xia,REN Xiao-ting,ZHANG Sheng-wan,LI Mei-ping,YU Li-gang
(College of Life Science,Shanxi University,Taiyuan 030006,China)
The polyphenol was extracted by ultrasonic assisted method,and the extraction process was optimized by response surface method. On the basis of single factor experiment,the response surface experiment with four factors and three levels was used to study the effect of ultrasonic power,extraction time,extraction temperature and liquid-solid ratio on the extraction rate of polyphenols.The results showed that the optimal extraction conditions were ultrasonic powder of 384.00 W,extraction time of 30.00 min,extraction temperature of 65.00 ℃and liquid to solid ratio of 23.00 mL/g,under these conditions,the experimental TPY was(28.10±0.38) mg GAE/g,which was well matched with the predicted values(28.14 mg GAE/g). In addition,the antioxidative activity of the polyphenols was investigated by measuring its scavenging ability on 1,1-diphenyl-2-picryl-hydrazyl(DPPH)invitro,and EC50value of extracted kiwifruit peel polyphenols was 0.13 mg/mL. The results indicated that the extracted polyphenols had good antioxidant activity.
kiwifruit peel;polyphenols;ultrasound-assisted extraction;response surface methodology;antioxidative activity
2016-11-07
郭彩霞(1984-),女,博士,讲师,研究方向:食品安全与生物技术,食品化学与营养,E-mail:guocx@sxu.edu.cn。
山西省自然科学基金(2015021139)。
TS255.1
B
1002-0306(2017)11-0244-07
10.13386/j.issn1002-0306.2017.11.038

