甘油和生物素对酿酒酵母产胞内谷氨酸的影响
刘立聪,汤 超,王 志,代 俊,李 欣,姚 娟,郑国斌,吕正波,陈 雄
(1 湖北工业大学生物工程与食品学院,发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北 武汉 430068;2 湖北省酵母功能重点实验室,安琪酵母股份有限公司,湖北 宜昌 443003;3 安琪酵母(德宏)有限公司,云南 德宏 678400)
甘油和生物素对酿酒酵母产胞内谷氨酸的影响
刘立聪1,汤 超1,王 志1,代 俊1,李 欣1,姚 娟2,郑国斌2,吕正波3,陈 雄1
(1 湖北工业大学生物工程与食品学院,发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,湖北 武汉 430068;2 湖北省酵母功能重点实验室,安琪酵母股份有限公司,湖北 宜昌 443003;3 安琪酵母(德宏)有限公司,云南 德宏 678400)
为降低Crabtree效应,提高酿酒酵母胞内谷氨酸的产量,研究补料物质分别为纯糖蜜、甘油加糖蜜以及甘油加糖蜜加生物素等3种条件下酿酒酵母的生长代谢。结果表明:用甘油替代部分糖蜜进行流加,可以降低Crabtree效应,但碳源利用率显著降低;在此基础上添加生物素后,既降低了Crabtree效应,又解决了碳源利用率低的问题;其中流加800 mL糖蜜、300 g甘油和4 mg生物素时,胞内谷氨酸含量在12 h达到3.04%,比只流加糖蜜时的峰值2.28%(18 h)提高33.3%,而且发酵周期缩短了6 h。
Crabtree效应; 酿酒酵母; 甘油; 生物素; 胞内谷氨酸
酵母抽提物具有丰富的营养价值,作为新一代集营养、调味和保健为一体的天然高级调味料,越来越受到广泛关注[1-2]。酵母抽提物含有18种以上氨基酸,但存在总体呈味上比味精强而鲜度不突出的缺点[3-4],其谷氨酸的含量不足是其主要原因之一[5]。这与酵母抽提物的制备工艺和酿酒酵母突出丙酮酸脱羧进入乙醇合成途径、弱化三羧酸循环途径(TCA)碳流量的遗传背景有关[6],致使胞内谷氨酸含量偏低以及胞内蛋白水解后总谷氨酸含量不稳定。
酿酒酵母存在明显的Crabtree效应,也使碳代谢溢流向乙醇合成途径而对TCA以及谷氨酸合成不利[7-8],而且基础碳源(如葡萄糖)浓度越高,Crabtree效应强度也越强,溢流合成乙醇效应越大[9]。显然,Crabtree效应是提高酿酒酵母胞内谷氨酸合成效率的一个瓶颈。
酿酒酵母工业发酵通常以糖蜜(含30%蔗糖)为主要碳源,通过迟效碳源替代部分糖蜜可能会减弱Crabtree效应。甘油作为一种较为经济的迟效碳源,能被酿酒酵母利用并与乙醇代谢有着密切关系[10-11]。考虑到糖蜜中含有一定量的生物素[12]及其对糖代谢速率和CO2固定的影响[13-14],以甘油部分替代糖蜜后,添加适宜浓度的生物素是必要的。但是,目前有关为降低酿酒酵母Crabtree效应、提高胞内谷氨酸含量的策略还未见报道,如何在碳代谢水平优化碳流进入谷氨酸合成途径,是富谷氨酸酵母生产过程中至关重要的问题。
为了提高酿酒酵母的生物量和胞内谷氨酸的含量,本研究优化了补料成分及其组成,确定了合适的甘油和生物素流加方式,降低了乙醇的生成效率,显著提高了胞内谷氨酸含量。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种 酿酒酵母(Saccharomycescerevisiae)J-5由安琪酵母股份有限公司提供。
1.1.2 培养基 斜面培养基:蔗糖,50 g/L;酵母浸粉,20 g/L;MgSO4·7H2O,1 g/L;KH2PO4,1 g/L;pH, 4.8~5.0。121 ℃灭菌20 min。
种子培养基(YS培养基):蔗糖,100 g/L;酵母浸粉,20 g/L;MgSO4·7H2O,1 g/L;KH2PO4,1 g/L;pH,4.8~5.0。250 mL三角瓶装液量50 mL,121℃灭菌20 min。
发酵培养基:糖蜜(含30%蔗糖),100 mL/L;酵母浸粉,10 g/L;工业蛋白胨, 20 g/L;MgSO4·7H2O, 1 g/L;KH2PO4,0.5 g/L;FeSO4·7H2O, 2 g/L。121 ℃灭菌20 min。
1.1.3 流加补料策略 流加速率以及通风量和搅拌转速控制策略如表1所示。
发酵过程中温度控制在30 ℃,用10%硫酸和10%氨水(均为体积分数,下同)控制pH值在4.8~5.0范围。
补料策略1:糖蜜(约含30%可发酵性糖)1 300 mL。
补料策略2:糖蜜650 mL+200 g甘油,水定容至1 300 mL。
补料策略3:糖蜜650 mL+200 g甘油+2.4 mg生物素,水定容至1 300 mL。
补料策略4:糖蜜650 mL+250 g甘油+3 mg生物素,水定容至1 300 mL。
补料策略5:糖蜜800 mL+300 g甘油+4 mg生物素,水定容至1 300 mL。
1.1.4 仪器 高压灭菌锅,上海博讯实业有限公司医疗设备厂;DZF-6020电热鼓风干燥箱,重庆银河实验仪器有限公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;电子分析天平,北京赛多利斯天平有限公司;TG18M台式高速离心机,长沙平凡仪器仪表有限公司;HNY-211B恒温摇床,天津市欧诺仪器仪表有限公司;CJ-1D洁净工作台,天津市泰斯特仪器有限公司;容声BCD-560WD11HY对开门冰箱,海信容声冰箱有限公司;pH计,赛默飞世尔科技有限公司;高效液相色谱U3000,安捷伦公司;10 L发酵罐,上海联环生物工程设备有限公司。
1.2 方法
1.2.1 种子培养方法 将斜面菌种用接种环勾出一环在新鲜斜面培养基上划满整个表面,30 ℃培养12 h;再向培养好的斜面中每支倒入15 mL无菌水洗脱表面菌体,并用移液枪吹打均匀成菌悬液,然后用移液枪转接至三角瓶,每瓶接种量为10%(5 mL菌悬液),放置摇床180 r/min,温度30 ℃培养10 h。
1.2.2 酵母胞内谷氨酸测定 样品预处理:取发酵液2.5 mL,6500 r/min离心5 min倒掉上清水洗菌体2次,再用5 mL去离子水重悬菌体,-20℃冻1 h,80 ℃水浴15 min,反复冻融3次[15]。冻融好的菌悬液6500 r/min离心5 min取上清600 μL于2 mL离心管再向其中加入2倍体积(1.2 mL)冰冻后的无水乙醇,10 000 r/min,4 ℃离心5 min,用1 mL的注射器和0.22 μm的滤头过滤上清于样品瓶,-20℃下保存。胞内游离谷氨酸含量采用HPLC检测[16]。
HPLC分析条件:色谱柱为安捷伦 ZORBAX SB-Aq column(150 mm×4.6 mm×5 μm,Aglient,USA);柱温30 ℃;进样量20 μL;紫外检测波长210 nm;采用10 M pH 1.8的K2HPO4(磷酸调pH)作为流动相;流速0.6 mL/min。根据所测标品,谷氨酸的保留时间为4.6 min。

1.2.3 菌体干重测定 取发酵液2.5 mL,6500 r/min离心5 min,倒掉上清水洗菌体2次,放置在80 ℃的烘箱连续烘干24 h,取出放入干燥器冷却后称质量。
1.2.4 总糖测定方法 总糖浓度测定采用硫酸蒽酮法[17]。
1.3 数据处理
所有试验数据至少3个平行试验平均值。采用origin 8.5和Excel 2003对试验数据分析。
2 结果与分析
2.1 补料策略1对酵母产胞内谷氨酸发酵过程的影响
根据1.1.3的补料控制参数,在3~14 h(图1中用箭头标出)流加1 300 mL糖蜜。该补料策略对酵母产胞内谷氨酸、菌体生长的影响如图1所示。
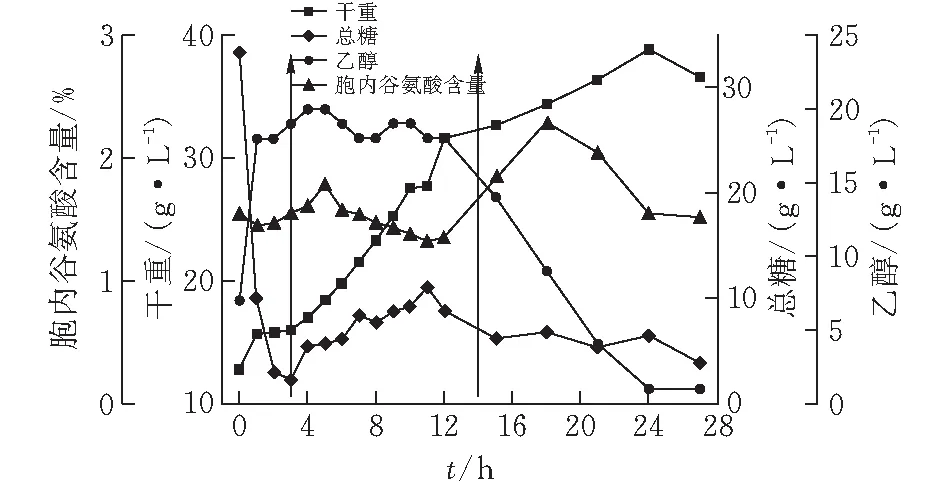
图 1 10 L罐上补料策略1对酿酒酵母J-5发酵的影响
由图1可知,酵母生物量一直处于增长状态,在24 h达到峰值38.8 g/L;0~3 h发酵过程,碳源被快速利用,伴随着乙醇大量的生成,胞内谷氨酸呈先降后升趋势,在3~14 h补料期间,乙醇一直维持在19 g/L左右,此期间胞内谷氨酸在5 h有一个峰值1.78%,之后一直缓慢下降,直到补料结束;总糖消耗至6 g/L左右,乙醇被重新利用,胞内谷氨酸呈先增后降趋势,在18 h达到峰值2.28%。补料期间随着流加糖蜜体积的增加,菌体快速增长,但总糖一直处于缓慢增长状态,同时乙醇一直维持在高位状态,而胞内谷氨酸呈缓慢下降趋势,说明酵母生长代谢过程中Crabtree效应明显,生成的丙酮酸大部分进入乙醇合成途径;后期碳源不足,乙醇被重新利用时胞内谷氨酸才有所增长,表明发酵过程中削弱Crabtree效应对酿酒酵母胞内谷氨酸合成有利。因此,后续实验考虑调整碳源组成来控制Crabtree效应。
2.2 补料策略2对酵母产胞内谷氨酸发酵过程的影响
酿酒酵母可以利用甘油做碳源[10],那么,用迟效碳源甘油替代部分糖蜜能否减弱Crabtree效应?按补料策略2试验,该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图2所示。
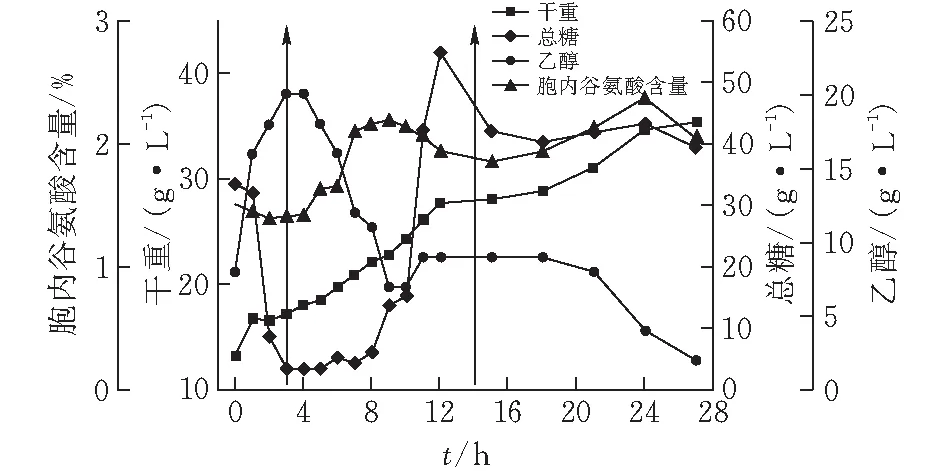
图 2 10 L罐上补料策略2对酿酒酵母J-5发酵的影响
由图2可知,整个发酵周期酵母菌体一直在增长,在发酵结束时达到峰值35.36 g/L,其生长速率和生物量都要低于图1,0~3 h总糖、乙醇和胞内谷氨酸变化趋势与图1相同,而在补料期间,乙醇则处于下降趋势,由20 g/L降至7 g/L,随后维持在9 g/L左右,直到21 h再次被利用;补料期间胞内谷氨酸3~9 h呈增长趋势达到一个峰值2.19%,之后缓慢下降,这与总糖的变化有关,总糖在补料期间几乎未利用,酵母生长及胞内谷氨酸合成的所需碳源大部分来源于乙醇,因而胞内谷氨酸在9~14 h未继续增长反而下降了;直到补料结束,酵母为维持生长和合成谷氨酸,碳源才被再次消耗,后续胞内谷氨酸有一个小幅度增长,达到2.37%,比图1中的峰值2.28%提高了约4%。但碳源的利用率明显不足,直到发酵结束总糖浓度有40 g/L左右。由此可知,用甘油替代糖蜜虽然减弱了Crabtree效应,但也使得碳源利用率显著降低,推测原因可能是由于甘油替代了糖蜜,而替代糖蜜中所含的生物素并没有及时补加,这样使得补料组分中的生物素不足。适量的生物素可通过丙酮酸羧化酶固定CO2提高进入三羧酸循环的碳通量[18],而且还能促进碳代谢由异柠檬酸流向谷氨酸[14]。因此,考虑后续实验在此基础上添加生物素,以考察其对酵母产胞内谷氨酸、菌体生长和主要代谢的影响。
2.3 补料策略3对酵母产胞内谷氨酸发酵过程的影响
通过折算被替代糖蜜中的生物素含量,在补料成分中添加生物素,具体按补料策略3试验,该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图3所示。由图3可知,发酵过程中酵母生长趋势与图2一致,但酵母的生长速率明显有所提高,在24 h达到峰值39.18 g/L,比35.36 g/L提高10.8%;0~3 h各项指标变化趋势与前两批一致;补料期间,乙醇趋势与图2一致,由20 g/L降至10 g/L并维持,补料结束后再次被利用;补料期间胞内谷氨酸呈增长趋势,在12 h达到峰值2.82%,比图1和图2中的峰值分别提高约23.7%和19%,之后缓慢下降,在此期间总糖的利用率明显提高,未出现随补料体积增加而急剧增加的情况,同时发酵结束时总糖仅维持在5 g/L左右。说明:在甘油替代部分糖蜜的基础上,添加一定量的生物素,既能缓解Crabtree效应,使胞内谷氨酸含量明显提高,又可以提高甘油+糖蜜的利用率。因此,猜想在后续实验中增加甘油的比例,同时按策略3中甘油与生物素的比例,相应增加生物素的量,可能会使Crabtree效应更弱,从而进一步提高胞内谷氨酸含量。
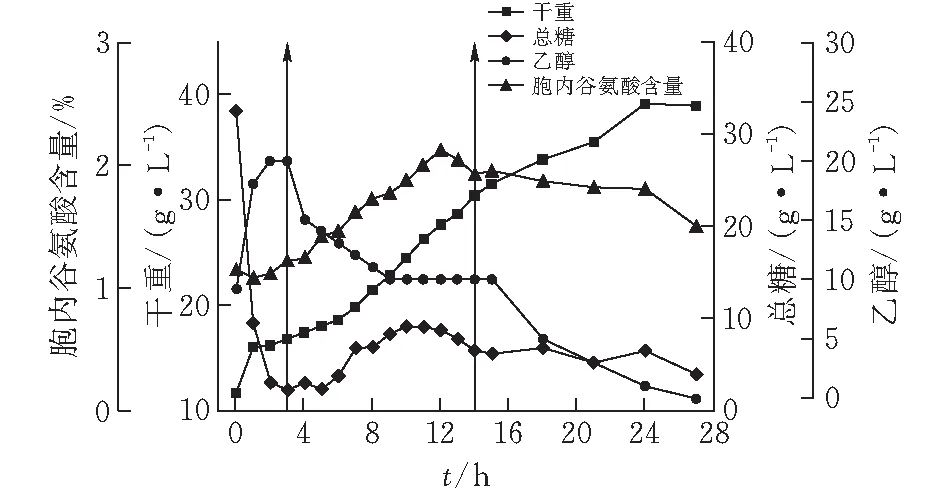
图 3 10 L罐上补料策略3对酿酒酵母J-5发酵的影响
2.4 补料策略4对酵母产胞内谷氨酸发酵过程的影响
甘油替代部分糖蜜的同时添加生物素确实能减弱Crabtree效应,说明调整碳源组成是有效的,那么,增加甘油的比例能否进一步减弱Crabtree效应呢?因此按补料策略4试验,该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图4所示。由图4可知,酵母在整个发酵周期一直呈增长趋势,在发酵结束时达到峰值39.22 g/L,生物量与图3基本一致;整个发酵过程中乙醇、总糖和胞内谷氨酸的变化趋势与图3高度相似,这也再次证明用甘油替代糖蜜的同时添加相应的生物素既减弱了Crabtree效应,又提高了碳源的利用率;虽然胞内谷氨酸在13 h达到峰值2.89%,比图1和图3中的峰值分别提高了约26.7%和2.5%,但补料期间的乙醇并未如2.3中的猜想那样降至更低水平,而且补料结束之后,胞内谷氨酸依然呈下降趋势。这表明提高补料组分中甘油的比例并没有进一步减弱Crabtree效应,补料期间胞内谷氨酸的略微提高可能与增加了碳源(甘油)有关;后期胞内谷氨酸的下降情况说明发酵后期碳源不足。因此,考虑后续实验中增加补料组分中糖蜜和甘油的量,研究其能否进一步提高胞内谷氨酸或使发酵后期胞内的谷氨酸含量处于维持状态。
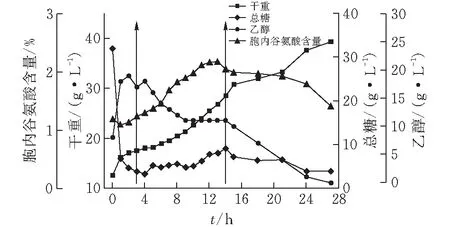
图 4 10 L罐上补料策略4对酿酒酵母J-5发酵的影响
2.5 补料策略5对酵母产胞内谷氨酸发酵过程的影响
为了进一步提高胞内谷氨酸含量和维持发酵后期胞内谷氨酸的水平,提高了补料成分中糖蜜和甘油的量,具体按补料策略5试验。该补料模式对酵母产胞内谷氨酸、菌体生长和主要代谢的影响如图5所示。
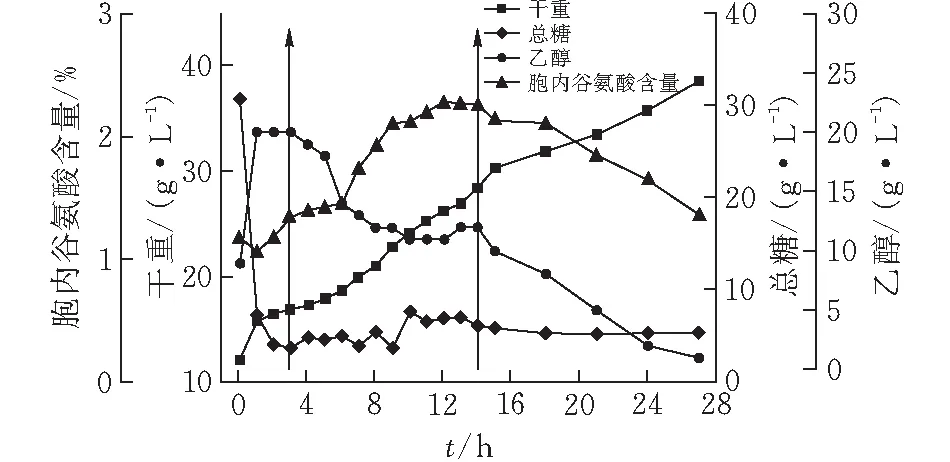
图 5 10 L罐上补料策略5对酿酒酵母J-5发酵的影响
由图5可知,在该条件下发酵,菌体的生长和主要代谢参数变化与2.4相似,这同样验证了甘油和生物素所产生的作用;生物量在发酵结束达到峰值38.72 g/L,补料期间的乙醇下降后维持在11 g/L左右,胞内谷氨酸呈上升趋势在12 h达到峰值3.04%,比图4和图1的峰值分别提高了5.2%和33.3%,虽然胞内谷氨酸相较2.4有略微提高,但后期还是未处于维持状态。从后期总糖和乙醇的量来分析,可能发酵过程中流加的碳源仍然不足,使得发酵后期菌体生长不得不利用谷氨酸作碳源,因此,后期胞内谷氨酸呈下降趋势。
2.6 种补料策略的比较
由表2可知,对比策略1和策略2各项参数,发现甘油替代糖蜜能减弱了Crabtree效应,让乙醇浓度降低,但也使得碳源利用率显著降低,发酵结束时残糖维持在高水平(40 g/L),生物量峰值有所降低;而后续3种策略,生物素的添加,既让Crabtree效应减弱,又显著提高了碳源利用率,生物量峰值回升,同时胞内谷氨酸含量明显提高(由2.28%增长至3.04%),发酵周期也缩短了约6 h。
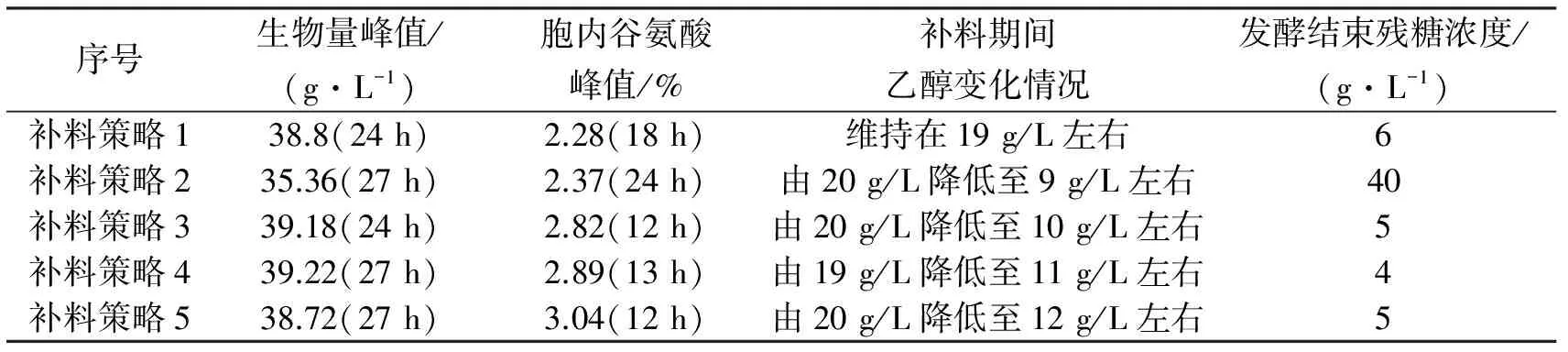
表2 5种补料策略的比较
3 结论
针对酿酒酵母发酵产胞内谷氨酸的过程中,流加糖蜜使Crabtree效应明显、胞内谷氨酸产量低的问题,本研究通过改变发酵过程中补料成分的组成,流加混合成分(糖蜜800 mL,300 g甘油,4 mg生物素,体积加水补至1300 mL)显著提高了胞内谷氨酸的含量,其峰值达到3.04%(12 h),相较于发酵过程中只流加1300 mL糖蜜时的峰值2.28%(18 h)提高了33.3%,缩短了发酵周期约6 h。研究结果显示,在甘油替代糖蜜的基础上添加相应质量的生物素能够显著减弱Crabtree效应,提高胞内谷氨酸的含量。综上所述,在补料成分中添加甘油和生物素是减弱Crabtree效应、提高胞内谷氨酸含量的有效方式之一。
[1] 白卫东,蔡鹏昌,钱敏. 酵母抽提物的生产及应用[J]. 中国调味品,2009, 34(10):62-65.
[2] 王琴,黄嘉玲,黎奇欣,等. 酵母抽提物的生产技术进展[J]. 现代食品科技,2013(7):1747-1750.
[3] 李沛.安琪酵母抽提物及其在食品调味品中的应用[J].中国酿造,2010(2):17-21.
[4] 郭永.酵母抽提物的研究进展[J].中国调味品,2010,35(12):24-27.
[5] 盛国华. 酵母提取物的特性及研究开发[J]. 食品工业科技,1991(4):57-60.
[6] Abbott D A, Zelle R M, Pronk J T, et al. Metabolic engineering ofSaccharomycescerevisiaefor production of carboxylic acids: Current status and challenges[J]. FEMS Yeast Research, 2009, 9(8):1123-1136.
[7] 徐国强,陈修来,吴满珍. 调控辅因子水平减少酿酒酵母积累副产物乙醇[J]. 食品与发酵工业,2014, 40(10):6-10.
[8] Kajihata S, Matsuda F, Yoshimi M, et al.13C-based metabolic flux analysis ofSaccharomycescerevisiaewith a reduced Crabtree effect.[J]. Journal of Bioscience & Bioengineering, 2015, 120(2):140-144.
[9] Guidi F, Magherini F, Gamberi T, et al. Effect of different glucose concentrations on proteome ofSaccharomycescerevisiae[J]. Biochimica Et Biophysica Acta Proteins & Proteomics, 2010, 1804(7):1516-1525.
[10] Kim J W, Chin Y W, Park Y C, et al. Effects of deletion of glycerol-3-phosphate dehydrogenase and glutamate dehydrogenase genes on glycerol and ethanol metabolism in recombinantSaccharomycescerevisiae[J]. Bioprocess and Biosystems Engineering, 2012, 35(1):49-54.
[11] Seo H B, Yeon J H, Jeong M H, et al. Aeration alleviates ethanol inhibition and glycerol production during fed-batch ethanol fermentation[J]. Biotechnology & Bioprocess Engineering, 2009, 14(5):599-605.
[12] Cook A H, Cook A H. The chemistry and biology of yeasts[M]. Academic Press Inc, 1958:538.
[13] 刘加庆,周丽,田勇. HPLC检测生物素的方法研究[J]. 发酵科技通讯,2008, 37(2):17-21.
[14] 陈宁. 氨基酸工艺学[M]. 北京:中国轻工业出版社,2008.
[15] 郭卫芸,杜冰,袁根良. 反复冻融法破壁啤酒废酵母的研究[J]. 酿酒科技,2009, 2009(3):103-105.
[16] 钱敏,白卫东,赵文红. 酵母抽提物中游离氨基酸的测定与分析[J]. 现代食品科技,2012, 28(7):878-881.
[17] 陈秋竹. 硫酸蒽酮法测定注射用双黄连(冻干)中总糖的含量[J]. 贵州医药,2013(12):1114-1115.
[18] 龚大春. 酵母生物学[M]. 北京:中国水利水电出版社,2015.
[责任编校: 张 众]
Effects of Glycerol and Biotin additions on intracellular Glutamate Production by Saccharomyces cerevisiae
LIU Licong1,TANG Chao1,WANG Zhi1,DAI Jun1,LI Xin1, YAO Juan2,ZHENG Guobin1, LYU Zhengbo3, CHEN Xiong1
(1KeyLaboratoryFermentationEngin. (MinistryofEducation),HubeiProvincialCooperativeInnovationCenterofIndustrialFermentation,CollegeofFoodandBioengin.,HubeiUniv.ofTech.,Wuhan430068,China; 2HubeiProvincialKeyLaboratoryofYeastFunction,AngelYeastCo.,Ltd,Yichang443003,China; 3.AngelYeast(DeHong)Co.,Ltd,Dehong678400.China)
In order to reduce the Crabtree effect and increase the intracellular glutamate production by Saccharomyces cerevisiae, the growth and metabolism of Saccharomyces cerevisiae has been studied under three conditions: pure molasses addition, molasses addition with glycerol, molasses addition plus glycerol with biotin. The results show that the molasses addition, partly substituted by glycerol, can reduce the Crabtree effect, but the carbon source utilization rate has significantly decreased. Molasses addition plus glycerol with biotin batch culture has reduced not only the Crabtree effect, but also resolved the problem of a low carbon source utilization rate by molasses addition with glycerol batch culture. When the fed batch culture was done with molasses (800 mL) as well as glycerol (300 g) and biotin (4 mg), the intracellular glutamate content reached 3.04% at 12 h, which was 33.3% higher than that of the pure molasses 2.28%(18 h), and the fermentation period was shortened by 6 h.
Crabtree effect;Saccharomycescerevisiae; glycerol; biotin; intracellular glutamate
2017-03-06
刘立聪(1991-), 男, 湖北洪湖人,湖北工业大学硕士研究生,研究方向为发酵工程
陈 雄(1969-),男,湖北荆门人,工学博士,湖北工业大学教授,研究方向为酿造工程
1003-4684(2017)02-0042-05
Q815
A

