羟基氧化铁在浆态床中的脱硫化氢研究
沈宪林, 胡 兵
(湖北工业大学材料与化学工程学院, 湖北 武汉 430068)
羟基氧化铁在浆态床中的脱硫化氢研究
沈宪林, 胡 兵
(湖北工业大学材料与化学工程学院, 湖北 武汉 430068)
利用水热法合成α晶相的羟基氧化铁,探究其室温下在浆态床鼓泡反应器中脱除硫化氢标准气中的硫化氢性能。通过测得的脱硫穿透曲线来说明初始硫化氢浓度、浆液固含量以及表观气速等对体系催化性能的影响,并利用XRD、XPS和氮气脱附吸附等表征手段对催化剂以及再生反应过程中的固体样品进行测试,以分析催化剂的再生性能。实验表明,催化剂吸附脱除硫化氢性能受浆液固含量、硫化氢初始浓度以及气流速的影响很大。再生反应过程中,催化剂的晶相保持不变,5次再生循环使用,脱硫性能变化不大,可保持在93%以上,再生性能良好。催化剂的单次脱硫性能可达到134 mg H2S/羟基氧化铁。
硫化氢; 浆态床鼓泡反应器; 羟基氧化铁
气相中的H2S不仅对人体造成危害,而且在煤制合成气、天然气以及城市垃圾的消解气[1]等的利用过程中腐蚀管道和反应器等设备2-3]。传统的脱硫化氢方法包括干法脱硫和湿法脱硫。干法脱硫包括氧化锌法、氧化铁法、锰矿法和活性炭吸附法等[4-7],然而大多数脱硫剂的使用和再生都需要在中高温下进行,虽然脱硫精度高,但耗能巨大。羟基氧化铁是近年来比较热门的一种干法脱硫剂[8-10],在常温下脱硫化氢,表现出很高的硫容。Takuji Yamamoto等[11]研究了羟基氧化铁在固定床中的脱硫化氢性能,主要从初始硫化氢浓度、表观气速以及床层温度等几个实验条件下对脱硫化氢过程做了分析,并考察了吸附反应的传质过程。在实际应用中,固定床存在催化剂利用率低、再生及更换困难等问题。而浆态床则很好地解决了固定床中存在的这些问题。羟基氧化铁在浆态床中的脱硫化氢研究未见报道。本文从初始硫化氢浓度、固含量、气体流量等实验条件下研究了羟基氧化铁在浆态床鼓泡反应器中的脱硫化氢性能,并考察了催化剂的再生性能。
1 实验
1.1 实验材料和仪器
用到的化学药品主要有FeSO4·7H2O和碳酸钠,均为分析纯。所使用的主要仪器有磁力搅拌器、上海雷磁 PHSJ-3F型酸度计、转子流量计、气瓶、长春湿式气体流量计、空气泵、带气体分布器的玻璃管(d=3 cm,h=30 cm)以及洗气瓶等。
1.2 羟基氧化铁的制备
称取100 g FeSO4·7H2O,在70℃下溶解在200 mL去离子水中。保持此温度不变,逐勺加入Na2CO3粉末,按碱比(沉淀剂与铁盐的物质的量之比)为1∶1加完为止,持续反应1 h。然后停止加热,在室温下调节pH为7~ 8之间。陈化3 h后过滤,用60℃热水多次洗涤滤渣,直到用氯化钡溶液滴定滤液无明显沉淀生成。将滤渣在表面皿上摊开,晾干24 h,然后放在干燥箱中,于60℃下干燥24 h。最后将固体充分研磨,装入样品袋,放置在常温干燥箱中,以备后用。氮气脱附吸附分析表明所制的催化剂比表面积为92.4m2/g,孔径主要以2.74 nm介孔为主。
1.3 样品的表征
样品的晶相是利用荷兰帕纳科(PANalytical)X’Pert Pro 型X射线衍射仪(XRD)测定的,测试条件是,CuKα为辐射源,电压为40 kV,管电流为40 mA,扫描速度为1.7°/min,扫描范围为10°~80°;颗粒的表面价键结构通过傅里叶远红外光谱仪(FTIR)分析得到;催化剂表面元素的化合价分析则利用hermo Fisher 公司ESCALAB 250Xi 光电子能谱仪(XPS)来分析得到,测试条件:激发源为单色化Al Ka;催化剂的比表面积以及孔结构则通过BERSORP mini2氮气脱附吸附测试数据,用BET和BJH方法分析得到。
1.4 羟基氧化铁脱硫化氢及再生性能
1.4.1 实验装置 实验装置如图1所示。
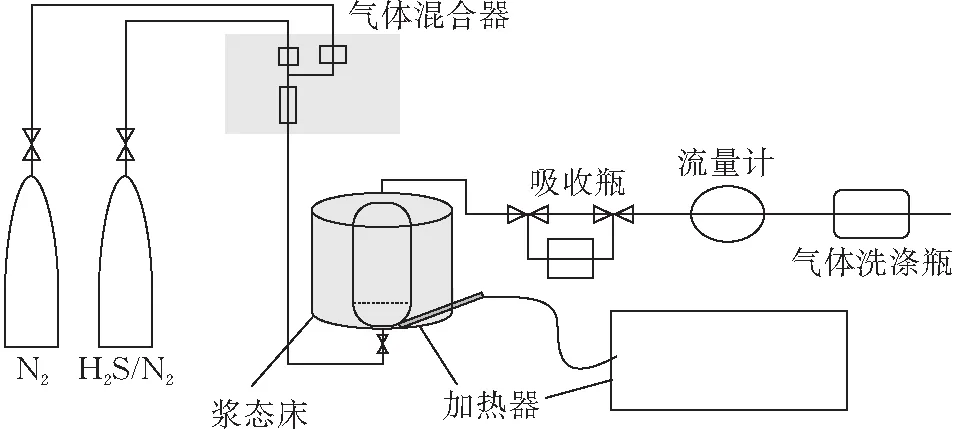
图 1 脱硫工艺流程示意图
1.4.2 实验分析方法 脱硫化氢过程中,对采样的气体,采用碘量法(参照GB/T 11060.1 -2010)分析硫化氢浓度。对浆液进行采样,静置一段时间后,用酸度计测浆液pH值,然后过滤,真空干燥,用XRD、XPS、IR以及氮气脱附吸附等分析手段对所得固体以及原样进行表征。再生过程中,硫含量采用称重法来测定。湿基羟基氧化铁吸附硫化氢的性能则通过下式说明:
式中:Ks表示单位质量干基催化剂吸附的硫化氢的量,Ws表示吸附硫化氢后体系的总质量,W0表示吸附硫化氢前体系的总质量,m表示用于吸附硫化氢的羟基氧化铁的质量。
1.4.3 实验过程 向装置中通入N2,以置换出装置内的空气。用水做分散介质,配制一定固含量的催化剂的浆液,置于带有气体分布器的玻璃管(即浆态床鼓泡反应器)中,然后在一定的床层温度下以一定速率向其中通入一定浓度的硫化氢标准气。反应过程在常压下进行,每隔20min在出口管取样检测硫化氢浓度。以出口气硫化氢浓度Ct与入口气硫化氢浓度C0的比值η为纵轴坐标,时间t为横轴坐标,作两者的相关图,并据此分析不同因素对体系脱硫性能的影响。对于不同因素的影响,固含量w选取4个测试点(3%、4.5%、6%、7.5%),气体流量v选择3个测试点(0.35L/min、0.55L/min、0.75L/min),硫化氢初始浓度C选取3个测试点(0.1%、0.2%、0.4%)。利用空气氧化法对催化剂进行再生,通过多次循环吸附再生得到的Ks,考查了再生时间t和再生次数n对催化剂脱硫性能的影响。
2 结果与讨论
2.1 不同实验条件对脱硫性能的影响
在气液固三相浆态床反应器[12]中,硫化氢浓度、气体流量和气体分布器会影响气液之间的传质过程,浆液固含量和颗粒的大小会影响液固之间的传质过程。因而在一定的条件下,改变其中一种实验条件,可能改变床层的脱硫性能。根据单因素变量下的脱硫穿透吸附曲线,可分析出各因素的影响大小。
2.1.1 浆液的固含量 图2表示的是不同浆液固含量下硫化氢出口气的浓度与初始硫化氢浓度的比值η随时间t的变化曲线。实验在气流量为0.35L/min,气体初始浓度为0.4%,室温20℃下进行。从图中可见,出口与入口硫化氢浓度比值随着时间的推移而增大,最后基本保持不变。随着浆液固含量的升高,η的变化率会变小;而且当比值不变的时候,固含量高的,η更小。由此可知,羟基氧化铁对水中硫化氢的吸附有一段平衡过程,而在硫化氢的传质速率与吸附反应速率相当时,会出现这一平衡。但是在吸附过程中,浆液很快变色,这说明吸附反应速率很高,可推测该平衡是由气固传质阻力造成的。综上可知,浆液的固含量越高,越有利于硫化氢的吸附。然而,由于固含量还会影响浆液的性质,以至于影响到气液传质过程[12],因而可推测有个最佳的固含量使得吸附效果达到最好,不过本实验中未表现出这一结果。
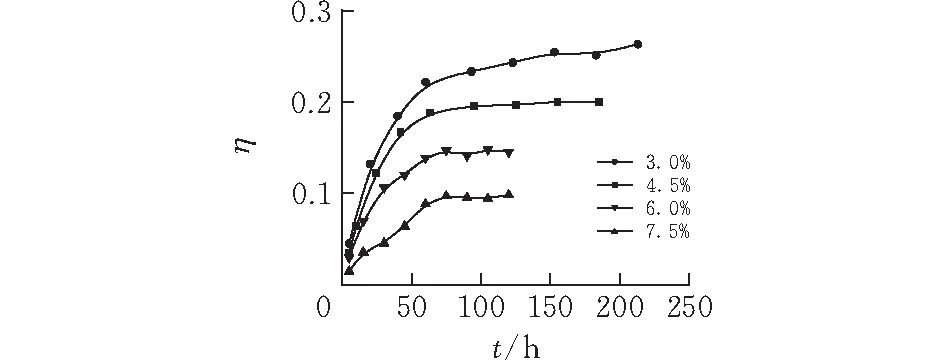
图 2 不同浆液固含量下体系的脱硫化氢穿透曲线
2.1.2 初始硫化氢浓度 图3表示不同硫化氢初始浓度下床层的穿透曲线。实验条件为,温度20℃,气体流量3.5 L/min,固含量6%。从图中可见初始硫化氢浓度越低,浆液对硫化氢的吸附性能就越好,表现为在相同的反应时间内,出口气与入口气硫化氢的比值更小。而硫化氢浓度大的,其吸附速率更快。这是因为硫化氢浓度大的,气液传质速度更快,从而增加了表观反应动力,但是受催化剂脱硫性能的限制,低浓度的硫化氢气体会表现出更好的脱除率。
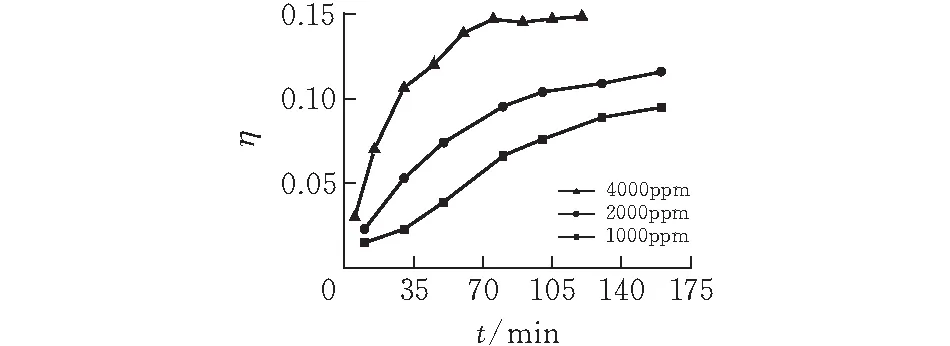
图 3 不同初始硫化氢浓度下体系的脱硫化氢穿透曲线
2.1.3 气体流量 图4表示的是不同气流速下床层的硫化氢吸收穿透曲线。实验条件为温度20℃,气体初始硫化氢浓度为0.4%,固含量6%。从图中可见气体流速对床层的脱硫化氢性能有一定影响。根据气体流量和玻璃管直径之间的关系可知,本实验中气体在床层中最大表观气速为1.77 cm/s。根据鼓泡塔浆态反应器中的流区图可知,反应器中的流体为均匀气泡流[12]。气流速会影响到气体在床层中的停留时间以及气含率,从而影响到气液传质过程。
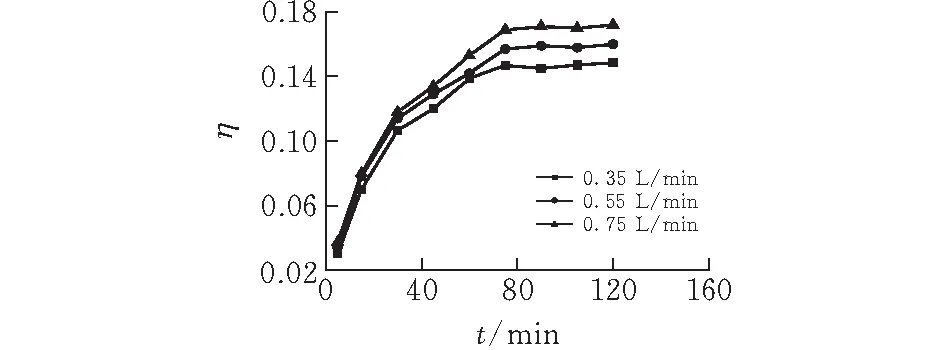
图 4 不同气速下体系的脱硫化氢穿透曲线
2.2 羟基氧化铁再生前后的性能
1)再生性能曲线 图5a表示在氧气氧化再生催化剂的过程中,不同再生时间t下的羟基氧化铁的脱硫性能。从图中可见,再生时间为1.5 h时,催化剂的再生性能跟初始的相近,而随着再生时间的延长,催化剂的再生性能并未提高反而有所下降。图5b表示再生次数对催化剂脱硫性能的影响。从图中可以看出随着再生次数的增加,催化剂的吸附性能有所降低。5次循环使用后,再生性能可保持在93%以上。催化剂再生性能的降低可能存在两方面的原因。通过实验观察到,在过滤过程中有极细的催化剂颗粒存在滤液中,这会导致一些催化剂的损失。另一个原因可由以下的XPS以及PH值分析得到。
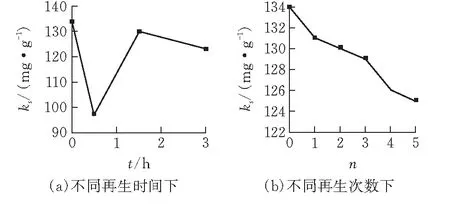
图 5 羟基氧化铁的脱硫性能
2)XPS分析 图6是FeOOH在不同的再生时间下表面元素中S(2p)轨道和Fe(2p)轨道的XPS谱图。从图6a可见S的化合态有高价硫(168.6 eV)、零价硫(164 eV)和低价硫(162.4 eV)3种存在形式,而从三者峰面积之比可知,随着再生时间的推移,低价态的硫不断转化为零价态硫和高价态硫而使其含量不断降低。
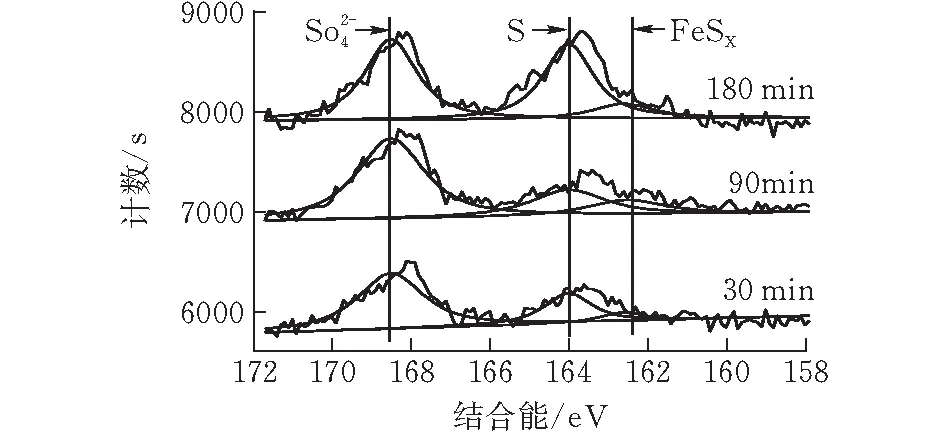
(a)S(2p)轨道
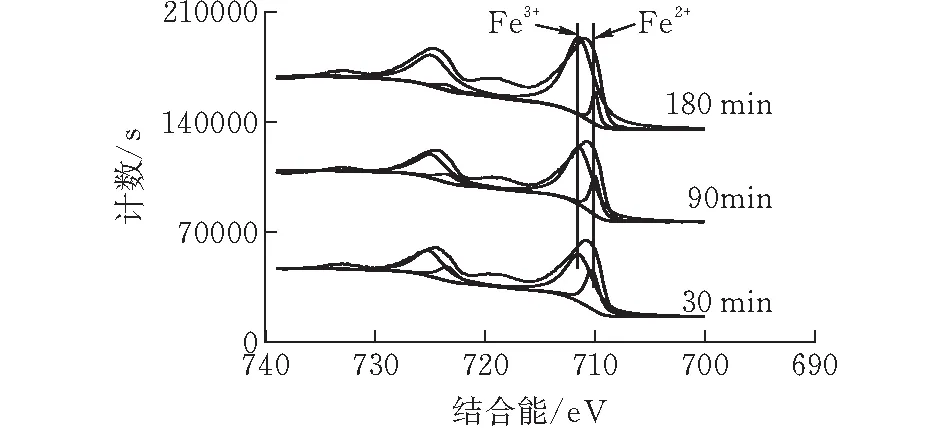
(b) Fe(2p)轨道图 6 再生过程中S(2p)轨道和Fe(2p)轨道的xps谱图
从图5b可知Fe的化合态有+2(709.6 eV)和+3(710.6 eV)两种,从其峰面积之比可知,两者的含量之比随着再生时间的推移而不断下降。Fe2+的存在说明羟基氧化铁在脱除硫化氢的过程中与H2S发生了氧化反应。这与文献[13]所报道的一致,即可推测吸附反应和再生反应过程如下:
吸附反应
2FeOOH + 3H2S → Fe2S3+ 4H2O ;
Fe2S3→ FeS + FeS2
再生反应
2FeS + 2FeS2+ 3O2+ 2H2O → 4FeOOH + 6S
然而,图5a还显示出有部分硫转化为高价硫化合物,这与文献[14]相符,可以推测其间发生了以下副反应:
FeS2+ H2O + 3.5O2→ FeSO4+ H2SO4
该副反应不仅不利于单质硫的回收,而且会导致催化剂转变为成可溶性盐而流失。另外随着循环次数的增多,系统的酸性会越来越强,这将不利于硫化氢的吸附反应过程。
3)pH值分析 图7显示了新鲜催化剂在相同体积的水溶液中和在不同再生时间下体系的pH值。从图中可以看出,吸附反应完全后的体系相对于催化剂水溶液的pH值几乎不变,而随着再生时间的推移pH值逐渐减小,这进一步说明生成高价硫的副反应是存在的。然而从图中也可以看出,pH值变化很小,这说明发生副反应的量很少。
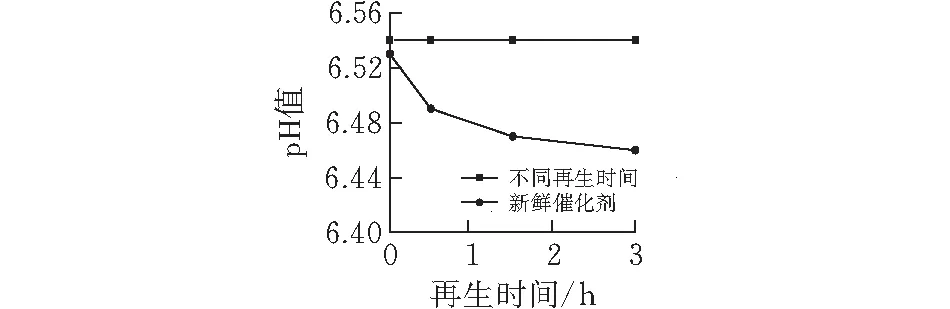
图 7 再生过程中的体系和新鲜催化剂水溶液的pH值
4)XRD分析 从图8可知,再生后有硫单质生成,羟基氧化铁的晶相不变。与JCPDS卡片库中的标准谱图作对比,可确认羟基氧化铁的晶相为α-FeOOH(81-0462),而生成的单质硫为S8(53-1109)。由此可知,再生过程不会改变催化剂的结构,这说明催化剂的结构很稳定。
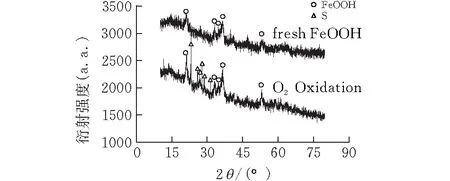
图 8 再生前后FeOOH的XRD衍射图
3 结论
本实验成功制备了α-FeOOH,考察其在浆态床反应器中的脱硫化氢性能,研究发现浆液固含量、硫化氢初浓度以及气体流量等实验条件对床层脱硫性能有很大的影响。实验表明,无论是在哪种形式的床层下,操作条件对传质过程的影响都很大。利用XPS、XRD、氮气脱附吸附等测试方法对空气氧化法再生过程进行了分析,结果表明再生过程中,催化剂结构稳定,而高价硫化物随着循环次数的增加、催化剂脱硫性能降低而产生。这与此前脱水体硫化氢的研究结果[8]是一致的。本研究对进一步探讨浆态床脱硫化氢过程中的流体力学有一定的指导意义。鉴于再生时间较长,未来的研究中可以对过氧化氢的再生过程进行探讨,另外针对再生过程中的高价硫副反应的抑制,可以考虑从温度上来研究。
[1] Michael WH, Evangelou a, Anette Brem b, et al. Soil application of biochar produced from biomass grown on trace element contaminated land[J]. Journal of Environmental Management, 2014, 146: 100-106.
[2] Bartholomew CH, Bowman RM. Sulfur poisoning of cobalt and iron Fischer-Tropsch catalysts[J]. Appl. Catal, 1985, 15 : 59-67.
[3] Yang H, Cahela DR, Tatarchuk BJ. A study of kinetic effects due to using microfibrous entrapped zinc oxide sorbents for hydrogen sulfide removal[J]. Chem. Eng. Sci, 2008, 63: 2707-2716.
[4] Li L, Sun TH, Shu CH, et al. Low temperature H2S removal with 3-D structural mesoporous molecular sieves supported ZnO from gas stream[J]. Journal of Hazardous Materials, 2016, 311: 142-50.
[5] Rakmak N, Wiyaratn W, Bunyakan C, et al. Synthesis of Fe/MgO nano-crystal catalysts by sol-gel method for hydrogen sulfide removal[J]. Chemical Engineering Journal, 2010, 162(1): 84-90.
[6] Zhang J, Wang G, Wang W, et al. Effect of calcination temperature on desulfurization performance over MnxOysupported on MCM-41 at low temperatures[J]. Research on Chemical Intermediates, 2016, 42(6): 6003-6012.
[7] Zhang Z, Wang J, Li W, et al. Millimeter-sized mesoporous carbon spheres for highly efficient catalytic oxidation of hydrogen sulfide at room temperature[J]. Carbon, 2016, 96: 608-615.
[8] Sun J,Zhou J,Shang C,et al.Removal of aqueous hydrogen sulfide by granular ferric hydroxide-Kinetics,capacity and reuse[J].Chemosphere,2014,117:324-329.
[9] 巩志坚. 常温脱硫剂活性组分铁氧化物制备原理及脱硫研究[D]. 北京:煤炭科学研究总院, 2005.
[10] 钱红辉. 氧化铁脱硫剂的制备、改性及回收利用研究[D]. 武汉:武汉科技大学, 2010.
[11] Yamamoto T,Tayakout-Fayolle M,Geantet C.Gas-phase removal of hydrogen sulfide using iron oxyhydroxide at low temperature:Measurement of breakthrough curve and modeling of sulfidation mechanism[J].Chemical Engineering Journal,2015,262:702-709.
[12] 陈诵英, 孙彦平. 化学反应器工程[M]. 北京: 化学工业出版社, 2011: 106-111.
[13] Cao Y, Shen L, Hu X, et al. Low temperature desulfurization on Co-doped α-FeOOH: Tailoring the phase composition and creating the defects[J]. Chemical Engineering Journal, 2016, 306: 124-130.
[14] Halfyard J E, Hawboldt K. Separation of elemental sulfur from hydrometallurgical residue: A review[J]. Hydrometallurgy, 2011, 109(1-2):80-89.
[责任编校: 张 众]
Removal of Hydrogen Sulfide by Iron Oxyhydroxide in Slurry Reactor
SHEN Xianlin, HU Bing
(SchoolofMaterialsandChemicalEngin.,HubeiUniv,ofTech.,Wuhan430000,China)
The goethite successfully synthesized by hydrothermal method was applied to remove hydrogen sulfide from gas phase in slurry reactor at room temperature.The performance of the catalyst was evaluated by measuring the breakthrough curve (BTC) of the reactor under different reaction conditions including solid content of the slurry(w), superficial gas velocity(v) and initial H2S concentration(c0).The samples to be analyzed were characterized by XPS,XRD and BET surface area analyzer.The experiments showed that the tests conditions including w,v, c0, have great effect on the desulfurization performance of the reactor.In the recycling of the catalyst,the crystal phase of the catalyst remained unchanged,and the removal of hydrogen sulfide kept above 93% after five recycles.The single desulfurization performance of the catalyst could reach 134 mg H2S / g catalyst.
Key words: hydrogen sulfide;Slurry ibubble ireactor; iron oxyhydroxide
2017-01-06
湖北省自然科学基金(2013CKB032); 湖北工业大学博士科研基金(200701)
沈宪林(1989-), 男, 湖北广水人,湖北工业大学硕士研究生,研究方向为煤制合成气脱硫化氢
胡 兵(1968-),男,湖北红安人,博士,湖北工业大学教授,研究方向为新型催化技术与绿色化学工艺
1003-4684(2017)02-0051-04
TQ546.5
A

