利用SRAP标记分析日本落叶松2代优树的遗传多样性
汪成成
(辽宁省林业科学研究院,辽宁 沈阳 110032)
利用SRAP标记分析日本落叶松2代优树的遗传多样性
汪成成
(辽宁省林业科学研究院,辽宁 沈阳 110032)
为研究日本落叶松2代优树间的遗传多样性,该文利用SRAP分子标记的方法对选择的80个样本进行了遗传多样性分析。结果表明:筛选出的8对引物共扩增出235条DNA条带,其中多态性条带223条,多态性百分率为94.89%,每对引物可扩增出20~37条多态性条带,平均每对引物扩增的多态性条带数为29.4条。利用UPGMA法进行聚类,当相似系数为0.824时将80个日本落叶松种质材料划分为4个类群。聚类基本与子一代的亲缘关系符合,类群间遗传基础较狭窄,亲缘关系较近,为日后建立日本落叶松2代种子园的工作提供了理论依据。
日本落叶松;2代优树;遗传多样性;SRAP
日本落叶松Larix kaempferi系松科落叶松属乔木,因其适应性强、生长快、材质好、用途广,生长量远远地超过了乡土树种长白落叶松和华北落叶松,已成为我国北方地区引种最成功的造林树种之一。日本落叶松的苗木主要是靠种子园或母树林产种获得,日本落叶松优树选择和初级种子园营建工作早在1963年就开始了,但是初级种子园是按表型选择的优株建成的。由于选优林地生态环境条件较复杂,造成表型选择误选率较高,不经子代测定就全部纳入种子园的构建,不可避免地影响了种子园的总体遗传水平。以往主要是依靠子代测验来评估种子园遗传增益,由于组成种子园优树的不同,这种评价往往不能真实地体现种子园的总体遗传水平,对于种质资源保护和遗传改良都非常不利[1-2]。本研究欲通过SRAP分子标记技术对日本落叶松2代优树的遗传多样性进行评价,力求在日本落叶松2代种子园的建成中,既获得较高的遗传增益,又具有较高的遗传多样性。
1 材料与方法
1.1 样 品
供试的80个日本落叶松样品均采自辽宁省抚顺市清原县大孤家国营林场日本落叶松2代优树,采集后用锡纸包裹,然后在锡纸上编号,投入液氮罐后及时带回实验室,保存于-80℃超低温冰箱中备用。80个供试材料的基本情况见表1。

表1 日本落叶松的供试材料
1.2 DNA提取与检测
采用CTAB法提取DNA,用0.8%琼脂糖凝胶电泳检测DNA浓度与纯度,取部分基因组DNA稀释到50 ng·μL-1,保存于-20℃的冰箱内备用。
1.3 SRAP扩增与检测
SRAP分子标记的引物由北京鼎国昌盛生物技术有限责任公司合成生产,本试验所用的引物序列见表2。SRAP-PCR反应总体积为25 μL,其中模板DNA 2 μL,引物0.5 μL,dNTPs 0.5 μL,10×PCR buffer 2.5 μL,Taq酶0.5 μL,ddH2O 18.5 μL。
PCR反应程序为94℃预变性5 m in;94℃变性1 m in,35℃退火1 m in,72℃延伸1 m in,一共循环5次;然后4℃变性1 m in,35℃退火,72℃延伸1 min,一共循环35次;最后72℃延伸10 m in,4℃保存。PCR产物用8%的非变性聚丙烯酰胺凝胶于150 V的恒压下电泳,电泳后通过固定、银染、显影后拍照分析。
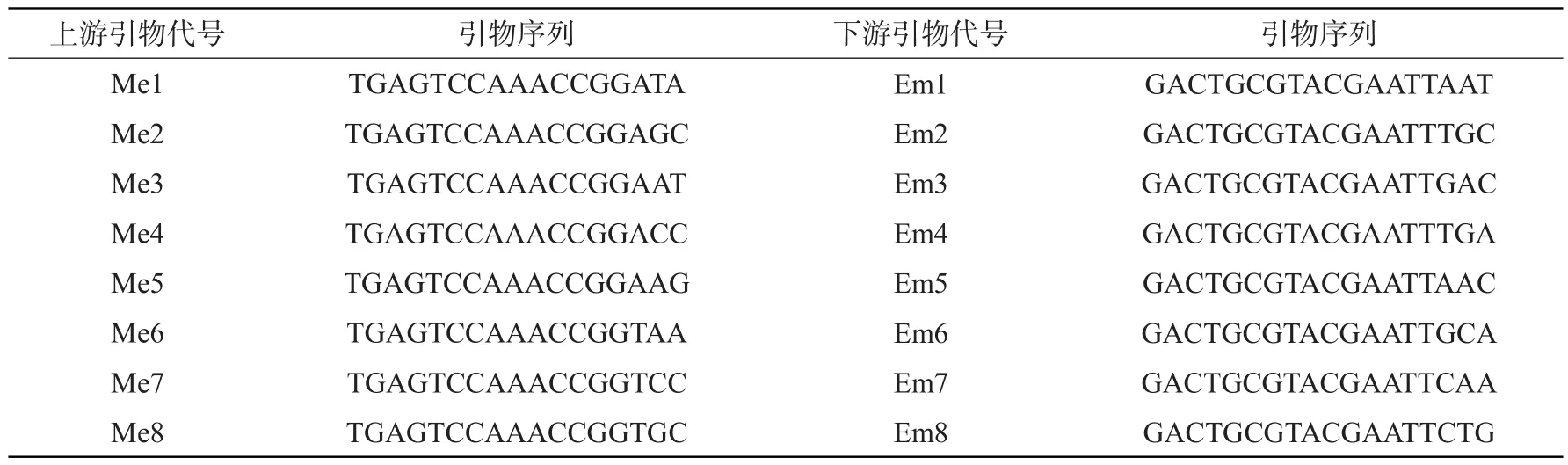
表2 SRAP引物代号及序列
1.4 数据处理
统计引物对供试材料所扩增的清晰可辨的总带数,按DNA条带的有或无赋值,有记为“1”,无记为“0”,构建二维数据矩阵。根据SRAP扩增的结果,利用NTSYS-pc version 2.1软件对统计的“0/1”数据矩阵进行分析,得到Dice相似性系数,并利用UPGMA法进行聚类分析,构建树状图。
2 结果与分析
2.1 SRAP标记的遗传多态性分析
经过初筛和复筛,从64对引物组合中筛选出8对扩增条带清晰且数目较多、多态性高、重复性较好的引物组合进行PCR扩增,扩增的片段大部分集中在70~220 bp,其中ME6-EM 8组合的扩增图谱见图1-3。

图1 引物组合M 6E8对21-40号日本落叶松DNA的扩增结果
图2 引物组合M 6E8对41-70号日本落叶松DNA的扩增结果
图3 引物组合M 6E8对71-100号日本落叶松DNA的扩增结果
8对SRAP引物扩增统计结果见表3。8对SRAP引物共扩增出235条DNA条带,其中多态性条带223条,多态性百分率94.89%,每对引物可扩增出20~37条多态性条带,平均每对引物扩增的多态性条带数29.4。这些统计结果表明,供试的日本落叶松材料之间存在着丰富的遗传多样性。
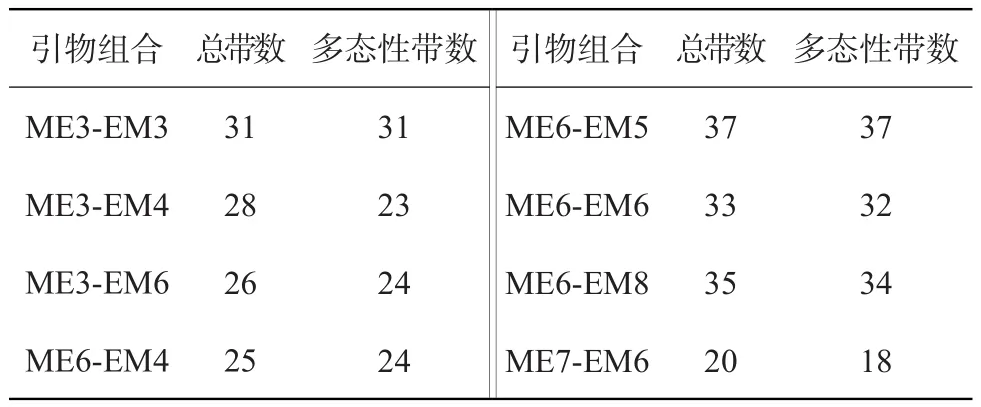
表3 SRAP引物组合扩增带数及多态性带数
2.2 基于SRAP标记的遗传相似系数分析
利用NTSYS-pc version2.1软件对扩增结果进行相似系数计算,得到SRAP标记扩增结果的相似性系数矩阵。SRAP扩增结果的遗传相似性在0.791 1~0.917 2,其中编号为31和80的遗传相似系数最低为0.791 1(图4),表明二者亲缘关系最远;编号为78和79的遗传相似系数最高为0.917 2(图5),表明二者亲缘关系最近。从整个相似性系数来看,变幅为0.126 1,表明所选材料之间的差异不是很明显。相似性系数越大,遗传距离越小,说明两者之间的亲缘关系越亲近;反之亦然。从结果看所选材料差异较明显,具有较丰富的遗传多样性,这也是日本落叶松种质资源多样性的分子基础。
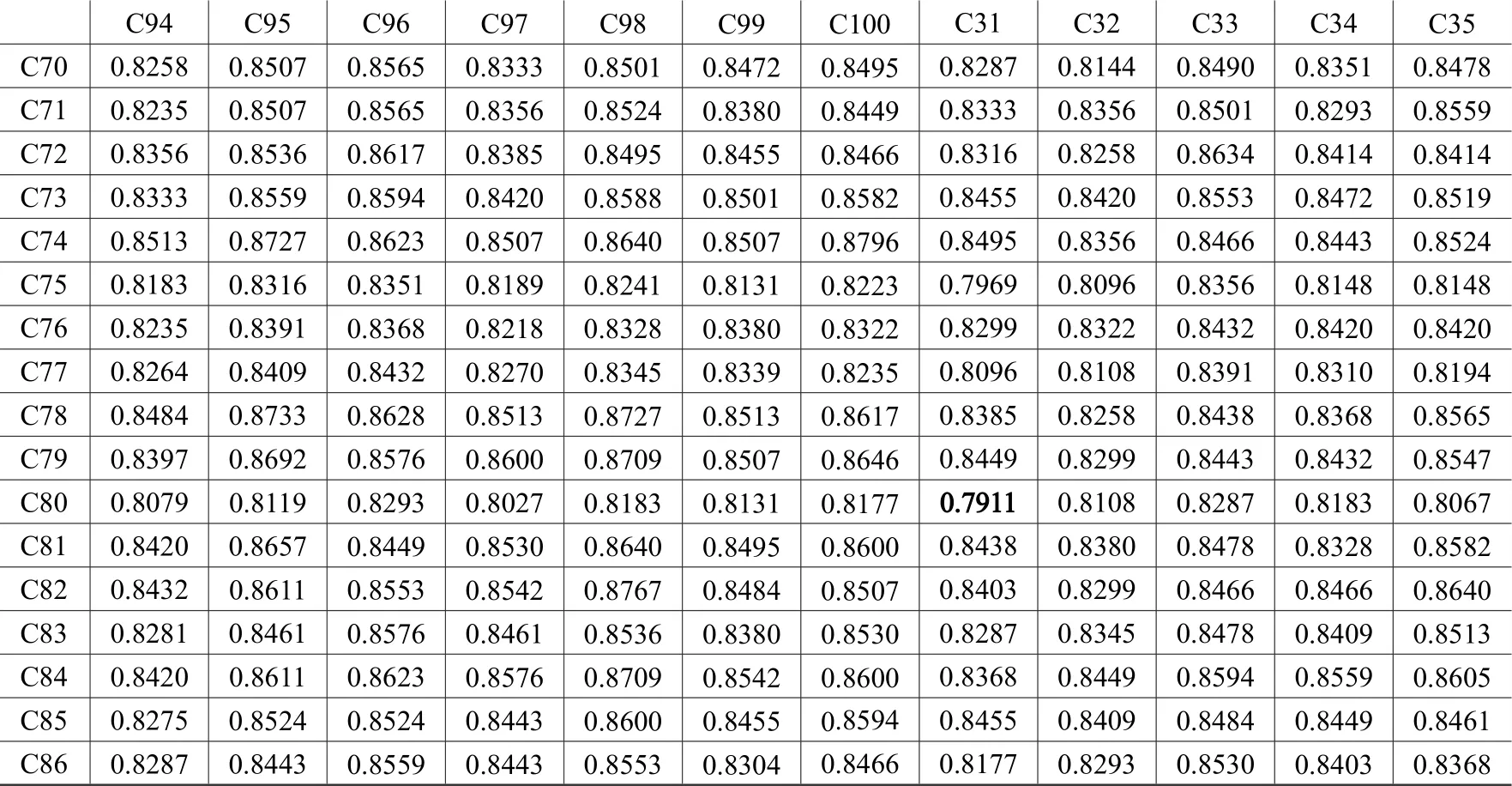
图4 SRAP标记中包含编号31和80的部分供试材料之间的相似性系数

图5 SRAP标记中包含编号78和79的部分供试材料之间的相似性系数
2.3 基于SRAP标记的聚类分析
基于日本落叶松SRAP遗传相似性系数,利用UPGMA法进行聚类,获得聚类树状图(图6)。当相似系数为0.824时,可将80个日本落叶松种质材料划分为4个类群。类群Ⅰ包括46个样本材料,该类群在相似系数为0.844时又可以划分为4个亚类群,其中亚类群Ⅰ-1包括19个样本材料;亚类群Ⅰ-2只有编号为25这1个样本材料;亚类群Ⅰ-3包括24个样本材料;亚类群Ⅰ-4只有编号为63和66这2个样本材料。类群Ⅱ包括30个样本材料,类群Ⅲ和类群Ⅳ分别只有2个样本材料。从划分的类群可以看出,所选的80份日本落叶松样本间的遗传基础较狭窄,亲缘关系比较近。
3 结论与讨论
SRAP(Sequence-Related Amplified Polymorphism,相关序列扩增多态性)[3]是由美国加州大学作物系LI和QUIROS博士[4]在2001年提出来的,这项标记技术是一种无需任何序列信息即可直接PCR扩增的新型分子标记技术[5]。因其具有操作简便、多态性强、中等产量、易于分离条带及测序等优点,目前被广泛应用于遗传多样性分析[6-10]、性状的标记[11]、基因定位及QTL分析、基因克隆、遗传图谱构建[12]等领域。顾晓燕[13]等利用SRAP分子标记技术对来自亚洲的84份老芒麦种质的遗传多样性和遗传关系进行了分析,结果显示23个引物组合共产生337条扩增条带,其中多态性条带为203条,多态性比率为60.24%,在GS=0.84时,将供试种质划分成2个明显不同的组群。陈大霞[14]等利用SRAP分子标记的方法对12个不同来源地的大黄进行遗传关系的分析,24对引物组合共扩增出272条条带,其中有199条为多态性条带,占73.2%,遗传相似系数变化范围为0.578 4~0.941 6。李杰勤[15]等利用SRAP分子标记技术对20个黑麦草品系的遗传多样性进行分析,结果发现53个引物组合共扩增出705条条带,其中多态性条带共597条,多态性比率为78.95%,以阈值为0.63时可将这20个品系分为4类。目前许多学者的研究证明SRAP是一项能够揭示种质间遗传多样性的有效的分子标记技术。
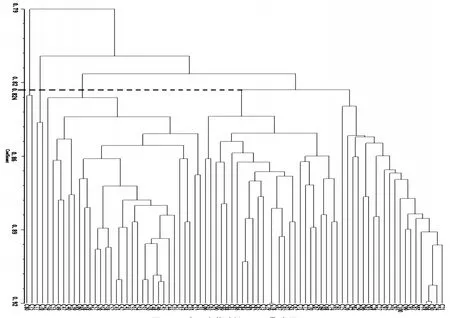
图6 80个日本落叶松SRAP聚类图
利用SRAP分子标记技术分析日本落叶松2代优树遗传多样性,结果表明筛选出的8对引物共扩增出235条DNA条带,其中多态性条带223条,多态性百分率为94.89%,每对引物可扩增出20~37条多态性条带,平均每对引物扩增的多态性条带数为29.4条。利用UPGMA法进行聚类,当相似系数为0.824时将80个日本落叶松种质材料划分为4个类群。聚类基本符合与子一代的亲缘关系,类群间遗传基础较狭窄,亲缘关系较近,为日后建立日本落叶松2代种子园的工作提供了理论依据。
[1]朴楚炳,张万雄,刘君.兴安落叶松天然优良林分改造为母树林的研究初报[J].林业科技,1991,16(3):17-23.
[2]张源润,周全良,梅曙光,等.华北落叶松无性系种子园子代测定研究[J].宁夏农学院学报,2004,25(4):8-11.
[3]RUIZ JJ,GARCIA-MARTINEZ S,PICO B,et al.Genetic variability and relationship of closely related Spanish traditional cultivars of tomato as detected by SRAP and SSR markers[J].J Am Soc Horticult Sci,2005,130(1):88-94.
[4]LI G,QUIROS C F.Sequence-related amplified polymerphism(SRAP),A new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001,103:455-461.
[5]NEVENA N,JOHN W,ROBERT L.Detection of DNA polymorphism in sugar beet bulks by SRAP and RAPD markers[J].Journal of Biotechnology,2007,131:32-35.
[6]姜树坤,马慧,刘君,等.利用SRAP标记分析玉米遗传多样性[J].分子植物育种,2007,5(3):412-416.
[7]文雁成,王汉中,沈金雄,等.用SRAP标记分析中国甘蓝型油菜品种的遗传多样性和遗传基础[J].中国农业科学,2006,39(2):246-256.
[8]RIAZ A,Li G,QURESH Z,et al.Genetic diversity of oilseedBrassica napusinbred lines based on sequencerelated amplified polymorphism and its relation to hybrid performance[J].Plant Breeding,2001,120:411-415.
[9]FERRIO M,PICO B,NUEZ F.Genetic diversity of a germplasm collection ofCucurbita pepousing SRAP and AFLP markers[J].Theoretical and App lied Genetics, 2003,107:271-282.
[10]BUDAK H,SHEARMAN R C,PARMAKSIZ I,et al. Molecular characterization of buffalo grass germplasm using sequence-related amplified polymorphism markers[J].Theoretical and App lied Genetics,2004,108:328-334.
[11]海燕,何宁,康明辉,等.新型分子标记SRAP及其应用[J].河南农业科学,2006,(9):9-11.
[12]LI X G,LIU N,HUANG B H,et al.Phylogenetic analysis and genetic mapping of Chinese Hedychium using SRAP markers[J].Scientia Horticulturae,2008, 117:369-377.
[13]顾晓燕,郭志慧,张新全,等.老芒麦种质资源遗传多样性的SRAP分析[J].草业学报,2014,23(1):205-216.
[14]陈大霞,李隆云,钟国跃,等.用SRAP标记分析正品大黄的遗传关系[J].中国中药杂志,2008,33(20):2309-2312.
[15]李杰勤,王丽华,詹秋文,等.20个黑麦草品系的SRAP遗传多样性分析[J].草业学报,2013,22(2):158-164.
(责任编辑:张素清)
Analysis of genetic diversity of second-generation tree of Larix kaempferi by SRAP
WANG Chengcheng
(Liaoning Academy of Forestry Science,Shenyang 10032,China)
In this study,we used SRAP molecular marker technology to analyze genetic diversity among 80 populations of second-generation tree of Larix kaempferi.The result showed that 8 SRAP primers amplified 235 DNA bands,223 polymorphism bands among these,the polymorphic percentage was 94.89%.Each pair of primers can amplify the article 20 to 37 polymorphism bands,the average number of polymorphic bands was 29.4.Using UPGMA method for clustering,when the similarity coefficient of 0.824,80 materials of Larix kaempferi were divided into four groups.Clustering in line w ith and son generation of genetic relationship,between groups they had a narrow genetic basis and a close genetic relationship,it provided a theoretical basis to set up the second generation seed orchard of Larix kaempferi in the future work.
Larix kaempferi;Second-generation tree;genetic diversity;SRAP
S791.223
A
1001-1714(2017)02-0019-07
2016-11-25
国家“十二五”科技支撑项目(2012BAD01B01)。
汪成成(1985-),女,工程师,现从事森林培育研究。E-mail:yuanlinwcc@163.com。

