骨碎补含药血清经wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的影响
陈云刚, 谭国庆,任维龙,徐展望
(山东中医药大学 1.第一临床医学院, 2.附属医院脊柱骨科,山东 济南 250014)
骨碎补含药血清经wnt/β-catenin信号通路对大鼠骨髓间充质干细胞成骨分化的影响
陈云刚1, 谭国庆2,任维龙1,徐展望1
(山东中医药大学 1.第一临床医学院, 2.附属医院脊柱骨科,山东 济南 250014)
目的 研究骨碎补含药血清经wnt/β-catenin信号通路对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成骨分化的作用,探讨其可能的作用机制。方法 用不同浓度含药血清干预BMSCs,CCK-8法分别检测血清干预BMSCs 3、5、7、9 d BMSCs的增殖能力,连续诱导7、10、14 d并进行ALP活性检测,诱导21 d后茜素红染色评价BMSCs的矿化能力,RT-PCR法检测β-catenin、LRP5、GSK-3β、RUNX-2及Osteriex mRNA表达;ELISA法检测细胞内β-catenin、LRP5蛋白表达量。结果 骨碎补含药血清具有明显的促进BMSCs增殖的作用,在一定的时间段提高了ALP活性,促进钙化结节形成;上调wnt/β-catenin信号通路β-catenin、LRP5、RUNX-2及Osteriex mRNA表达;下调GSK-3β mRNA表达,上调β-catenin、LRP5蛋白表达。结论 骨碎补含药血清可以促进BMSCs的增殖及成骨分化,其机制与激活wnt/β-catenin信号通路,上调β-catenin、LRP5、RUNX-2及Osteriex mRNA表达,下调GSK-3β mRNA表达及上调β-catenin、LRP5蛋白表达密切相关。
骨碎补;含药血清;骨髓间充质干细胞;wnt/β-catenin;增殖;碱性磷酸酶;成骨分化
骨质疏松症(osteoporosis,OP)是绝经后妇女和老年人的常见病,以骨量丢失为主要特征,易发生脆性骨折,具有较高的致残率和致死率,给社会增加了沉重的负担,是仅次于心血管疾病的第二大疾病。据国际骨质疏松基金会统计,34%的绝经期妇女、20%的老年男性会发生骨质疏松症[1]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有多向分化能力,可以定向分化为成骨细胞。随着研究的深入,BMSCs在OP发病过程中发挥的作用日益引起关注,其成骨分化能力的强弱可能是OP的发病机制之一。研究证实,经典的wnt/β-catenin信号通路在调控BMSCs向成骨细胞分化的过程中起到关键性作用。研究发现[2-3],补肾类中药对OP具有良好的治疗效果,并促进BMSCs向成骨细胞分化。骨碎补(Rhizoma drynariae)作为补肾壮骨代表药物,其活性成分骨碎补黄酮已被证实可以促进体外BMSCs增殖,并促进其向成骨方向分化[4]。目前,关于骨碎补治疗OP的实验研究多集中在其促进BMSCs增殖、促进成骨分化及成骨相关基因的表达上,探讨骨碎补经wnt/β-catenin信号通路促进成骨分化的研究极少。本实验以BMSCs为靶细胞,通过体外培养的方式探讨骨碎补含药血清促进BMSCs成骨分化可能作用机制。
1 材料
1.1 动物 SPF级SD大鼠40只,♀♂各半,3月龄,由济南朋悦实验动物繁育有限公司提供,动物质量合格证号:SCXK(鲁)20140007,实验过程中对动物的处置符合动物伦理学标准。
1.2 试剂及试剂 骨碎补购于山东中医药大学附属医院药房,L-DMEM培养基(批号F04ED090,MACGENE)、南美胎牛血清(批号NZJ1221,HyClone)、β-甘油磷酸钠(批号S20S7G21494,上海源叶生物科技有限公司)、碱性磷酸酶染液(批号20160818,南京建成生物有限公司)、碱性磷酸酶检测试剂盒(批号20160813,南京建成生物有限公司),TRIpure Reagent(批号231527AX, 北京艾德莱生物科技有限公司),Transcriptor Frist Strand cDNA Synthesis Kit(批号13713422,Roche),Rat β-catenin ELISA Kit(批号GR201612-1,武汉基因美生物科技有限公司),Rat LRP5 ELISA Kit(批号GR201612-1,武汉基因美生物科技有限公司),引物委托生工生物工程(上海)股份有限公司设计合成,β-actin引物序列:上游5′-CACCCGCGAGTACAACCTTC-3′,下游5′-CCCATACCCACCATCACACC-3′;β-catenin序列:上游5′-TGGTGGGCTGCAGAAAATGGTT-3′,下游5′-ACGATGGCCGGCTTGTTGC-3′; LRP5序列:上游5′-CCTGGCGCTGTGACGGCTTCC-3′, 下游5′-CAATGGCGCTGCTGTGGGCTGGTA-3′; GSK-3β序列:上游5′-TGGGTCATTTGGTGTGGTAT-3′,下游5′-GACCTCATCTTTCTTCTCGC-3′。RUNX-2序列:上游5′-GAACCCACGGCCCTCCCTGAACTC-3′,下游5′-AGCGGCGTGGTGGAATGGATGGAT-3′,Osterix序列:上游5′-CTGGGGGCAATTGGTTAGGTGGTG-3′,下游5′-GGGGGCAAAGTCAGACGGGTAAGT-3′。
1.3 器材 CO2培养箱(HF160W,上海力康发展有限公司),台式高速冷冻离心机(Neofuge23R,上海力康发展有限公司),研究用万能级显微镜(OLYMPUS/IX71,日本奥林巴斯公司),实时荧光定量PCR仪(LightCycler480II,瑞士),酶联免疫仪(美国Biotek Elx800,美国伯腾仪器有限公司),流式细胞仪(BD FACSVERSE,美国),数显恒温水浴锅HH-2(江苏金坛荣华仪器公司),微量紫外可见光分光光度计(凯奥/K5600,北京凯奥科技发展有限公司),超净工作台(SW-CJ-2FD,上海博讯实业有限公司)。
2 方法
2.1 骨碎补含药血清制备 根据成人每日所需药量换算成大鼠总的用药剂量,将骨碎补用水煎法进行药液浓缩,所得药液4℃冰箱储藏备用,用药前恢复到常温。SPF健康SD大鼠32只,3月龄,体质量(200±30)g,随机均分为低剂量、中剂量、高剂量、空白组4组,每组8只,每日8 ∶00am和2 ∶00pm灌胃,低剂量组每日灌服正常人给药量1倍剂量(0.81 g·kg-1)骨碎补水煎液,中剂量组每日灌服正常人给药量5倍剂量(4.05 g·kg-1)骨碎补水煎液,高剂量组每日灌服正常人给药量10倍剂量(8.1 g·kg-1)骨碎补水煎液,空白组每日灌服等体积生理盐水,连续3 d。末次灌胃全天剂量,1.5 h后腹主动脉取血,静置2 h后,离心(2 500 r·min-1,4 ℃,15 min)后去上层血清,56℃水浴灭活补体,0.22 μm微孔滤膜过滤,-20℃保存。
2.2 分组和给药 将细胞分为空白1组、空白2组、空白3组、低剂量组、中剂量组、高剂量组。空白1组(Control group 1)给予L-DMEM、100 kU·L-1链霉素和100 kU·L-1青霉素、10%胎牛血清培养基;空白2组(Control group 2)给予L-DMEM、100 kU·L-1链霉素和100 kU·L-1青霉素、10%空白大鼠血清培养基;空白3组(Control group 3)给予L-DMEM、10%空白大鼠血清及成骨分化诱导液(100 U·mL-1链霉素和100 U·mL-1青霉素的DMEM培养基、1 mmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸钠、50 mg·L-1抗坏血酸);低剂量组(low dose group,LDG)给予L-DMEM,10%低剂量含药血清、成骨分化诱导液;中剂量组(middle dose group,MDG)给予L-DMEM、10%中剂量含药血清、成骨分化诱导液;高剂量组(high dose group,HDG)给予L-DMEM、10%高剂量含药血清、成骨分化诱导液。
2.3 骨髓间充质干细胞的分离和扩增 采取全脊髓贴壁法,按以下方法分离培养SD大鼠BMSCs:大鼠麻醉后,置于75%酒精溶液浸泡15 min,超净台内快速去除周围组织,取出股骨,75%酒精溶液浸泡30 s,咬骨钳咬除两干骺端,5 ml注射器吸取含10%胎牛血清和100 kU·L-1青、链霉素的L-DMEM培养基反复冲洗髓腔,直至骨质外观微亮。收集髓腔冲洗液,转移至25 cm2培养瓶中,37℃,5% CO2培养箱中继续培养,24 h后首次换液,以后每2 d换液1次。待细胞融合80%以上后,用0.25%胰蛋白酶消化,按1 ∶3传代,继续培养。选择生长良好的第3代细胞,用流式细胞仪进行细胞表面抗原检测,以确定其具有BMSCs的免疫表型。
2.4 骨髓间充质干细胞的鉴定 根据查阅文献[5],BMSCs的表面抗原标记对CD29、CD44、CD105等反应阳性,CD34、CD45等反应阴性。检测步骤如下:首先用 0.25%胰蛋白酶消化细胞,制备单细胞悬液,1 500 rpm离心3 min,PBS重悬,细胞浓度2×108·L-1,PBS冲洗2次取细胞悬液400 μL,分别加入FITC、APC、PE标记的抗体避光孵育40 min,PBS冲洗1次,流式细胞仪检测。
2.5 CCK-8检测 选用各组生长状态良好的第3代细胞,胰蛋白酶消化后制成单细胞悬液,以1×107·L-1接种于96孔培养板上,每孔加入100 μL细胞悬液(含细胞数目约1 000个),每组设6个复孔,分别加入各组对应培养基,标记后置37 ℃ 5% CO2培养箱中培养,分别在d 3、5、7、9取板检测。每孔加入10 μL CCK-8试剂,37 ℃继续孵育4 h终止培养,选择490 nm波长,在酶标仪上测各孔吸光度(A),结果以A490吸光度值表示细胞增殖水平。
2.6 ALP活性检测及矿化结节数计算 另取各组第3代BMSCs,以1×107·L-1接种于24孔板,共72孔。每组18孔,加入相应的培养液连续培养7、10、14 d,每组每次取6孔,按照AKP检测试剂盒说明书进行ALP活性检测,562 nm处测定吸光度并换算为金氏单位。将第3代BMSCs接种到6孔板,每组设3个复孔。各组细胞培养至d 21时,弃去培养液,PBS清洗后,95%乙醇固定30 min, 0.2%茜素红染色30 min,清水冲洗。置40倍镜下观察并拍照,随机选取不重复的12个视野,计数各组细胞的矿化结节数,评价BMSCs的矿化能力。
2.7 wnt/β-catenin信号通路相关mRNA及成骨相关mRNA检测 BMSCs按1×107·L-1接种到6孔板内培养,待细胞80%以上铺满瓶底时,各组分别加入各组对应培养液继续培养,每2 d换液1次,培养7 d后,用Trizol提取各组细胞的总RNA,紫外分光光度计检测RNA纯度A260/A280在1.8~2.2。cDNA单链合成条件:① 30 ℃,10 min;② 42 ℃,60 min;③ 95 ℃,5 min;④ 5 ℃,5 min,共一个循环。qPCR反应条件:① 95 ℃,5 min;② 95 ℃,20 s;③ 62 ℃,15 s;④ 72 ℃,15 s;⑤ 72 ℃,5 min。②~④为45个循环。检测各实验组细胞中基因的表达情况,反应结束后,由电脑自动生成荧光扩增曲线、标准曲线以及熔解曲线,根据靶基因的标准曲线计算各组基因拷贝数,记录CT值,通过ΔΔCT=(CT目的基因-CT内参基因)处理组-(CT目的基因-CT内参基因)空白组,计算各组2-ΔΔCT值,即得该目的基因给药组mRNA表达与空白组mRNA的倍数。
2.8 BMSCs总蛋白提取及酶联免疫法(ELISA)检测Wnt/β-catenin信号通路相关蛋白β-catenin、LRP5的表达 取各组连续培养7 d BMSCs细胞,每组取6孔提取细胞总蛋白,按如下方法:胰蛋白酶消化细胞后,4 ℃,1 500 r·min-1离心5 min,PBS洗3次,估计细胞总体积,加入RIPA裂解缓冲液,冰上裂解30 min。离心10 min(12 000 r·min-1,4 ℃),取上清,-80 ℃保存。取各组细胞总蛋白产物分别按照β-catenin、LRP5酶联免疫试剂盒操作说明书进行检测各组蛋白表达水平。

3 结果
3.1 BMSCs形态及流式细胞术表型鉴定结果 刚接种时BMSCs与其他细胞混杂,呈圆形。培养24 h后开始贴壁生长,呈短纺锤状,数量较少。3 d后贴壁细胞体积逐渐增大,数量增多,细胞逐渐伸展,呈梭形、多角形,开始成簇生长。7~9 d集落数量逐渐增多,并相互融合。9~11 d一般能达到80%以上细胞融合状态。传代后细胞呈圆形,接种12 h内贴壁,逐渐伸展呈纺锤形,形态均一,增殖速度较快,5 d可铺满瓶底80%以上,呈漩涡状(Fig 1)。流式细胞仪检测第3代细胞表面标志物结果显示,其表面 CD29、CD44、CD45 阳性细胞比率分别为94.17%、95.50%、0.37%,结合BMSCs的形态观察可以认定本实验培养细胞为骨髓间充质干细胞。

Fig 1 Photomicrograph of BMSCs cultured for different time points
3.2 CCK-8检测结果 与空白3组对比,其他各组在各时间点吸光度值更高,差异有统计学意义(P<0.05)。其中,中、高剂量组在各时间点吸光度值较低剂量组明显升高,差异有统计学意义(P<0.05);在7、9 d时,中剂量组和高剂量组对比,无明显差异,P>0.05。低、中、高剂量组在3~5 d时促进BMSCs增殖作用更明显,7~9 d进入平台期。见Fig 2。
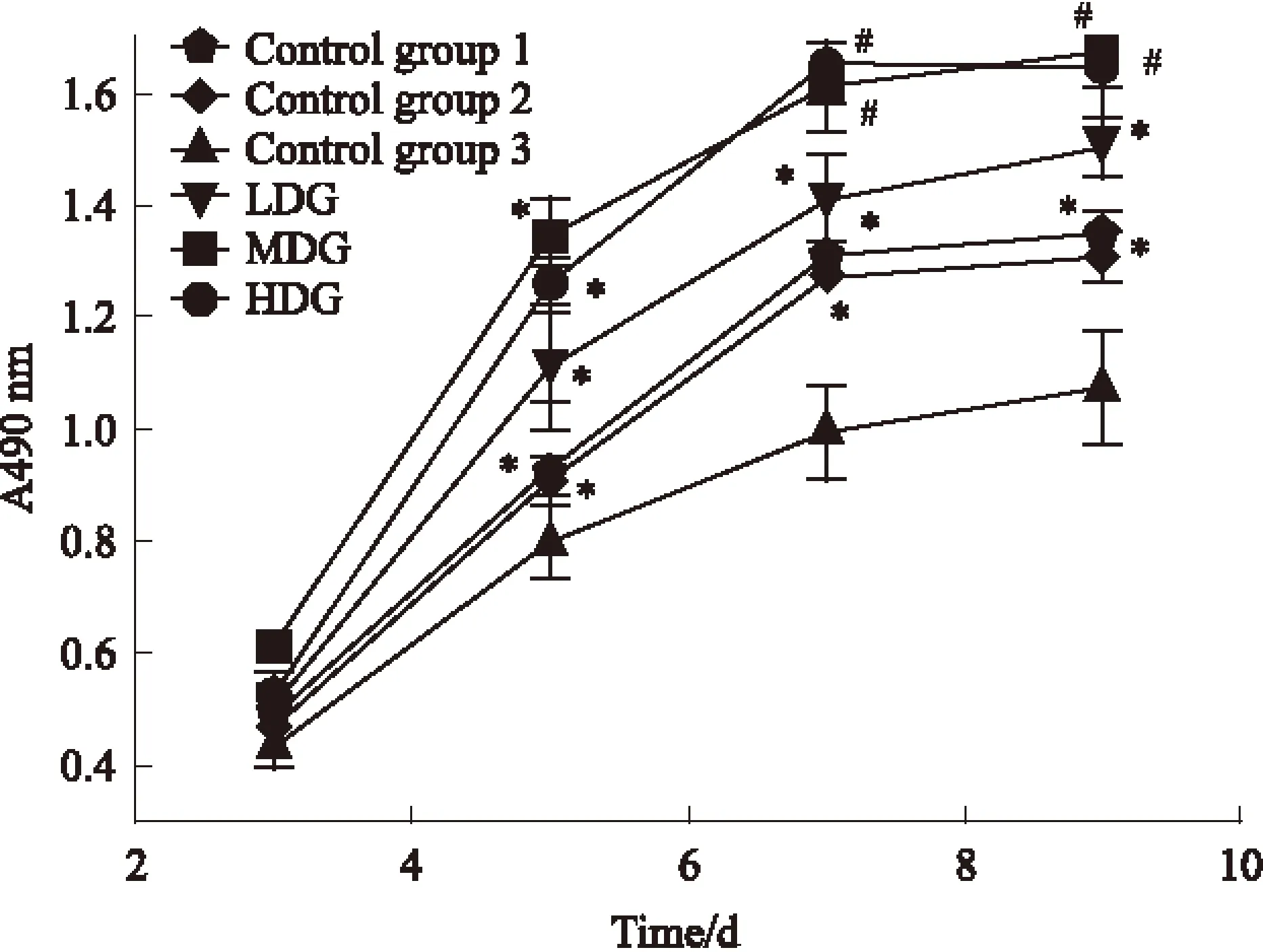
Fig 2 Effect of drug-containing serum on proliferation of BMSC
*P<0.05vscontrol group 3;#P<0.05vsControl group 1,2,3,LDG
3.3 ALP染色和活性检测结果 各组在不同培养液培养后发现,空白3组、低剂量组、高剂量组在7~14 d随时间延长ALP活性逐渐增强,并维持在一个较高的水平;中剂量组在培养10 d后ALP活性即达到较高的水平,并随时间延长ALP活性呈现降低趋势。与空白1组、空白2组、空白3组对比,低、中、高剂量组在各时间点ALP活性更高,差异有统计学意义(P<0.05)。其中,中剂量组在各时间点ALP活性明显较其他组更高,以培养10 d ALP活性增强最为明显(P<0.05)。见Tab 1。
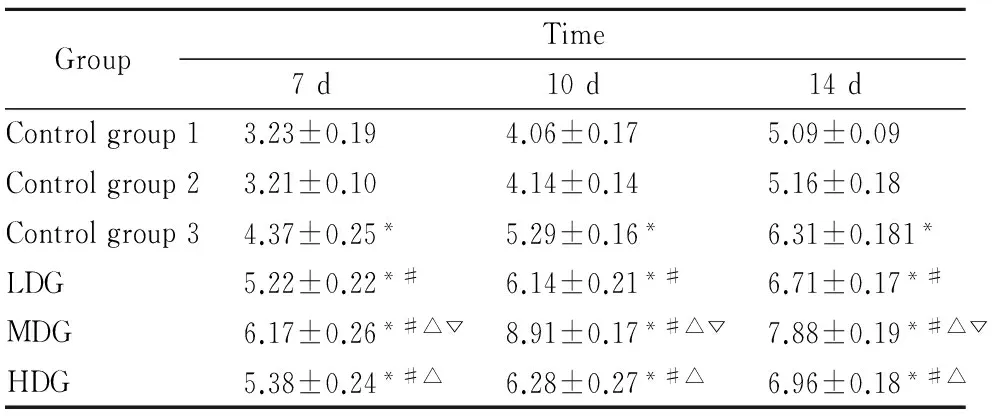
GroupTime7d10d14dControlgroup13.23±0.194.06±0.175.09±0.09Controlgroup23.21±0.104.14±0.145.16±0.18Controlgroup34.37±0.25*5.29±0.16*6.31±0.181*LDG5.22±0.22*#6.14±0.21*#6.71±0.17*#MDG6.17±0.26*#△▽8.91±0.17*#△▽7.88±0.19*#△▽HDG5.38±0.24*#△6.28±0.27*#△6.96±0.18*#△
*P<0.05vsControl group 1,2;#P<0.05vsControl group 3;△P<0.05vsLDG;▽P<0.05vsHDG
3.4 各组BMSCs矿化结节数比较 干预21 d后,各组均有矿化结节形成。茜素红染色后发现各组均呈现大小不均的红色致密结节(Fig 3),与空白1组、空白2组、空白3组比较,低、中、高剂量组矿化结节数均明显增加(P<0.05),中浓度组矿化结节数最多,与低、高剂量组比较,差异有统计学意义(P<0.05)。见Tab 2。

Fig 3 A:Control group 1;B:Control group 2;C:Control group 3;D:LDG,E:MDG;F:HDG
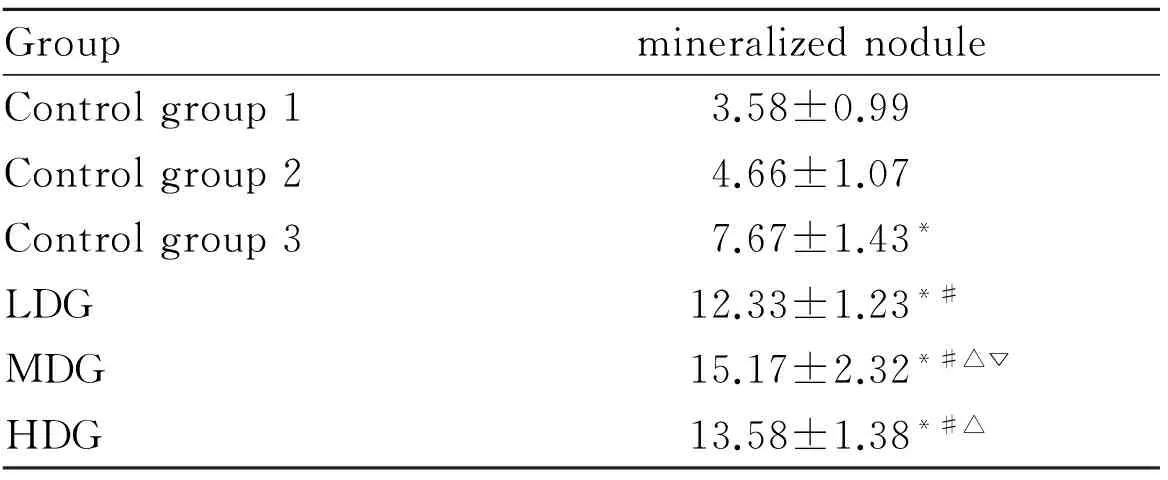
Tab 2 Comparisons of mineralized nodule in different groups(n=12)
*P<0.05vscontrol group 1,2;#P<0.05vscontrol group3;△P<0.05vsLDG;▽P<0.05vsHDG
3.5 BMSCs培养7 d β-catenin、LRP5、GSK-3β、RUNX2及Osterix mRNA表达水平比较 如Fig 4所示,含药血清干预7 d后低、中、高剂量组的β-catenin、RUNX2、LRP5及Osterix mRNA表达较空白1组、空白2组明显增加,GSK-3β明显降低,差异有统计学意义(P<0.05);中剂量组β-catenin、RUNX2及Osterix mRNA的表达水平明显高于空白3组低剂量组和高剂量组,差异有统计学意义(P<0.05)。
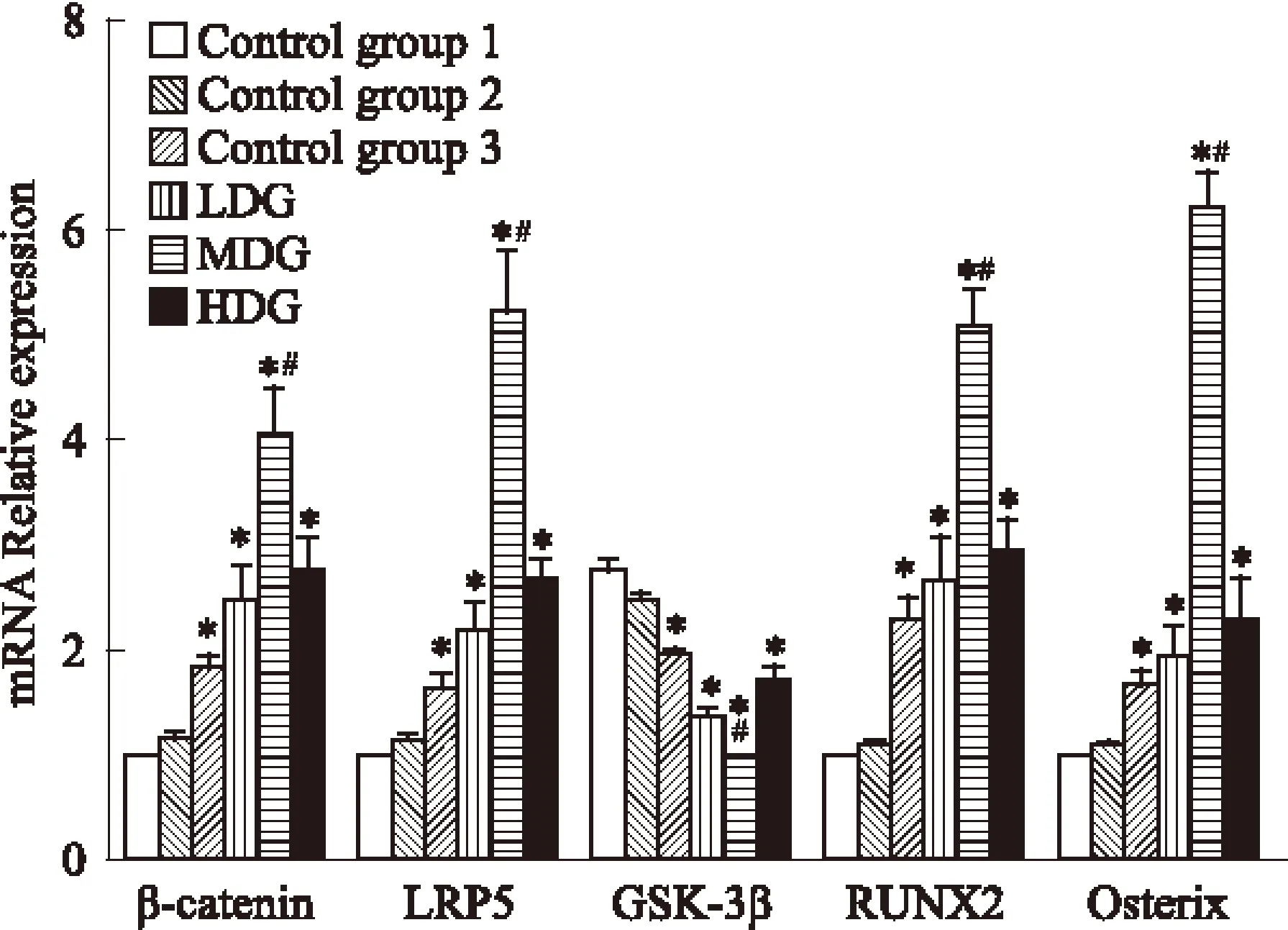
Fig 4 Effect of expression of LRP5, beta-catenin, GSK-3 beta, RUNX2 and Osterix mRNA containing serum on ±s,n=3)
*P<0.05vscontrol group 1,2;#P<0.05vscontrol group 3, LDG,HDG
3.6 BMSCs培养7 d各组Wnt/β-catenin信号通路相关蛋白的表达水平比较 如Fig 5所示,含药血清干预7d后低、中、高剂量组,空白3组与空白1组,空白2组相比β-catenin、LRP5蛋白表达组明显增加(P<0.05);中剂量组较低、高剂量组,空白3组更能促进β-catenin、LRP5蛋白表达(P<0.05)。
4 讨论
中医学认为骨的生长、发育、成熟、衰退与肾精的盛衰密切相关。黄帝内经曰:“肾者,主骨生髓”。历代医家将骨质疏松症归纳为“骨痿、肾虚、虚劳”等范畴,基本病机为肾精虚衰,不能荣髓,髓不生骨,故多从补肾壮骨论治,以补肾作为治疗之本。骨碎补作为补肾壮骨类中药在临床应用中已取得不错的疗效[6],骨碎补提取物在体外实验中已被证实对BMSCs增殖具有明显的促进作用,并可以促进BMSCs的成骨分化[4]。因此,应用骨碎补研究其对BMSCs的成骨分化具有明确的理论和实践基础。
BMSCs具有多向分化能力,在一定的诱导条件下可以定向分化为成骨细胞、成软骨细胞、脂肪细胞等[7],组织工程学中常选用β-甘油磷酸钠、地塞米松、抗坏血酸作为成骨诱导剂诱导BMSCs体外定向成骨分化[8]。实验发现一定浓度骨碎补提取物柚皮苷可以促进BMSCs的增殖,但提取物最佳干预浓度不一[9-11],分析可能与实验所用细胞、种类及药材的差异导致。目前关于骨碎补对BMSCs的体外增殖的作用大都应用其提取物单体直接作用于细胞,含药血清对BMSCs的体外增殖的研究较少。刘伟等[12]发现高浓度的骨碎补提取物作用细胞会对细胞产生毒性作用或者抑制作用。本实验发现中剂量骨碎补含药血清可以在3、5、7、9 d明显促进BMSCs的增殖,与低剂量组和各空白组比较有明显差异,而在7 d、9 d中剂量组与高剂量组比较无明显差异,分析可能是细胞达到一定密度后,由于受培养器材空间的限制,对其继续增殖产生了影响。本实验中未发现骨碎补含药血清对细胞产生毒性作用或抑制作用,在7 d以后即进入平台期。ALP是一种主要分布在细胞膜上的钙结合转运蛋白,是在BMSCs的成骨诱导过程中最早表达的、成骨细胞形成的标志[13]。有文献指出BMSCs在成骨分化过程中7~14 d是ALP分泌高峰期,本实验发现中剂量组ALP活性在诱导10 d后达到高峰,与其他各组有明显差异,且诱导21 d后钙结节形成的数量最多。
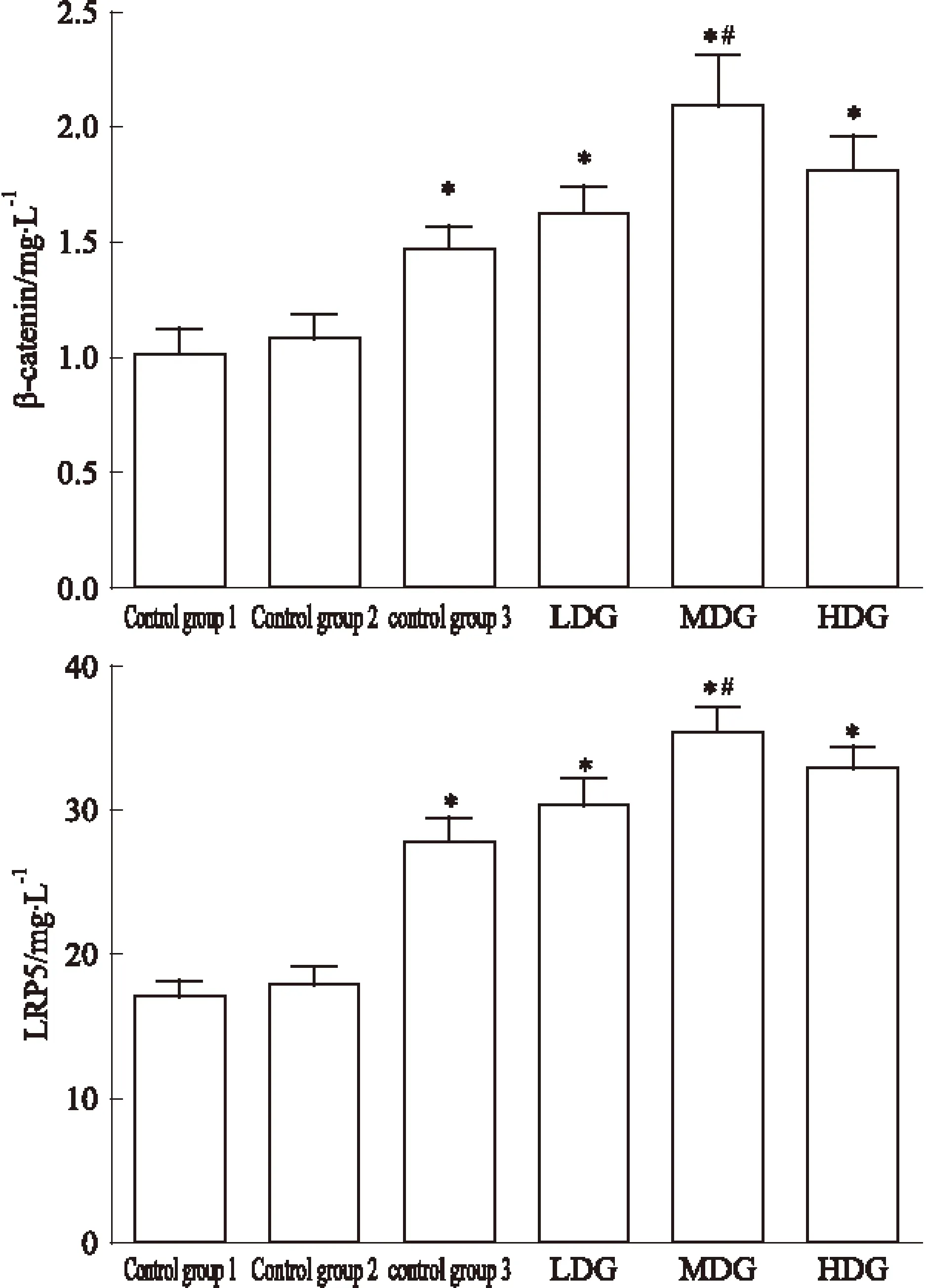
Fig 5 Effect of expression of LRP5 and beta-catenin protein containing serum on ±s,n=3)
*P<0.05vscontrol group1,2;#P<0.05vscontrol group 3, LDG,HDG
目前,骨碎补对治疗骨质疏松症的基础研究主要集中在其促进BMSCs的增殖及成骨分化,其分子生物学机制研究鲜有报道。众所周知,经典的Wnt/β-catenin信号通路是调控BMSCs成骨分化的一条重要通路,β-catenin是该通路的关键因子,在细胞增殖、定向分化过程中发挥重要作用,其在胞质中的浓度决定着经典Wnt信号通路的激活与关闭。该通路的调控机制为:Wnt蛋白与Frizzled受体及LRP5/6结合,通过激活细胞内散落蛋白(DSH)来激活GSK-3β结合蛋白(GBP),而GBP可以抑制GSK3β对β-catenin的磷酸化,进而抑制β-catenin降解,使胞质内的β-catenin得以稳定并不断积累入核,调节靶基因的转录和表达[14]。可见LRP5、GSK-3β及β-catenin是wnt/β-catenin信号通路的重要节点。RUNX2能通过上调骨钙素、I型胶原、骨桥蛋白等基因的转录来实现BMSCs的成骨分化[15],而Osterix是处在RUNX2下游的成骨分化关键调控因子。该通路还可以通过β-catenin增强wnt信号通路的靶基因碱性磷酸(alkaline phosphatase,ALP)的转录来促进成骨分化。本研究显示,BMSCs经成骨诱导7d后骨碎补含药血清明显上调β-catenin、LRP5、RUNX2及Osterix mRNA的表达,下调GSK-3β的表达,胞质中β-catenin、LRP5的蛋白表达水平升高,且中剂量组三者的表达量较其他组有明显差异,提示骨碎补含药血清通过激活Wnt/β-catenin信号通路,并提高该通路调控的RUNX2、Osterix mRNA表达及提高ALP的活性来实现BMSCs的成骨分化。
总之,本实验分别从血清药理学、细胞生物学、分子生物学3个角度对骨碎补含药血清促进BMSCs成骨分化的机制进行探讨,认为骨碎补含药血清促进BMSCs成骨分化与wnt/β-catenin细胞通路的激活密切相关,但其具体作用机制仍需进一步研究。
(致谢:本实验在山东中医药大学附属眼科医院眼科研究所完成,在此对实验室各位老师的指导和帮助表示衷心的感谢!)
[1] Morales-Torres J, Gutiérrez-Urea S.Osteoporosis Committee of Pan-American League of Associations for Rheumatology. The burden of osteoporosis in Latin America[J].OsteoporosInt,2004,15(8):625-32.
[2] 程 敏,王庆伟,刘雪英,等.女贞子治疗去卵巢大鼠骨质疏松的实验研究[J].中国药理学通报,2013,29(2):229-33.
[2] Cheng M,Wang Q W,Liu X Y, et al. Treatment with FLL for osteoporosis in ovariectomized rats[J].ChinPharmacolBull,2013,29(2):229-33.
[3] 明磊国,葛宝丰,陈克明,等.蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响[J].中国药理学通报,2010,26(8):1098-103.
[3] Ming L G,Ge B F,Chen K M, et al. Effects of osthol on bone marrow stromal stem cell differentiation and proliferationinvitro[J].ChinPharmacolBull,2010,26(8):1098-103.
[4] 张 军,李浩鹏,杨平林,等.骨碎补总黄酮含药血清对成骨细胞增殖、分化、周期及凋亡的影响[J],中药材,2009,32(7):1090-3.
[4] Zhang J,Li H P,Yang P L, et al. Effects of total flavonoids from Rhizoma Drynariae medicated serum on proliferation,differentiation,cell cycle and apoptosis of osteoblastsinvitro[J].JChinMedicinalMaterials,2009,32(7):1090-3.
[5] 崔 洁,蒋明德,梅浙川,等.电穿孔法转染增强型绿色荧光蛋白基因对人骨髓间充质干细胞生物学特性的影响[J].中国生物制品学杂志,2011,24(7):797-801.
[5] Cui J,Jiang M D,Mei Z C,et al.Effect of transfection with enhanced green fluorescent protein gene by elec-troporation on biological characters of human bone marrow mesenchymal stem cells[J].ChinJBiologicals,2011,24(7):797-801.
[6] 眭承志,樊孝俊,林景雄,等. 骨碎补总黄酮治疗老年性骨质疏松症(低转换型)生命质量的评价[J].光明中医,2012,27(1):15-20.
[6] Sui C Z,Fan X J,Lin J X,et al.Evaluation of life quality of the total flavonoids of Rhizoma Drynariae in the treatment of senile osteoporosis[J].GuangmingJChinMed,2012,27(1):15-20.
[7] Fu L, Tang T, Miao Y, et al. Stimulation of osteogenic differentiation and inhibition of adipogenic differentiation in bone marrow stromal cells by alendronate via ERK and JNK activation[J].Bone,2008,43(1):40-7.
[8] 李萍华,刘钰瑜,崔 燎.骨髓间充质干细胞成脂和成骨分化过程中Wnt信号通路的调控效应[J].中国组织工程研究与临床康复,2010,14(10):1749-54.
[8] Li P H,Liu Y Y,Cui L. Regulating effects of Wnt signaling pathway on differentiation of bone marrow mesenchymal stem cells into osteoblasts and adipocytes[J].JClinRehabTissEnginRes,2010,14(10):1749-54.
[9] 李念虎,徐展望.柚皮苷促进成骨细胞分化并有效改善卵巢切除所致的骨质疏松[J].中国骨质疏松杂志,2013,19(8):777-82.
[9] Li N H,Xu Z W. Naringin promotes osteoblast differentiation and effectively reverses ovariectomy-induced osteoporosis[J].ChinJOsteoporos,2013,19(8):777-82.
[10]Chang E J, Lee W J, Cho S H, et al. Proliferative effects of flavan-3-ols and propelargonidins from rhizomes of Drynaria fortunei on MCF-7 and osteoblastic cells[J].ArchPharmRes,2003,26(8):620-30.
[11]Li F,Meng F,Xiong Z,et al. Stimulative activity of Drynaria fortunei(Kunze) J.Sm.extracts and two of its flavonoids on the proliferation of osteoblastic like cells[J].Pharmazie, 2006,61(11):962-5.
[12]刘 伟,赵劲民,苏 伟,等.骨碎补总黄酮可促进兔骨髓间充质干细胞的增殖和分化[J].中国组织工程研究与临床康复,2011,15(32):6021-6.
[12]Liu W,Zhao J M,Su W,et al.Effects of assemble flavone of rhizoma drynariae on proliferation and differentiation of rabbit bone marrow mesenchymal stem cells[J].JClinRehabTissEnginRes,2011,15(32):6021-6.
[13]宋 囡,何文智,王智民,等. 左、右归丸对大鼠骨髓间充质干细胞骨向分化中TGF-β1mRNA的影响[J].中国实验方剂学杂志,2013,19(18):210-4.
[13]Song N,He W Z,Wang Z M et al.Effect of Zuogui Wan and Yougui Wan on TGF-β1 on osteogenic differentiation of bone marrow mesenchymal stem cells[J].ChinJExperTraditMedFormul,2013,19(18):210-4.
[14]Mulholl D J,Dedhar S,Coetzee G A,et al.Interaction of nuclear receptors with the Wnt/beta-catenin/Tcf Signaling Axis:Wnt you like to knew[J].EndocrRev,2005,26(7):898-915.
[15]Gersbacha C A, Byers B A, Aavlath G K,et al.Runx2/Cbfal atimulates transdifferentiation of primary skeletal myoblaats into a mineralizing osteoblastic phenotype[J].ExpCellRes,2004,300(2):406-17.
Effect of Rhizoma drynariae drug-containing serum on osteogenic differentiation of bone marrow mesenchymal stem cells by wnt/beta-catenin signaling pathway
CHEN Yun-gang1, Tan Guo-qing2, REN Wei-long1, XU Zhan-wang1
(1.TheFirstclinicalMedicalCollege,ShandongUniversityofTraditionalChineseMedicine,Jinan250014,China;2.SpinalDeptofOrthopedics,theAffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250014,China)
Aim To investigate the drug-containing serum of Rhizoma drynariae on osteogenesis differentiation of bone marrow mesenchymal stem, and discuss the possible mechanism.Methods BMSCs were cultured in media with different concentrations of medicine containing serum.BMSCs proliferation ability was detected in 3,5,7,9 days by CCK-8. ALP activity was detected after 7,10,14 days′ induction. After 3 weeks culturing, alizarin red staining was performed to observe the formation of calcium nodules. The expression of β-catenin,LRP5,RUNX-2 and Osteriex mRNA were detected using RT-PCR. The protein expression of β-catenin,LRP5 was detected using Elisa method.Results Rhizoma drynariae drug-containing serum could obviously promote the proliferation of BMSCs and calci-fied nodule formation.Besides, the ALP activity was improved in a certain period of time. The expression of β-catenin,LRP5,GSK-3β,RUNX-2 and Osteriex mRNA were significantly up-regulated,and the protein expression of β-catenin,LRP5 was up-regulated too. The expression of GSK-3β was down-trgulated. Conclusions Rhizoma drynariae drug-containing serum promotes mineralization and osteogenic differentiationof BMSCs, and the mechanism is closely related with activating WNT/beta-catenin signaling pathway, raising the beta-catenin, LRP5, RUNX-2, and Osteriex mRNA expression, beta-catenin, LRP5 protein expression,and down-regulation of GSK-3β mRNA expression.
Rhizoma drynariae; containing serum;bone marrow mesenchymal stem cells; wnt/β-catenin; proliferation; alkaline phosphatase; osteogenesis differentiation
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.034.html
2017-01-17,
2017-02-08
国家自然科学基金资助项目(No 81473709)
陈云刚(1984-),男,博士生,研究方向:脊柱脊髓损伤,脊柱退行性疾病的基础与临床,E-mail:chen_yungang@163.com; 徐展望(1960-),男,博士,教授,博士生导师,研究方向:脊柱脊髓损伤,脊柱退行性疾病的基础与临床, 通讯作者, E-mail:xzw6001@163.com
10.3969/j.issn.1001-1978.2017.06.017
A
1001-1978(2017)06-0830-07
R-332;R282.71;R329.24;R336;R681;R977.3