有氧和抗阻运动对大鼠白色脂肪棕色化的作用
杨星雅,李鹏飞,房国梁,于 涛,李 良,田 野,冯葆欣
YANG Xing-ya1,LI Peng-fei1,FANG Guo-liang1, YU Tao1,LI Liang1,Tian Ye2,FENG Bao-xin1
有氧和抗阻运动对大鼠白色脂肪棕色化的作用
杨星雅1,李鹏飞1,房国梁1,于 涛1,李 良1,田 野2,冯葆欣1
YANG Xing-ya1,LI Peng-fei1,FANG Guo-liang1, YU Tao1,LI Liang1,Tian Ye2,FENG Bao-xin1
现代社会物质条件的丰富和久坐的生活方式,使越来越多的人患有肥胖及其相关疾病,如2型糖尿病、心血管疾病、高脂血症等。哺乳动物的脂肪组织包括白色脂肪组织(WAT)和棕色脂肪组织(BAT)两大类,WAT主要功能是以甘油三酯的形式储存能量,它还是机体最大的分泌器官,在调节机体胰岛素敏感性和能量代谢平衡中发挥重要的作用;相反,BAT是一种耗能组织,通过细胞内线粒体内膜的UCP1,使线粒体的氧化磷酸化解偶联,导致能量以热能的形式消耗,因其可以氧化分解脂肪,故可能具有抵抗肥胖的作用。传统观点认为,啮齿动物和其他小型哺乳动物含有丰富的棕色脂肪组织,但是大型哺乳动物在婴儿长大之后棕色脂肪含量消失殆尽。但2009年,多项研究表明,成人体内也有着具有活性的棕色脂肪,主要分布在锁骨上方和颈部区域[9,22,25]。
人们很早就注意到,在持续的寒冷或某些药物的刺激下,白色脂肪组织中包含一些表达UCP1的细胞[7,24]。研究表明,经典的肩胛区BAT来源于一种表达myf-5的祖细胞,和肌肉是同一种来源。而在WAT组织中出现的、被诱导出来的BAT样细胞具有与经典BAT类似的生化特性和产热潜能,但却有着不同的前体细胞[18]。2010年发表的一篇研究中,将这种不同于BAT和WAT的新型细胞称为beige细胞[15],也称米色脂肪细胞,这一过程被称为白色脂肪棕色化。
UCP1作为棕色脂肪和米色脂肪发挥产热作用的重要因子,对其进行调控的因子也被认为是调控棕色化的重要因子[2],如PGC-1α[4]、PRDM16[21]等都对UCP1具有正向调控作用。2012年,发表在Nature上的一篇研究发现一种骨骼肌运动相关蛋白irsin,其重要的生物学功能就是能够促进白色脂肪棕色化[4],使运动作为新的一种诱导白色脂肪棕色化的因素进入人们的视野。De Matteis等(2013)通过对大鼠进行有氧训练后发现,白色脂肪出现了多腔室的脂滴,进一步证明了运动可以诱导白色脂肪棕色化的发生。
2014年,Norheim等首次报道了12周的运动干预(每周2 次60 min的有氧训练和2次60 min的力量训练)对糖尿病前期患者和正常成年人腹部皮下白色脂肪组织基因表达的影响,合并数据后发现,UCP1基因表达量显著上升;然而,Ronn等(2014)的研究表明,6个月的运动训练(每周3次60 min的有氧运动)并没有引起大腿皮下白色脂肪组织出现棕色化的现象,相关标志物(PRDM16等)无明显变化。出现截然相反的结果的原因是多方面的,但不可忽视的是,前者在运动方案中加入了抗阻运动,而后者仅是有氧运动。由于目前关于白色脂肪棕色化的动物实验研究所涉及的基本都是有氧运动,对于其他运动方式,如抗阻训练,能否使WAT产生棕色化作用的研究还比较少,所以,本研究通过动物实验的方法,建立抗阻和有氧两种运动模型,对这两种运动对皮下和内脏的白色脂肪棕色化的作用进行研究。
1 材料和方法
1.1 动物类型
6周龄雄性SD大鼠(购自北京维通利华实验动物技术有限公司),适应性饲养1周后进行训练,自由饮水进食,光照比为12 h:12 h。随机分为3组,分别是安静对照组(C)、有氧训练组(T)和抗阻训练组(L)。
1.2 训练方案
1.2.1 抗阻训练方案(爬梯法)[12]
爬梯1.1×0.18 m,80°倾斜放置,顶部有一个小笼子供大鼠休息,负重装置固定于大鼠尾部。适应性训练:先将大鼠进行3天的适应性爬梯训练,训练包含4~8次的递增负荷爬梯训练。初始负荷为大鼠体重的50%,然后每次递增负荷30 g,直到大鼠完成8次爬梯训练或已无法完成整个爬梯高度。在刺激尾部的情况下连续3次仍不能完成爬梯训练则判定为失败。大鼠能够成功完成爬梯训练的最大负荷认为是该轮训练大鼠的最大负荷。接下来的一轮训练先进行4次爬梯训练,负荷分别为前次最大负荷的50%、75%、90%和100%。如果大鼠能够完成这4次训练,在随后的爬梯训练中,每次递增负荷30 g,直到大鼠完成8次爬梯训练或已无法完成整个爬梯高度,以确定新的最大负荷。抗阻训练每3天进行1次,共进行8周。
1.2.2 有氧训练方案(跑台法)[3,14]
适应性训练: 大鼠先进行1周的适应性训练,速度为10 m/min,每天训练10 min,连续适应训练5天。正式训练:第1周速度为15 m/min,训练20 min;然后在8周时间里,训练速度增至28 m/min,训练时间增至60 min;整个训练过程跑台坡度均为0°;每周1~周5训练,周末休息2天。
1.2.3 样品制备
各组动物在最后一次训练结束后,48 h后用10%的水合氯醛溶液腹腔麻醉,皮下脂肪取双侧腹股沟脂肪,内脏脂肪取双侧附睾脂肪,各自称重并记录后,做好标记,取出一部分放入多聚甲醛中固定,其他组织立即放入液氮中迅速冷冻,然后放-80℃保存。
1.3 实验分析
1.3.1 形态学研究
取用多聚甲醛固定的组织,石蜡包埋切片,经HE染色,光镜下观察其形态,用imageJ软件对脂滴面积进行计算,在一个视野内取10个完整脂滴计算其平均面积。
1.3.2 荧光定量PCR实验
取适量的组织,放入预冷的玻璃匀浆器中,按照动物组织总RNA提取试剂盒(天根)说明提取总RNA,用反转录试剂盒(Takara)将RNA反转录成cDNA,利用从NCBI数据库中查找的相关基因的序列设计特异性引物(表1),进行SYBR GREEN法荧光定量PCR实验(Takara)。根据各反应孔的Ct值,用相对定量法算出各目的基因的相对表达量。

表1 实时荧光定量PCR所用引物列表Table1 The List of Primer in qRT-PCR
1.3.3 统计方法
2 研究结果
2.1 两种运动对大鼠体重的影响
训练前和训练后分别将大鼠称重,C组、T组和L组大鼠的体重增加量分别是201±72 g、105±41 g和140±39 g,有氧训练后大鼠体重增量仅是对照组的52%,统计学检验有显著性差异(P<0.01),抗阻训练后大鼠体重总增量为对照组的70%(P<0.05;图1)。

图1 8周有氧和抗阻训练对大鼠体重的影响Figure1. Effect of Aerobic and Resistance Exercise on the Body Weight of Rats
2.2 两种运动对腹股沟和附睾脂肪重量的影响
训练后取双侧腹股沟脂肪和双侧附睾脂肪称重,C组、T组和L组的腹股沟脂肪(双侧)的脂肪重量分别是:0.37±0.11 g、0.27±0.05 g、0.36±0.09 g;附睾脂肪(双侧)的脂肪重量分别是:7.65±2.61 g、4.81±1.72 g、6.45±2.32 g。有氧运动后腹股沟脂肪减少了27%,附睾脂肪减少了37%,均有显著性差异;抗阻训练后腹股沟脂肪减少了3%,附睾脂肪减少了16%,都无显著性差异(图2)。
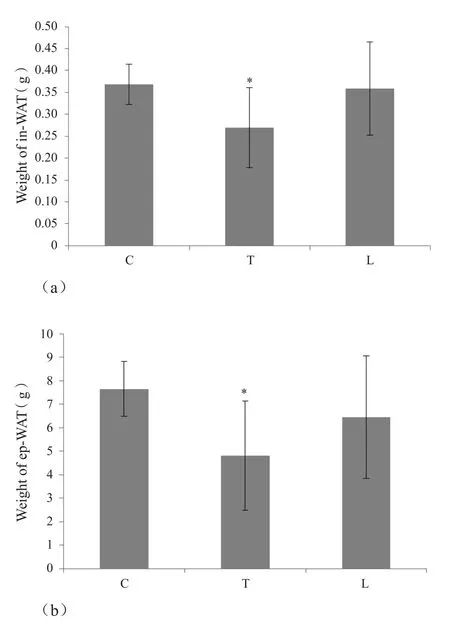
图2 3组大鼠脂肪重量比较Figure2. Effect of Aerobic and Resistance Exercise on Weight of WAT of Rats
2.3 两种运动方式对WAT形态学的影响
有氧训练后,腹股沟脂肪的脂滴面积(1 245±454μm2)与C组(1 924±557μm2)相比明显降低,有显著性差异(P<0.05),且其中出现了一些多腔室的小细胞成簇的聚集,还出现了少量类似血管的管状物,附睾脂肪并未出现相似的变化,但脂滴面积(3 006±875μm2)与C组脂滴面积(4 144±846μm2)相比明显降低,有显著性差异 (P<0.05);抗阻训练后腹股沟脂肪脂滴面积(1 740±139μm2)和附睾脂肪脂滴面积(3 498±966μm2)分别与各自的对照组相比均略有降低,但无显著性差异(P<0.05;图3)。
2.4 两种运动方式对白色脂肪棕色化相关基因mRNA表达的影响
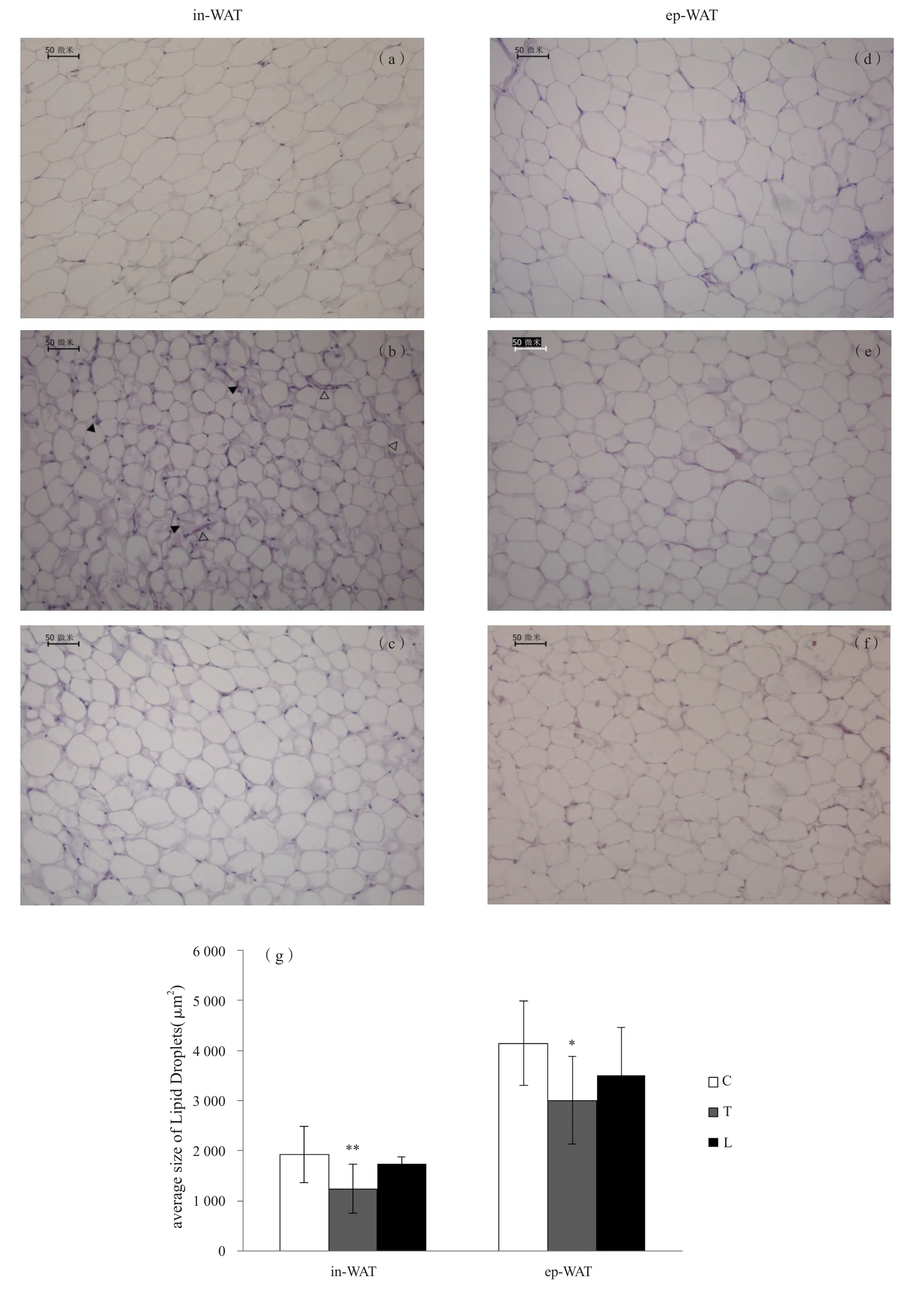
图3 两种运动方式对大鼠白色脂肪形态的影响Figure 3. Effect of Aerobic and Resistance Exercise on morphology of WAT of Rats
有氧训练后腹股沟脂肪中棕色脂肪相关基因的表达情况:PRDM16的mRNA是C组的1.56倍(P<0.05),PPARγ是C组的1.65倍(P<0.05),PGC-1α是C组的1.49倍(P<0.05),UCP1是C组的1.44倍(P<0.05);附睾脂肪中表达情况为:PRDM16的mRNA是C组的0.68倍(P>0.05),PPARγ是C组的1.33倍(P>0.05),PGC-1α是C组的0.83倍(P>0.05),UCP1是C组的0.80倍(P>0.05)。抗阻训练后腹股沟脂肪中棕色脂肪相关基因的表达情况:PRDM16的mRNA是C组的1.20倍(P>0.05),PPARγ是C组的1.07倍(P>0.05),PGC-1α是C组的1.14倍(P>0.05),UCP1是C组的0.82倍(P>0.05);附睾脂肪中表达情况为:PRDM16的mRNA是C组的0.78倍(P>0.05),PPARγ是C组的1.98倍(P>0.05),PGC-1α是C组的0.45倍(P<0.05),UCP1是C组的0.85倍(P>0.05)。可以看出,有氧训练使腹股沟脂肪中的棕色脂肪相关基因的表达量升高较为明显,但对附睾脂肪中的棕色脂肪相关基因的表达无明显诱导作用;而抗阻训练对腹股沟和附睾脂肪中棕色脂肪相关基因均无明显诱导作用,而且对附睾脂肪中除PPARγ以外的基因的表达有一定的抑制作用(图4)。
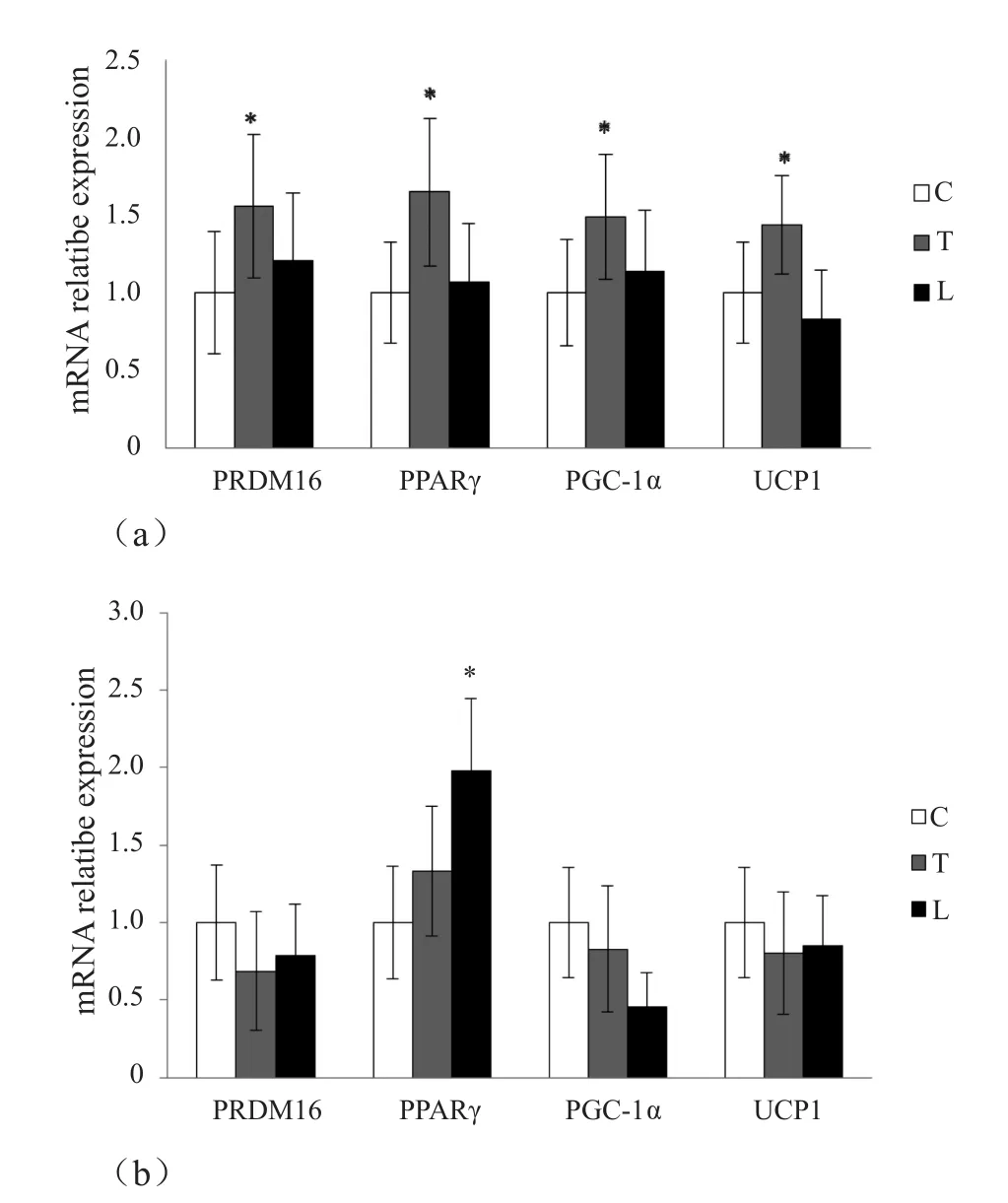
图4 两种运动训练后白色大鼠脂肪中棕色脂肪相关基因的表达情况Figure4. Effect of Aerobic and Resistance Exercise on mRNA Content of PRDM16,PPARγ,PGC-1α,UCP1 in WAT of Rats
3 讨论
众所周知,规律的运动训练可对白色脂肪组织的形态和功能产生重要的影响,如减少脂肪组织、降低脂质含量等[8,11]。近年来,多项研究表明,运动可以诱导白色脂肪棕色化,即在白色脂肪组织中出现米色脂肪细胞。Wu等(2014)的研究也表明,8周跑台训练(5次/周,运动时间为60 min,速度从24 m/min递增至42 m/min)可显著增加大鼠腹股沟米色脂肪细胞的含量,并增加PGC-1α和UCP1等蛋白的含量。
Bostrom等(2012)研究发现,3周自主跑轮运动可明显增加内脏脂肪和附睾脂肪垫UCP1基因表达水平,而最显著的增加发生在皮下脂肪部位,增加高达25倍。本研究通过对大鼠进行8周的有氧和抗阻训练后发现,从形态、功能等各方面来看,这两种运动方式对皮下和内脏白色脂肪的棕色化产生了不同程度的影响。
两种运动对腹股沟和附睾白色脂肪的形态学的影响:白色脂肪和棕色脂肪的形态有很大区别,白色脂肪的细胞富含脂滴,脂滴所占体积可达细胞的90%以上,而棕色脂肪含有丰富的线粒体与血管,且细胞含有多个脂滴,并且胞质内含有很多细胞器[5],近年来发现的米色脂肪细胞,其形态与棕色脂肪十分接近,但散在的分布在白色脂肪内。在本研究中,选取了皮下腹股沟脂肪和内脏的附睾脂肪进行组织染色,结果显示,对照组大鼠腹股沟脂肪和附睾脂肪都表现为典型的白色脂肪形态,且附睾脂肪的脂滴要略大于腹股沟脂肪,两种运动训练组的两个部位的脂肪组织的脂滴面积都有所减小,与前人的研究结果一致[8,11];其中有氧运动后的皮下脂肪染色发现了一部分细胞体积较小,周围有许多小脂滴的细胞,且在视野内出现了少量的血管,提示,皮下脂肪在有氧运动后可能发生了棕色化作用而诱导产生了米色脂肪细胞,在2015年的一项研究中,11天的自主跑轮运动后,小鼠的皮下脂肪的HE染色结果也出现了类似的变化[20]。而抗阻运动后的皮下和附睾脂肪以及有氧运动后的附睾脂肪的脂肪形态与各自的对照组一致,仅有略微的脂滴变小,从形态学方面看,有氧运动仅能使皮下脂肪产生棕色化作用,而对内脏脂肪作用不明显,抗阻运动对皮下和内脏白色脂肪均不能使其产生棕色化作用。
两种运动对白色脂肪棕色化的作用:白色脂肪棕色化的过程中有许多转录因子、蛋白质和分泌的因子参与,如PPARγ、PGC-1α、PRDM16等。PPARγ是一种配体激活的转录因子,活化后可促进线粒体生成,增加UCP1表达。在Sirt1激活状态下,PPARγ通过募集Sirt1,配体构象发生改变,可发生脱乙酰基作用。在WAT中,脱乙酰基的PPARγ与PRDM16 相作用,促进能量的生成和白色脂肪棕色化[16]。PGC-1α是一种转录共激活因子,参与多种能量代谢及线粒体的发生和氧化代谢过程。它可以控制线粒体生物合成,并通过对解偶联蛋白的诱导和核呼吸因素的调节而影响氧化呼吸的作用。近几年的研究表明,PGC-1α通过诱导膜蛋白FNDC5表达,从FNDC5上剪切出来一个可分泌多肽片段irisin,作用于白色脂肪进而诱导棕色化的产生[4]。PRDM16是一种锌指蛋白,可在转录水平控制脂肪细胞的分化进程;可抑制白色脂肪细胞相关基因的表达,而促进棕色脂肪细胞相关基因的表达,如UCP1和PGC-1α等。另外,PRDM16对米色脂肪细胞的生成也具有重要调控作用。研究表明,当阻断PRDM16表达时,白色脂肪细胞产热相关的基因表达受到抑制,从而降低β-AR激动剂诱导的棕色化进程[19]。本研究中,大鼠经过8周的有氧运动后,皮下脂肪中PPARγ、PGC-1α、PRDM16这些棕色化正调控因子都产生了显著的提高,棕色脂肪标志基因UCP1的mRNA表达水平也显著升高,但附睾脂肪中除了PPARγ略有升高外,其他基因均有不同程度的下降,表明皮下脂肪在有氧运动的刺激下发生了棕色化作用,诱导产生了米色脂肪细胞,而同样的运动并没能刺激附睾脂肪发生棕色化作用。有研究证明,皮下脂肪中葡萄糖稳态、胰岛素功能的相关基因(如Glut1、Pparγ)以及脂代谢相关基因(如β肾上腺素受体)的表达量都高于内脏脂肪[1],且PRDM16可以在皮下脂肪高表达,而在内脏脂肪的表达量特别低[6],这与本研究中的结果一致;大鼠进行8周抗阻运动后,皮下脂肪中PPARγ、PGC-1α、PRDM16的mRNA水平这些调控因子都略有升高,UCP1的mRNA表达水平却略有下降,但都无显著性差异,附睾脂肪中除PPARγ的mRNA水平显著升高外,其他基因水平都有所下降,证明抗阻运动并不能使皮下脂肪和附睾脂肪发生棕色化作用。
4 研究结论
有氧运动可以显著地减少皮下和内脏脂肪的重量和脂滴的面积,且能诱导皮下脂肪组织中出现米色脂肪细胞,也可以促进棕色化相关基因的mRNA在皮下脂肪中的表达显著升高,而对内脏脂肪的棕色化诱导作用不明显;抗阻运动对皮下脂肪和内脏脂肪的减脂效果均不显著,且不能促进两类白色脂肪发生棕色化作用。
[1] ATAMON G,YANG X M,MUZUMDAR R,et al.Differential gene expression between visceral and subcutaneous fat depots[J]. Horm Metab Res,2002,34:622-628.
[2] BARTEL T A,HEEREN J.Adipose tissue browning and metabolic health[J].Nat Rev Endocrinol,2014,10(1):24-36.
[3] BEDFORD T G,TIPTON C M,WILSON N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures [J].J Appl Physiol Respir Environ Exe Physiol,1979,47(6) :1278-1283.
[4] BOSTROM P,WU J,JEDRYCHOWSKI M P,et a1.A PGC1 -α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature,2012,481(7382):463-468.
[5] CINTI S.The adipose organ[J].Prostaglandins Leukot Essent Fatty Acids,2005,73:9-15.
[6] COHEN P,LEVY J D,ZHANG Y,et al. Ablation of PRDM16 and beige adipose causes metabolic dysfunction and a subcutaneous to visceral fat switch[J]. Cell,2014,156:304-316.
[7] COUSIN B,CINTI S,MORRONI M,et al.Occurrence of brown adipocytes in rat white adipose tissue:molecular and morphological characterization[J].Cell Sci,1992,103(4):931-942.
[8] CRAIG B W,HAMMONS G T,GARTHWAITE S M,et al.Adaptation of fat cells to exercise: response of glucose uptake and oxidation to insulin[J].Appl Physiol,1981,51:1500-1506.
[9] CYPESS A M,IJEHMAN s,WILLIAMS G,et al.Identif i cation and importance of brown adipose tissue in adult humans[J].N End J Med,2009,360(15):1509-1517.
[10] DE MATTEIS R,LUCERTINI F,GUESCINI M,et al.Exercise as a new physiological stimulus for brown adipose tissue activity[J]. Nutr Metab Cardiovasc Dis,2013,23(6):582-590.
[11] GOLLISCH KS,BRANDAUER J,JESSEN N,et al.Effects of exercise training on subcutaneous and visceral adipose tissue in normal-and high-fat diet-fed rats[J].Am J Physiol Endocrinol Metab,2009,297:E495-E504.
[12] HORNBERGER TA JR.,FARRAR RP.Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat [J].Can J Appl Physiol,2004,29(1) :16-31.
[13] NORHEIM F,LANGLEITE T M,HJORT H M,et al.The effects of acute and chronic exercise on PGC-1alpha,irisin and browning of subcutaneous adipose tissue in humans[J].FEBSJ,2014,281(3):739-749.
[14] OLIVEIRA N R,MARQUES S O,LUCIANO T F,et al.Treadmill training increases SIRT-1 and PGC-1 α protein levels and AMPK phosphorylation in quadriceps of middle-aged rats in an intensity-dependent manner [J].Mediators Inf l amm,2014,2014:987017.
[15] PETROVIC N,WALDEN T B,SHABALINA I G,et al.Chronic peroxisome proliferator-activated receptor gamma (PPARgamma)activation of epididymally derived white adipocyte cultures reveals a population of thermogenically competent, UCP1-containing adipocytes molecularly distinct from classic brown adipocytes[J]. J Biol Chem,2010,285:7153-7164.
[16] QIANG L,WANG L,KON N,et al.Brown remodeling of white adipose tissue by SirT1-dependent deacetylation of Pparγ[J]. Cell,2012,150(3):620-632.
[17] RONN T,VOLKOV P,TORNBERG A,et al.Extensive changes in the transcriptional profile of human adipose tissue including genes involved in oxidative phosphorylation after a 6-month exercise intervention[J].Acta Physiol(Oxf),2014,211(1):188-200.
[18] SEALE P,BJORK B,YANG W,et al.PRDM16 controls a brown fat/skeletal muscle switch[J]. Nature,2008,454: 961-967.
[19] SEALE P,CONROE H M,ESTALL J,et al.Prdm16 determines the thermogenic program of subcutaneous white adipose tissue in mice[J].J Clin Invest,2011,121(1):96-105.
[20] STANFORD K I,MIDDELBEEK R J W,TOWNSEND K L,et al.A novel role for subcutaneous adipose tissue in exercise-induced improvements in glucose homeostasis[J].Diabetes,2015,64:2002-2014.
[21] TMJKOVSKI M,AHMED K,ESAU C C,et a1.MyomiR-133 regulates brown fat differentiation through Prdml6[J].Nat Cell Binl,2012,14:1330-1335.
[22] VIRTANEN KA,LIDELL ME,ORAVA J,et al.Functional brown adipose tissue in healthy adults[J].New England J Med,2009,3(60):1518-1525.
[23] WU MV,BIKOPOULOS G,HUNG S,et al.Thermogenic capacity is antagonistically regulated in classical brown and white subcutaneous fat depots by high fat diet and endurance training in rats: impact on whole-body energy expenditure[J].Biol Chem,2014,289(49):34129-34140.
[24] YOUNG P,ARCH JR,ASHWELL M.Brown adipose tissue in the parametrial fat pad of the mouse[J].FEBS Lett,1984;167:10-14.
[25] ZINGARETTI M C,CROSTA F,et al.The presence of UCP1 demonstrates that metabolically active adipose tissue in the neck of adult humans truly represents brown adipose tissue[J].FASEB J,2009,23:3113-3120.
Effect of Aerobic and Resistance Exercise on Browning of White Adipose Tissue in Rats
目的:对比两种不同的运动方式——有氧运动和抗阻运动对大鼠白色脂肪棕色化的作用。方法:雄性SD大鼠随机分为3组,分别为安静对照组(C)、有氧训练组(T)和抗阻训练组(L),有氧训练方式为跑台训练:8周的时间里速度由15 m/min增至28 m/min,训练时间由20 min增至60 min,每周训练5天。抗阻训练方式为递增负荷爬梯训练,爬梯长1.1 m,负重装置固定于大鼠尾部,初始负荷为体重的50%,之后不断增加负荷,每3天进行1次,共训练8周。最后一次训练结束后48 h取大鼠的双侧腹股沟脂肪和附睾脂肪,组织进行HE染色,荧光定量PCR,观察两种运动对脂肪组织形态和相关基因mRNA的影响。结果: T组腹股沟脂肪和附睾脂肪的脂滴面积都显著减小,腹股沟脂肪组织里还出现了一些多腔室的小细胞成簇的聚集和少量类似血管的管状物;L组两类脂肪的脂滴面积比C组略有减小但不显著;T组的PRDM16、PPARγ、PGC-1α、UCP1 的mRNA在腹股沟脂肪中的表达量与C组相比有显著升高,在附睾脂肪中的表达量除PPARγ以外都略有降低,L组的上述基因在腹股沟脂肪中表达量与C组相比略有升高但无显著性,在附睾脂肪中的表达量也表现为除PPARγ以外都出现不同程度的降低。结论:有氧运动可以促进皮下白色脂肪棕色化,但对内脏脂肪作用不明显;抗阻运动对皮下和内脏脂肪均无促进其发生棕色化的作用。
有氧运动;抗阻运动;白色脂肪棕色化;皮下脂肪;内脏脂肪
Objective:To compare the effect of aerobic and resistance exercise on browning of white adipose tissue(WAT)in rats. Methods:Sprague-Dawley rats were randomly assigned to three groups:control group(C),aerobic exercise group(T),resistance exercise group(L). The rats of T group performed treadmill exercise,speed increase from 15m/min to 28m/min,and the time increased from 20min to 60 min during 8 weeks,training were performed 5 days per week. The rats in L group were allowed to climb a 1.1m vertical ladder with weights attached to their tails and the weights were progressively increased. Sessions were performed one times per three days for 8 weeks. Then bilateral inguinal fat(in-WAT) and epididymal fat(ep-WAT) were isolated at 48h after the last exercise section. The Hematoxylin –Eosin(HE) staining was used to observe The morphology of adipocyte,and the Quantitative Real-time PCR was used to detect the mRNA expression of browning genes. Result:The lipid droplets of in-WAT and ep-WAT in T group were smaller than that in C group,and some multilocular cells and blood vessels appeared in the in-WAT. The size of lipid droplets of in-WAT and ep-WAT decreased slightly in L group. The content of PRDM16,PPARγ,PGC-1αand UCP1 mRNA of in-WAT in T group increased signif i cantly while that in L group increased with no signif i cant compared with C group. All of these genes mRNA content of ep-WAT whether in L group or T group were lower than that in C group except PPARγ. Conclusion:The aerobic exercise can induce browning of subcutaneous WAT,but has no signif i cant effect on visceral WAT. Resistance exercise has no effect on subcutaneous WAT and visceral WAT.
aerobic exercise;resistance exercise;browning of WAT;subcutaneous WAT;visceral WAT
G804.7
A
1000-677X(2017)06-0069-06
10. 16469/j. css. 201706007
2016-11-21;
2017-04-26
国家体育总局体育科学研究所基本科研业务费资助项目(15-28)。
杨星雅,女,实验师,硕士,主要研究方向为运动生物化学、运动与脂肪代谢,E-mail:yangxingya@ciss.cn。
1.国家体育总局体育科学研究所,北京 100061;2. 国家体育总局体育文化发展中心,北京 100061
1.China Institute of Sport Science,Beijing 100061,China;2.Sports Culture Development Center,Beijing 100061,China.

